高效液相色谱-串联质谱法测定废水中5种喹诺酮类抗生素
姚倩钰,贺德春,龚道新,丁紫荣,赵 波,张漫雯,黎玉清
1.湖南农业大学资源环境学院,湖南 长沙 410000 2.环境保护部华南环境科学研究所,广东 广州 510000 3.原广州军区工程环境质量监督站,广东 广州 510507
高效液相色谱-串联质谱法测定废水中5种喹诺酮类抗生素
姚倩钰1,2,3,贺德春2,龚道新1,丁紫荣2,赵 波2,张漫雯2,黎玉清2
1.湖南农业大学资源环境学院,湖南 长沙 410000 2.环境保护部华南环境科学研究所,广东 广州 510000 3.原广州军区工程环境质量监督站,广东 广州 510507
建立高浓度有机废水中5种喹诺酮类抗生素的高效液相色谱-串联质谱测定方法。水样经HLB固相萃取小柱富集净化,12 ml甲醇洗脱、浓缩并加入内标溶液后,定容至1 mL待测。以C18柱为分离柱,含0.01%甲酸的甲醇-含0.01%甲酸的水溶液为流动相,目标物质在10 min内分离。在0.25~1 250 ng/mL范围内,目标物质线性关系良好(R2>0.99)。基质加标试验结果表明,纯水中的回收率为61.40%~91.92%,废水中的回收率为54.92%~101.87%,检出限为0.25~2.5 ng/L,方法定量限为0.36~3.99 ng/L。应用该方法对21家猪场的64份废水样品进行分析,5种喹诺酮类抗生素的检出频率为47%~95%,平均检出浓度为980~5 734 ng/L。该方法快速、准确,适用于高浓度有机废水中喹诺酮类抗生素的同时测定。
高效液相色谱-串联质谱;固相萃取;废水;喹诺酮类抗生素
Abstract:A method was established for determination of 5 fluoroquinolone antibiotics in high concentration of organic wastewater using solid phase extraction (SPE) followed by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) in this paper. Aqueous samples were developed with Oasis HLB solid-phase extraction (SPE) cartridges and the targeted antibiotics were subsequently eluted by 12 mL methanol. After concentration, the elutes were added internal standards and determined by HPLC-MS/MS equipped with a reverse-phase C18column. The results of method development showed that the 5 kinds of fluoroquinolone could be efficiently separated within 10 minutes by HPLC-MSMS; the calibration curve ranged 0.25-1 250 ng/mL and showed high relationship (R2>0.99). The recoveries for all analytes in pure water matrices were above 60%, and the recoveries of target compounds in real wastewater samples ranged 54.92%-101.87%; detection limits varied between 0.25-2.5 ng/L and quantization limits were 0.36-3.99 ng/L. The presented method was successfully applied to quantify the five fluoroquinolones in 64 wastewater samples from 21 pig farms. The detection frequency of five quinolones in real samples was 47%-95% and the average detection concentration was found to be 980 to 5 734 ng/L. All the results indicate that this method is suitable for rapid determination of fluoroquinolone antibiotics in high concentration of organic wastewater.
Keywords:high performance liquid chromatography-tandem mass spectrometry;solid phase extraction;wastewater;fluoroquinolone antibiotics
1946年,首次报道在饲料中添加抗生素能提高畜禽的日增重,之后抗生素的使用越来越广泛,滥用现象也日益严重[1-2]。抗生素在使用过程中,只有极少部分被动物或人吸收,并通过代谢反应生成无活性产物,大部分是以原药的形式随动物粪尿排出体外,进入环境中[3-6]。抗生素的潜在风险主要表现在它的生物毒性效应上,在环境中大量残留会对土壤、水体生态环境、植物生长,以及人类健康具有潜在危害,例如,抗生素抗性基因污染,出现耐药性微生物,抑制动植物生长,对动物、人体产生直接毒性反应、过敏反应等毒副作用[7-9]。喹诺酮类抗生素因其广谱、高效、低毒等特点,广泛应用于兽医临床,各种畜禽废弃物和环境介质中也广泛检测到喹诺酮类抗生素的残留[10-12]。喹诺酮类抗生素在养殖行业的使用及其风险引起了广大科研工作者的高度关注。同时,洛美沙星、培氟沙星、氧氟沙星、诺氟沙星等喹诺酮类药物也在人类医疗中广泛使用,其在养殖行业的大量使用将给人类健康带来巨大危险。2015年9月,农业部发布公告规定自2016年1月1日起,养殖业停止经营、使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4种原料药的各种盐、脂及其制剂[13]。开展废水中喹诺酮类抗生素的检测方法及残留现状研究,对于评估其环境与健康风险,加强监督管理具有重要意义。
近年来,高效液相色谱法[14]、液相色谱串联质谱法[15-20]广泛应用于各种介质中抗生素的检测。但高效液相色谱法无法克服基质干扰效应,尤其难以克服高浓度有机废水的基质干扰。液相色谱串联质谱法具有更高的灵敏性和选择性,能够有效克服基质干扰[21]。本文通过对高效液相色谱串联质谱法测定条件进行优化,完善了废水中抗生素的富集与净化等前处理条件,建立一种同时测定废水中5种喹诺酮类抗生素的检测方法,为快速、准确测定废水中抗生素含量提供技术支撑。应用建立的检测方法,对多个省市猪场废水中5种喹诺酮类抗生素的残留现状进行调查。
1 材料与方法
1.1试剂与材料
诺氟沙星(NOR)、恩氟沙星(ENR)、培佛沙星(PEF)、氧氟沙星(OFL)、环丙沙星(CIP),均购于德国,纯度大于99.0%。分别称取10.0 mg上述抗生素,用甲醇定溶于10 mL的容量瓶中,配置成浓度为1.0 mg/mL的标准储备液,转移至棕色瓶内,存放于-18 ℃的冰箱中。
溶剂耗材:甲醇(色谱纯);甲酸(色谱纯);盐酸(分析纯);一次性注射器;0.22 μm的尼龙滤膜,0.45 μm,200 mm玻璃纤维滤膜。
1.2仪器与设备
快速液相色谱(Agilent 1260 Infinity,Agilent,美国)-串联三重四级杆质谱(ABsciex 4000 Qtrap,AB SCIEX,美国)联用仪;24位固相萃取仪(美国);氮吹浓缩仪(MGS-2200,日本)、超声波清洗仪(SCQ-1000C)。
1.3液相色谱和质谱条件
1.3.1 色谱条件
色谱柱:Waters Cortecstm C18(2.7 μm,4.6 ×100 mm);流动相:A相为0.01%甲酸的水溶液,B相为0.01%甲酸的甲醇溶液;流速为0.5 mL/min,进样体积:10 μL,柱温为45 ℃;梯度洗脱程序为0~6 min, B相从10%增至75%,6~9 min, B相从75%增至95%,9~12 min,B相保持95%,12~12.1 min, B相从95%降至10%,平衡3.0 min。
1.3.2 质谱条件
离子源:电喷雾电离源(ESI+);离子源电压:5 500 V,源温度:450 ℃,雾化气:0.045 MPa,干燥气:0.05 MPa,气帘气:0.03 MPa,检测方式:多反应离子扫描模式(MRM)。
1.4样品采集与前处理
1.4.1 样品采集与保存
用棕色玻璃瓶采集养殖场的原水和各污水处理工艺段的出水,共64份样品,水样用硫酸调节pH至2左右,速运回实验室于4 ℃冷库避光保存,48 h内进行萃取。采样养殖场情况见表1。
1.4.2 样品前处理
准确量取500 mL经0.45 μm玻璃纤维滤膜过滤后的水样,用盐酸将pH调成2.0,加入0.5 g Na2EDTA,混匀静置0.5 h。以5~10 mL/min的流速将水样匀速通过依次用10 mL去离子水、10 mL甲醇、10 mL去离子水活化的Oasis HLB固相萃取小柱。水样富集完成后,用10 mL去离子水淋洗,弃去全部流出液后抽真空干燥10 min,再用12 mL甲醇洗脱,收集洗脱液于玻璃试管中,氮吹至近干,加入900 μL甲醇复溶,加入100 μL进样内标,涡旋0.5 min,用0.22 μm针头过滤器过滤后转至2 mL进样瓶中,待测。

表1 采样养殖场基本情况Table 1 The general information of pig farms wherewastewater sample were collected from
注:养殖规模以生猪出栏量计,头/a。
2 结果与讨论
2.1仪器分析条件的选择与优化
2.1.1 色谱条件的选择和优化
[21-22]报道,以 Waters C18色谱柱为分离柱,比较了3组不同流动相对目标化合物的分离效果与灵敏度的影响。第一组A相为含0.01%甲酸的水溶液,第二组A相为含0.1%甲酸的水溶液,第三组A相为含5 mmol/L乙酸铵的水溶液,3组流动相的B相均为含0.01%甲酸的甲醇溶液。实验结果表明,第一组流动相的分离效果和灵敏度均较好。通过优化流动相组分比例,调整洗脱梯度,达到较好的分离效果。5种抗生素的总离子流色谱图和MRM色谱图见图1。
2.1.2 质谱条件的选择
采用直接注射的进样方法,根据目标化合物的理化性质,选取ESI作为电离源,优化母离子/子离子对。根据母离子与丰度高、干扰小的两个子离子形成的离子对分别进行定性、定量分析。5种目标抗生素的优化质谱参数见表2。

图1 5种抗生素的总离子流色谱图和MRM谱图Fig.1 Total ion chromatogram and MRM chromatogram of the 5 antibiotics
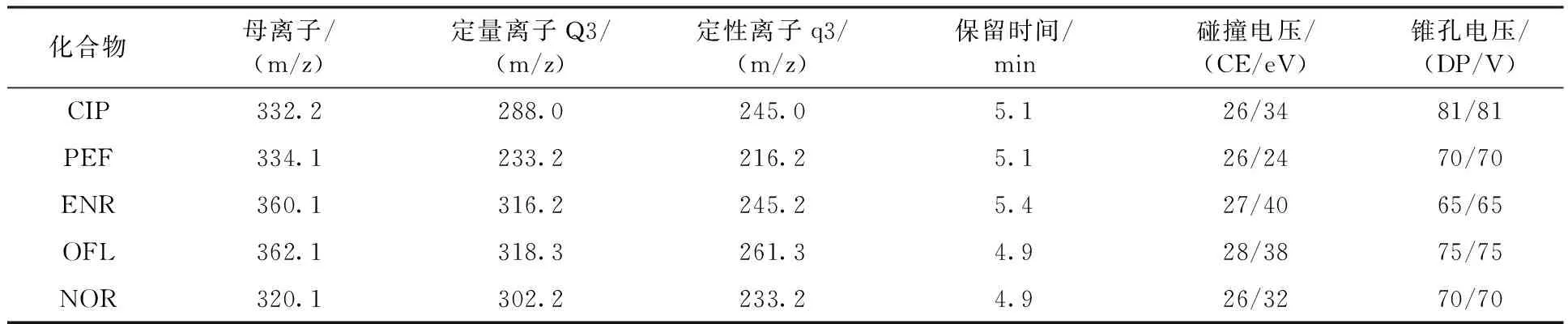
化合物母离子/(m/z)定量离子Q3/(m/z)定性离子q3/(m/z)保留时间/min碰撞电压/(CE/eV)锥孔电压/(DP/V)CIP332.2288.0245.05.126/3481/81PEF334.1233.2216.25.126/2470/70ENR360.1316.2245.25.427/4065/65OFL362.1318.3261.34.928/3875/75NOR320.1302.2233.24.926/3270/70
2.2样品前处理条件的选择与优化
2.2.1 固相萃取柱的选择
在抗生素的分析中,Oasis HLB固相萃取柱应用最为广泛[23-24]。近年来,国内有关厂商推出可替代Oasis HLB固相萃取柱使用的PEP固相萃取柱,其价格远低于Oasis HLB柱。通过试验比较了Oasis HLB和PEP柱对目标化合物的富集效率。在1 000 mL超纯水中分别加入50 ng(以OFL为例)的5种抗生素,依照1.4.2小节进行样品前处理后上机测定。2种固相萃取小柱对目标化合物的富集效率如图2所示。PEP柱对PEF的吸附能力较弱,HLB柱对5种抗生素的回收率为90.4%~111.7%,本实验选用HLB柱作为富集、净化柱。若研究对象为不包括PEF在内的其余4种抗生素时,可用PEP柱代替Oasis HLB用作水样的富集、净化柱,在保证测试准确性同时,可极大降低实验成本。
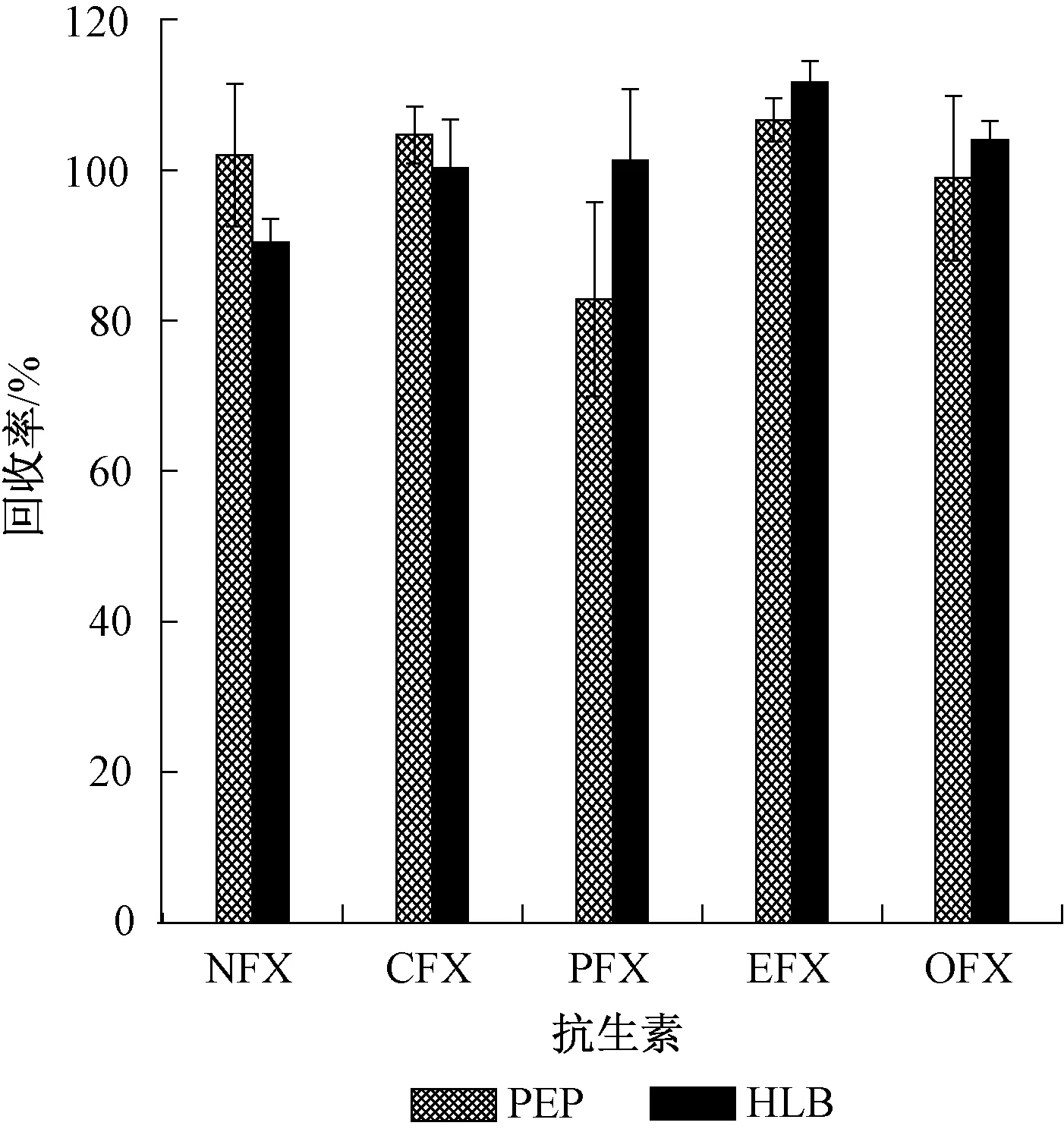
图2 萃取柱对目标物质回收率的影响Fig.2 Effect of the SPE cartridge on the recovery of antibiotics
2.2.2 洗脱溶剂的选择
根据文献报道,甲醇[25-26]、乙腈[27]等常用作抗生素分析的洗脱溶剂。本实验比较了甲醇、乙腈、甲醇-乙腈混合液(体积比为8∶2)作为洗脱溶剂的洗脱效果。实验共3组,每组3个平行样品。向1 000 mL水样中添加50 ng(以OFL为例)5种抗生素,调节溶液pH为2.0,加入0.5 g的Na2EDTA,按上述的前处理方法处理样品,对样品进行测定。3种洗脱溶剂的回收率如图3所示。由于乙腈、甲醇乙腈混合液对CIP的回收率较低,甲醇对5种抗生素的回收率为83.8%~119.7%,故本实验选取甲醇作为洗脱溶剂。
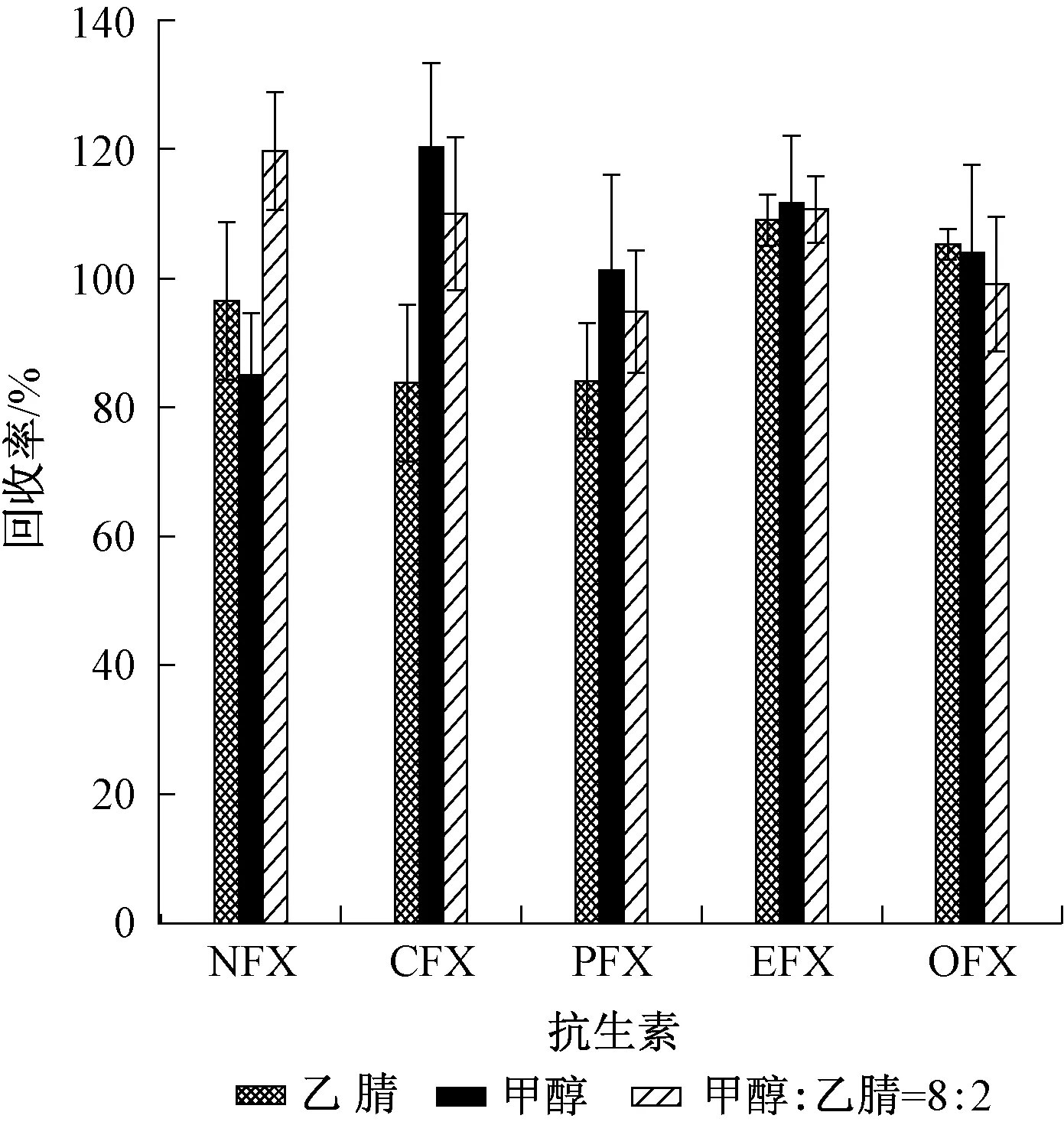
图3 洗脱溶剂对目标物质回收率的影响Fig.3 Effect of the elution solvent on the recovery of antibiotics
2.2.3 洗脱溶剂用量选择
取500 mL水样6份,分别添加50 ng(以OFL为例)5种抗生素,调节pH为2.0,加入0.5 g的Na2EDTA,将水样以5~10 mL/min的速度通过活化过的固相萃取柱,用去离子水清洗小柱,分别用2、4、6、8、10、12 mL的甲醇进行洗脱,洗脱液氮吹近干后用甲醇溶解,转移至进样瓶中测定。每段洗脱液目标化合物的回收率如图4所示。洗脱溶剂用量为8 mL时,大多数抗生素的回收率已经达到稳定,其中ENR在洗脱体积为10 mL时,回收率基本达到稳定,为了能够获得较好的回收率,实验最终确定洗脱溶液用量为12 mL。
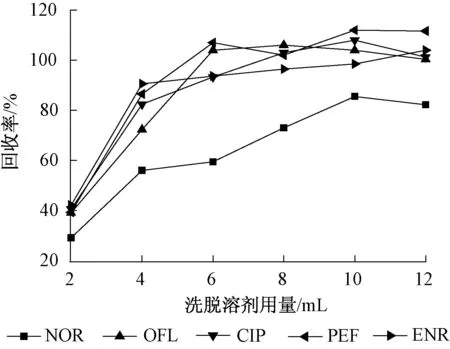
图4 洗脱溶剂用量对目标物质回收率的影响Fig.4 Effect of the elution solvent volume on the recovery of antibiotics
2.3方法性能评价
2.3.1 精密度与准确度
以超纯水和某养猪场原水水样分别作为基质进行基质加标回收率实验,每个添加水平分别做6个平行样,试验结果见表3。当分别添加低、中、
高3种浓度时,5种抗生素在超纯水中回收率为 61.4%~91.92%,相对标准偏差为 6.10%~12.63%,在原水中回收率为56.72%~101.87%,相对标准偏差为2.67%~9.63%。该方法可以满足环境中抗生素物质的分析要求。
2.3.2 线性范围与检测限
因各种抗生素的检出限不同,配置成7个浓度梯度的标准溶液系列,子离子定量,横坐标为质量浓度,纵坐标为目标抗生素与内标物峰面积的比值,做回归分析,绘制标准曲线。显示5种抗生素的线性相关系数R2>0.99。对标准曲线上最低浓度点进行稀释,上机测定,以10倍左右信噪比的浓度作为仪器定量限。以仪器定量限结合目标化合物的回收率和取样体积,计算方法的定量限。线性关系和仪器检出限见表3。5种抗生素的检出限为0.25~2.5 ng/L,定量限为0.36~3.99 ng/L。
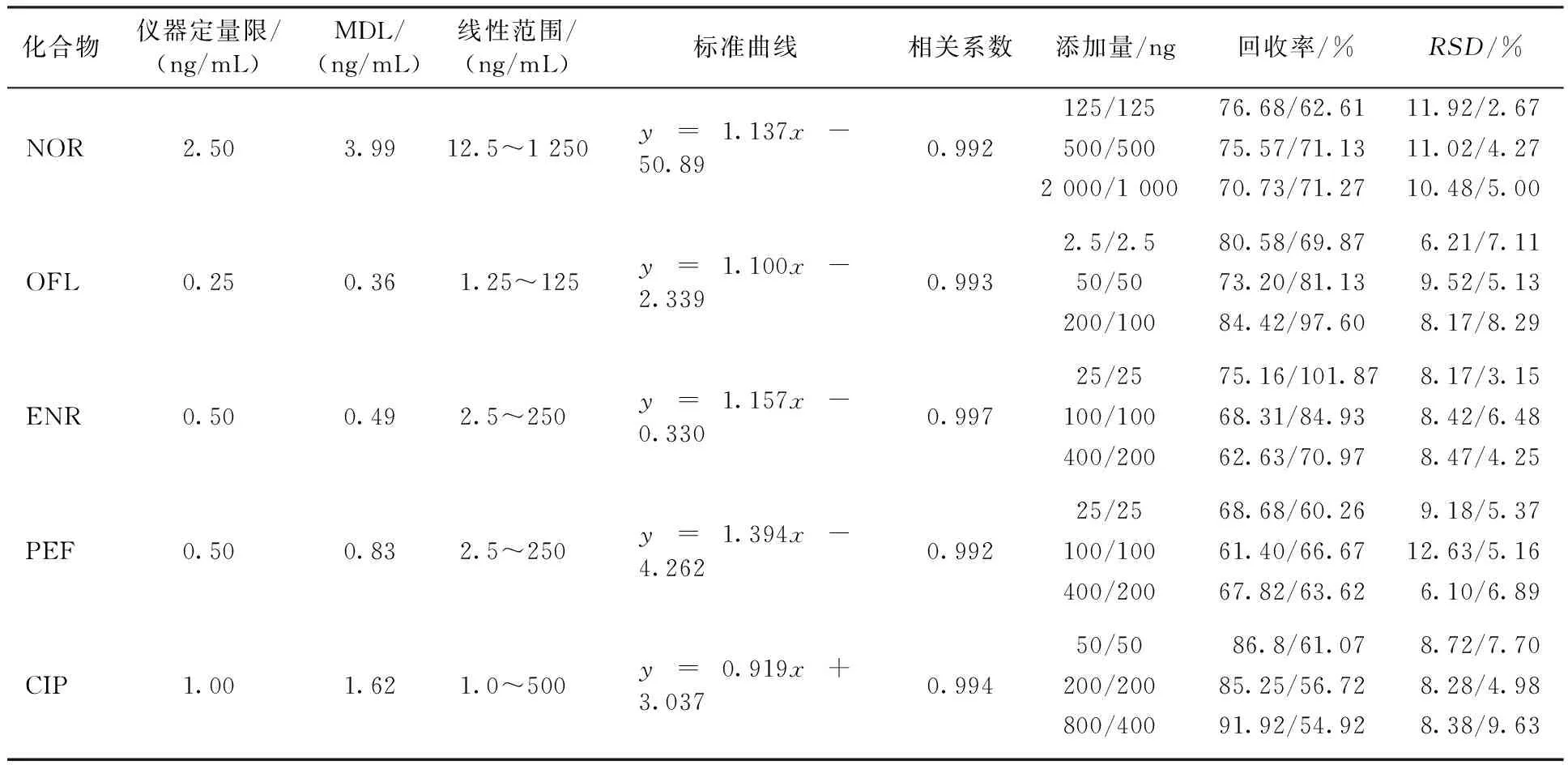
表3 5种化合物的检测限、标准曲线、回收率(n=6)及相对标准偏差Table 3 Detection limit、standard curve、recovery rate (n=6) and RSD of antibiotics
2.4废水中喹诺酮类抗生素检测
运用建立的分析方法对8个省的21家养猪场的废水进行测定,结果如表4所示。5种喹诺酮类抗生素在64份养殖废水样品中均有不同浓度的检出,除培氟沙星的检出率相对较低(47%)外,其余4种喹诺酮类抗生素检出率均在80%以上。表明,喹诺酮类抗生素广泛残留于养殖废水中。5种抗生素的平均检出浓度为980.2~5 734.5ng/L,最大浓度为11 320.0~62 400.0 ng/L。丁佳丽等[28]报道,长三角地区养猪废水中环丙沙星、恩诺沙星、诺氟沙星检出浓度为3 110~7 760 ng/L。陈军平、姜凌霄[29-30]在江西省开展的采样检测表明,养猪场废水中诺氟沙星、氧氟沙星检出率均为100%,最高检出浓度分别为34、 911 ng/L。闾幸[31]在浙江嘉兴地区的研究表明,秋冬两季养猪废水恩诺沙星、诺氟沙星、环丙沙星的检出浓度为30~5 920 ng/L。本试验测得的养殖废水中喹诺酮类抗生素平均及最大检出浓度均远高于文献报道,可能与养殖场抗生素的使用不尽规范有关,不同养殖场抗生素的使用量、使用次数等不同,导致废水中抗生素的残留浓度变化幅度较大。
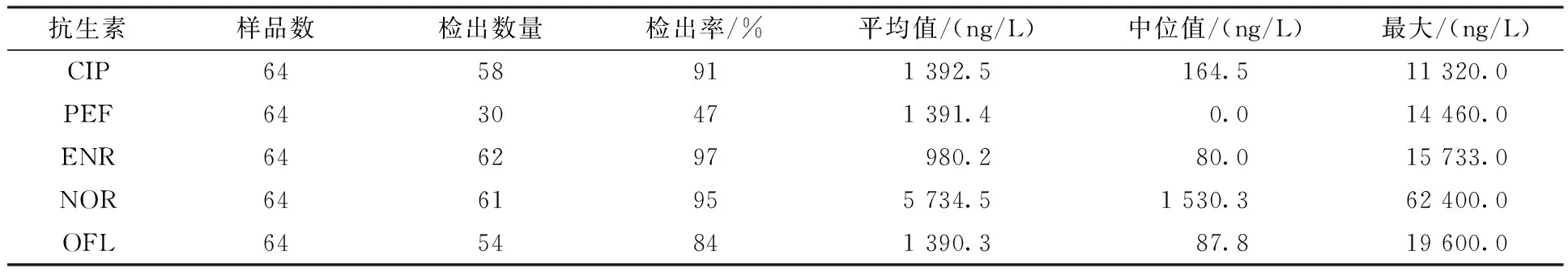
表4 废水中喹诺酮类抗生素的检出情况Table 4 Concentrations of antibiotics in wastewater
农业部已明确规定2016年1月1日起,禁止洛美沙星、培氟沙星、氧氟沙星和诺氟沙星在养殖业中使用,但培氟沙星、氧氟沙星和诺氟沙星在猪场废水中仍被广泛检出,表明实际生产中对该禁令的执行并不理想,大量养殖场仍存在违法使用喹诺酮类抗生素的现象,需加强对畜禽养殖业抗生素使用的监管。
3 结论
建立了废水中5种喹诺酮类抗生素的高效液相色谱-串联质谱的分析方法。5种抗生素在废水中的回收率为56.72%~101.87%,相对标准偏差为2.67%~9.63%,方法定量限为0.36~3.99 ng/L。方法的准确度和精密度均达到抗生素物质残留分析的要求。
对21家猪场废水的监测结果表明,5种喹诺酮类抗生素在猪场废水中的检出率分别为47%(PEF)、91%(CIP)、97%(ENR),95%(NOR)、84%(OFL),平均检出浓度分别为1 392.5(CIP)、1 391.4(PEF)、980.2(ENR)、5 734.5(NOR)、1 390.3(OFL)ng/L。养殖业禁止使用的培氟沙星、氧氟沙星、诺氟沙星均具有较高的检出频率和检出浓度。表明,养猪场在抗生素的规范使用方面仍存在诸多问题,急需加强监管。
参考文献(References):
[ 1] 王振,王建云.畜禽养殖中抗生素使用的现状、问题及对策[J].中国动物保健,2009(7):55-57.
WANG Zhen, WANG Jianyun. Situation the use of antibiotics in livestock, Problems and Solutions[J].China Animal Health, 2009(7):55-57.
[ 2] 王云鹏,马越.养殖业抗生素的使用及潜在危害 [J].中国抗生素杂志,2008,33(9):519-521.
WANG Yunpeng, MA Yue. Potential public hazard of using antibiotics in livestock industry[J]. Chinese Journal of Antibiotics,2008,33(9):519-521.
[ 3] 王慧慧,王淑平.畜禽排泄物中抗生素残留与控制技术研究进展[J].土壤通报,2011,42(1):250-256.
WANG Huihui, WANG Shuping. Residue antibiotics in livestock and poultry excretion and related control technologies: a review[J]. Chinese Journal of Soil Science, 2011.42(1):250-256.
[ 4] 张艳,李彦文,莫测辉,等.高效液相色谱-荧光测定蔬菜中喹诺酮类抗生素[J].广东农业科学,2009(6):176-180.
ZHANG Yan, LI Yanwen, MO Cehui, et al. Deter-mination of quinolones antibiotics in vegetable using high performance liquid chromatography fluorescence[J]. Journal of Guang Dong Agricultural Sciences, 2009(6):176-180.
[ 5] 张树清,张夫道,刘秀梅,等.规模化养殖畜禽粪主要有害成分测定分析研究[J].植物营养与肥料学报,2005,11(6):822-829.
ZHANG Shuqing, ZHANG Fudao, LIU Xiumei, et al. Determi-nation and analysis on main harmful composition in excrement of scale livestock and poultry feedlo-ts[J].Plant Nutrition and Fertilizer Science, 2005,11(6):822-829.
[ 6] 张树清.规模化养殖畜禽粪有害成分测定及其无害化处理效果[D].北京:中国农业科学院,2004.
[ 7] 邓玉,倪福全.水环境中抗生素残留及其危害[J].南水北调与水利科技,2011,9(3):96-100.
DENG Yu, NI Fuquan. Research on antibiotics residues and hazardous in aquatic environment: a review[J]. South-to-North Water Diversion and Water Science & Tech-nology, 2011,9(3):96-100.
[ 8] 孙刚,袁守军,计峰,等.畜禽粪便中抗生素残留危害及其研究进展[J].环境与健康杂志,2009,26(3):277-279.
SUN Gang, YUAN Shoujun, JI Feng, et al. Environmental impact of antibiotics contamination from livestock and poultry dejecta: a review of recent[J]. Journal of Environment and Health, 2009,26(3):277-279.
[ 9] 季秋洁. 3种氟喹诺酮类抗生素在猪粪中的残留与降解[D].合肥:安徽农业大学,2012.
[10] 邰义萍,罗晓栋,莫测辉,等.广东省畜牧粪便中喹诺酮类和磺胺类抗生素的含量与分布特征研究[J]. 环境科学,2011,32(4):1 188-1 193.
TAI Yiping, LUO Xiaodong, MO Cehui. et al. Occurrence of quin-olone and sulfonamide antibiotics in swine and cattle manures from large-scale feeding operations of Guangdong province[J]. Environmental Science, 2011,32(4):1 188-1 193.
[11] 刘锋,廖德润,李可,等.畜禽养殖基地磺胺类喹诺酮类和大环内酯类抗生素污染特征[J].农业环境科学学报,2013,32(4):847-853.
LIU Feng, LIAO Derun, LI Ke, et al. Pollution characteristics of the sulfonamides, quinolones and macrolides in the samples collected from livestock and poultry feedlots[J].Journal of Agro-Environment Science, 2013,32(4):847-853.
[12] 李佩佩,张小军,梅光明,等. 超高效液相色谱-串联质谱检测养殖水体中喹诺酮类抗生素[J].浙江大学学报(理学版), 2015, 42(3):334-338.
LI Peipei, ZHANG Xiaojun, MEI Guangming, et al. Determination of quinolones in aquaculture waters by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Zhejiang University (Science Edition), 2015, 42(3):334-338.
[13] 中华人民共和国农业部.第2292号公告[BE/OL].(2015-09-08)[2017-01-05].http://www.moa.gov.cn/sydw/stzz/ybfk/dt/201509/t20150908_4820832.htm.
[14] 孙艳侠.高效液相色谱在乳品抗生素残留检测中的应用[J].山西农业科学,2010.38(3):10-13.
SUN Yanxia. Review on determination of antibiotics residues in dairy products by high performance liquid chromatography[J].Journal of Shanxi Agricultural Sciences, 2010.38(3):10-13.
[15] 钟东莲,丁明,汤富彬,等.高效液相色谱-电喷雾串联质谱法测定畜禽粪便中四环素类抗生素[J].分析科学学报,2014,30(3):433-436.
ZHONG Donglian, DING Ming, TANG Fubin, et al. Determination of tetracycline’s antibiotics residues in anim-al manur by liquid chromatography with tandem mass spectrometry[J]. Journal of Analytical Science, 2014,30(3):433-436.
[16] 吴小莲,包艳萍,向垒,等.固相萃取-高效液相色谱-串联质谱法同时测定蔬菜中8种磺胺类抗生素[J].环境化学,2013,32(6):1 038-1 044.
WU Xiaolian, BAO Yanping, XIANG Lei, et al. Simultaneous dete-rmination of eight sulfonamide antibiotics in vegetab-les using solid phase extraction and high performance liquid chromatography coupled with mass spectrome-try[J]. Environmental Chemistry,2013,32(6):1 038-1 044.
[17] 李刚,颜智勇,谭秀益,等.畜禽养殖废水中抗生素检测技术研究进展[J].绿色科技,2011(11):97-99.
LI Gang, YAN Zhiyong, TAN Xiuyi, et al. Advances of detect-ion technology for antibiotics from livestock and poultry breeding wastewater[J].Journal of Green Science and Technology, 2011(11):97-99.
[18] YE Z Q,HOWARD S, WEINBERG. Trace analysis of trimethoprim and sulfonamide, macrolide, quinolone, and tetracycline antibiotics in chlorinated drinking water using liquid chromatography electrospray tandem mass pectrometry [J]. Anal Chem, 2007,79(3):1 135-1 144.
[19] CAHILL J, FURLONG E T, BURKHARDT M R, et al. Determination of pharmaceutical compounds in surface-water and ground-water samples by solid-phase extraction and high-performance liquid chromatography electrospray ionization mass spectrometry [J]. Journal of Chromatography A, 2004, 1 041(1/2):171-180.
[20] 秦宏兵,顾海东. 超高效液相色谱-串联质谱法测定饮用水源水中磺胺类抗生素[J]. 中国环境监测,2013,29(1):98-102.
QIN Hongbing, GU Haidong. Determination of sulfonamide antibiotics in drinking source water using ultra performance liquid chromatography tandem mass spectrometry[J].Environmental Monitoring in China, 2013,29(1):98-102.
[21] 万位宁,陈熹,居学海,等.固相萃取-超高效液相色谱串联质谱法同时检测畜禽粪便中多种抗生素残留[J].分析化学研究报告,2013,41(7):993-999.
WAN Weining, CHEN Xi, JU Xuehai, et al. Simultaneous determination of residual antibiotics in livestock manure by solid phase extraction-ultra-high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2013,41(7):993-999.
[22] 刘佳佳,佘永新,刘洪斌,等.高效液相色谱-串联质谱法同时测定动物源食品中24种磺胺类药物残留[J].分析实验室, 2011, 30(2):9-13.
LIU Jiajia, SHE Yongxin, LIU Hongbin, et al. Simul-taneous determination of 24 sulfonamides residues in animal pro-ducts by high performance liquid chromato-graphy tandem mass spectrometry [J].Chinese Journal of Analysis Laboratory. 2011,30(2):9-13.
[24] 薄海波,雒丽丽,曹彦忠,等.超高效液相色谱-串联质谱法测定牛奶和奶粉中6种聚醚类抗生素残留量[J].分析化学研究报告,2009,37(8):1 161-1 166.
BO Haibo, LUO Lili, CAO Yanzhong, et al. Determination of six polyether antibiotics residues in milk and milk powder by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry. 2009,37(8):1 161-1 166.
[25] 张俊,罗阳,潘曼曼,等. 水体中磺胺、四环素、喹诺酮类抗生素检测方法[J]. 中国环境监测,2013,29(4):111-115.
ZHANG Jun, LUO Yang, PAN Manman, et al. Analysis of sulfonamide, tetracycline and quinolones antibiotics in surface water[J].Environmental Monitoring in China, 2013,29(4):111-115.
[26] 杨长志,康庆贺,马东升,等.高效液相色谱法测定动物源性食品中甲氧苄氨嘧啶残留量[J].化学工程师,2005,19(12):19-21.
YANG Changzhi, KANG Qinghe, MA Dongsheng, et al. Determination of trimethoprim residues in animal foods by high pero-rmance liquid chromatography. The Chemical Engineer, 2005,19 (12):19-21.
[27] USEPA 1694 PPCPs, Pharmaceuticals and personal are products in, water soil, sediment and bio-solidsy HPLC/MS/MS[S]. Washington: US. Environmental Protection Agency,2007.
[28] 丁佳丽,刘锐,郑薇,等.养猪废水和污泥中11种兽用抗生素的同时分析技术及其在生物降解过程的应用[J].环境科学,2015,36(10):3 918-3 925.
DING Jiali, LIU Rui, ZHENG Wei, et al. Method for simultaneous determination of 11 veterinary antibiotics in piggery wastewater and sludge and its application in biological treatment [J]. Environment Science, 2015,36(10):3 918-3 925.
[29] 陈军平,杨艳丽,吴志强,等.江西省畜禽养殖废水及环境中抗生素残留现状调查[J].安徽农业科学,2015,43(31):224-227,230.
CHEN Junping, YANG Yanli, WU Zhiqiang, et al. Pollution of antibiotics in livestock wastewater and the environmental water in Jiangxi province[J].Journal of Anhui Agricultural Sciences, 2015,43(31):224-227,230.
[30] 姜凌霄.鄱阳湖区典型养猪场废水抗生素污染特征及催化降解研究[D].南昌:南昌航空大学,2012.
[31] 闾幸.生猪养殖废水及地表水中兽用抗生素污染现状与处理技术研究[D].上海:上海师范大学硕士论文,2015.
DeterminationofFiveFluoroquinoloneAntibioticsinWastewaterbyHighPerformanceLiquidChromatography-TandemMassSpectrometry
YAO Qianyu1,2,3, HE Dechun2, GONG Daoxin1, DING Zirong2, ZHAO Bo2, ZHANG Manwen2, LI Yuqing2
1.College of Resource and Environment, Hunan Agricultural University, Changsha 410000, China 2.South China Institute of Environmental Science, MEP, Guangzhou 510000, China 3.The Constructional and Environmental Quality Supervising Station of Original Guangzhou Military Region, Guangzhou 510507, China
X830.2
A
1002-6002(2017)03- 0139- 08
10.19316/j.issn.1002-6002.2017.03.21
2017-01-09;
2017-03-06
环保公益性行业科研专项项目(201509038)
姚倩钰(1993-),女,山西运城人,学士,助理工程师。
贺德春

