前列腺腺癌中整合素αvβ3、基质金属蛋白酶-2和-9表达及关系
胡 森 王继贤 童占表 张栋邦
(青海红十字医院泌尿外科,青海 西宁 810000)
前列腺腺癌中整合素αvβ3、基质金属蛋白酶-2和-9表达及关系
胡 森 王继贤 童占表 张栋邦
(青海红十字医院泌尿外科,青海 西宁 810000)
目的检测前列腺腺癌中整合素αvβ3、基质金属蛋白酶(MMP)-2和-9表达,分析其相关性及在不同临床病理特征中的意义。方法观察组为58例前列腺腺癌患者,对照组为31例前列腺增生患者,均留取术后新鲜组织,两组中整合素αvβ3、MMP-2和MMP-9表达应用流式细胞术检测。结果整合素αvβ3、MMP-2和MMP-9在观察组中表达量明显高于对照组。观察组中整合素αvβ3、MMP-2和MMP-9表达量均与增殖指数、Gleason评分和转移相关。观察组中整合素αvβ3和MMP-2、整合素αvβ3和MMP-9的表达呈正相关。结论前列腺腺癌中存在着明显的整合素αvβ3、MMP-2和MMP-9的高表达,三种蛋白在肿瘤发生中可能有一定促进作用。整合素αvβ3可能通过对细胞外基质进行降解促进肿瘤进展。
前列腺腺癌;整合素αvβ3;基质金属蛋白酶(MMP)-2;MMP-9
前列腺癌病变常隐匿,病变的发展较快〔1〕。病变进展中可以出现转移相关蛋白的表达异常〔2〕。整合素是一种黏附分子,可以调节细胞与基质的连接,并对细胞间信号传导起重要作用〔3〕。整合素αvβ3是经典成员,可以识别G蛋白耦联受体(GRD)序列的膜受体蛋白,促进肿瘤的黏附、迁移及浸润的整个过程〔4〕。基质金属蛋白酶(MMP)-2、-9是细胞外基质降解的蛋白,能破坏细胞外的基底膜,使肿瘤转移的通路打开,促进细胞迁移〔5〕。本实验检测前列腺腺癌术后组织中整合素αvβ3、MMP-2和MMP-9的表达,分析其临床意义。
1 资料与方法
1.1一般资料 2014年2月至2016年9月青海红十字医院行前列腺癌手术治疗患者58例为观察组,年龄51~82(平均69.4)岁。纳入均经病理学确诊,并符合世界卫生组织的诊断标准。31例前列腺增生切除的组织为对照组,年龄55~79(平均67.5)岁。两组均于术后留取新鲜组织,并置于70%的酒精中固定保存。两组一般资料无明显差异。
1.2整合素αvβ3、MMP-2和MMP-9蛋白的检测 应用流式细胞术检测整合素αvβ3、MMP-2和MMP-9的表达。将70%酒精固定的术后组织用眼科剪刀剪碎,在不锈钢网上轻搓组织,并用生理盐水冲洗,将组织搓完后用300目铜网过滤。收集过滤后的细胞悬液,离心1 min后制备单细胞悬液(1×106/ml),取1 ml单细胞悬液,加入一抗、磷酸盐缓冲液(PBS)及异硫氰酸荧光素(FITC)-IgG二抗(严格按实验步骤进行)。采用BC公司生产的Epics-XLⅡ型流式细胞仪,采用Expo32 ADC进行数据分析。
1.3结果判定 以荧光指数(FI)表示蛋白表达的半定量。FI=(肿瘤中蛋白表达的平均荧光强度-对照样品平均荧光强度)/正常对照样品平均荧光强度。
1.4统计学方法 应用SPSS17.0统计软件进行t检验,线性相关分析。
2 结 果
2.1整合素αvβ3、MMP-2和MMP-9在两组中的表达 整合素αvβ3、MMP-2和MMP-9在观察组中表达量明显高于对照组。见表1。
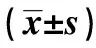
表1 整合素αvβ3、MMP-2和MMP-9在两组中表达
2.2整合素αvβ3、MMP-2和MMP-9的表达在观察组不同临床病理特征中的比较 观察组中整合素αvβ3、MMP-2和MMP-9的表达量均与增殖指数、Gleason评分和转移相关。见表2。
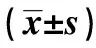
表2 整合素αvβ3、MMP-2和MMP-9的表达在观察组不同临床病理特征中的比较
2.3观察组中整合素αvβ3、MMP-2和MMP-9的相关性 整合素αvβ3和MMP-2的表达呈正相关(r=0.476,P=0.034 5),和MMP-9的表达呈正相关(r=0.482,P=0.039 4)。
3 讨 论
前列腺癌是由分泌性细胞构成的一种侵袭性恶性上皮性肿瘤。饮食及环境因素均是肿瘤形成的诱发因素,可引起肿瘤细胞异型性增加,基底细胞丢失,肿瘤性病变形成。肿瘤形成中可以出现多种蛋白的表达失常〔6,7〕。本实验提示整合素αvβ3、MMP-2和MMP-9三者是促进上皮细胞癌变的重要因素。三者参与肿瘤细胞的增殖及异型性的形成,也对肿瘤的转移起重要促进作用。前列腺癌转移的第一步是肿瘤侵及脉管,最常见的部位是区域性淋巴结和骨盆及中轴的骨骼。转移性病变的形成与细胞外基质的降解有关。MMPs家族在降解细胞外基质中有重要作用,MMP-2及MMP-9是家族中的经典成员,属明胶酶类,对基底膜和Ⅳ型胶原的降解作用强〔8,9〕。也有研究显示MMP-9可以有多种生物学功能,如对肿瘤间质血管生成的促进作用,对MMP-2分泌的增强作用等〔10,11〕。整合素αvβ3可以通过识别细胞外基质及细胞膜上免疫蛋白超家族黏附分子、细胞间黏附分子等介导肿瘤细胞黏附作用,并引起细胞信号传导异常及调节细胞生存、增殖和凋亡等〔12,13〕。也有观点认为整合素αvβ3促进肿瘤转移时还能通过其配体结合提供肿瘤细胞需要的离子,抑制P53的活性,引起肿瘤细胞的生长和繁殖〔14,15〕。本研究提示整合素αvβ3对细胞外基质具有调节作用,尤其整合素αvβ3高表达时可以促进MMP-2及MMP-9的分泌,引起蛋白间级联反应的形成〔16,17〕。整合素αvβ3上调后激活MMPs家族的其他成员,如MMP-1,同时能增强其配体,如玻璃体结合蛋白和纤维结合蛋白的识别能力,进而更有效地促进细胞外基质的有效溶解,引发肿瘤细胞的迁移〔18〕。整合素αvβ3可通过活化磷脂酰肌醇3-激酶和翻译调节因子及细胞外调节蛋白激酶信号通路抑制内皮细胞凋亡,使肿瘤细胞的血液供应丰富〔19〕。整合素αvβ3的表达可使Caspase-8重新出现于细胞膜,从而激活Caspase,进而使药物对5-氟尿嘧啶的耐药性增强,肿瘤呈进展状态〔20〕。
1徐振宇,高建平,张征宇,等.RECK基因在前列腺癌组织中的表达及其与基质金属蛋白酶的关系〔J〕.医学研究生学报,2005;18(7):577-9.
2王俊生,罗 勇,林云华,等.转移相关蛋白在前列腺癌组织中的表达及其意义〔J〕.中国肿瘤临床,2011;38(16):957-60.
3Felding-Habermann B,Fransvea E,O′Toole TE,etal.Involvement of tumor cell integrin αvβ3 in hematogenous metastasis of human melanoma cells〔J〕.Clin Exp Metast,2002;19(5):427-36.
4Brooks PC,Stromblad S,Sanders LC,etal.Localization of matrix metalloproteinase MMP-2 to the surface of invasive cells by interaction with integrin αvβ3〔J〕.Cell,1996;85(5):683-93.
5黄晓曦,许东坡,王力群,等.MMP-2/MMP-9在乳腺癌组织中的表达及其生物学意义〔J〕.癌症,2001;20(11):1251-5.
6杨 阔,孟 超,徐 勇,等.血管生成拟态和基质金属蛋白酶-2在前列腺癌中的表达及意义〔J〕.中华泌尿外科杂志,2012;33(10):791-4.
7徐振宇,许传亮,孙颖浩,等.前列腺癌组织中RECK基因的表达及其与基质金属蛋白酶-2的关系〔J〕.上海医学,2004;27(5):298-9.
8Hwang Q,Cheifetz S,Overall CM,etal.Bone sialoprotein does not interact with pro-gelatinase A(MMP-2) or mediate MMP-2 activation〔J〕.BMC Cancer,2009;9(1):1-11.
9Riley SC,Gibson AH,Leask R,etal.Secretion of matrix metalloproteinases 2 and 9 and tissue inhibitor of metalloproteinases into follicular fluid during follicle development in equine ovaries〔J〕.Reproduction,2001;121(4):553.
10贾中耀,马 明,于妮娜.COX-2、MMP-2在前列腺癌的表达及意义〔J〕.山东医药,2010;50(29):52-3.
11王钦文,刁鑫伟,陈正堂,等.血管内皮生长因子和基质金属蛋白酶-9在前列腺癌中的表达及其相互关系〔J〕.第三军医大学学报,2009;31(19):1859-61.
12Yang J,Xue F,Zhan Y,etal.Matrix metalloproteinase-2 promotes αvβ3 integrin-mediated adhesion and migration of human melanoma cells by cleaving fibronectin〔J〕.PLoS One,2012;7(7):e41591.
13Welser-Alves JV,Boroujerdi A,Tigges U,etal.Microglia use multiple mechanisms to mediate interactions with vitronectin;non-essential roles for the highly-expressed αvβ3 and αvβ5 integrins〔J〕.J Neuroinflamm,2011;8(1):157-7.
14Daghighi S,Sjollema J,Dijkstra RJ,etal.Real-time quantification of matrix metalloproteinase and integrin αvβ3 expression during biomaterial-associated infection in a murine model〔J〕.Eur Cells Mater,2014;27(1):26-8.
15Hofmann UB,Westphal JR,van Kraats AA,etal.Expression of integrin αvβ3 correlates with activation of membrane type matrix metalloproteinase-1(MT1-MMP) and matrix metalloproteinase-2 (MMP-2) in human melanoma cells in vitro and in vivo〔J〕.Int J Cancer,2000;87(1):12-9.
16Godefroy E,Manches O,Dreno B,etal.Matrix metalloproteinase-2 conditions human dendritic cells to prime inflammatory TH2 cells via an IL-12-and OX40L-dependent pathway〔J〕.Cancer Cell,2011;19(3):333-46.
17Daemi N,Thomasset N,Lissitzky JC,etal.Anti-β4 integrin antibodies enhance migratory and invasive abilities of human colon adenocarcinoma cells and their MMP-2 expression〔J〕.Int J Cancer,2000;85(6):850-2.
18叶再元,叶 平,杨 琼.丹参酮ⅡA对人胃癌MKN-45细胞整合素β1、基质金属蛋白酶-7表达影响〔J〕.中国中西医结合外科杂志,2009;15(3):294-8.
19Cohen K,Flint N,Shalev S,etal.Thyroid hormone regulates adhesion,migration and matrix metalloproteinase 9 activity via αvβ3 integrin in myeloma cells〔J〕.Oncotarget,2014;5(15):6312-22.
20刘 松,刘恩宇,牛卫博,等.整合素αvβ6在胃癌AGS细胞增殖和凋亡中的作用〔J〕.中国现代普通外科进展,2010;13(2):102-4.
胡 森(1978-),男,副主任医师,主要从事泌尿系肿瘤研究。
R73
A
1005-9202(2017)20-5072-02;
10.3969/j.issn.1005-9202.2017.20.053
〔2016-11-17修回〕
(编辑 苑云杰)

