大鼠骨髓单核细胞移植对溃疡性结肠炎模型大鼠的修复作用
韩宇鹏 鲍秀琦 颜 玉 陈 刚 邱 冰 吴 宇 王 雪 姜 威
(佳木斯大学附属第一医院, 黑龙江 佳木斯 154007)
大鼠骨髓单核细胞移植对溃疡性结肠炎模型大鼠的修复作用
韩宇鹏 鲍秀琦 颜 玉 陈 刚 邱 冰 吴 宇 王 雪 姜 威
(佳木斯大学附属第一医院, 黑龙江 佳木斯 154007)
目的探讨骨髓单核细胞(BM-MNCs)移植对溃疡性结肠炎(UC)的修复作用。方法将标记的异体大鼠BM-MNCs移植到大鼠UC模型内,观察大鼠的精神、进食、活动、大便情况及体重变化,结肠大体形态,黏膜组织损伤的情况。结果移植7 d后大鼠的一般情况、体重、排便情况明显优于磷酸盐缓冲液(PBS)组;大鼠结肠组织大体及光镜观察,移植后3 d及7 d,移植组与PBS组结肠大体标本无明显差别,移植后14 d,移植组结肠大体标本可见黏膜充血、水肿、糜烂、无明显溃疡;荧光显微镜观察,移植14 d的大鼠结肠组织中均可观察到DAPI标记的BM-MNCs细胞。结论BM-MNCs移植可以促进大鼠UC模型损伤结肠组织的修复。
骨髓单个核细胞;移植;溃疡性结肠炎
目前,溃疡性结肠炎(UC)的治疗方法主要有药物诱导缓解、药物维持及外科手术,但具有一定的副作用和并发症。骨髓单个核细胞(BM-MNCs)是成体组织干细胞,不仅具有组织的自我更新和细胞的定向分化潜能,又能产生一些可促进神经、血管再生的细胞因子,包括造血干细胞、骨髓间充质干细胞和内皮祖细胞等〔1〕。近年来,大量的实验研究〔2~12〕结果表明BM-MNCs可借助于受损部位的细胞因子、黏附因子等的趋化作用,向病变部位迁移,实现其向损伤组织的定植和归巢。本实验旨在研究BM-MNCs的培养及BM-MNCs对UC的治疗效果。
1 材料与方法
1.1材料 清洁级健康成年雄性SD大鼠54只,体重(250±10)g,6~8周龄,购自哈尔滨医科大学实验动物学部;三硝基苯磺酸、弗氏完全佐剂均购自美国sigma公司;水合氯醛购自天津大茂化学制剂厂;DAPI购自北京华迈科世纪公司。
1.2方法
1.2.1分组 36只大鼠采用免疫复合法制备UC模型后,随机分为BM-MNCs移植组及磷酸盐缓冲液(PBS)组,每组18只,余18只用于提取BM-MNCs。
1.2.2制备家兔结肠黏膜抗原 剥离家兔的结肠并分离黏膜层,加入十二烷基硫酸钠(SDS)裂解液,低温研磨黏膜层组织成组织匀浆液, 95℃作用5 min,可将蛋白酶从组织匀浆液中去除,4℃,15 000 r/min离心10 min后,留取上清液转入透析袋中,为了去除上清液中SDS,将透析袋逐步浸入梯度浓度的生理盐水中。采用双缩脲法测定蛋白后,取蛋白含量为20 mg/ml上清液与等体积弗氏完全佐剂充分混合,制备家兔抗原乳化液备用。
1.2.3提取BM-MNCs 缓慢腹腔注射10%水合氯醛溶液,麻醉SD大鼠,待其完全麻醉后用剪刀将腿部皮肤备皮,浸入75%酒精,消毒3~5 min。清除肌肉、筋膜后充分暴露股骨和胫骨并取出关节,分离股骨和胫骨两端骨皮质并在骨骺处注入5 ml抗凝液,反复冲洗骨髓腔,收集骨髓液至离心管中,4℃,1 500 r/min离心10 min,弃去上清液,沉淀中加入2 ml PBS液后充分涡旋混合,重复低温离心。将骨髓液缓慢倾覆于等体积的淋巴细胞分离液上层,混合液4℃,2 000 r/min离心15 min,弃除上清液,留取白色细胞层4℃保存。
1.2.4DAPI标记BM-MNCs 用含DAPI(终浓度为50 μg/ml)的DIEM培养基重悬细胞,于含5%CO2饱和湿度、37℃培养箱中染色2 h,收集细胞并计数。
1.2.5制备UC模型及BM-MNCs静脉移植 第1、14天时,将0.4 ml抗原乳化剂充分涡旋,混匀后缓慢注射大鼠腹股沟及足跖处,且末次注射后24 h内需要给予大鼠禁食但不禁水,缓慢腹腔注射10%水合氯醛溶液麻醉,将硅胶管(直径0.2 cm×长度15 cm)液体石蜡润滑,轻柔插入肛门内约8 cm,然后缓慢推注含有100 mg TNBS/kg+50%乙醇的灌注液,灌注后不仅保持身体平躺且臀部要抬高至自然清醒。UC模型成模24 h后,分别给予移植组大鼠经尾静脉注射1 ml BM-MNCs细胞悬液(3×106个/ml);PBS组注入相同体积的PBS溶液。
1.2.6观察一般情况 UC大鼠移植BM-MNCs后,进行常规饲养,温度与湿度均适宜,每天观察各组大鼠的精神状态、食欲和食量情况、日常活动、毛发光泽度、大便次数和性状等情况并记录。分别于移植后的3、7、14 d每组随机抽取6只大鼠麻醉后处死,剖取其结肠并小心纵行剪开,经PBS冲洗干净后,观察大鼠的结肠组织的组织学和病理学变化和结肠表面黏膜层的损伤情况。
1.2.7荧光显微镜观察BM-MNCs分布 避光取已固定的移植组结肠组织块经冰冻切片包埋剂包埋后制作冰冻切片(20 μm)。部分切片待风干后加荧光淬灭剂,封片。荧光显微镜下观察结肠组织中并拍照,细胞核呈蓝色荧光,即为DAPI标记的BM-MNCs。
1.3统计学方法 应用SPSS21.0软件行t检验。
2 结 果
2.1一般情况 两组大鼠于造模1 d后,均开始出现食欲不振甚至厌食,背部拱起活动减少,肛门处可见暗红色、黑色黏稠样稀便,体重减轻。造模3 d后,出现UC的典型临床症状,大鼠形体消瘦,表情淡漠精神不振,毛发枯干无光亮,懒动,大便次数减少,褐色伴有脓汁为黏稠样的稀便,有腥恶臭味,体重减轻明显。移植组大鼠7 d后,一般状况有所改善,精神活动状态有好转,食欲渐强及体质量增加,但肛周仍有少量的稀样便;PBS组临床症状无变化,但腹围增加,体重减轻。移植后的第6天有1只SD大鼠死亡。移植组大鼠14 d后,一般精神活动状态良好,喜动、毛色有光泽,进食量和体质量明显增加,仍排有稀便但无脓血;PBS组大鼠进食量较前稍有增加,其他症状改善不明显,腹围明显增大,体质量略有增加。 其中有1只SD大鼠在移植后9 d死亡。经过BM-MNCs移植治疗后,两组大鼠体质量变化百分比有统计学意义(P<0.05)。见表1。
2.2结肠黏膜组织形态学观察 移植3 d后,两组大鼠结肠回盲部结肠扩张,距离肛周13 cm内的结肠黏膜有广泛的肿胀充血、组织糜烂甚至坏死,同时还可见直径0.5~1 cm的溃疡灶存在。移植7 d后,两组大鼠均表现结肠回盲部的管腔较前明显扩张,结肠在距离肛周7~11 cm处与肠壁明显增厚,皱襞消失,质地脆,和周围的组织可形成明显的组织粘连及包裹,结肠的黏膜层出现广泛的水肿、充血、组织糜烂和坏死等病变,并可见不同程度的溃疡。移植14 d后,移植组大鼠表现为结肠回盲部的管腔稍有缩窄,肠组织与周围组织粘连不明显,但结肠的黏膜层仍有水肿、充血,组织糜烂、未见明显溃疡,并可见局部瘢痕增生;PBS组大鼠回盲部的结肠管腔表现明显扩张,部分可见巨结肠,结肠在距离肛周7~13 cm处与周围的组织形成广泛的粘连、包裹,结肠黏膜层广泛而明显的水肿、充血、组织糜烂及坏死。见图1。
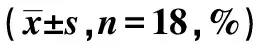
表1 两组移植后大鼠体重变化
与PBS组比较:1)P<0.05

图1 大鼠结肠黏膜形态学观察(×10)
2.3BM-MNCs在大鼠结肠分布 DAPI标记细胞的细胞核呈蓝绿色荧光,观察在移植后14 d组的大鼠结肠组织中可见,被标记的细胞主要分布在结肠黏膜层及黏膜下层,而肌层未见分布。见图2。

图2 移植14 d后DAPI标记的BM-MNCs在大鼠结肠分布(×100)
3 讨 论
UC是由遗传、环境、免疫调节间复杂的相互作用等多个因素共同导致、严重威胁病人健康的炎症性肠病(IBD)。传统的UC治疗一直是医学的难题之一〔2〕。
本实验成功在大鼠体内提取了BM-MNCs,其成活率可达95%,荧光显微镜观察,结果与Hayashi等〔5〕与和Wei等〔13〕的研究结果一致,表明BM-MNCs细胞可迁移和定植于损伤的结肠组织中。本实验显示在移植初期,BM-MNCs移植组大鼠的体重会出现短暂降低,随后体重逐渐恢复;而PBS组大鼠的体重呈持续、急剧降低,结果与Hayashi等〔5〕通过BMSCs移植治疗UC大鼠的实验结果相一致。
虽然BM-MNCs移植疗法治疗UC效果显著,较传统治疗手段有着明显的优越性,但是目前BM-MNCs移植对IBD的治疗还处于理论研究和临床试验阶段。
1Vulliet PR,Greeley M,Halloran SM,etal.Intracoronary arterial injection of stromal cell and microinfarction in dogs〔J〕.Lancet,2012;363 (9411):783-4.
2Lopez CSO,Sullivan KM,McDomald GB.Course of cecropsdisease after allogeneic marrow transplantation〔J〕.Gastroenterology,1998;114(3):433-40.
3Wu Y,Wang J,Scott PG,etal.Bone marrow-derived stem cells inwound healing:a review〔J〕.Wound Repair Regen,2007;15(Suppl 1):18-26.
4Kuo TK,Hung SP,Chuang CH.etal.Stem cell therapy for liver disease:parameters governing the success of using bone marrowmesenchymal stemcells〔J〕.Gastroenterology,2008;134(7):2111-21.
5Hayashi Y,Tsuji S,Tsuji M,etal.Topical implantation of mes-enchymal stem cells has beneficial effects on healing of experimental colitis in rats〔J〕.J Pharmacol Exp Ther,2008;326(2):523-31.
6Wei YM,Nie YQ,Lai JY,etal.Comparison of the population caopacity of hematopoietic and mesenchymal stem cells in experimental colitis rat model〔J〕.Transplantation,2009;88(1):42-8.
7Nishida T,Tsuji S,Tsuji M,etal.Cultured bone marrow cell local implantation accelerates healing of ulcers in mice〔J〕.J Gastroenterol,2008;43(2):124-35.
8Ryan JM,Barry F,Murphy JM,etal.Interferon-gamma does not break,but promotes the immunosuppressive capacity of adult human mesenchymal stem cells〔J〕.Clin Exp Immunol,2007;149:353-63.
9Bamba S,Lee CY,Brittan M,etal.Bone marrow transplantation ameliorates pathology in interleukin-10 knockout colitic mice〔J〕.J Pathol,2006;209(2):265-73.
10Brittan M,Chance V,Elia G,etal.A regenerative role for bone marrow following experimental colitis:contribution to neovasculogenesis and myofibroblasts〔J〕.Gastroenterology,2005;128:1984-95.
11Khalil PN,Weiler V,Nelson PJ,etal.Nonmyeloablative stem cell therapy enhances microcirculation and tissue regeneration in murine inflammatory bowel disease〔J〕.Gastroenterology,2007;132:944-54.
12Sato Y,Araki H,Kato J,etal.Human mesenchymal stem cells xenografted directly to rat liver are differentiated into humanhepatocytes without fusion〔J〕.Blood,2005;106:756-63.
13Wei YM,Nie YQ,Lai JY.etal.Comparison of the population caopacity of hematopoietic and mesenchymal stem cells in experimental colitis rat model〔J〕.Transplantation,2009;88(1):42-8.
黑龙江省自然科学基金项目(H201367);黑龙江省卫生厅科研项目(2013245);黑龙江省大学生创新创业训练计划项目(201610222023)
姜 威(1977-),男,副主任医师,硕士生导师,主要从事溃疡性结肠炎的基础与临床研究。
韩宇鹏(1982-),男,主治医师,硕士,主要从事溃疡性结肠炎的临床研究。
R574
A
1005-9202(2017)20-4992-03;
10.3969/j.issn.1005-9202.2017.20.016
〔2017-03-22修回〕
(编辑 滕欣航)

