基于微流控芯片的细菌趋化性检测研究进展
臧潇倩 李哲煜 张笑颜 江 雷 任南琪 孙 凯*
1(哈尔滨工业大学城市水资源与水环境国家重点实验室, 哈尔滨 150090)2(中国科学院理化技术研究所, 北京 100101)
评述与进展
基于微流控芯片的细菌趋化性检测研究进展
臧潇倩1李哲煜1张笑颜1江 雷2任南琪1孙 凯*1
1(哈尔滨工业大学城市水资源与水环境国家重点实验室, 哈尔滨 150090)2(中国科学院理化技术研究所, 北京 100101)
细菌趋化性是指有运动能力的细菌对环境化学物质梯度产生响应,趋向某些化学诱导剂或避开某些化学驱避剂的移动行为,是微生物适应环境变化而生存的一种基本属性。研究细菌趋化性对于利用细菌治理环境、控制病原菌侵染机体以及开发微生物工业项目等方面都具有重要意义。微流控芯片可以实现对细菌趋化性的定性与定量检测,与传统的检测方法相比,可以更好地对细菌的微环境进行控制,有较高的灵敏度。近年来,基于微流控技术检测细菌趋化性研究得到了飞速发展。本文从微流控芯片的结构、工作方式及主要应用3个方面对近年出现的微流控趋化性检测装置进行了介绍和评述。
微流控; 细菌; 趋化性; 微环境; 评述
2017-04-24收稿;2017-05-18接受
本文系国家自然科学基金项目(No.61674046)资助
* E-mail: ksun@hit.edu.cn
1 引 言
在自然环境中,适合细菌生长繁殖的场所都有一定的离子浓度和营养成分,细菌能够感受周围环境中的化学物质,并沿着化学物质的浓度梯度定向运动,这种性质称为趋化性[1]。细菌朝着化学物质高浓度的方向运动,称为正趋,该化学物质就是引诱剂;反之为负趋,该化学物质为趋避剂。在大多数情况下,正趋化物能作为细菌的碳源和能源,而负趋化物则对细菌有毒害作用。细菌靠趋化作用趋向有利环境,避离不良环境,这样细菌就能够有选择地吸附到某些藻类、甲壳类或贝壳类等动植物的表面得以生存,因而趋化性是细菌在特定环境中定居的一个重要生态学因素。细菌趋化性在诸如原位生物除污、生物膜的形成、感染的发病机制、固氮化作用、微生物在地下环境和土壤中的迁移以及微生物采油等领域的研究中具有重要意义[2]。
传统研究细菌趋化性的方法有很多种,每种传统研究方法各有其优缺点[3],如毛细管检测法、停留扩散室检测法、群板检测法等方法简单易行,且发展成熟,但只能进行趋化性定性分析,而不能实现定量检测;栓细胞检测法和游动细胞自动追踪检测法可以对单个细胞的运动进行跟踪观察,为细菌趋化性机理和理论模型的研究提供了方法,但是栓细胞检测法观察过程耗时较长,对细胞运动的检测重复性差,并且不能对浓度梯度产生反应;而游动细胞自动追踪检测法每次只能追踪一个细胞,且需要高度复杂的数据记录设备。这也使得利用传统检测方法对细菌趋化性进行定量分析和对细菌运动进行精确表征较难实现。
近年来,微流控芯片技术逐渐发展成熟[4],凭借分析快速、成本低、消耗低、重现性好、通量高、多功能、集成好并可以在接近生理环境下运行等特点,成为近年来热点前沿分析技术之一,为细菌趋化性的定性及定量研究提供了新的平台。
2趋化性微流控芯片的材料选择和结构特点
根据使用目的, 可见选择不同的微流控芯片材料、结构及加工手段。为了将微流控芯片应用于细菌趋化性的研究之中,需要在微流控芯片中形成可控的、稳定的、可量化的趋化剂浓度梯度,并且在通道内创建适宜微生物生存的微环境,使微生物保持正常的生理结构与生理机能,且能够在环境中自由运动。因此,在趋化性研究中,需要根据所选择的研究对象以及所需的实验条件,对微流控芯片的通道结构及尺寸进行设计与加工,使得装置内可以形成所需的流体流动状态、溶液混合方式、细菌与趋化剂的接触方式及各种浓度梯度等。
2.1趋化性微流控芯片的材料选择
研制微流控芯片的过程中,首先要考虑芯片材料的选取,选取原则大体有下述几点: (1)与工作介质之间要有良好的化学和生物相容性;(2)应有很好的电绝缘性和散热性;(3)应具有良好的光学性能,对检测信号干扰小或无干扰;(4)表面要具有良好的可修饰性,可产生电渗流或可固载生物大分子;(5)制作工艺简单,成本低廉[5]。在利用微流控芯片对细菌趋化性进行检测时,除满足上述几个条件外,还要考虑实验所用菌种与芯片材料之间的相互作用,使细菌在通道内可以保持正常的生理活性,不发生吸附或粘附,能够自由运动。
用于制作微流控芯片的材料主要有石英、玻璃以及有机高分子聚合物,如热塑性材料聚甲基丙烯酸甲酯(PMMA)[6,7]和聚碳酸酯(PC)[8]、热固型材料聚二甲基硅氧烷(PDMS)[9]等。石英和玻璃是最早引入的微流控芯片基片材料,具有良好的电渗性质和优良的光学特性,表面吸附和表面反应能力强,化学稳定性好,因此在细菌趋化性检测时,常用作芯片的基片材料。PMMA具有良好的透光性、一定的耐冲击性和耐久性,但是与微生物的相容性差,存在难以进行表面修饰的问题,且可变性较强,因此实验过程中再现性差[6,7]。PC是一种强韧的热塑性树脂,具有良好的透光性、耐热性、耐冲击性和抗氧化性,在适宜温度范围内具有良好的机械性能,但是PC材料耐水解稳定性不高,耐磨性差,且易受有机化学品侵蚀,因此需要在芯片材料的耐受性范围内选择实验条件[8]。PDMS又称硅橡胶,是目前制作微流控芯片应用最多的一种材料。该材料透光度/透气性好、化学惰性强、无毒廉价、韧性好、强度高,且可以通过等离子体氧化直接与自身或其他材料进行粘合或键合,不需要粘合剂。但PDMS具有疏水性,会造成通道中积蓄气泡,通过表面修饰改性能够解决该问题;PDMS能吸收周围环境中的有机溶剂和小分子物质,在用于微生物趋化性实验时,通道内的生物分子和某些药物分子会被PDMS材料吸收,对实验结果造成影响,因此需要对其进行修饰和改性,如利用硅原子[10]、聚电解质多层膜[11]、表面活性剂涂层[12]及磷脂双层膜[13]等对PDMS进行修饰,以满足实验要求[9]。
2.2趋化性微流控芯片的结构特点
用于研究细菌趋化性的微流控芯片除了要满足材料、温度等的要求外,还要考虑到细菌的生理活动特征。基于微流控芯片的细菌趋化性研究表明,不同生理特性的细菌所需的实验条件不同,因此需要对微流控芯片的结构与通道内部环境进行精确设计与调控[14]。
一方面,细菌会向狭小空间或死角聚集,使该区域的细菌浓度升高。Park等[15,16]为了探究细菌在微小结构中的行为,设计了一种微结构(图1A),中间为250 μm × 250 μm的方形浓缩池,通过40 μm宽的通道与外界相连。实验时向芯片内通入菌液,使细菌均匀分布,经过一段时间后,观察到细菌会通过微细通道聚集到方形浓缩池中。在此基础上,该研究组又设计了一种迷宫结构(图1B),发现细菌会在半封闭区域聚集,从而使菌浓度升高,这是由于细菌自身生理活动分泌出的某些物质,可作为细菌的趋化剂而发挥作用。可见,在利用微流控芯片进行细菌趋化性实验时,需要考虑到细菌运动的特性,避免通道中出现死角,积存细菌,或直接利用这一特性在芯片中设计浓缩孔,使细菌聚集,便于对细菌进行量化分析,并且有效降低检测限。
另一方面,细菌能够通过分裂繁殖或者改变自身形态穿过微米级通道[17,18]。Mannik等[18]设计了含有亚微米级通道结构的微流控芯片(图1C),微细通道由6个腔室分隔开,并且逐级变细,通过各级通道内菌的运动,探究菌的移动情况。结果表明,大肠杆菌在0.4~0.8 μm通道内能利用鞭毛进行自主运动,而在小于0.4 μm(小于大肠杆菌直径)通道内,会通过分裂繁殖或改变自身形态穿过通道进入下一个腔室,亚微米级的通道和腔室可以使得细菌有更加丰富的生理形态,增加了细菌形态的多样性。因此,在设计微流控芯片时需考虑到细菌的这一特性,根据所需的实验条件设计通道宽度,保证细菌在通道的运动状态和活动范围。
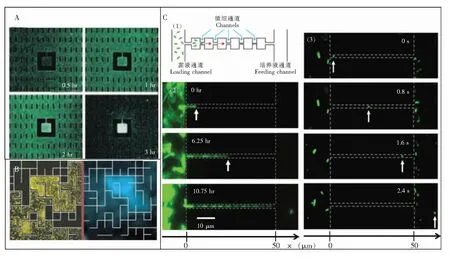
图1 细菌在微米级通道内的运动情况: (A)GFP标记的大肠杆菌在芯片内分布情况荧光图像,大肠杆菌通过40 μm宽的微米级通道进入250 μm×250 μm的中央浓缩孔,3 h后孔内的菌浓度比外部菌浓度高近7倍[15,16];(B)左图为哈维氏弧菌在迷宫结构芯片中培养8 h后的暗场成像,右图为反应菌体内部荧光反应的光子计数成像,表示细菌高度聚集区域的活跃群体感应现象[15,16];(C)细菌在微细级通道内的运动行为,(1)实验芯片结构图,(2)细菌在0.6 μm的通道内的运动情况,(3)细菌在1.2 μm宽的通道内的运动情况[18]。Fig.1 Movement of bacteria in microchannels: (A) Epifluorescence images of green fluorescent protein(GFP)-labeled E. coli in M9 minimal media as they accumulate into a central 250 μm × 250 μm enclosure via a 40-μm-wide channel. After 3 h the density of cells inside is more than seven times greater than outside[15,16]. (B) Dark-field image of V. harveyi after cultivation for 8 hours in the maze. Photon-counting image of the intrinsic luminescence, indicating active quorum sensing in areas where the cells have accumulated at high density[15,16]. (C) Setup for studying bacterial movement in small constrictions. (1) Schematic of the experiment. (2)Time-lapse fluorescent images of bacterial growth in a 0.6 μm wide channel. (3) Time-lapse images of an E. Coli bacterium that swims through a 1.2-μm wide channel[18].
3 用于细菌趋化性检测的微流控装置
用于研究细菌趋化性的微流控芯片需要在通道内形成一定的浓度梯度,根据其微流控芯片通道内部形成浓度梯度的方式,可以将其分为基于动态流体的微流控装置(Flow-based microdevice)和基于静态扩散的微流控装置(Diffusion-based microdevice)[19],两者各有优缺点和适用范围。
3.1动态流体微流控装置
动态流体微流控装置主要通过设计不同构型的微通道,利用通道中液体的层流混合建立浓度梯度[19]。其优势在于可以通过改变芯片微通道构造或液体流速等条件,在通道内快速形成多种分布形式的稳定浓度梯度。
第一个“T”型通微流控芯片是由Mao等[21]在2003年设计并提出的(图2A)。装置由两侧入口分别通入趋化剂和缓冲剂,两溶液在主通道汇合,基于通道内两层流体间的扩散产生浓度梯度,在出口处设计了呈扇形对称分布的22条回收通道,因此实现了细菌趋化性的定性及定量分析。利用此装置进行了大肠杆菌对几种氨基酸的趋化性检测,其灵敏度高,检测限相比于毛细管检测法低了近3个数量级,作者还通过实验进一步发现了大肠杆菌对L-亮氨酸的双重趋化反应。在这款微流控装置中,趋化性实验结果是通过通道末端22个回收通道中的相对菌量测定的,因此细菌在通道内的运动行为会对测量结果有很大影响,通道内流体对细菌运动的干扰会使测量结果存在一定的偏差。其次,主通道上游位置的趋化剂浓度梯度最高,沿通道向下会由于层流液体间的扩散作用逐渐降低,使得细菌的趋向运动发生变化,加快液体流速会减缓扩散的发生,但同时也会减小细菌与趋化剂的接触和响应时间,影响测量结果的精确度。
Lanning等[22]在文献[20]的三入口平行流通道基础上又设计了一种微流控芯片,装置也呈“T”型,但只有两个入口(图2B)。细菌菌液不是作为单独的液流通入通道内,而是将细菌加入到缓冲溶液及趋化剂中,从两个入口同时通入芯片,初始阶段细菌沿通道横向呈均匀分布,沿通道向下,两液体扩散混合产生趋化剂浓度梯度,细菌的分布会逐渐发生变化,不再呈现均匀分布。该研究使用光散射法对细菌分布进行测量,将观察所得的分布结果与细菌运动方程[23]的数值解进行拟合,得到趋化灵敏度系数[24]。作为对照实验,在通道内充满液体后停止通入,使液体不再流动,只在横向上发生扩散,取固定位置,观察细菌分布随时间的变化情况,结果表明,0.1~1.0 mm/s的流量不会影响大肠杆菌在通道内的趋化迁移,说明细菌在通道内的运动是由趋化性而非水力因素或非生物因素引起的。该装置保证了细菌初始阶段在通道内的均匀分布,更加还原了自然环境条件下细菌的分布状况,可用于研究地下水或土壤中细菌的趋化性行为。
Kim等[25]开发了一种“Y”字型的微流控芯片(图2C),其结构特点在于主通道两侧由箭头形棘齿结构组成的浓缩孔阵列。3个入口包括两侧的趋化剂入口、缓冲剂入口及中间的菌液入口,实验中主通道内会形成趋化剂的浓度梯度,诱导细菌从中间向两侧做偏移运动,表现出趋化性,并根据通道两侧浓缩孔中细菌浓度量化表征趋化性。浓缩孔的箭头形棘齿结构有利于对细菌进行分离诱导,使其只能单向移动进入浓缩孔且不易逸出,可以在浓缩孔中积累细胞,从而提高了细菌趋化反应的检测灵敏度。这一装置优于其它“Y”型通道的特点在于可以通过分析通道不同距离处浓缩孔内的细菌浓度,对特定趋化剂条件下化学受体的灵敏度进行定量分析及对比,空间与时间两个维度上实现对细菌趋化性行为进行探究和表征。但由于棘齿型浓缩孔结构对细节加工的要求较高,且容易在浓缩孔中聚集难以排除的气泡,因此需要在实验前与实验过程中对芯片进行清洗与抽真空处理。
“圣诞树”型结构[26]是最常见的浓度梯度微流控芯片结构,该结构前端设置有两个入口,分别通入趋化剂溶液与缓冲溶液,通过层层分流与混合后汇入同一条通道,由于层流作用在通道内形成浓度梯度。Englert等[27]在此基础上设计了一种微流控芯片(图2D),将“圣诞树”型通道装置与“Y”型通道相连接,趋化剂溶液与缓冲溶液同时通入芯片,流经“圣诞树”型通道形成浓度梯度后,进入“Y”型通道内,通入“Y”型通道的细菌直接进入到已经建立好的浓度梯度溶液中,避免了细菌突然暴露在高浓度趋化剂下而扰乱其化学感受器,并且保证细菌对趋化剂浓度梯度有足够的反应时间,从而提高了微流控芯片的检测精度。
动态流体微流控装置需要从外部接入压力注入设备,并且会使细菌暴露在流体剪切力下,使细菌除自身运动外,还受到外部压力的影响。此外,在流体微流控装置中,通道内的趋化剂浓度梯度分布沿通道向下会发生变化,因而细菌在通道内的运动也会受到一定影响。
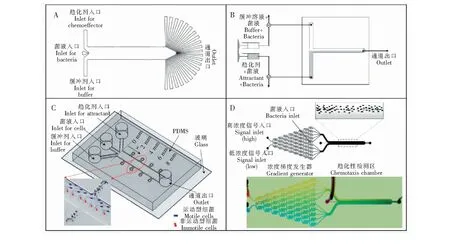
图2 动态流体微流控芯片装置: (A)扇形分布出口的微流控芯片装置,设有3个入口及22个均匀分布的出口[21];(B)“T”型通道装置,设有两个入口分别通入菌液和趋化剂[22];(C)“Y”型通道装置,主通道的两侧设置有箭头型棘齿结构浓缩空阵列[25];(D)“圣诞树”结构通道装置,由圣诞树结构的浓度梯度发生器和Y型趋化性检测区域组成[27]。Fig.2 Flow-based devices for microfluidic chemotaxis assays: (A) A fan-distribution outlets microfluidic chip device with 3 inlets and 22 outlets[21]; (B) A T-shape device with two inlets for bacteria and attractant[22]; (C) Y-shaped device that combined with arrowhead-shaped ratchet structures beside the main channel[25]; (D) Schematic representation of the μFlow device. The device consists of a gradient-mixing module and a chemotaxis observation module[27].
3.2静态扩散微流控装置
静态扩散微流控装置克服了动态流体微流控装置的缺点,它是在静态稳定的无流体环境中,建立化学物质的浓度梯度,细菌仅依靠自身扩散表现趋化性。此设备可以不依赖于外部压力设备, 并且可以保证外部流体对细菌运动的影响达到最小化,但是,扩散微流控装置在对化学物质浓度梯度分布的控制上灵活性较差。静态扩散微流控装置主要是在微流控芯片通道中或通道下方加入多孔介质,如水凝胶、琼脂糖层等,能够在无液体流动的情况下提供稳定的趋化剂浓度梯度,此类装置主要有3种工作方式: 一通道法、两通道法和三通道法[28]。
一通道法是将趋化剂溶液和缓冲溶液两平行流体通入通道内并稳定后,停止流动,细菌处在由停流扩散产生的趋化剂浓度梯度下,这种方式只能建立不稳定的浓度梯度,维持时间较短。Seymour等[29]设计了一个两入口单通道微流控芯片(图3A),两入口分别通入趋化剂和菌液,待液流稳定后关闭注射器泵,由于通道内液体为层流状态,可认为在注射器泵关闭时,通道内流体立刻停止流动,只进行静态扩散,细菌也会在趋化作用下进行横向运动。利用此芯片研究了3种海洋微生物对多种趋化因子的趋化反应,还分析了细菌群在营养斑块内的移动速度,证实了一些海洋细菌能够进行快速持续的趋化反应。这一装置还可实现两种分析模式: (1)实时观测细菌群体数据,可以确定实验过程中的趋化迁移率、解离常数、趋化敏感性及随机运动系数;(2)单细胞数据,可以获得趋化性行为的运动速度、运动时间、移动距离及旋转角度的信息。其优点是可以同时测量细菌分布和运动轨迹以及趋化剂浓度分布,并且还可以将细菌运动及分布情况与趋化剂的浓度分布联系起来进行测量与分析。
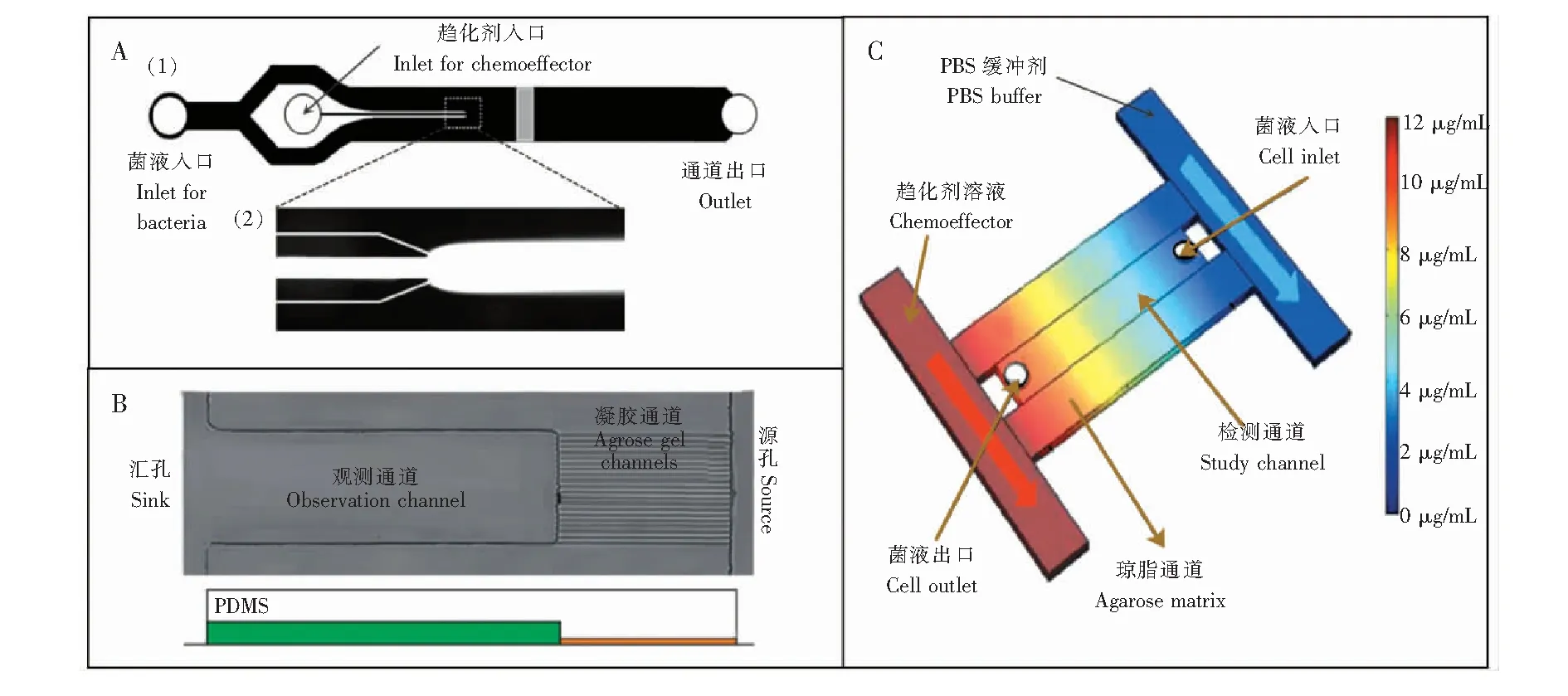
图3 静态扩散微流控芯片装置: (A)有独立菌液入口和趋化剂入口的单通道装置,(1)结构示意图,(2)为虚线框内的荧光图像[29];(B)设有凝胶通道与观测通道的微流控芯片,在观测通道内无液体流动[30];(C)装置包含两条主通道和3条垂直通道,图中颜色表示不同位置处染色剂的不同浓度,浓度与颜色对应值在右侧图例标出[19]。Fig.3 Diffusion-based devices for microfluidic chemotaxis assays: (A)Single channel microfluidic device with separate inlet for bacterias and for chemotaxis, (1)Schematic of the device,(2)Epifluorescent image of the region in the dashed box[29]; (B)Microfluidic device with agarose gel channel and observation channel where is no flow[30]; (C)Microfluidic device with two main channels and three vertical channels, Colors in the figure represent different concentrations of the dye at different locations in the device, The concentration of the dye corresponds to each color is shown in the legend[19].
两通道法是通过源通道和汇通道在静态流体室内产生稳定的浓度梯度,将细胞暴露在稳定无液体流动的二维浓度梯度下。Si等[30]设计的微流控芯片(图3B),通道两端设有源孔和汇孔,由一条通道连接,源孔一侧的通道是由琼脂凝胶填充的20条平行通道,称为琼脂凝胶通道,在汇孔一侧的通道为细菌可以自由运动的观测通道。实验时,首先向汇孔内加入菌液,静置1 h,使细菌通过自由扩散进入到观测通道;再向源孔加入所需检测的趋化剂溶液,通过扩散进入琼脂凝胶通道和观测通道,形成精确的浓度梯度,细菌会产生相应趋化反应。该装置操作简单,可以表征及对比分析细菌对几种不同趋化剂/驱避剂的趋化性反应,还可筛选趋化性种群类型,实现对趋化剂和驱避剂的快速检测和量化分析。Murugesan等[19]设计的芯片(图3C)可在约10 mm宽的通道内建立稳定的浓度梯度,使趋化性实现可视化,并大大提高了趋化性的检测范围,作者选用山梨糖醇为趋化剂,硫酸镍为驱避剂,分别做了正/负趋化性实验,以及双重趋化剂浓度梯度实验,与此相比,其它微流控装置只能在几微米的宽度内建立浓度梯度。在实验过程中,源/汇通道内的流体处于流动状态,且流体压力极难平衡,非常容易对静态流体室内的细菌运动造成大的干扰,甚至导致细菌逃逸。
三通道法则通过纳米结构膜、凝胶层等多孔材料形成更稳定的静态流体室,极大地减少了汇/源通道内的流体流动对中间检测通道的干扰。Weng等[31]设计了一款微流控芯片研究尿素对幽门螺旋杆菌趋化性的影响,该装置设有3条微通道,中间通道为静态流体室,通过纳米结构膜与两侧的源/汇通道隔开(图4A),实验时先通入菌液,待菌液充满通道后封闭出入口,并向两侧的通道中分别通入缓冲剂和尿素溶液,尿素分子会透过纳米结构膜扩散进入静态流体室,产生浓度梯度。实验结果,除通过荧光强度进行细菌群体运动趋势的观察外,优良的结构设计使检测系统捕捉和记录到了单个细菌体的旋转和翻滚行为,并发现随尿素浓度梯度增加,幽门螺旋杆菌的运动速率会下降。为了方便灵活调控结构孔径,Son等[32]开发了另一种结构方式,即在源/汇通道与细菌检测通道之间设置PDMS微柱阵列,并通入液体凝胶,待凝胶固化将源/汇通道与检测通道隔开(图4B),实验时先向检测通道通入菌液并封住出入口,从而在细菌检测通道形成静态流体室。通过这一装置对海洋细菌溶藻弧菌的趋化性行为进行了探究,结果表明,与大肠杆菌不同,溶藻弧菌的趋化性运动的强弱并非取决于趋化剂浓度梯度,而主要由其运动速度决定,提出了一种由运动速度建立起来的新的趋化性运动模型。Ahmed等[23]构建了基于水凝胶的微流控芯片(图4C),与上述实验建立的线性浓度梯度相比,此装置通过中间通道的特殊构型实现了不随时间变化的非线性浓度梯度分布,探究了线性浓度梯度(图4C(1))和非线性浓度梯度(图4C(2))两种模式下的趋化性反应,通过实验得到了大肠杆菌在线性及非线性浓度梯度下的趋化性分布情况,结果与数学模型预测结果较为相符。Kim等[33]也利用结构类似的三通道微流控芯片,探究了沙雷氏菌在氧气或/和核黄素浓度梯度下的趋化性运动,结果表明,沙雷氏菌会趋向高氧浓度或高核黄素浓度的方向运动;此外,与有氧条件相比,沙雷氏菌在无氧条件下对核黄素的趋化性趋势显著增强,证明了双电子受体在沙雷氏菌的趋化性和运动中的重要性。Zhuang等[34]的实验研究对象不是个体分散的细菌,而是表面黏附有粘质沙雷氏菌的聚苯乙烯颗粒(图4D),通过对细菌驱动的微颗粒的运动轨迹进行统计分析,首次阐明了附着于微结构上细菌群的合作趋化性的基本作用机制,结果表明,不同于单个细菌匀速且定向的趋化性运动,细菌驱动微颗粒的运动速度相对稳定,但运动方向是不断变化的。

图4 静态扩散微流控芯片装置: (A)通过纳米结构膜分割开3条通道,尿素分子可以穿过膜在检测通道形成浓度梯度[31];(B)芯片制作完成后,通过凝胶入口通入液体凝胶,在源/汇通道与检测通道之间形成凝胶层[32];(C)基于扩散的微流控芯片装置示意图,可以建立线性浓度梯度(1)和非线性浓度梯度(2)[23];(D)基于凝胶层的三通道结构,表面附有粘质沙雷氏菌的聚苯乙烯颗粒作为研究对象通入中间的检测通道[34]。Fig.4 Diffusion-based devices for microfluidic chemotaxis assays: (A)Three channels was separated by the nanostructured membrane, urea molecules can pass through the membrane and form a concentration gradient in the test channel[31];(B)After the chip was finished, the liquid hydrogel was passed into the inlet and formed a hydrogel layer between the source/sink and the test channel[32];(C)Schematic of a diffusion-based device which can generate gradient for (1) linear and (2) nonlinear gradients[23].;(D)A three-channel microfluidic chip based on hydrogel, the microswimmers that attached by Serratia marcescens bacteria is introduced into the test channel[34].
4 微流控趋化性检测的应用
研究微生物趋化性对于控制病原菌侵染机体、研究细菌抗药性、利用细菌治理环境以及开发微生物工业项目等方面都具有重要的研究价值。微流控芯片在细菌迁移和趋化性研究方面的技术已逐渐趋于成熟,因此将微流控检测法应用于趋化性研究,在生物医学、环境学等领域也引起广泛关注。
趋化性在微生物的致病机理中起着重要的作用,很多情况下病原细菌需要依靠趋化性进行运动。而在生物医学方面,对人体内特定细胞的趋化性进行研究也有着重要的意义。Butler等[35]开发了一种简单的微流控装置(图5A),探究了人体内中性粒细胞与烧伤细胞的关系。装置由一条主通道和侧面几条垂直排列的侧向通道构成,实验中,首先向主通道中通入趋化剂,在压力作用下趋化剂会流入侧向通道,待侧向通道内充满趋化剂溶液后停止通入;然后将中性粒细胞悬浮在缓冲溶液中通入主通道,由于溶液的层流混合扩散作用,在侧向通道内会形成趋化剂的浓度梯度,中性粒细胞则会在趋化性作用下向侧向通道内运动,根据侧向通道内中性粒细胞的数量对其趋化性进行定性及定量分析,可以运用该装置对潜在性自身免疫性疾病进行诊断。
在抗药性研究方面,可以通过微流控趋化性技术实时观察跟踪细菌的变化,从而更加深入地了解细菌的抗药性。Zhang等[36]设计了一种可产生浓度梯度的微流控芯片(图5B),上侧通道通入细菌营养液,下侧通道通入细菌营养液和环丙沙星(约高于最小抑制浓度200倍),在两通道之间形成了环丙沙星的浓度梯度,将细菌加入到芯片中间的腔室,在10h时便在含有环丙沙星的通道内出现了细菌,即为抗药性细菌,结果表明细菌在不均匀的环境条件下会更快地出现抗药性。Balaban等[37]用微流控芯片跟踪了暴露于抗生素的大肠杆菌的生长,细菌个体在抗生素作用下生长速度慢,但当重新通入培养基时它们也能够转变到正常状态再生长。Jiang等[38]采用微流控芯片系统(图5C)对抗生素敏感细菌及耐药性细菌进行了研究,结果表明无论是耐药性细菌还是敏感细菌,其中生长速率慢的细菌都表现出更强的抗药性。

图5 微流控趋化性研究在致病机理及抗药性研究中的应用: (A)左侧主通道内通入中性粒细胞悬浮液,其中中性粒细胞在趋化性作用下进入右侧的测向通道[35];(B)细菌抗药性研究芯片简图,中间为细菌通入腔室,上下边缘通道为培养基及抗生素流经通道[36];(C)细菌抗药性及耐药性研究芯片装置,装置分为4个主通道,每条主通道两侧都有小的细菌培养腔室[38]。Fig.5 Applications in pathogenic and drug resistance of microfluidics-based chemotaxis studies: (A)Microfluidic chip with meutrophils in the main channel[35]; (B)An overview of the microfluidic chip showing the flow of the nutrient streams and the nutrient +Cipro containing streams[36]; (C) Microfluidic chip which can monitor the responses of sensitive and drug resistant strains, including four separated main channels and small chambers on both sides of the channels[38].
此外,微流控趋化性检测在环境中的应用也逐渐得到重视,主要包括环境监测、物质的毒性测试、土壤中或水中的细菌对污染物的趋化性等。Buffi等[39]将一种与砷接触会发出绿色荧光的大肠杆菌包裹在琼脂糖小球中放入微流控芯片(图6A),使小球聚集在芯片下游的腔室中,当含有砷的水样通入芯片后,与腔室中小球内部的大肠杆菌接触反应,使大肠杆菌发出绿色荧光,根据大肠杆菌发出荧光的强弱可检测水中砷的含量,检测限可精确到μg/L级别;Zheng等[40]采用了“圣诞树”型结构的微流控芯片来探究重金属毒性(图6B),这一装置是通过圣诞树结构产生浓度梯度,在下半部趋化性检测部分的小室中通入海洋微藻,微藻由于不同浓度的重金属影响,其运动行为受到了干扰,最后通过计算芯片小室中海洋微藻的运动来检测重金属的毒性。Boehm等[41]开发了一种可以快速检测和识别细菌的微流控芯片(图6C),该芯片基于电阻抗的方法检测细菌,通过固定的单克隆抗体,成功检测出水中浓度为104CFU/mL的大肠杆菌。
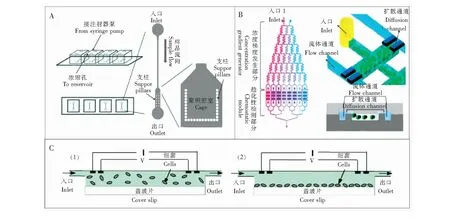
图6 微流控趋化性研究在环境中的应用: (A)将细菌趋化性用于探究污水中砷含量的微流控芯片[39];(B)将圣诞树结构微藻动力检测微流控芯片应用于重金属毒性检测[40];(C)悬浮细胞(1)或附着细胞(2)阻抗式细胞传感器应用于水中细菌的快速检测[41]。Fig.6 Application of microfluidics-based chemotaxis studies in environment: (A) A microfluidic biosensor for arsenite detection in aqueous samples[39]; (B) Microalgal motility measurement microfluidic chip for toxicity assessment of heavy metals[40]; (C) Schematic drawing of impedance-based bacteria sensor for suspended (1) and attached cells (2)[41].
目前,在环境领域,微流控芯片的研究主要集中在大肠杆菌、铜绿假单胞杆菌等常见易培养的细菌,如果将微流控芯片技术引入到污水细菌的研究中,把传统的摇瓶、孔板或反应器转变为小的芯片,可能会为污水中细菌的抑制或降解实验提供一种新的方法,并获得比传统实验方法更多的信息。
5 结 语
由于微流控装置的材料和结构灵活多变、易于调控,且可以根据检测需要选择合适的工作方式,因此为微生物趋化性检测提供了新的方法。但是,在未来的发展中,仍然需要解决一些瓶颈问题,主要包括: (1)功能单一,目前的研究多数停留在趋化性检测的定性与定量阶段,难以实现有效的混菌筛选。(2)定量分析困难,现有的研究更多集中在趋化剂浓度梯度调控和和流体剪切力影响,对于微生物所处微环境的更多要素缺少调控。(3)预处理问题,如何减少预处理对微生物活性的影响,尤其是厌氧微生物或者未培养微生物。(4)检测手段的局限性,虽然荧光标记技术获得了快速的发展,但是相对种类庞大的微生物家族仍然不足。微流控与电化学以及拉曼成像技术的结合或将成为解决途径。
随着微流控技术的不断发展,趋化性检测技术会趋于更加便携可控、形式创新的方向发展,不仅在实验应用中提供便利,还会在实际工程中发挥重要作用。
1 LOU Zheng, JIANG De-Gao.MicrobiologyChina,1986, 13(5): 32-36
娄 峥, 江德杲. 微生物学通报,1986, 13(5): 32-36
2 LI Yan, MOU Bo-Zhong.Chin.J.Appl.Environ.Biol.,2006, 12(1): 135-139
李 燕, 牟伯中. 应用与环境生物学报,2006, 12(1): 135-139
3 Wu M.IntegrBiol,2010, 2(11-12): 604-629
4 YANG Xiu-Juan, LI Xiang, TONG Yan-Li, LI Ou-Lian, LIU Cui, CHEN Zuan-Guang.Chin.J.CellBiol.,2008, 30(6): 721-726
杨秀娟, 李 想, 童艳丽, 李偶连, 刘 翠, 陈缵光. 中国细胞生物学学报,2008, 30(6): 721-726
5 LIN Bing-Cheng, QIN Jian-Hua.LaboratoryonaMicrofluidicChip. Beijing: Science Press,2008: 16
林炳承, 秦建华. 微流控芯片实验室. 北京: 科学出版社,2008: 16
6 Barker S L, Tarlov M J, Canavan H, Hickman J J, Locascio L E.Anal.Chem.,2000, 72(20): 4899-4903
7 Hulme J P, And P R F, Goddard N J.Anal.Chem.,2004, 76(1): 238-243
8 Roberts M A, Rossier J S, Paul Bercier A, Girault H.Anal.Chem.,1997, 69(11): 2035-2042
9 Ng J M, Gitlin I, Stroock A D, Whitesides G M.Electrophoresis,2002, 23(20): 3461-3473
10 Roman G T, Hlaus T, Bass K J, Seelhammer T G, Culbertson C T.Anal.Chem.,2005, 77(5): 1414-1422
11 Liu Y, Fanguy J C, And J M B, Henry C S.Anal.Chem.,2007, 72(24): 5939-5944
12 Dou Y H, Bao N, Xu J J, Chen H Y.Electrophoresis,2002, 23(20): 3558-3566
13 Yang T, Jung S, Mao H, Cremer P S.Anal.Chem.,2001, 73(2): 165-169
14 Wu J, Wu X, Lin F.LabChip,2013, 13(13): 2484-2499
15 Park S, Wolanin P M, Yuzbashyan E A, Lin H, Darnton N C, Stock J B, Sliberzan P, Austin R.Proc.Natl.Acad.Sci.USA,2003, 100(24): 13910-13915
16 Park S, Wolanin P M, Yuzbashyan E A, Silberzan P, Stock J B, Austin R H.Science,2003, 301(5630): 188
17 Männik J, Wu F, Hol F J H, Bisicchia P, Sherratt D J, Keymer J E, Dekker C.Proc.NatlAcadSci.USA,2012, 109(18): 6957-6962
18 Männik J, Driessen R, Galajda P, Ketmer J E, Dekker C.Proc.Natl.AcadSci.USA,2009, 106(35): 14861-14866
19 Murugesan N, Singha S, Panda T, Das S K.J.Micromech.Microengin.,2016, 26(3): 035011
20 Wolfram C J, Rubloff G W, Luo X.Biomicrofluidics,2016, 10(6): 061301
21 Mao H, Cremer P S, Manson M D.Proc.Natl.Acad.Sci.USA,2003, 100(9): 5449-5454
22 Lanning L M, Ford R M, Long T.Biotechnol.Bioeng.,2008, 100(4): 653-663
23 Ahmed T, Stocker R.Biophys.J.,2008, 95(9): 4481-4493
24 Lewus P, Ford R M.Biotechnol.Bioeng.,2001, 75(3): 292-304
25 Kim M, Kim S H, Lee S K, Kim T.Analyst,2011, 136(16): 3238-3243
26 Jeon N L, Dertinger S K W, Chiu D T, Choi I S, And A D S, Whitesides G M.Langmuir,2000, 16(22): 8311-8316
27 Englert D L, Manson M D, Jayaraman A.Appl.Environ.Microbiol.,2009, 75(13): 4557-4564
28 Ahmed T, Shimizu T S, Stocker R.NanoLett.,2010, 10(9): 3379-3385
29 Seymour J R, Ahmed T, Marcos, Stocker R.Limnol.OceanograMeth.,2008, 6(5): 477-488
30 Si G, Yang W, Bi S, Luo C, Ouyang Q.LabChip,2012, 12(7): 1389
31 Weng X, Neethirajan S, Vogt A.Appl.Sci.,2016, 6(5): 1-9
32 Son K, Menolascina F, Stocker R.Proc.Natl.AcadSci.USA,2016, 113(31): 8624-8629
33 Jun K B, Chu I, Sebastian J, Tiffany K, Micheala A, TerAvest, Largus T A, Wu M M.FrontMicrobiol.,2016, 7: 1438
34 Jiang Z, Sitti M.Sci.Rep.,2016, 6: 32125
35 Butler K L, Ambravaneswarn V, Agrawal N, Bilodeau M, Tomer M, tompkins R G, Fagan S, Irimia D.PolsOne,2015, 5(7): e11921
36 Zhang Q, Austin R H.Science,2011, 333(6050): 1764-1767
37 Balaban N Q, Merrin J, Chait R, Kowalik L, Leibler S.Science,2004, 305(5690): 1622-1625
38 Jiang X, Kang Y, Pan X, Yu J, Ouyang Q, Luo C.Integr.Biol.,2014, 6(2): 143-151
39 Buffi N, Merulla D, Beutier J, Barbaud F, Lintel H, Renaud P, Meer J R.LabChip,2011, 11(14): 2369-2777
40 Zheng G, Wang Y, Qin J.Anal.Bioanal.Chem.,2012, 404(10): 3061-3069
41 Boehm D A, Gottlieb P A, Hua S Z.Sens.ActuatorsB,2007, 126(2): 508-514
This work was supported by the National Natural Science Foundation of China (No.61674046).
AdvanceinBacteriaChemotaxisonMicrofluidicDevices
ZANG Xiao-Qian1, LI Zhe-Yu1, ZHANG Xiao-Yan1, JIANG Lei2, REN Nan-Qi1, SUN Kai*1
1(StateKeyLaboratoryofUrbanWaterResourceandEnvironment,
HarbinInstituteofTechnology,Harbin150090,China)
2(TechnicalInstituteofPhysicsandChemistry,ChineseAcademyofSciences,Beijing100101,China)
Chemotaxis is the response ability of motile cells to chemicals gradients in environment and the migration toward higher concentration of chemoattractant or lower concentration of repellent. This mechanism is a basic nature of microorganisms to adapt to the environmental changes. The research of microbial chemotaxis is of great significance in utilizing bacteria to solve environment problems, control the pathogen infection, and develop microbial industrial projects. Microfluidic devices can realize qualitatively and quantitatively detect of bacterial chemotaxis. In comparison with traditional detect methods, microfluidic assay has an accurate control over bacterial microenvironment, with a higher sensitivity. In the past few years, bacterial chemotaxis study based on microfluidic assay was developed rapidly. In this paper, the microfluidic chemotaxis detectors that appeared in recent years were introduced from the aspect of chip structure, working principle and their applications. Finally, we provided insights into the challenges of bacterial chemotaxis and provided future perspectives.
Macrofluidics; Bacteria; Chemotaxis; Microenvironment; Review
24 April 2017; accepted 18 May 2017)
10.11895/j.issn.0253-3820.170259

