纳米基因扩增技术及其应用
桑付明 李 鑫 刘 佳
(哈尔滨工业大学(威海)海洋科学与技术学院, 威海 264209)
纳米基因扩增技术及其应用
桑付明*李 鑫 刘 佳
(哈尔滨工业大学(威海)海洋科学与技术学院, 威海 264209)
聚合酶链式反应(PCR)是20世纪80年代中期发展起来的一种应用广泛的体外DNA扩增技术,但目前该技术仍然存在着一些问题,如特异性差、灵敏度低和假阳性等。近年来,随着纳米科技的发展,一些纳米粒子如金属纳米粒子、碳纳米材料、量子点和纳米金属氧化物等被引入到PCR反应体系中,即纳米基因扩增技术(NanoPCR)。该技术大幅度提高了PCR的扩增效率、选择性、灵敏度和特异性,推动了生物学技术的发展,具有非常重要的理论意义和应用价值。本文综述了近年来纳米基因扩增技术的主要研究进展、反应机理,并探讨了其应用研究。
纳米基因扩增技术; 纳米材料; 特异性; 扩增效率; 热启动;评述
2017-02-17收稿; 2017-09-04接受
本文系国家自然科学基金(No. 21407035)、山东省自然科学基金(No. ZR2014BM021)和威海市大学共建项目(No. 2014XGJ15)资助
* E-mail: sangfuming@hitwh.edu.cn
1 引 言
聚合酶链式反应(PCR)是美国的Mullis于1985年提出的可以在体外进行特定DNA复制的技术[1]。PCR技术操作简单省时,可将微量的目的基因片段在短时间内扩增到数百万倍,已广泛用于基因克隆[2]、DNA测序[3]、基因分析[4]、基因芯片[5]及法医学[6]等领域。尽管PCR技术发展已经很成熟,但在实际操作中,始终存在一些问题,如假阴性、假阳性、产物特异性差、扩增效率低甚至不扩增,以及富含GC碱基对的DNA很难通过PCR扩增得到产物[7]等情况,限制了PCR技术的进一步发展及其更广泛的应用,因此如何提高PCR技术的特异性、灵敏度及稳定性至关重要[8]。目前,采用较多的方法是使用PCR增效剂,如二甲亚砜(DMSO)、甘油、甲酰胺和甜菜碱等[9~11]。这些增效剂有利于减少DNA的二级结构并降低GC富集区的熔点及解链温度,有助于模板完全变性,促进模板与引物的特异性结合,因此在一定程度上提高了PCR的扩增效率和特异性,但其扩增结果仍然不理想,未完全解决PCR中存在的上述难题。
近年来,纳米材料由于其独特的化学、物理特性,例如大的比表面积、小尺寸效应等,受到研究者的广泛关注,并逐步渗透到生命领域,推动了生命科学技术的发展。一些纳米材料如纳米金[12]、量子点(Quantum dots, QDs)[13]、碳纳米管[14]等被应用到PCR扩增中,形成了纳米基因扩增技术(NanoPCR)。该技术显著地提高了PCR的特异性、扩增效率及灵敏度,并加快了PCR反应进程,已成为当前的研究热点。本文主要从各种纳米材料对PCR扩增技术的影响、机理探讨及其应用3个方面分别进行概述。
2 纳米材料对PCR扩增体系的影响
纳米材料晶粒极小,比表面积大,因而具有许多特殊的性质,如表面效应、量子效应等,但不同的纳米材料又有不同的特性,如水溶性、生物相容性及热稳定性等[15],因此对PCR体系的影响也不相同。
2.1纳米金对PCR体系的影响
Li等[12]首先用柠檬酸钠为稳定剂制备粒径为10 nm的纳米金,作为PCR增效剂进行实验。当纳米金浓度为0.4~0.8 nmol/L时,提高了两轮再扩增体系的特异性,明显抑制了非特异性片段的扩增(图1)。但当纳米金浓度超过1.0 nmol/L时,过量的纳米金对PCR产生抑制作用。另外,即使在较低的退火温度(25 ~40℃)下,PCR扩增特异性仍然非常高,即纳米金拓宽了PCR的退火温度。随后,Pan等[16]以多轮PCR为研究体系,发现加入纳米金后,经过六轮扩增,仍然可得到特异性强的目标条带,而普通PCR体系(未加入纳米金)扩增到第四轮时就不能得到目标条带,这进一步证实了纳米金可以提高PCR扩增的特异性。Vu等[17]以多重PCR为研究体系,研究纳米金对PCR扩增的影响。他们认为纳米金不能直接提高PCR特异性,而是更有利于体系中小片段DNA的扩增,对大片段DNA的扩增起抑制作用;另外,他们推测AuNPs的这种作用源于其良好的表面效应而非热传导效应,且纳米金与DNA聚合酶吸附作用更强,导致体系中聚合酶的实际浓度降低,促进了小片段的扩增。
Li等[18]研究了0.7 nmol/L 纳米金(13 nm)对PCR扩增的影响,发现纳米金可以显著提高PCR扩增效率,缩短反应时间。他们对不同的PCR体系、不同DNA聚合酶及不同长度的DNA片段分别进行研究,发现对于普通PCR,其灵敏度可以提高5~10倍,而对于实时定量PCR,至少可以提高104倍。Li等[18]将纳米金的这些作用归于其良好的热传导性,可以有效改善PCR体系的升降温速率。纳米金有助于双链DNA的解链,利用这一点,Yang等[19]研究发现,加入纳米金可以促进高GC模板GNAS1启动子区域(~84%GC)的扩增。Girilal等[20]则从生物合成的角度出发,用嗜热脂肪土芽孢杆菌的无细胞提取物来合成纳米金。该方法合成的纳米金具有良好的热传导效应和热稳定性,可以缩短PCR的反应时间,提高其特异性、扩增效率。
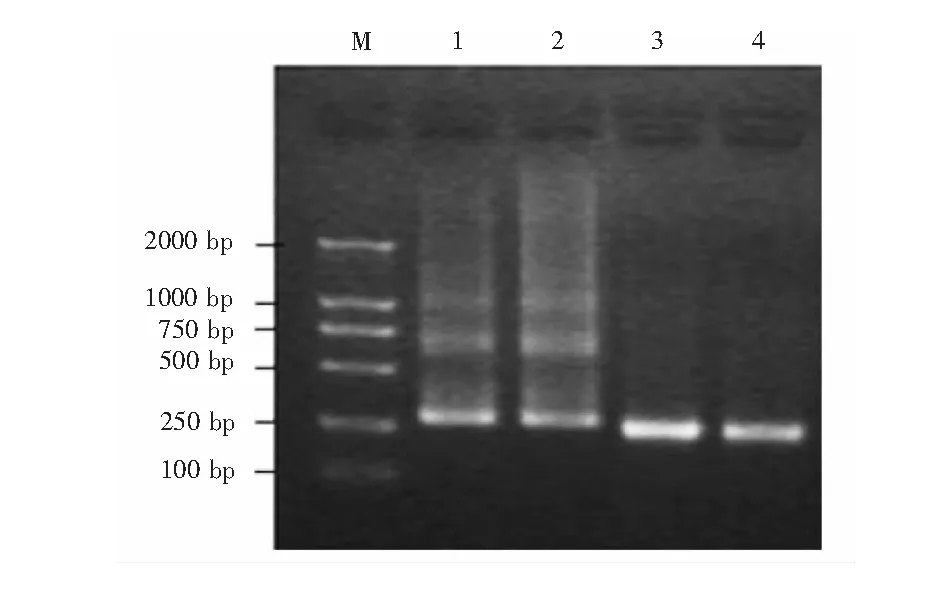
图1 纳米金(0.4 nmol/L,10 nm)对PCR特异性的影响。λ-DNA为模板,目标片段长度283 bp。1.5%琼脂糖凝胶电泳检测。M: maker。泳道1和泳道2:无纳米金的PCR结果;泳道3和泳道4:添加纳米金的PCR结果[12]Fig.1 Effect of gold nanoparticles ( 10-nm AuNPs, 0.4 nmol/L) on the specificity of polymerase chain reaction (PCR).PCR was performed by employing a 283-bp target sequence from a λ-DNA template, and PCR products were analyzed by agarose gel electrophores (1.5%). Lane M is marker; lanes 1 and 2 show the results of PCR performed in the absence of AuNPs; lanes 3 and 4 show the results of PCR performed with AuNPs. bp=base pair[12]
不同表面修饰的纳米金与PCR组分的相互作用不同,因而其对PCR的影响也不同。Cao等[21]研究发现聚酰胺胺(PAMAM)树状大分子(G5-NH2)可以提高PCR的特异性,随后Chen等[22]采用氨基末端聚酰胺胺(PAMAM)树状大分子(G5-NH2)包裹纳米金(Au-DENPs), 并将其应用到PCR体系中。研究结果表明,Au-DENPs能够有效地提高PCR的特异性及扩增效率。当Au原子与G5-NH2摩尔比例为100∶1时,检出限可达0.37 nmol/L。作者认为包含有纳米金的树形大分子可以保持3D球形形态,能更好地与PCR组分进行相互作用。该课题组[23]还进一步探究不同末端聚酰胺胺(PAMAM)树状大分子(G5-NH2)包裹纳米金(Au-DENPs)对于PCR体系的影响,发现氨基和羟基末端修饰的纳米金更加有效,所需浓度最低。
2.2量子点对PCR反应的影响
量子点作为一种新型荧光无机纳米材料,具有发光波长可调性、发光效率高和发光峰窄等特点,受到广泛关注,例如单分子检测、细胞成像、肿瘤靶向和诊断等应用[24]。另外,量子点具有优异的理化性质及生物相容性,被用于PCR扩增中,包括硫基乙酸修饰CdTe量子点和硫基乙酸修饰的CdSe以及CdSe/ZnS量子点等[25~27]。
Wang等[25]考察了在不同退火温度和不同长度模板DNA条件下,羧基修饰的CdTe量子点对PCR体系特异性的影响。通过与纳米金结果对比发现,量子点可以显著提高PCR体系的特异性,但当CdTe量子点浓度超过最佳浓度时会产生抑制作用。特别对于短DNA片段,量子点的效果更加显著。和纳米金类似,采用量子点的PCR体系,在退火温度范围为30~45℃时仍可得到特异性强的扩增产物。
Ma等[26]采用硫基乙酸修饰量子点,发现在低退火温度下(25~45℃),仍可大幅度提高PCR体系产率和特异性。通过对不同表面修饰的量子点的研究,他们指出,量子点提高PCR特异性的原因是基于量子点核自身结构与DNA聚合酶作用,而不是其表面状态。Liang等[27]以多重PCR为研究模板,采用粒径4.5 nm的CdTe QDs进行研究,证实QDs可以减少多重PCR体系中非特异性的扩增,因而显著提高扩增的特异性,进一步证实了以前的研究结果。 本课题组的研究发现,量子点可以加快PCR的扩增速率,将扩增时间由143 min降到46 min[28]。
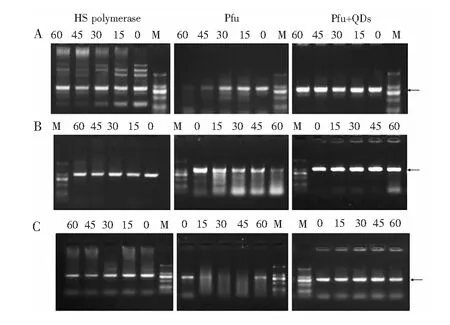
图2 基于量子点的热启动及其与热启动酶结果的对比。 PCR体系在50℃下分别预温浴不同时间(0-1 h); 引物分别为 (A) B9-10; (B) B17-18; (C) A99-100;1.2 % 琼脂糖凝胶电泳检测。 M: MW DL2000[29]。Fig.2 Confirmation of hot-start (HS) effects by three pairs of primers with three test models after incubation for different time (0-1 h). (A) B9-10; (B) B17-18; and (C) A99-100. PCR products were analyzed by agarose gel electrophoresis (1.2%). Lane M: MW DL2000[29].
热启动PCR是实现可重复性好、灵敏度高、特异性强的基因扩增的一种非常重要的技术。该技术利用各种物理、化学方法控制PCR反应的必须组分,如DNA聚合酶和Mg2+等来影响PCR的进行,从而有效的抑制非特异性产物以及引物二聚体的形成,提高引物和模板结合的效率。目前应用广泛的是商品化的热启动酶,但其价格昂贵,不适合大量实际样本的常规检测。最近,本课题组发现,量子点可以动态调控常规PCR中高保真聚合酶(Pfu酶)的活性,实现类似“热启动”的高效DNA体外复制过程[29]。加入了量子点的PCR反应体系在50℃分别温育不同时间(0~1 h),仍然得到特异性的扩增,且结果可以与商品化的热启动酶相媲美,而对照(未加量子点)实验则出现了大量非特异性扩增片段(如图2)。
随后,本研究组将该技术应用于荧光定量PCR,构建了基于量子点的高通量荧光定量PCR体系[30]。分别以质粒 DNA和PCR 产物为模板,PCR反应液在50℃温育1 h, 即使是在再轮扩增体系中,仍得到特异性强的扩增(图3),而对照实验得到的都是二聚体以及非特异性扩增。实验中还发现,CdTe量子点对基于高保真聚合酶的PCR体系效果明显,而普通Taq聚合酶则没有明显效果。实验初步证实了量子点与普通Taq聚合酶的非特异性吸附相互作用弱于其与高保真聚合酶之间的作用,所以对于普通Taq聚合酶没有明显效果。在低温下量子点和聚合酶结合从而降低酶的活性,抑制了非特异性片段的扩增;在高温时,二者分离,聚合酶的活性恢复,因而量子点起到了很好的热启动效果。不过考虑到PCR体系的复杂性,量子点影响PCR的机理还有待进一步的探究。相对于其它热启动技术, 该技术具有简单、成本低、重复性好、普适性好、易于推广等优点,可以应用于大量实际样品的高通量扩增。
2.3碳纳米管对PCR反应体系的影响
碳纳米管具有导电性好、比表面强度高、机械强度高[31]、韧性高等优点,广泛的应用于生物传感器、DNA纳米科技等方面,且该材料具有良好的表面性能和高热传导效率,因而碳纳米管在PCR扩增中也得到较多的应用。
Cui等[32]首先提出单壁碳纳米管(SWNTS)可以提高PCR的产率,但其浓度超过3 μg/mL时反而会起抑制作用。此外,研究还发现,即使没有Mg2+,SWNTS可以替代Mg2+的作用,保证DNA聚合酶的正常催化聚合活性。
为了满足实验分析需要,DNA样品通常需要重复扩增多次。在实际PCR操作中,也会采用上一轮扩增的结果来作为下一轮扩增的模板DNA,因此当遇到DNA扩增效果不好、产率低的现象,便会导致重复扩增次数增加,产物特异性降低。基于这样的考虑,Zhang等[33]提出碳纳米管的悬浮体有助于这样的重复PCR扩增以及长片段PCR扩增。实验结果表明,当体系加入碳纳米管后,PCR进行到第六轮扩增后仍可得到目标产物,同时还发现,该粒子还可提高长片段PCR的扩增效率。 Zhang等[34]以长度为14.3 kb的长DNA片段作为模板,发现0.8~1.6 mg/mL多壁碳纳米管(MWCNTs)可以提高PCR
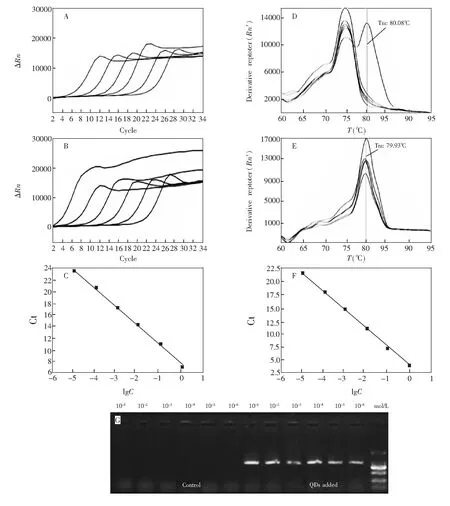
图3 基于量子点的热启动在实时定量PCR中的应用。模板为人类基因组的长度为963 bp的PCR产物,荧光染料是EvaGreen,PCR体系在50℃中预温育1 h,采用Pfu聚合酶。(A)Pfu扩增曲线; (B)Pfu+QDs扩增曲线; (C)Pfu标准曲线; (D)Pfu熔解曲线; (E)Pfu+QDs熔解曲线;(F)Pfu+QDs标准曲线; (G)上述结果的琼脂糖凝胶电泳图(1.2%)。Lane M: MW DL2000[30]。Fig.3 Real time PCR analysis of the second round amplification of a 96.3 bp target from human genomic DNA after 1 h preincubation at 50℃ using the EvaGreen detection system. Pfu DNA polymerase was used as polymerase. (A) Linear amplification data for control without QDs; (B) linear amplification data with QDs; (C) standard curve for control without QDs; (D) melting curve analysis for control without QDs; (E) melting curve analysis with QDs; (F) standard curve with QDs; (G) agarose gel (1.2%) electrophoresis of real time PCR products for different template dilutions. Lane M: MW DL2000[30].
体系的产率和特异性,其最佳浓度为0.8 mg/mL。 另外纳米碳粉也对PCR体系产生促进作用,并且由于其尺寸和表面性能,浓度不同会产生不同的影响。Quaglio等[35]将MWCNTs与PDMS相结合,这种复合纳米材料具有良好的热传导性和热稳定性,运用到PCR体系中提高了PCR的扩增效率,整体时间比之前减少了75%,因此通过改变复合碳纳米管含量,可以更精确的控制生物反应的流程效率。
2.4氧化石墨烯与还原石墨烯纳米材料对PCR反应体系的影响
石墨烯(GO)是碳原子以SP2杂化方式形成的一种单原子层厚度的准二维的纳米材料,具有高比表面积、良好的稳定性和生物相容性等,在生物医学等领域得到了广泛的应用[36,37]。另外,其还具有良好的传热、导电以及与单链DNA及蛋白质相结合的特性等,因而广泛应于于PCR扩增中[38,39]。
Jia等[37]首先发现当在PCR中添加12 mg/mL~60 mg/mL的GO时,可以提高 PCR扩增的特异性,而GO浓度低于12 mg/mL时对PCR体系没有影响,GO浓度高于70 mg/mL时则会产生抑制作用。还原石墨烯(rGO)对于PCR体系的最佳添加浓度为0.8 mg/mL,在添加浓度超过12 mg/mL时则会产生明显的抑制作用。对于多轮PCR的扩增,rGO作用更加明显,经过8轮扩增后仍然得到特异性的扩增,可能由于GO和rGO相比,其负电位较强,和DNA分子之间的斥力更大,因此效果不如rGO。
石墨烯良好的热传导性可以提高PCR的选择性和特异性。Abdul等[39]研究也证明了GNFs可以提高PCR的导热系数,且效果主要取决于GNFs的浓度。当加入GNFs过量时,会起到抑制作用。同时,粒子的大小也是关键因素,影响其表面积,当表面积增大时,PCR的产率也会提高。实验通过流体力学(CFD)模型模拟是否添加GNFs的对照实验,其结果也说明了GNFs优良的热导效应是增强PCR效率的主要原因。
2.5金属氧化物纳米材料对PCR体系的影响
TiO2和SiO2等金属氧化物纳米粒子对于PCR体系的影响也比较明显。Abdul等[40]研究发现,将粒径为25 nm的TiO2加入到不同DNA模板来源(如质粒DNA,基因DNA,互补DNA)的PCR体系中,扩增效率和空白对照组相比高2.9~6.9倍,且通过减少每个循环周期的时间,最终所用时间是原来的一半,其最佳使用浓度为0.4 nmol/L。TiO2良好的热传导效应,加速了模板DNA的变性,从而缩短反应时间。Wan等[41]也研究了TiO2在PCR中的作用,并与其它纳米材料进行比对。实验发现,当TiO2浓度达到0.8 μg/mL时会对体系产生抑制作用,当浓度达到5 μg/mL时,反应被完全抑制。实验还证明了当TiO2与银纳米粒子结合时,其促进效果更加显著。Lenka等[42]分别在普通 PCR、q-PCR(实时定量PCR)、RT-PCR(反转录PCR)中,对粒径为7 nm的TiO2所产生的作用进行探究,发现在普通PCR体系中,0.2 nmol/L TiO2可实现目标DNA在极低模板浓度下的扩增,并且和前人的结果对比,发现加入小粒径的TiO2的PCR产率是大粒径(25 nm)的3倍甚至更高,但在q-PCR、RT-PCR中,则没有明显效果。
Park等[43]将聚多巴胺包覆的SiO2(PDA silica)和碳化的聚多巴胺包覆的SiO2(C-PDA silica)纳米粒子分别加入到PCR反应体系中,考察它们对PCR体系的作用。研究发现C-PDA粒子表面可以提供多个接触点用来结合引物和聚合酶,增加了体系稳定性,而碳化的聚多巴胺包覆的SiO2效果最突出。由此可见,复合纳米材料可以不同程度改善PCR体系的环境,使其更有利于反应的进行。
Ma等[44]认为磁性纳米粒子具有良好的磁化强度、超顺磁性,相对于其它纳米材料,其表面更容易功能化,他们对粒径为8~10 nm的表面修饰了羧基的Fe3O4纳米材料进行研究,研究结果表明,其可以提高PCR的灵敏度,检出测限可达到4.26 amol/L。
3 纳米PCR中纳米材料的作用机理
引物错配和非特异性扩增严重影响了PCR扩增的灵敏度和特异性,而纳米材料通常具有良好的表面性能、热传导作用以及与单链DNA和蛋白质特异性结合等特性,广泛地应用于纳米基因扩增中,并极大地提高其扩增特异性、灵敏度和产率。但是由于PCR体系自身的复杂性,目前对于纳米PCR的机理仍然不是很清楚。根据目前的研究结果,推测纳米材料优化PCR主要基于以下两个方面。
3.1纳米材料的表面作用
纳米材料表面积大,表面效应强,其作用主要可以分为两方面:一方面与引物或模板DNA作用,另一方面则是与体系中的聚合酶相互作用。
Li等[45]利用纳米金团聚所产生的颜色变化设计了杂交试验,根据实验结果提出,纳米金对于单链DNA(ssDNA)作用更强。Li等[11]也采用纳米金进一步验证了以上结论,并提出纳米金与单链结合蛋白(SSB)作用类似。首先双链DNA(dsDNA)由于磷酸基团暴露在外面,与单链DNA(ssDNA)相比,碱基暴露程度小,由于静电效应,纳米金更容易与ssDNA结合。在粒径1~50 nm范围内,ssDNA相对dsDNA更加柔软, 易于缠绕在纳米金的表面。SSB或者纳米金选择性地结合ssDNA,阻碍引物和模板的错配,降低了体系错配的可能性,减少了非特异性的扩增。
除DNA以外,PCR反应体系中还包含蛋白质等。 Yi等[46]观考察了有无羧基化的多壁碳纳米管和单壁碳纳米管对于PCR体系的影响,研究结果表明,纳米材料会与体系内的限制性内切酶、DNA聚合酶相互作用,从而降低甚至抑制酶的活性,基于此提出了蛋白质和纳米材料相互作用机理。Mi等[47]认为纳米金可以动态调节DNA聚合酶活性,起到类似热启动PCR 的作用,有效抑制非特异性扩增。实验中还发现,在较低温度时,纳米金会降低高保真Pfu聚合酶的活性,即使在30~60℃温育1 h后,仍然可以得到特异性很高的单一目标产物。 本研究组的研究也发现量子点具有类似的热启动效应[29],初步认为这种类似热启动的效应主要源于量子点和高保真聚合酶Pfu的相互作用,使得扩增结果更加准确可信,此外,还可以减少实验成本,对于未来研究具有重要意义。
Lou等[48]利用纳米金进一步验证了以上的结论,并从PCR作用流程进行了深层次探究。首先,他们证明了纳米粒子可以作用于体系中的聚合酶,通过良好的表面性能与聚合酶结合从而改变聚合酶的有效浓度。其次,他们更深入地探究了纳米材料对于错配过程的影响, 发现纳米材料的加入会使得错配体系温度更低。实验结果表明,1 nmol/L 纳米金可以使正反向错配体系的退火温度降低1.0℃和1.7℃,而完全匹配体系则减少0.3℃和1.0℃,通过增加引物完全匹配和错配之间的退火温度差增强PCR体系的特异性。 他们还提出了纳米材料表面与PCR产物结合,在变性时促进其分解的机理。
Bai等[49]采用氨基修饰的二氧化硅磁性纳米材料(ASMNPs)对纳米PCR反应机理进行了更全面的研究。首先,他们认为纳米材料表面的活性基团会结合PCR中的DNA聚合酶、Mg2+、引物或DNA模板等,所以当加入过量时,会降低反应速率,抑制PCR的进行。其次,纳米材料并不会抑制因错配而导致的非特异性扩增,而是低浓度的纳米粒子会抑制长片段的扩增,高浓度的纳米粒子则会抑制小片段的扩增,即纳米粒子的表面性能对PCR产生显著的影响。因此,了解每种纳米材料的表面特征,对于优化其在PCR上的作用有很大的帮助。
3.2纳米材料的热传导性
纳米材料良好的热传导性在PCR体系不同温度变化的循环过程中也可能会起到重要的作用。Li等[18]通过改变PCR体系、DNA聚合酶、模板DNA的长度等探究其作用机理,提出纳米材料良好的热传导性能,可以有效的改善PCR体系升/降温速率,从而缩短反应时间,使体系的反应效率明显增加。实验结果发现,纳米金可使PCR的灵敏度提高5~10倍,对于q-PCR的灵敏度可以提高104倍。Lin等[50]提出金纳米粒子通过提高体系的热传导性,来提高热循环效率,因而提高PCR体系的特异性和扩增效率。纳米金促进DNA模板解链,同时大幅度提高引物、DNA片段与模板发生错配的解离速率,缩短了反应时间,从而提高PCR的特异性和效率。Xun等[51]制备了表面修饰mPEG2000的CdSe/ZnS量子点(QD590-mPEG2000),该量子点可在体系进行40个热循环后仍保持稳定,荧光信号没有降低,同时也保证了该材料在PCR体系中与其它成分的兼容性,作用不会受到影响,进一步证实了纳米材料的热传导性对于体系的调节起到不可忽视的作用。Abdul等[39]证明GNFs可以提高PCR体系的导热系数,进而提高PCR的扩增效率及其特异性,其中GNFs的尺寸大小起到了关键性作用。
4 纳米PCR的应用及展望
NanoPCR具有高灵敏度、高特异性及高选择性等优点,目前该技术在病毒检测、基因测序中应用广泛。 Ma等[52]利用NanoPCR技术来检测和区分野生型和基因缺失型伪狂犬病病毒(PPV),从病毒中选取3组引物进行特异性扩增,分别得到431 bp(gB)、316 bp(gE)和202 bp(gG)3组产物。实验结果表明,当采用这种纯化质粒构建的带有特殊基因片段产物,其灵敏度是传统PCR的100~1000倍。
Cui等[53]利用该技术实现了对猪细小病毒(PPV)的检测,对该病毒有良好的灵敏度和选择性,成功实现对109份试剂样品的检测,对于研究PPV有重要意义,同时也为研究其它病毒提供了新的思路。
Wang等[54]利用NanoPCR技术对猪的博卡病毒检测(PBoV)进行检测,与普通PCR技术相比,灵敏度为原来的100倍,最低检测限为6.70×101个拷贝。而Yuan等[55]则首次利用NanoPCR技术对猪流行性腹泻病毒(PEDV)的RNA基因组进行检测,灵敏度是常规RT-PCR的100倍, PEDV RNA最低检测限为2.7×10ng/μL,这项研究可以应用于临床诊断和PEDV的现场实时监测。他们还利用这项技术对鸭坦布苏病毒(DTMUV)进行检测56],灵敏度提高了10倍,最低RNA检测拷贝数为1.8 ×102/μL。该课题组还进行脑心肌炎病毒(EMCV)方面的检测[57],在保证体系与样品中其它病毒无交叉作用条件下,实现了最低检测RNA拷贝数为1.2 ×102/μL,同时这也是nanoPCR技术在该病毒研究领域的首次应用。而Elhusseini等[58]则采用粒径为15 nm的纳米金加入到PCR体系中,将马疱疹病毒1型(EHV-1)的检出限从104~105个降到102个DNA拷贝,并改善了原检测体系出现假阴性的问题。
在人类病毒研究方面,沙门氏菌在很多发展中国家依旧是对健康有严重威胁的病毒,对于这样的伤寒类病毒多采用血样检测,灵敏度和对病毒的选择性都有待提高。Rehman等[59]采用磁性纳米粒子对PCR技术进行改进,降低了基于VNTRs的伤寒杆菌PCR检测的非特异性,促进了该技术的发展。
细菌气溶胶含量微小,且成分复杂,其定量检测一直是难点。Xu等[60]利用TiO2纳米粒子结合银纳米粒子引入PCR中来检测空气中的细菌气溶胶。通过检测大肠杆菌和枯草芽孢杆菌的数量,发现将两种纳米粒子混合后的效果明显高于单个纳米粒子,最低检测浓度可达到40 pg/μL,灵敏度约为传统PCR的500倍。
NanoPCR技术的发展为生物分子的研究开辟了一个新的思路和方向,相比传统PCR技术,当体系中添加入纳米材料时,通过其优良的表面性能和热传导效应,可以有效缩短反应时间,提高扩增效率和体系特异性,进而提高检测灵敏度。NanoPCR在实际研究尤其是在病毒检测方面具有重要的应用价值和意义,为人类病毒的研究发展提供了新的可能,在未来生物医学领域具有良好的应用前景。另一方面,由于PCR反应体系的复杂性以及纳米材料的自身特点等原因,NanoPCR的反应机理仍然不清楚,因此详实的探究NanoPCR的反应机理非常重要,而开发更多无毒高效的纳米材料并将其应用PCR技术中是未来重要的研究方向。
1 Mullis K B, Faloona F A.MethodsEnzymol.,1987, 155: 335-350
2 Filteau M J, Lagace G. LaPointe G, Roy D G.Syst.Appl.Microbiol.,2010, 33(3):165-173
3 Tiba M R, Moura d C, Carazzolle M F, Leite D d S. Braz.J.Infect.Dis.,2011, 15(2): 144-150
4 Jung Y L, Jung C, Parab H, Park H G.ChemBioChem,2011, 12(12): 1387-1390
5 Huber M, Mündlein A, Dornstauder E, Schneeberger C, Tempfer C B, Mueller M W, Schmidt W M.Anal.Biochem.,2002, 303(1): 25-33
6 Kasai K, Nakamura Y, White R.J.ForensicSci.,1990, 35(5): 1196-1200
7 Zhang Z Z, Yang X, Meng L Y, Liu F, Shen C C, Yang W G.BioTechniques,2009, 47(3): 775-779
8 HE Qi-Di, HUANG Dan-Ping, HUANG Guan, CHEN Zuan-Guang.ChineseJ.Anal.Chem.,2016, 44(4): 542-550
何启迪, 黄丹萍, 黄 冠, 陈缵光. 分析化学,2016, 44(4): 542-550
9 Varadaraj K, Skinner D M.Gene,1994, 140(1): 1-5
10 Henke W, Herdel K, Jung K, Schnorr D, Loening S A.NucleicAcidsRes.,1997, 25(19): 3957-3958
11 Chou Q, Russell M, Birch D E, Raymond J, Bloch W.NucleicAcidsRes.,1992, 20(16): 4371
12 Li H K, Huang J H,Lv J H, An H, Zhang X D,Zhang Z Z, Fan C H, Hu J.Angew.Chem.Int.Ed.,2005, 44(32): 5100-5103
13 Wang L B, Zhu Y Y, Jiang Y, Qiao R R, Zhu S F, Chen W, Xu C L.J.Phys.Chem.B,2009, 113(21): 7637-7641
14 Cui D X, Tian F R, Kong Y, Titushikin I, Gao H J.Nanotechnology,2004, 15(1): 154-157
15 Nel A E, Mädler L, Velegol D, Xia T, Hoek E M V, Somasundaran P, Klaessig F , Castranova V, Thompson M.Nat.Mater.,2009, 8(7): 543-557
16 Pan J K, Li H K, Cao X Y, Huang J H, Zhang X D, Fan C H,Hu J.J.Nanosci.Nanotechnol.,2007, 7(12): 4428-4433
17 Vu B V, Litvinov D,Willson R C.Anal.Chem.,2008, 80(14): 5462-5467
18 Li M, Lin Y C, Wu CC, Liu H S.NucleicAcidsRes.,2005, 33(21): e184
19 Yang W C, Li X H, Sun J L, Shao Z F.ACSAppl.Mater.Interfaces,2013, 5(22): 11520-11524
20 Girilal M, Mohammed Fayaza A, Mohan Balaji P, Kalaichelvana P T.ColloidsSurf.B,2013, 106(6): 165-169
21 Cao X Y, Shi X Y, Yang W C, Zhang X D, Fan C H, Hu J.Analyst,2009, 134(1): 87-89
22 Chen J J, Cao X Y, Guo R, Shen M W, Peng C, Xiao T Y, Shi X Y.Analyst,2011, 137(1): 223-228
23 Cao X Y, Shen M W, Zhang X D, Hu J, Wang J H, Shi X Y.Electrophoresis,2012, 33(16): 2598-2603
24 Walling M A, Novak J A, Shepard J R E.Int.J.Mol.Sci.,2009: 10(2): 441-491
25 Wang L B, Zhu Y Y, Jiang Y, Qiao R R, Zhu S F, Chen W, Xu C L.J.Phys.Chem.B,2009, 113(21): 7637-7641
26 Ma L, He S B, Huang J, Cao L, Yang F, Li L J.Biochimie,2009, 91(8): 969-973
27 Liang G F, Ma C, Zhu Y L, Li S C, Shao Y H, Wang Y, Xiao Z D.NanoscaleRes.Lett. ,2011, 6(1): 1-7
28 Sang F M, Yang Y, Zhao H X, Ma M R, Zhang ZZ.J.Exp.Nano.,2015, 10(6): 476-482
29 Sang F M, Yang Y, Wang JJ, Huang X Y, Ren J C, Zhang Z Z.J.Exp.Nano.,2014, 9(10): 1051-1063
30 Sang F M, Yang Y, Yuan L, Ren J C, Zhang Z Z.Nanoscale,2015, 7(38): 15852-15862
31 Hüttel A K, Steele G A, Witkamp B, Poot M, Kouwenhoven L P, Zant H S J.NanoLett.,2009, 9(7): 2547-2552
32 Cui D X,Tian F R, Kong Y, Titushikin I, Gao H J.Nanotechnology,2004, 15(1): 154-157
33 Zhang Z Z, Wang M C, An H J.Nanotechnology,2007, 18(35): 355706
34 Zhang Z Z, Shen C C, Wang M C, Han H, Cao X H.BioTechniques,2008, 44(4): 537-545
35 Quaglio M, Bianco S, Castagna R, Cocuzza M, Pirri C F.Microelectron.Eng.,2011, 88(8): 1860-1863
36 Daniel R, Dreyer R S. Ruoff. Christopher W B.Angew.Chem.Int.Ed.,2010, 49(49): 9336-9345
37 Cai W W, Piner R D, Stadermann F J, Park S J, Shaibat M A, Ishii Y, Yang D X, Velamakanni A, An S J, Stoller S M, An J H, Chen D M, Ruoff R S.Science,2008, 321(5897): 1815-1817
38 Jia J, Sun L P, Hu N, Huang G M, Weng J.Small,2012, 8(13): 2011-2015
39 Abdul K R, Kafafy R M, Salleh H M, Faris W F.Nanotechnology,2012, 23(45): 455106
40 Abdul K R, Sonawane P J, Sasi B K, Sahu B S, Pradeep T, Das S K, Mahapatra N R.Nanotechnology,2010, 21(25): 255704
41 Wan W J, Yeow J T W, Dyke M I V.IEEECNanotechnol.,2009, 9: 458-461
42 Lenka G, Weng W H.Dig.J.Nanomater.Bios.,2013, 8(4): 1435-1445
43 Park J Y, Back S H, Chang S J, Lee S J, Lee K J, Park T J.ACSAppl.Mater.Interfaces,2015, 7(28): 15633-15640
44 Ma W, Yin H H, Xu L G, Wang L B, Kuang H, Xu C L.Chem.Commun.,2013, 49(47): 5369-5371
45 Li H X, Rothberg L.Proc.Natl.Acad.Sci.,2004, 101(39): 14036-14039
46 Yi C Q, Fong CC, Chen W W, Qi S J, Tzang C H, Lee S T, Yang M S.Nanotechnology,2007, 18(2): 1055-1060
47 Mi L J, Wen Y Q, Pan D, Wang Y H, Fan C H, Hu J.Small,2009, 5(22): 2597-2600
48 Lou X H, Zhang Y.ACSAppl.Mater.Interfaces,2013, 5(13): 6276-6284
49 Bai Y L, Cui Y, Paoli G C, Shi C L, Wang D P, Shi X M.ACSAppl.Mater.Interfaces,2015, 7(24): 13142-13153
50 Lin Y, Li J, Yao J, Liang Y, Zhang J, Zhou Q F, Jiang G B.Environ.Chem.,2013, 58(36): 4593-4601
51 Xun Z, Zhao X Y, Guan Y F.Nanotechnology,2013, 24(35): 355504
52 Ma X J, Cui Y C, Qiu Z, Zhang B K, Cui S J.J.Virol.Methods,2013, 193(2): 374-378
53 Cui Y, Wang Z, Ma X, Liu J, Cui S.Lett.Appl.Microbiol.,2014, 58(2): 163-167
54 Wang X L, Bai A Q, Zhang J, Kong M M, Cui Y C, Ma X J, Ai X, Tang Q H, Cui S J.J.Virol.Methods,2014, 202(16): 106-111
55 Yuan W Z, Li Y N, Li P, Song Q Y, Li L M, Sun J G.J.Virol.Methods,2015, 220: 18-20
56 Yuan W Z, Li J N, Li P, Sun J G, Chen L G, Liu J X.Lett.Appl.Microbiol.,2015, 62(1): 63-67
57 Yuan W Z, Li Y N, Wang J C, Wang J F, Sun J G.Vet.Arhiv,2016, 86(1): 1-8
58 Elhusseini D M, Helmy N M, Tammam R H.RSCAdv.,2016, 6(60): 54898-54903
59 Rehman A, Sarwar Y, Raza Z A, Hussain S Z, Mustafa T, Khan W S, Ghauri M A, Haque A, Hussain I.Analyst,2015, 140(21): 7366-7372
60 Xu S Y, Yao M S.J.Aerosol.Sci.,2013, 65(65): 1-9
This works was supported by the National Natural Science Foundation of China (No. 21407035)
卓立汉光新品推出:Omni-λBright300光纤输出可调单色光源
卓立汉光多年专注于光谱仪与高稳定光源研发,积累了丰富的经验,可提供多种可调单色光源(其组件包括氙灯、溴钨灯、氘灯等光源以及光谱仪),主要用于光、电元器件的表征。典型应用如下:光探测器量子效率(QE)测量系统、太阳能电池光电转换效率测量(QE/ IPCE)系统、各类CCD/CMOS 影像器件模组光色标定系统等。 承载十年研发经验,全新推出高性能、高输出功率的可调单色光源Omniλ-Bright 系列。
典型应用:
PEC光电化学测试; 透反吸测试系统; 太阳能电池量子效率测试系统; 用于荧光光谱测试系统的激发光源; 表面光电压测试; 探测器光谱响应度测试系统; 光学镜头透过率测试系统; 防护眼镜产品测试系统; CCD/CMOS影像器件模组的光色标定。
Omni-λBright 系列可调单色光源主要由200 mm 焦距影像光谱仪、75W 氙灯光源以及其他配件组成。整个系统的光学设计经过多次优化,以保证最佳的分辨率和最大的光通量,同时又最大强度地抑制了杂散光,提升测量的准确度, 用户通过简单的几个步骤就可以快速实现测试。

FENXIHUAXUECHINESEJOURNALOFANALYTICALCHEMISTRY(月刊,1972年创刊)(Monthly,Started1972)第45卷 第11期 2017年11月Vol.45 No.11 November 2017编 辑主 编主 管主 办出 版印刷装订订 购国内总发行国外发行《分析化学》编委会地址:长春市人民大街5625号邮政编码:130022电话:0431-85262017http://www.analchem.cnE⁃mail:fxhx@ciac.ac.cn杨秀荣中国科学院中国化学会中国科学院长春应用化学研究所地址:北京东黄城根北街16号 邮政编码:100717吉林省保隆冠彩印刷有限公司国内:全国各地邮政局吉林省报刊发行局中国国际图书贸易总公司地址:北京399信箱 邮政编码 100044EditedbyEditor⁃in⁃ChiefSuperintendedbySponsoredbyPublishedbyPrintedbySubscriptionsForeignEditorialBoardofChineseJournalofAnalyticalChemistryAdd:5625RenminStreet,Changchun130022,ChinaTel:0431⁃85262017http://www.analchem.cnE⁃mail:fxhx@ciac.ac.cnYANGXiu⁃RongChineseAcademyofSciencesChineseChemicalSocietyChangchunInstituteofAppliedChemistry,ChineseAcademyofSciencesSciencePressAdd:16DonghuangchenggenNorthStreet,Beijing100717,ChinaJilinBaolongguancaiPrintingCo.,Ltd.LocalPostOfficesChinaInternationalBookTradingCorporationAdd:P.O.Box399,Beijing100044,China
国内统一刊号: CN 22-1125/O6国内邮发代号: 12-6国外发行: M336
定价: 45.00元
广告经营许可证号 2200004000094 广告代理: 北京行胜言广告有限公司 电话: 010-51289220 传真: 010-82781370
国内外公开发行
DevelopmentofNano-PolymeraseChainReaction
andItsApplication
SANG Fu-Ming*, LI Xin, LIU Jia
(SchoolofMarineScienceandTechnology,HarbinInstituteofTechnology(Weihai),Weihai264209,China)
Polymerase chain reaction (PCR) has become one of the powerful technique since its invention in 1980s. Nevertheless, PCR technique is still frequently impaired by its low specificity, poor sensitivity, false positive results, etc. Recently, nanomaterials including metal nanoparticles, carbon nanomaterials, quantum dots and nano metal oxide have been added into PCR solution to improve both quality and productivity of PCR. The nanoparticles assisted PCR (NanoPCR) has
considerable attentions due to its unprecedented sensitivity, selectivity and efficiency. In this view, the mainly used nanoparticles in NanoPCR, including gold nanoparticles, quantum dots, carbon nanomaterials, graphene and metallic oxide, was firstly summarized. And then, the possible mechanisms for highly improved sensitivity and selectivity were discussed. Finally, recent applications of NanoPCR were described.
NanoPCR; Nanomaterials; Specificity; Amplification efficiency; Hot-start;Review
17 February 2017; accepted 4 September 2017)
10.11895/j.issn.0253-3820.170097

