不同体温及PaCO2对老年患者腹腔镜术后早期精神改变的影响
李东白,李 莎,高露露,吕美红
(1.大连医科大学附属第二医院 麻醉科,辽宁 大连 116027;2.大连医科大学附属第一医院 麻醉科,辽宁 大连 116011)
李东白(1969-),男,教授。E-mail:dblee@sina.com
吕美红,副教授。E-mail:lyumeihong@163.com
论著
10.11724/jdmu.2017.05.11
不同体温及PaCO2对老年患者腹腔镜术后早期精神改变的影响
李东白1,李 莎1,高露露2,吕美红2
(1.大连医科大学附属第二医院 麻醉科,辽宁 大连 116027;2.大连医科大学附属第一医院 麻醉科,辽宁 大连 116011)
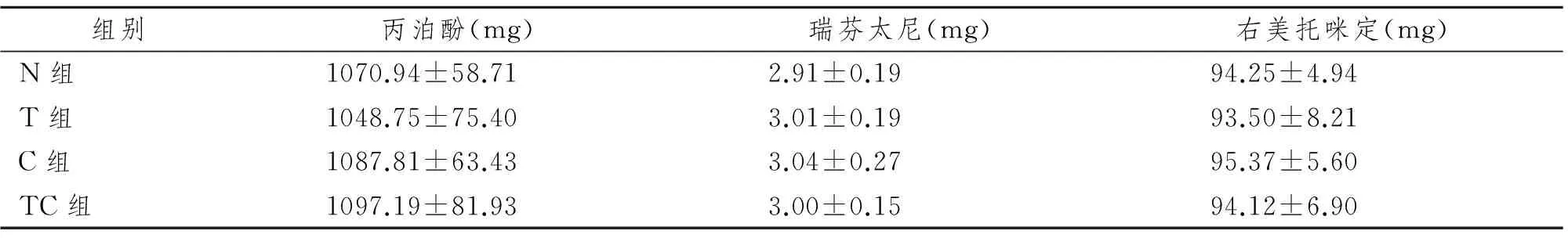
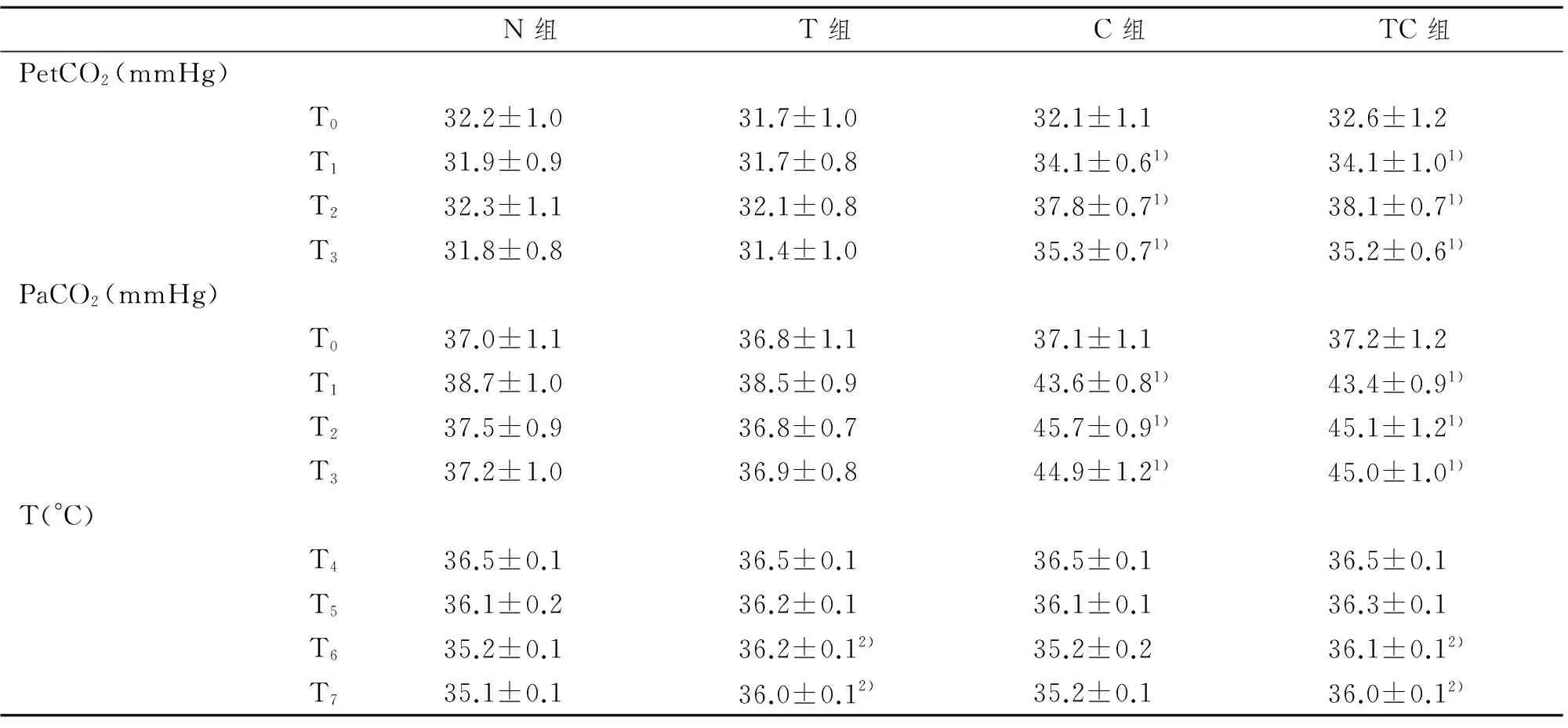
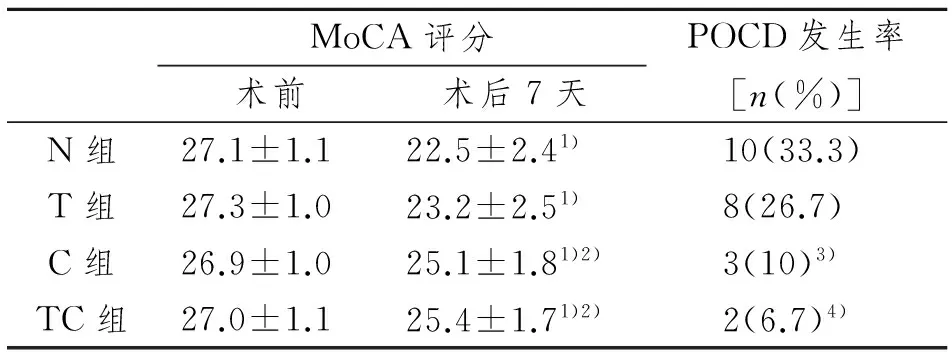
目的探讨不同水平的体温及PaCO2对老年患者腹腔镜术后早期精神改变的影响。方法纳入在择期、全麻下行腹腔镜胃癌根治术的患者120例,随机分为4组,每组30例。对照组(N组)(35 ℃ 体温;允许性高碳酸血症;腹腔镜手术;术后谵妄;术后认知功能障碍 腹腔镜手术因其微创性,病人术后恢复快等独特的优点在临床上应用越来越广泛,腹腔镜手术过程中体位的要求和随着人工气腹的建立而增大的腹内压可对病人呼吸与循环系统造成影响,尤其是在合并心肺疾病的老年患者中。允许性高碳酸血症(permissive hypercapnia,PHY)是近几年被认可的一种具有保护作用的通气方法,临床上常常通过降低潮气量的设定,减少患者每分钟通气量,使动脉血二氧化碳水平适度增高。一些研究证实,PHY在成人与新生儿肺疾病中的使用,可有效的保证脑血流量[1],增加患者的生存率,降低其死亡率[2-3]。麻醉期间, 由于大量补液及麻醉药对机体体温调节功能的抑制等因素很容易造成低体温(<36 ℃)[4]。低体温的发生可增加围术期不良事件发生率[5],尤其是老年患者。术后谵妄(POD)和术后认知功能障碍(POCD)是患者于术后早期精神改变的两种不同现象,因其多见于老年患者中,所以成为老年外科医学研究的重点。本文旨在探讨腹腔镜老年患者在不同体温下调控PaCO2水平是否会对老年患者术后早期精神改变产生影响。 选择2015年4月至2016年10月在大连医科大学附属第二医院全身麻醉下择期行腹腔镜下胃癌根治术的患者120例。 纳入标准:(1)ASA I~II级,(2)年龄≥65岁,(3)患者自愿参加本试验研究。排除标准:(1)术前MoCA得分≤26分,(2)术前合并中枢神经系统疾病,(3)既往有精神疾病病史,(4)严重听力、视力障碍,无法配合试验者,(5)有药物、酒精依赖史。 术前将患者随机分为4组,每组30例。对照组(N组)(35 ℃ 表1患者一般资料比较 组别例数性别(男/女)年龄(岁)教育程度(年)体重(kg)N组3017/1365.00±4.267.06±3.2158.12±8.91T组3018/1265.12±4.167.00±2.6359.05±8.37C组3018/1265.06±3.666.06±2.9058.53±8.48TC组3017/1364.88±3.266.19±2.8159.12±9.02 (1)麻醉前准备:所有患者均不给予术前用药。患者术前禁食12 h、禁饮8 h,入室后于左上肢开放外周静脉,连接心电图监测Ⅱ导联、右上肢无创血压(NBP)、心率(HR)、脉搏氧饱和度(SpO2)及脑电双频谱指数(BIS)。由熟练的麻醉医生对患者常规进行左桡动脉穿刺及右颈内静脉穿刺。桡动脉穿刺用于实时监测术中血压及作术中血气分析,右颈内静脉穿刺用于监测中心静脉压及术中补液。穿刺完毕后,加温组的患者在术区消毒范围外覆盖全身充气式保温毯。(2)麻醉诱导:从左上肢静脉依次给予咪唑安定0.05 mg/kg、依托咪酯0.3 mg/kg、顺式阿曲库铵0.2 mg/kg、舒芬太尼0.5 μg/kg,并持续面罩给氧,待病人意识消失及肌肉松弛后插入气管导管,连接麻醉机进行机械通气并连接EtCO2监测仪监测病人呼气末二氧化碳分压。一般气管导管内径(男性:ID=7.5 mm、女性:ID=7.0 mm)。麻醉诱导后患者均采取依据标准体重的潮气量6~8 mL/kg、呼吸频率12次/min、I:E为1:2的呼吸模式进行通气。将体温电极经单侧鼻孔置入患者鼻咽腔监测病人术中鼻咽温。(3)麻醉维持:术中均采用异丙酚4~8 mg/(kg·h)、瑞芬太尼0.2~0.3 μg/(kg·h)及右美托咪定0.4~1 μg/kg·min微量泵持续泵入、术中肌松的维持通过间断给予顺式阿曲库铵,脑电双频指数(BIS)监测值维持在40~60,血压心率维持变化在基础值的20%以内。必要时应用血管活性药物维持(麻黄碱、多巴胺、去氧肾上腺素等)。(4)麻醉苏醒:手术结束时停止所有静脉麻醉药物。待患者唤之有反应、恢复自主呼吸且节律与频率正常,潮气量>6 mL/kg,并可完成指令动作,生命体征平稳后拔出气管导管。(5)术中体温的维持:N组和C组的患者维持手术室温度为24 ℃,仅于病人身上覆盖无菌敷料,其他不作任何处置,术中监测鼻咽温。T组和TC组的患者维持手术室温度为24 ℃,术中用充气加温系统持续向保温毯内吹入温暖气体并依据鼻咽温调节吹入气体温度,若患者35 ℃<鼻咽温<36 ℃且调节气体温度无法升高鼻咽温时,则对患者输注加温液体,维持患者鼻咽温T≥36 ℃,术中监测鼻咽温。(6)术中PaCO2的维持:本试验依靠呼气末CO2分压(PetCO2)的水平来调节患者呼吸参数控制PaCO2水平。在手术过程中于气腹前(T0)、气腹后30 min(T1)、开腹后30 min(T2)、手术结束时(T3)4个时间点监测PaCO2可以准确地反映机体当时动脉血二氧化碳水平也可及时调节呼吸参数,维持N组和T组患者的PaCO2在35~45 mmHg,维持C组和TC组患者的PaCO2在45~50 mmHg。 记录患者麻醉时间、手术时间、停药-拔管时间、术中丙泊酚、瑞芬太尼和右美托咪定的剂量及术后寒颤例数。并在术中记录患者气腹前(T0)、气腹后30 min(T1)、开腹后30 min(T2)及手术结束时(T3)呼气末二氧化碳分压(PetCO2)及动脉血二氧化碳分压(PaCO2)。记录所有患者麻醉诱导后(T4)、气腹后1 h(T5)、开腹后1 h(T6)及手术结束时(T7)鼻咽温(T)。于术前1天与术后1周采用蒙特利尔智能量表(MoCA)北京版对患者认知功能障碍(POCD)情况进行评估,术后1、2、3天采用谵妄评定方法(CAM)量表对患者谵妄状态(POD)进行评估。 POCD的评估:采用1个标准差(1SD)法,即每个患者术后测试得分与术前比较,若降分值大于1个标准差(术前所有患者的标准差)则认为该患者出现POCD。 POD评估:CAM量表由4项组成:(1)急性起病,病情波动;(2)注意力不集中或不注意;(3)思维无序;(4)意识水平改变。若1+2+(3/4)则判定为发生POD。 4组患者麻醉时间、手术时间、停药-拔管时间比较差异无统计学意义(P>0.05)。见表2。 4组患者术中丙泊酚、瑞芬太尼、右美托咪定的用量比较差异无统计学意义(P>0.05)。见表3。 C组和TC组患者随着气腹时间的延长,PetCO2和PaCO2逐渐升高,与N组和T组比较,差异有统计学意义(P<0.05)。在C组和TC组中PetCO2最高可达42 mmHg,PaCO2可达49 mmHg。在T4和T5两个时间点,4组患者的T相比,差异无统计学意义(P>0.05)。但在T6和T7时间点,N组和C组与T组和TC组的T相比,差异有统计学意义(P<0.05)。T最低达35.1 ℃。见表4。 表2患者麻醉时间、手术时间、停药-拔管时间比较 组别麻醉时间(min)手术时间(min)停药-拔管时间(min)N组235.63±12.36217.81±12.3415.94±1.34T组231.56±19.98208.12±23.3017.31±2.51C组241.19±15.81224.38±16.8215.22±1.01TC组247.19±17.31228.75±16.1814.38±3.72 表3患者丙泊酚、瑞芬太尼、右美托咪定用量比较 组别丙泊酚(mg)瑞芬太尼(mg)右美托咪定(mg)N组1070.94±58.712.91±0.1994.25±4.94T组1048.75±75.403.01±0.1993.50±8.21C组1087.81±63.433.04±0.2795.37±5.60TC组1097.19±81.933.00±0.1594.12±6.90 表4患者各时点PetCO2、PaCO2和T的比较 N组T组C组TC组PetCO2(mmHg)T032.2±1.031.7±1.032.1±1.132.6±1.2T131.9±0.931.7±0.834.1±0.61)34.1±1.01)T232.3±1.132.1±0.837.8±0.71)38.1±0.71)T331.8±0.831.4±1.035.3±0.71)35.2±0.61)PaCO2(mmHg)T037.0±1.136.8±1.137.1±1.137.2±1.2T138.7±1.038.5±0.943.6±0.81)43.4±0.91)T237.5±0.936.8±0.745.7±0.91)45.1±1.21)T337.2±1.036.9±0.844.9±1.21)45.0±1.01)T(°C)T436.5±0.136.5±0.136.5±0.136.5±0.1T536.1±0.236.2±0.136.1±0.136.3±0.1T635.2±0.136.2±0.12)35.2±0.236.1±0.12)T735.1±0.136.0±0.12)35.2±0.136.0±0.12) 1)与N组和T组比较,P<0.05;2)与N组和C组比较,P<0.05。T1:气腹后30 min;T2:开腹后30 min;T3:手术结束时;T4:麻醉诱导后;T5:气腹后1 h;T6:开腹后1 h;T7:手术结束时 4组患者术后第1、2、3天的POD发生率差异无统计学意义,但是术后3天内N组患者中发生POD有11例、发生率为36.7%,T组有9例,发生率为30%,C组有4例,发生率为13.3%,TC组有2例,发生率为6.7%。与N组相比,C组和TC组患者发生率降低,差异有统计学意义(P<0.05),与T组相比,TC组发生率降低(P<0.05),但是C组和TC组相比,发生率无统计学意义(P>0.05)。见表5。 与术前相比,4组患者术后7天MoCA评分均降低且差值有统计学意义(P<0.05)。术后7天MoCA评分C组和TC组与N组和T组相比,差异有统计学意义(P<0.05)。N组10例发生POCD,T组8例,C组3例,TC组2例。与N组相比,C组和TC组患者发生率降低,差异有统计学意义(P<0.05),TC组与T组相比差异也具有统计学意义(P<0.05),但C组和TC组相比,差异无统计学意义(P>0.05)。见表6。 表5患者术后POD发生率比较 Tab 5 Comparison of the incidence of postoperative POD among patientsn(%) 1)与N组比较,P<0.05;2)与T组比较,P<0.05 表6患者术后POCD发生情况的比较 Tab 6 Comparison of the incidence of postoperative POCD among patients MoCA评分术前术后7天POCD发生率[n(%)]N组27.1±1.122.5±2.41) 10(33.3)T组27.3±1.023.2±2.51) 8(26.7)C组26.9±1.025.1±1.81)2) 3(10)3)TC组27.0±1.125.4±1.71)2) 2(6.7)4) 1)与术前比较,P<0.05;2)与N组和T组比较,P<0.05;3)与N组与C组比较,P<0.05; 4)与T组比较,P<0.05 N组患者中发生寒战有10例、发生率为33.3%,T组有0例,C组有7例、发生率为23.33%,TC组有2例、发生率为10%。与N组相比, T组和TC组患者发生率降低,差异有统计学意义(P<0.05),与T组相比,N组和C组发生率增加(P<0.05),但是T组和TC组相比,发生率无统计学意义(P>0.05)。 目前临床上关于术后早期精神改变的发病原因复杂,发病机制尚不清楚,其中麻醉方式与手术类型可能会影响患者的认知功能,本研究中患者在同一医院接受相同的术式治疗,术中采用相同的麻醉方式,可以尽可能避免上述两种方式对研究结果的影响。关于麻醉药物对术后认知能力的影响,有研究显示在儿童中应用异氟醚麻醉相较于瑞芬太尼可增加患儿术后谵妄的发生率[6],为避免吸入麻醉药对结果的影响,本研究中所有患者接受全凭静脉麻醉药物,而且术中依靠脑电双频指数(BIS)来指导麻醉镇静深度,避免麻醉深度影响结果。本文研究采用鼻咽部温度作为机体核心温度,T4、T5时4组患者的鼻咽温差异无统计学意义,可能的机制是在全身麻醉的患者中,诱导后1 h患者体温的下降主要是由于热量的重新分布而非热量的散失,热量由机体的核心分布于机体的外周[7],所以造成4组患者体温均下降。正常情况在麻醉诱导1 h后,由于机体表面通过辐射和对流而增加热量的流失[8],所以患者的体温开始逐渐下降,因T和TC组患者身上覆盖充气式保温毯,所以可以减少病人的辐射和对流,因此体温下降不明显。本文的研究结果显示在开腹1 h后,T和TC组患者的鼻咽温明显高于N和C组患者,差异有统计学意义。 关于术后精神改变的机制,不同学者提出不同理论:胆碱能学说、应激反应学说和炎性反应学说等。但目前仍存在争议,多数学者认为是在老年患者中枢神经系统退化的基础上,由手术及麻醉等相关因素诱发或加重的认知功能退行性改变,炎症反应可能是其发生的一个重要机制[9-10]。有研究证实,当发生POD及POCD时,与机体炎症反应相关的炎症性因子如TNF-α,IL-1β和IL-6随着认知功能的改变而改变。 Eckenhoff等[11]认为手术和麻醉通过调控炎症介质加强促炎介质TNF-α、IL-1β、IL-6的表达,减少IL-4、IL-10、TGF-β等抗炎介质的表达,引起突触和神经元的损伤,引起有害的神经炎症反应而引起机体认知功能的降低,而Terrando等[12]认为炎症介质的释放是全身炎症反应的后续反应,破坏血脑屏障。随着炎症反应的发生,血管内皮功能也发生障碍,当血管内皮结构改变时,血脑屏障结构发生改变,使脑血流减少,增加渗透性,使神经元发生炎症反应。PHY作为一种保护性通气策略,在临床上逐渐被证实,其脑神经保护主要机制为:(1)增加脑氧供,改善脑微循环,在一定范围内,随着机体PaCO2水平的增高,脑血管扩张,脑血流量增加,保证了脑血氧供应,同时高碳酸血症可升高机体动脉氧分压而改善患者手术区域和脑组织的氧分压[13],关于脑氧代谢率(CMRO2)研究显示随PaCO2水平的增高CMRO2降低[14],这与Jones等[15]的研究结果相反。(2)抑制兴奋性氨基酸神经递质的分泌,Vannucci等[16]研究发现允许性高碳酸血症患者脑脊液的谷氨酸的含量降低,减轻神经元兴奋性毒性反应,降低其损伤。(3)抑制炎症反应,炎症反应是POCD发生的一个重要机制,同低体温抑制炎症反应不同,在机体高碳酸血症下可抑制中性粒细胞上选择素和细胞粘附分子的表达,使中性粒细胞活性降低从而抑制炎症反应[17]。同时高碳酸血症可抑制自由基的产生,减轻氧化损伤,降低氧化应激反应,降低脂质过氧化,减轻脑损伤反应。 虽然具有神经保护作用的治疗性低温在临床上也在使用,但是其多用于治疗心脏骤停后脑损伤、新生儿缺血缺氧性脑病、中风、脑及脊髓损伤的患者,且治疗性低温的温度范围多为32~35 ℃。值得注意的是与Salazar F 等[18]研究不相同,本研究结果中N组和T组相比,C组和TC组相比术后谵妄和术后认知功能障碍的发生率无明显差异,可能的原因是在N组和C组中,鼻咽温最低为35.1 ℃,虽属浅低温的范畴但术中体温维持在35 ℃之上时并未表现出神经保护作用,在Salazar F等[18]研究中术中体温可达35 ℃之下。此外,在低温条件下,氧解离曲线左移不利于氧的释放,减少组织利用氧也可能对结果产生影响。 虽然本研究结果显示C组和TC组患者在术后谵妄和术后认知功能障碍的发生率无明显差异,但是C组患者在麻醉苏醒后发生寒战的为7例,而TC组为3例,术后寒战的发生可增加机体耗氧量,易引起术后低血氧、心肌缺血,甚至发生心肌梗死,尤其对于老年患者来说可增加围术期不良事件的发生率。因此,围术期实施安全有效的体温保护措施是必要的,在本研究中,围术期首先将手术室温度调节为24 ℃,减少病人与外界环境的温度差,以减少病人的散热,此外将加温毯覆盖在病人非消毒范围外,并在手术过程中利用气体加温系统持续向加温毯内吹入温暖的气体,可有效的维持病人体温≥36 ℃。 本研究结果全部采用主观评分标准对患者进行评估,没有测量客观指标,比如测定炎性因子等。此外,本研究未能建立长期随访来观察术后远期精神状况的情况。关于围术期低体温是否会对心肺功能正常的老年患者POD及POCD产生有益的影响仍是我们后续研究的重点。 综上所述,在老年患者腹腔镜手术中推荐维持鼻咽温≥36 ℃和PaCO245~49 mmHg,其可降低老年患者POD及POCD的发生率,且减少低体温产生的不良影响。 [1] Duong TQ, Iadecola C, Kim SG. Effect of hyperoxia, hypercapnia, and hypoxia on cerebral interstitial oxygen tension and cerebral blood flow[J]. Magn Reson Med,2001, 45(1):61-70. [2] De Campos T. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network[J]. Survey of Anesthesiology, 2001, 45(18):1301-1308. [3] Carlo WA. Permissive hypercapnia and permissive hypoxemia in neonates[J]. J Perinatol,2007, 27:64-70. [4] Sessler DI. Perioperative hypothermia in the high-risk surgical patient[J].Best Pract Res Clin Anaesthesiol, 2003, 17(4):485-498. [5] Wagner VD.Impact of perioperative temperature management on patient safety[J]. Surg Servi Manag, 2003,9(4):38-43. [6] Przybylo HJ, Martini DR, Mazurek AJ, et al. Assessing behaviour in children emerging from anaesthesia: can we apply psychiatric diagnostic techniques?[J].Pediatr Anesth, 2003,13(7):609-616. [7] Matsukawa T, Sessler DI, Sessler AM, et al. Heat flow and distribution during induction of general anesthesia[J]. Anesthesiology, 1995, 82(3):662-673. [8] Kurz A, Sessler DI, Christensen R, et al. Heat balance and distribution during the core-temperature plateau in anesthetized humans[J].Anesthesiology,1995, 83(3):491-499. [9] Mcdaniel M, Brudney C. Postoperative delirium: etiology and management[J]. Curr Opin Crit Care, 2012, 18(4):372-376. [10] Munster BC, Aronica E, Zwinderman AH, et al. Neuro inflammation in delirium: a postmortem case-control study[J].Rejuvenation Res,2011,14(6):615-622. [11] Eckenhoff RG, Laudansky KF. Anesthesia, surgery, illness and Alzheimer's disease[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2013,47:162-166. [12] Terrando N, Eriksson LI, Ryu JK, et al. Resolving postoperative neuroinflammation and cognitive decline[J].Ann Neurol, 2011, 70(6):986-995. [13] Akca O, Liem E, Suleman MI, et al. Effect of intra-operative end-tidalcarbon dioxide partial pressure on tissue oxygenation[J].Anaesthesia, 2003, 58(6):536-542. [14] Sicard KM, Duong TQ. Effects of hypoxia, hyperoxia, and hypercapnia on baseline and stimulus-evoked BOLD, CBF, and CMRO 2 in spontaneously breathing animals[J].Neuroimage, 2005, 25(3):850-858. [15] Jones M, Berwick J, Hewson-Stoate N, et al. The effect of hypercapnia on the neural and hemodynamic responses to somatosensory stimulation[J].Neuroimage, 2005, 27(3):609-623. [16] Vannucci RC, Brucklacher RM, Vannucci SJ. Effect of carbon dioxide on cerebral metabolism during hypoxia-ischemia in the immature rat[J].Pediatr Res, 1997, 42(1):24-29. [17] Zappe AC, Uluda K, Oeltermann A, et al. The influence of moderate hypercapnia on neural activity in the anesthetized nonhuman primate[J].Cereb Cortex, 2008, 18(11):2666-2673. [18] Salazar F, Donate M, Boget T, et al. Intraoperative warming and post-operative cognitive dysfunction after total knee replacement[J].Acta Anaesthesiol Scand, 2011, 55(2):216-222. EffectsofbodytemperatureandPaCO2levelsonearlymentalchangeafterlaparoscopyinelderlypatients LI Dongbai1, LI Sha1, GAO Lulu2, LYU Meihong2 (1.DepartmentofAnesthesiology,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China; 2.DepartmentofAnesthesiology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China) ObjectiveTo investigate the effects of different levels of body temperature and PaCO2on early postoperative mental change in elderly patients, who underwent elective laparoscopic surgery.MethodsTotally 120 patients over 60 years of age, who were diagnosed with gastric carcinoma and scheduled for laparoscopic radical surgery, were randomly divided into four groups (n=30 in each group): control group with 35 ℃ permissive hypercapnia; laparoscopy surgery; postoperative delirium; postoperative cognitive dysfunction R614.2 A 1671-7295(2017)05-0465-06 李东白,李莎,高露露,等.不同体温及PaCO2对老年患者腹腔镜术后早期精神改变的影响[J].大连医科大学学报,2017,39(5):465-470. 2017-06-02; 2017-09-19)1 资料与方法
1.1 研究对象
1.2 分 组


1.3 麻醉方法
1.4 指标分析
1.5 统计学方法
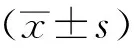
2 结 果
2.1 麻醉时间、手术时间、停药-拔管时间比较
2.2 术中用药量比较
2.3 患者PetCO2、PaCO2和鼻咽温(T)的比较




2.4 术后POD发生率比较
2.5 术后POCD发生情况比较
2.6 术后寒战发生情况比较
3 讨 论

