苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑制及机理研究
廖石榴,尹维,廖晓兰*,张亚*
苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑制及机理研究
廖石榴1,2,尹维1,2,廖晓兰1,2*,张亚1,2*
(1.湖南农业大学植物保护学院,湖南长沙410128; 2.植物病虫害生物学与防控湖南省重点实验室,湖南长沙410128)
通过测定苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌活性、菌液的600nm值、电导率、蛋白质含量、保护酶和呼吸代谢途径酶活性,探索苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌机理。结果表明:苋菜乙酸乙酯提取物对柑橘溃疡病菌的室内平板抑菌圈直径在15 mm以上,最低抑菌质量浓度为3.68 mg/mL;苋菜乙酸乙酯提取物不仅延迟了病原菌进入对数生长期的时间,而且使其电导率增加了15%;苋菜乙酸乙酯提取物对过氧化物酶(POD)、过氧化氢酶(CAT)、琥珀酸脱氢酶(SDH) 和苹果酸脱氢酶(MDH)的酶活力的抑制率分别为78.43%、68.63 %、63.14%、68.00%。扫描电镜观察发现,苋菜乙酸乙酯提取物使柑橘溃疡病菌的菌体细胞膜遭受损伤,菌体发生裂解;透射电镜观察发现,苋菜乙酸乙酯提取物使柑橘溃疡病菌的细胞壁和细胞膜结构受损,胞内空白面积增大,细胞质外泄,菌体裂解。
苋菜;乙酸乙酯提取物;柑橘溃疡病菌;抑菌机理
有关苋菜活性物对食品病原菌的抑菌活性的研究较多,如苋菜的水提物对面包中产生的罗克福尔青霉菌()有较好的抑制效果,苋菜的醇提物对食品中的多种细菌均有抑制效果[1–3]。进一步研究发现,在苋菜凝集素作用的过程中产生了4种新型的抗菌肽成分,这些抗菌肽成分在淀粉类食品加工时能长时间有效延长食品的贮藏寿命[4–6]。笔者测定苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌活性,测定经苋菜乙酸乙酯提取物处理的柑橘溃疡病菌的生长、含糖量、蛋白质含量和POD、CAT、SDH和MDH的酶活力[7–8],通过扫描电镜和透射电镜观察柑橘溃疡病菌细胞膜结构的变化,以期为开发苋菜资源作为新型植物源杀菌剂提供理论依据。
1 材料与方法
1.1 材料
供试苋菜(L,种质库编号Ⅱ9C0044,由湖南省农业科学院蔬菜研究所保存),由湖南农业大学浏阳科研基地提供。选取生长旺盛期的圆叶红苋菜健康叶片,洗净,自然光照下晾干后经高速粉碎机粉碎,过孔径0.25 mm筛,干燥阴凉处密封储存,备用。柑橘溃疡病菌(pv)由湖南农业大学植物病理学实验室提供。
1.2 方法
1.2.1苋菜乙酸乙酯提取物的制备
取苋菜叶干粉40 g,加入800 mL乙酸乙酯,常温振荡24 h后,静置,舍弃残渣,收集上清液,重复1次,合并2次所得上清液,以3 000 r/min离心,舍弃残渣,将获得的上清液40 ℃旋转浓缩至膏状物,用16.67%乙醇溶液溶解,得到苋菜乙酸乙酯提取物[9–11]。
1.2.2苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌活性的测定
1) 抑菌圈测定。将浓度为3´108cfu/mL的柑橘溃疡病菌菌悬液20 µL,均匀涂布于蔗糖蛋白胨培养基上,在平板中央对称两侧用打孔器打孔,并在其注入250 µL苋菜乙酸乙酯提取物,于培养箱中培养48 h后,测量其抑菌圈直径。
2) 最低抑菌质量浓度()的测定。苋菜乙酸乙酯提取物母液,其质量浓度为58.88 mg/mL,用二倍稀释法将母液稀释成6个浓度梯度,测量7种浓度苋菜乙酸乙酯提取物带药平板上的抑菌圈直径,以能产生抑菌圈的最低浓度为苋菜乙酸乙酯提取物的[12–16]
3) 苋菜乙酸乙酯提取物离体防效测定。将新鲜柑橘叶片用无菌水清洗干净,用70%乙醇擦拭叶片正反两面,晾干。①将叶片放入苋菜乙酸乙酯提取物中浸泡30 s后取出晾干,2 h后用柑橘溃疡病菌的菌悬液针刺接种叶片,放入垫有滤纸的培养皿中,28 ℃保湿培养,每皿2片叶,设3次重复。观察苋菜乙酸乙酯提取物的预防作用。②将柑橘叶片放入苋菜乙酸乙酯提取物中浸泡30 s后取出晾干,置于垫有滤纸的培养皿中,28 ℃保湿培养24 h后取出,用柑橘溃疡病菌的菌悬液针刺接种叶片,放入培养皿中28 ℃保湿培养,每皿2片叶,设3次重复。观察苋菜乙酸乙酯提取物的保护作用。③用柑橘溃疡病菌的菌悬液针刺接种叶片,放入垫有滤纸的培养皿中,28 ℃保湿培养,每皿2片叶,共设3次重复。待叶片开始显症时,将其放入苋菜乙酸乙酯提取物中浸泡30 s后取出晾干,放入培养皿中28 ℃保湿培养。观察各处理叶片的发病情况,以接种菌悬液、接种无菌水的叶片为对照。观察苋菜乙酸乙酯提取物的治疗作用[17–18]。
1.2.3苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌作用的测定
在150 mL牛肉膏培养液中加入300 µL浓度为3´108cfu/mL的柑橘溃疡菌悬液,加入质量浓度为30 mg/mL的苋菜乙酸乙酯提取物20 µL,135 r/min,28 ℃振荡培养,每隔3 h取样,共取5次样,观察柑橘溃疡病菌的生长状况。
将牛肉膏液体与柑橘溃疡菌菌液混合后,加入质量浓度为30 mg/mL苋菜乙酸乙酯提取物,每4 h取样,共取5个样,加入等量的40%三氯乙酸均匀混合,3 000 r/min离心12 min,取上清进行蒽酮比色,测定各菌液在620 nm下的吸光度值,以牛肉膏培养液作对照,测定柑橘溃疡病菌的糖含量。
取300 µL质量浓度为 30 mg/mL的苋菜乙酸乙酯提取物,加入150 mL正值生长对数期的菌液中,每隔3 h取样,共取样5次,3 000 r/min离心12 min,取上清,用无菌水将其稀释5倍,在10 mL试管中各加入0.1 mL混合液,再加入考马斯亮蓝G–250试剂,以不加苋菜乙酸乙酯提取物的菌液作对照。以加入的试剂为空白对照,测定柑橘溃疡病菌的蛋白质含量[20]。
取质量浓度分别为20、12、10、7、5 mg/mL的苋菜乙酸乙酯提取物各200 µL,加入150 mL柑橘溃疡病菌菌液中,135 r/min、28 ℃振荡培养24 h,以不加苋菜乙酸乙酯提取物的菌液为对照。各取10 mL处理液在低温环境下超声破碎,每次破碎5 s,处理2 min,5 000 r/min低温离心12 min。吸取1 mL上清液,测定过氧化物酶(POD)和过氧化氢酶(CAT)酶活,每处理重复3次。
分别取质量浓度为20、12、10、7、5 mg/mL的苋菜乙酸乙酯提取物200 µL,加入150 mL菌液中,135 r/min、28 ℃培养24 h,以不加苋菜乙酸乙酯提取物的菌液作对照。每处理各取2 mL于3 000 r/min离心15 min。将收集得到的菌体用0.1 mol/LpH值7.4的Tris–HCl缓冲液洗涤3次。将等体积的溶菌酶(2 g/L)加入菌体中,38 ℃静置15 min,待菌体发粘时立即取出冰浴;加入Tris–SDS缓冲液后5 000 r/min低温离心12 min,取出上清液作为样本,测定琥珀酸脱氢酶(SDH)、苹果酸脱氢酶(MDH)酶活力[21–24],每处理重复3次。
取5 mL菌液于具塞试管中,加入200 µL苋菜乙酸乙酯提取物后迅速测定初始电导率值;测定完毕后将试管置于摇床中振荡,分别在5、10、20 min和1、2、3 h后取样,测定电导率。
在振荡培养24 h的柑橘溃疡病菌菌液中加入400 µL苋菜乙酸乙酯提取物,继续振荡培养4 h,取出后2 500 r/min离心12 min,弃上清液,收集沉淀的菌体;用pH值为7.2的4 ℃磷酸缓冲液洗涤3~5次,倒入2.50%戊二醛固定;用磷酸缓冲液冲洗3次,然后将样品分别置于30%、50%、70%、80%、90%、95%、100%乙醇中逐级置换脱水,每次10~12 min,3 000 r/min离心;将脱水后的样品进行CO2临界点干燥后,在高真空蒸发器中喷金镀膜。将制备的样品在扫描电镜和透射电镜下观察苋菜乙酸乙酯提取物对菌体形态结构的影响[25]。
1.2.4数据处理与分析
采用DPS6.55软件对数据进行分析。
2 结果与分析
2.1 苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌活性
柑橘溃疡病菌涂布平皿并打孔,注入苋菜乙酸乙酯提取物,28 ℃培养48 h后,抑菌圈平均直径大于15 mm(图1)。
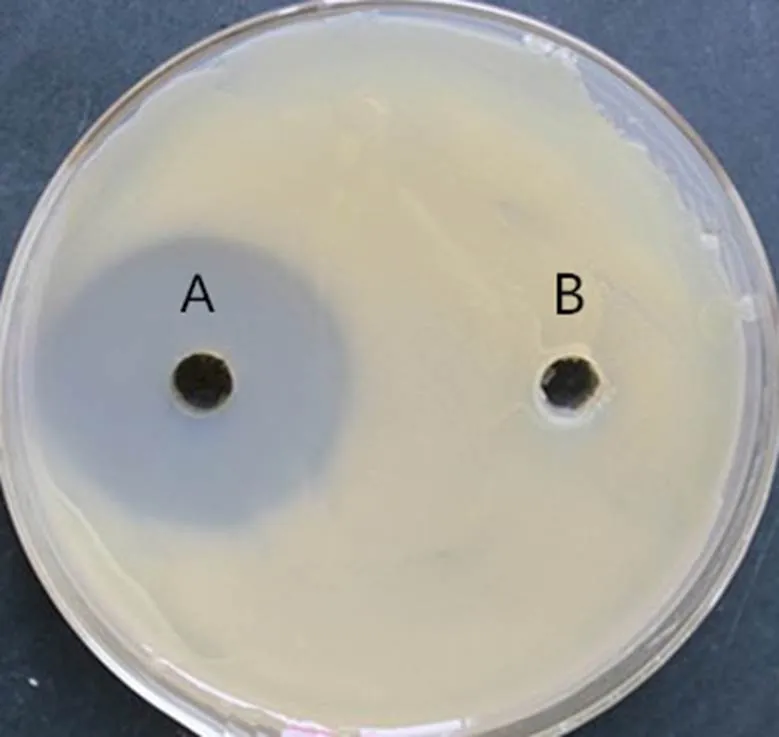
A孔 苋菜乙酸乙酯提取物;B孔 乙酸乙酯对照。
7种浓度梯度的苋菜乙酸乙酯提取物对柑橘溃疡病菌抑菌试验结果显示,苋菜乙酸乙酯提取物能有效地抑制柑橘溃疡病菌的生长,抑制作用与苋菜乙酸乙酯提取物浓度呈正相关,苋菜乙酸乙酯提取物对柑橘溃疡病菌的为3.68 mg/mL。
接种柑橘溃疡病菌菌悬液的5组处理在24 h后都开始显示症状,针刺处出现明显的感染病斑。6 d后,经预防、保护作用和治疗作用处理的叶片(图2–a,2–b,2–c)仅在针刺处出现黄绿色斑点,且经预防作用处理的叶片发病程度比保护作用处理的要轻,治疗作用处理的叶片的发病程度最轻,病斑最小;仅接种菌悬液的叶片上出现黄绿色不规则斑点和灰褐色块状病斑(图2–d)。

a 预防作用;b 保护作用;c 治疗作用;d 接菌对照。
2.2 苋菜乙酸乙酯提取物对柑橘溃疡病菌的抑菌机理
2.2.1对病原菌生长的影响
图3显示,柑橘溃疡病菌液的生长曲线和经苋菜乙酸乙酯提取物处理后的菌液的生长曲线有较大的差异。在600 nm的吸光度值处,柑橘溃疡病菌液吸光度要远大于经苋菜乙酸乙酯提取物处理后的吸光度,苋菜乙酸乙酯提取物处理的菌液进入对数期的时间相对延迟,表明苋菜乙酸乙酯提取物处理抑制了柑橘溃疡病菌的生长。
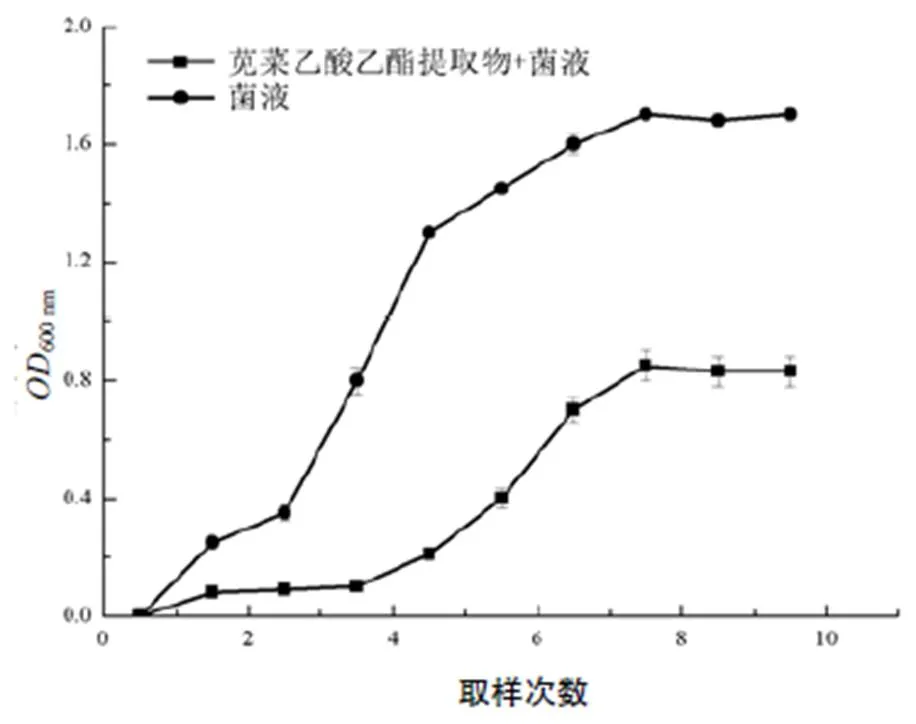
图3 不同取样次数的柑橘溃疡病菌悬液的吸光度
2.2.2对病原菌含糖量的影响
经苋菜乙酸乙酯提取物处理后的菌液相对含糖量大幅度增加,在处理20 h后,与柑橘溃疡病菌液的含糖量的差异趋于平稳。说明经苋菜乙酸乙酯提取物处理后,柑橘溃疡病菌利用糖的能力有明显降低的趋势,苋菜乙酸乙酯提取物能有效抑制病原菌对糖的利用能力。
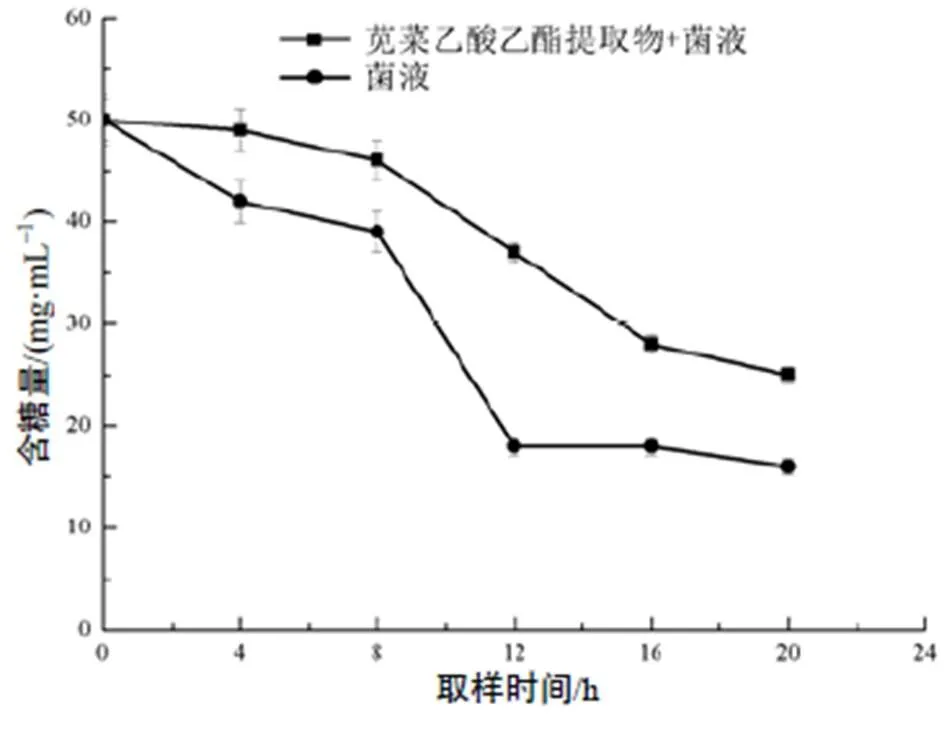
图4 柑橘溃疡病菌不同取样时间的含糖量
2.2.3对病原菌蛋白含量的影响
加入苋菜乙酸乙酯提取物的菌液,在2 h和4 h分别取样,蛋白含量都降低;6 h取样测定,经苋菜乙酸乙酯提取物处理后蛋白含量663 µg/mL,明显高于柑橘溃疡病菌液的。
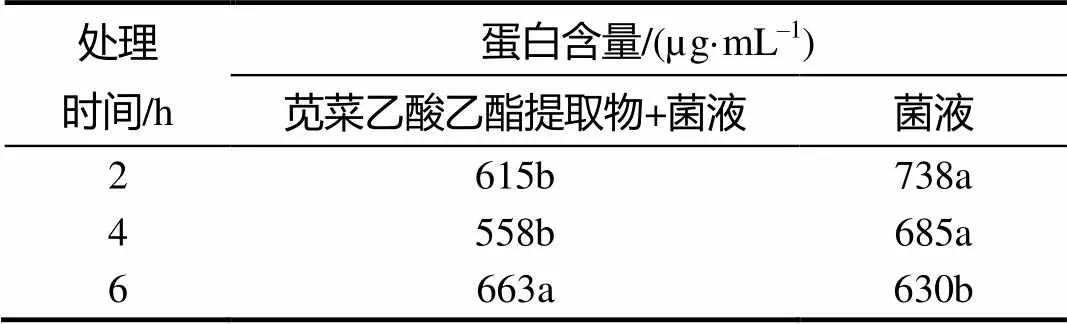
表1 苋菜乙酸乙酯提取物不同处理时间的柑橘溃疡病菌的蛋白含量
同列不同小写字母示差异显著(<0.05)。
2.2.4对病原菌保护酶和呼吸代谢酶的影响
对菌液酶活力测定结果(表2)表明,当苋菜乙酸乙酯提取物的质量浓度为20 mg/mL时,POD的活性与对照组相比降低了78.4%;当苋菜乙酸乙酯提取物质量浓度达到20 mg/mL时,CAT的活性与对照组相比降低了68.6%。苋菜乙酸乙酯提取物不仅降低柑橘溃疡病菌POD、CAT的酶活力,且苋菜乙酸乙酯提取物浓度与酶活力成反比。

表2 苋菜乙酸乙醇提取物处理柑橘溃疡病菌的酶活力
当苋菜乙酸乙酯提取物的质量浓度为20 mg/mL时,SDH的活性与对照组相比降低了63.1%,MDH的活性与对照组相比降低了68%。推测苋菜乙酸乙酯提取物可能主要通过抑制TCA方式来发挥对病原菌呼吸代谢的抑制作用。
2.2.5对病原菌细胞膜通透性的影响
经苋菜乙酸乙酯提取物处理后,菌液电导率值先急剧增加,其后电导率值增幅变小,慢慢趋于稳定(表3)。在此期间,经苋菜乙酸乙酯提取物处理菌液的电导率比对照组增加了15 %。

表3 苋菜乙酸乙酯提取物处理的柑橘溃疡病菌的电导率
同列不同小写字母示差异显著(<0.05)。
2.2.6对病原菌细胞形态的影响
扫描电镜下观察,菌体如图5–A所示;经苋菜乙酸乙酯提取物作用后的菌体,形状有不规则皱缩和较大变形,菌体发生裂解且内容物多处外泄(图5–B)。推测苋菜乙酸乙酯提取物使得菌体的细胞膜和细胞壁结构遭受损坏,导致细胞内物质发生渗漏,部分菌体发生严重裂解。
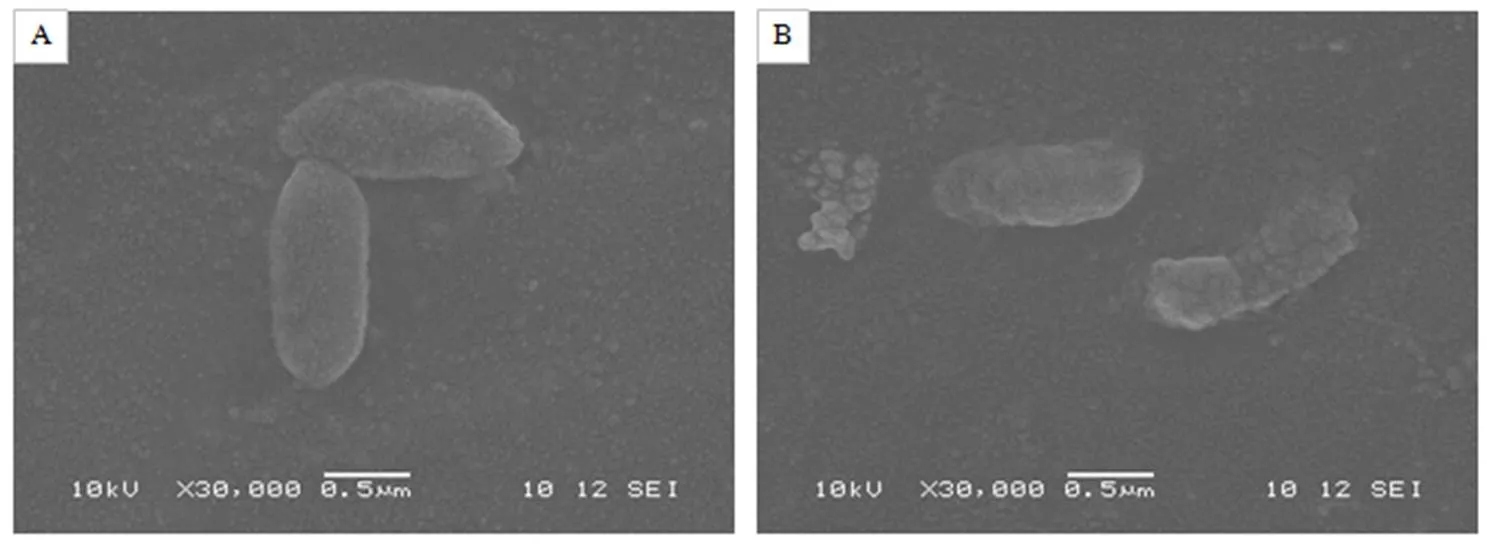
A 柑橘溃疡病菌;B 苋菜乙酸乙酯提取物作用后的菌体。
透射电镜观察,柑橘溃疡病菌菌体如图6–A所示。经苋菜乙酸乙酯提取物处理后,菌体细胞严重皱缩且有明显的变形,表面不再光滑,细胞壁等结构被破坏,胞质凝结成块,分布极其不均匀,菌体出现大面积的裂解现象。相对于正常的菌体而言,视野中清晰可见的菌体明显减少,且在菌体周边出现许多深色阴影部分,推测可能是菌体在苋菜乙酸乙酯提取物的作用下,细胞壁结构受损致使其内容物泄漏(图6–B)。结果显示,苋菜乙酸乙酯提取物在一定程度上破坏了菌体的细胞膜和细胞壁结构,使得细胞质外泄,菌体裂解。
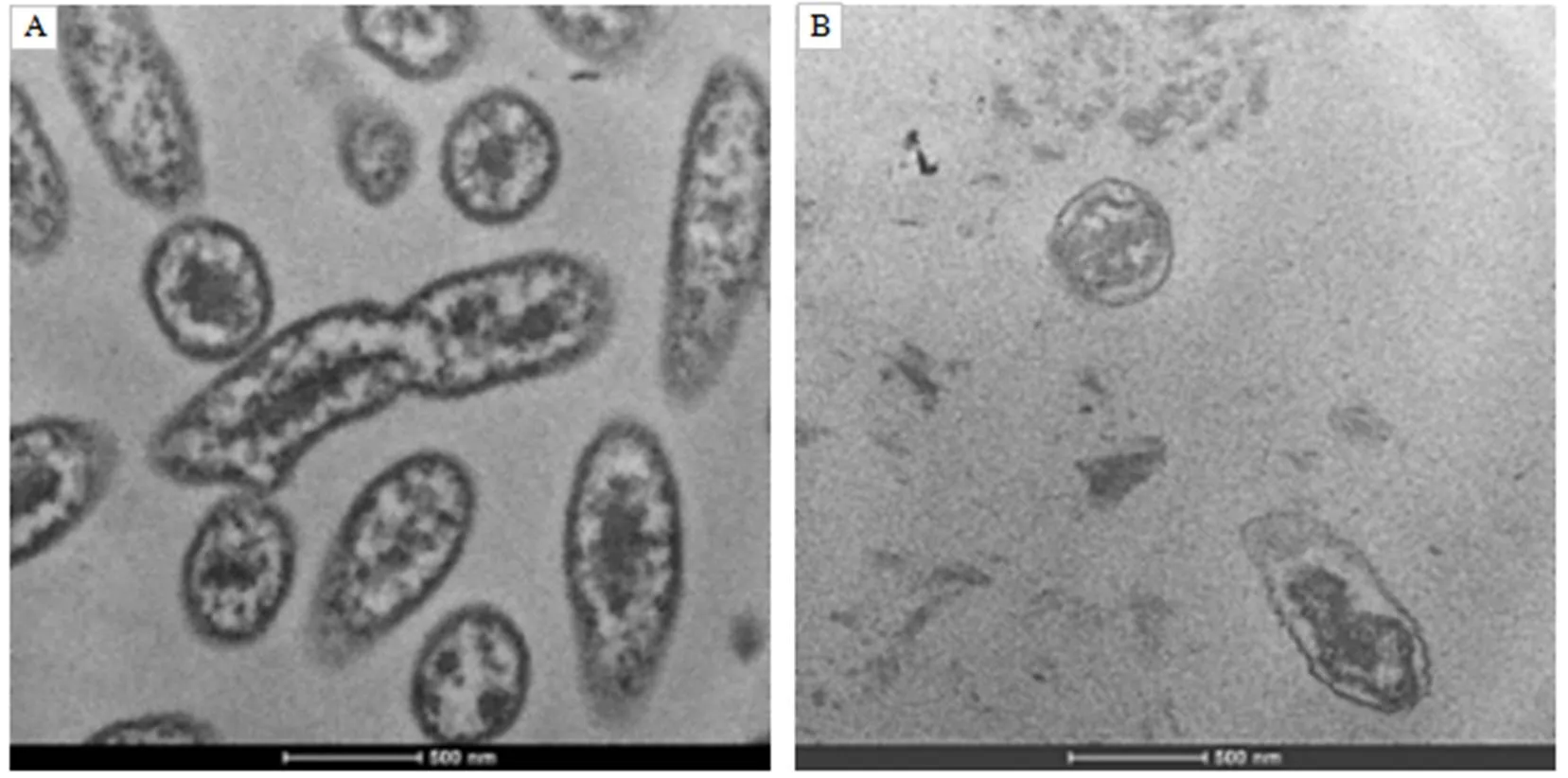
A柑橘溃疡病菌;B苋菜乙酸乙酯提取物作用后的菌体。
图6柑橘溃疡病菌的透射电镜观察(30 000×)
Fig.6TEM observation ofpv.(30 000×)
3 结论与讨论
研究结果表明,苋菜乙酸乙酯提取物对柑橘溃疡病菌有较好的抑菌效果,值为3.68 mg/mL,对比山茱萸粗提物对柑橘溃疡病菌的抑菌效果,值为62.5 mg/mL[26]有明显的优势。一般来说,植物提取液对病原菌的直接作用,包括抑制游动孢子的产生、破坏细胞壁和细胞膜的完整性、抑制蛋白和核酸等的合成和其他多种途径来实现。经过苋菜乙酸乙酯提取物处理后,柑橘溃疡病菌菌液的电导率明显增大,导致生物体内一些物质的外漏,说明苋菜乙酸乙酯提取物可以破坏菌体细胞膜的结构。随着苋菜乙酸乙酯提取物的进一步作用,供试菌对糖的氧化代谢被抑制,使得生物体的生长和繁殖受到阻碍。SDH和MDH是三羧酸循环中的关键酶类,它们的酶活数值变化可以直接反映出细胞的能量代谢情况,苋菜乙酸乙酯提取物对这2种酶有明显的抑制作用。在扫描电镜和透射电镜下观察,苋菜乙酸乙酯提取物使得柑橘溃疡病菌菌体皱缩,严重变形,菌体的保护结构遭到破坏,致使细胞质中蛋白质等物质有外泄的现象,致菌体生长和繁殖能力严重受损。
柑橘溃疡病菌是黄单胞杆菌属,由于同属细菌之间可能存在某些生理共性[27–28],可以利用这种生理共性开展苋菜乙酸乙酯提取物对黄单胞杆菌属的其他植物病原菌的抑菌试验,探索苋菜乙酸乙酯提取物对于植物病害防治的广谱性。
[1] ABD AZIZ S M,LOW C N,CHAI L C,et al.Screening of selected Malaysian plants against several food borne pathogen bacteria[J].International Food Research Journal,2001,18(3):1195–1201.
[2] CARLO G R,ROSSANA C,MARIA D A,et al.Long–term fungal inhibitory activity of water–soluble extract fromspp.seeds during storage of gluten–free and wheat flour breads[J].International Journal of Food Microbiology,2009,131:189–196.
[3] MAIYO Z C,NGURE R M,MATASYOH J C,et al. Phytochemical constituents and antimicrobial activity of leaf extracts of threeplant species[J]. African Journal of Biotechnology,2010,9(21):3178– 3182.
[4] LINA R A,MANUEL S G.Antifungal activity of a protean extract fromseeds[J]. Mexico Journal of Chemistry Society,2007,51(3):136–140.
[5] Silva–Sànchez C,De La Rosa A P B,Leòn–Galvàn M F,et al.Bioactive peptides in Amaranth () seed[J].Journal of Agriculture and Food Chemistry,2008,56:1233–1240.
[6] UUSIKUA N P,OELOFSEA A,DUODUB K G,et al.Nutritional value of leafy vegetables of sub–Saharan Africa and their potential contribution to human health:A review[J].Journal of Food Composition and Analysis,2010,23:499–509.
[7] 周磊,云宝仪,汪业菊,等.大黄素对金黄色葡萄球菌的抑菌作用机制[J].中国生物化学与分子生物学报,2011(12):1156–1160.
[8] 卢晓,周磊,谢鲲鹏,等.没食子酸对金黄色葡萄球菌抑菌活性及机制研究[J].中国食用菌,2012(4):54–56.
[9] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[10] 林燕如,张晓芝.苋菜叶蛋白提取工艺研究[J].北方园艺,2013(18):139–142.
[11] 夏日照,谢燕,尹维,等.苋菜活性物提取工艺及抑菌活性研究[J].中国蔬菜,2015(8):49–53.
[12] 陈红兵,王金胜,张作刚,等.万寿菊根的提取物对西瓜枯萎病反应的抗性研究[J].植物病理学报,2003,33(5):439–443.
[13] LEE H J,CHOI G J,CHO K Y.Correlation of lipid peroxidation incaused by dicarboximide fungicides with their fungicidal activity [J].J Agric Food Chem,1998,46:737−741.
[14] TANG X M,DAI S W.ESEM observation for biological samples[J].J Chin Electron Microscop Soc,2001,20:217−223.
[15] 陈志敏,商文静,吴云峰,等.几种中草药丙酮提取物对西瓜花叶病毒2号的抗性研究[J].西北农业学报,2013,12(4):35–37.
[16] 陈玉环,陈楚英,彭旋,等.桂枝主要抑菌活性成分对15种植物病原菌的室内毒力测定[J].中国南方果树,2015,44(5):48–50.
[17] 王利国.天然产物对植物病毒的抑制作用[J].中国生物防治,2000,16(3):127–130.
[18] 黄幼玲.柑橘溃疡病检疫与防治[J].植物保护,2007,33(6):132–135.
[19] 云宝仪,周磊,谢鲲鹏,等.黄芩素抑菌活性及其机制的初步研究[J].药学学报,2012,47(12):1587–1592.
[20] 陈禹先,周彤,谢鲲鹏,等.黄芩素对耐甲氧西林金黄色葡萄球菌抑菌机制的研究[J].畜牧兽医学报,2013,44(12):2000–2006.
[21] 王倩,谢明杰.木犀草素对金黄色葡萄球菌的抑菌活性及其机制[J].微生物学报,2010,50(9):1180–1184.
[22] 王海涛,王倩,谢明杰.大豆异黄酮对金黄色葡萄球菌的抑菌机制研究[J].中国农业科学,2009,42(7):2586–2591.
[23] 刘旺景,敖长金,萨茹丽,等.植物提取物抑菌活性及作用机理[J].动物营养学报,2016,28(8):2344–2352.
[24] 王远遐,姬兰柱,刘艳,等.虎杖提取物对苹果腐烂病菌的抑菌机制[J].中国生物防治学报,2015,31(1):148–156.
[25] 康莲娣.生物电子显微技术[M].合肥:中国科学技术大学出版社,2003:166–185.
[26] 舒晓燕,阮期平.山茱萸总苷的分离及抑菌活性研究[J].食品科学,2008,29(12):353–357.
[27] 杨玉萍,李艾莲.植物源杀菌剂研究进展[J].中国农业科技导报,2006(1):49–53.
[28] 陈晴,谢鲲鹏,云宝仪,等.黄柏等中草药对MRSA的抑菌作用及其对质粒的消除作用[J].微生物学杂志,2013,33(3):54–57.
责任编辑:罗慧敏
英文编辑:罗维
Inhibition ofpvby ethyl acetate extract ofL. and its mechanism
LIAO Shiliu1,2, YIN Wei1,2, LIAO Xiaolan1,2*, ZHANG Ya1,2*
(1. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 2.Hunan Key Lab.Biol & Ctrl of Plant Dis & Pests , Changsha 410128 , China )
To deduce the antibacterial mechanism of ethyl acetate extract ofL. againstpv, the antibacterial activity of ethyl acetate extract ofL. againstpv.was determined and the effects of ethyl acetate extract ofL. on600nm, conductivity, protein content and respiratory metabolism enzyme activity ofpv.strain liquid were investigated. The results show that the inhibition zone diameter onpv.with ethyl acetate extract ofL. was above 15 mm, with3.68 mg/mL. With ethyl acetate extract ofL., the growth ofpv.was delayed, and the conductivity ofpv.was increased by 15% and enzyme activities of POD, CAT, SDH and MDH were inhibited by 78.43%, 68.63%, 63.14%, 68%, respectively. Scanning electron microscopy showed that cell membrane ofpv.was damaged, the bacteria was lysed, and the cell was cracked with ethyl acetate extract ofL.. Transmission electron microscopy showed that ethyl acetate extract ofL. caused the damage of cell wall and cell membrane structure ofpv., and caused the increase of intracellular blank area, the leak of cytoplasm, and the lysis of bacteria.
L.; ethyl acetate extract;pv; inhibitory mechanism
S436.661.1
A
1007-1032(2017)05-0544-07
2017–06–08
2017–08–20
湖南省教育厅重点项目(16A095)
廖石榴(1993—),女,湖南临湘人,硕士研究生,主要从事农药学研究,liaoshiliu@aliyun.com;*通信作者,廖晓兰,博士,教授,主要从事农药学研究,liaoxl88@126.com;通信作者,张亚,博士,副教授,主要从事农药学研究,zhangya230@126.com
投稿网址:http://xb.hunau.edu.cn

