南高丛蓝莓快繁体系的建立
金如意,郭崇炎,王志龙,陈秋红,胡方志
南高丛蓝莓快繁体系的建立
金如意,郭崇炎#,王志龙*,陈秋红*,胡方志
(湖南农业大学农学院,湖南长沙 410128)
为建立一套完整、高效的蓝莓快繁体系,以南高丛蓝莓‘南金’的幼嫩枝条为试验材料,取带腋芽的茎段为外植体,分别进行外植体消毒、丛生芽诱导、组培苗继代增殖、组培苗生根和组培苗移栽试验。结果表明:用5% NaClO溶液消毒10 min、用0.1% HgCl2溶液消毒7 min时外植体的消毒效果最好;蓝莓茎段诱导形成丛生芽的最佳培养基是改良WPM+ZT 4.0 mg/L,增殖倍数达3.86,平均芽高为19.4 mm;组培苗最佳继代增殖培养基是改良WPM+ZT 1.0 mg/L,增殖倍数为1.82,平均株高达44.7 mm;组培苗最佳生根培养基组合是改良1/4 WPM+IBA 0.5 mg/L+NAA 1.0 mg/L;组培苗最佳移栽基质是蛭石+草炭土(体积比1∶1),移栽成活率可达96.95%。
南高丛蓝莓;诱导培养;继代培养;生根培养;植物激素
蓝莓为杜鹃花科(Ericaceae)越橘属()植物[1]。中国对蓝莓的研究始于20世纪80年代初。自2000年产业化生产栽培以来,中国的蓝莓种植面积迅速增加,优质蓝莓种苗的市场需求不断扩大[2]。蓝莓的繁殖方法较多,生产中常用的有种子育苗、绿枝扦插、分株嫁接等[3–5],但这些方法的繁殖较慢,品种容易退化。采用组织培养技术可以对蓝莓苗木进行规模化生产,提高效率,降低成本,保持品种的优良特性[6]。该技术是当前蓝莓大量繁殖的重要技术之一。
南高丛蓝莓‘南金’为早熟品种,其树势强,为开张型,枝梢多,花芽多;单株可以结果,无需授粉树;其叶片窄小,适宜在南方高温、高湿条件下生长;其果肉紧实,果粉多,含糖量高,酸甜比适中,风味浓郁,果蒂痕小而干,耐贮藏,耐运输。‘南金’蓝莓在江西、湖南等地区5月上中旬即可成熟,适宜在长江中下游地区种植[7]。目前,蓝莓组织培养育苗仍存在繁殖系数较低、生根率不高等问题[8]。笔者通过‘南金’蓝莓的组织培养试验,旨在建立一套较完整的蓝莓苗木快繁体系。
1 材料与方法
1.1 材料
试验材料为从浙江引进的南高丛蓝莓品种‘南金’。以春天新生的带腋芽半木质化幼嫩茎段为外植体。
1.2 方法
1.2.1培养条件
以改良WPM为基础培养基,通过改变激素种类及其浓度来配置不同的诱导、继代、生根培养基。各培养基中琼脂糖最终质量浓度为6 g/L,蔗糖最终质量浓度为30 g/L,pH值为5.2。各培养基均在121 ℃、131 kPa条件下灭菌20 min。试验植物进行组织培养的室内温度为(25±2)℃,光照度为2 000~ 2 500 lx,每天光照14 h。试验中用于组培苗诱导和继代的植物激素为6–BA(6–苄氨基腺嘌呤)、ZT(玉米素)、TDZ(噻二唑苯基脲),用于生根的植物激素为IBA(吲哚丁酸)和NAA(1–萘乙酸)。
1.2.2外植体消毒处理
剪取外植体,立即用洗洁精溶液清洗其表面灰尘等污物,用自来水冲洗3 h,接着用无菌水漂洗5次。将外植体铺于超净工作台上,吹干其表面水分,剪除外植体所有叶片。在超净工作台上进行消毒处理:将外植体剪成各含1个腋芽的小茎段(10~15 mm),将小茎段在75%乙醇中浸泡30 s,再在5% NaClO溶液中分别浸泡5、10、15 min,在0.1% HgCl2溶液中分别浸泡3、5、7 min,用无菌水清洗4遍。用滤纸吸干其表面水分,将每个外植体的两端各剪去1~2 mm茎段,接种于改良WPM培养基上(无任何激素添加),5 d后统计外植体的污染率和存活率。
1.2.3组培苗诱导培养
将成功消毒后的外植体分别接种到含不同激素种类、不同激素浓度的改良WPM诱导培养基上。按6–BA质量浓度0.5、1.0、2.0、3.0 mg/L,TDZ质量浓度0.005、0.050、0.100、1.000 mg/L,ZT质量浓度0.5、2.0、3.0、4.0 mg/L进行组合,共设置12个处理。每个处理设置3次重复。每次重复接种1瓶培养基。每瓶培养基接种15个外植体。60 d后统计不同处理对外植体诱导分化的影响。
1.2.4组培苗继代培养
将诱导培养中得到的生长健康、长势相近的不定芽分别剪成10 mm左右的茎段,分别接种到含不同激素种类、不同激素浓度的改良WPM继代培养基上。按6–BA质量浓度0.25、0.50、1.00、1.50、2.00 mg/L,TDZ质量浓度0.000 5、0.001 0、0.005 0、0.010 0、0.050 0 mg/L,ZT质量浓度0.25、0.50、1.00、1.50、2.00 mg/L进行组合,共设置15个处理。每个处理设置3次重复。每次重复接种1瓶培养基。每瓶培养基接种15个外植体。60 d后统计不同处理对外植体继代培养的影响。
1.2.5组培苗生根培养
将健壮、长势相近的蓝莓继代无菌苗剪成20 mm左右含顶端的茎段,分别竖直扦插入固体生根培养基中。选取培养基、IBA浓度、NAA浓度进行三因素三水平正交试验(表1),每个处理接种25~30个茎段。60 d后统计相关数据,观察组培苗生长状况。
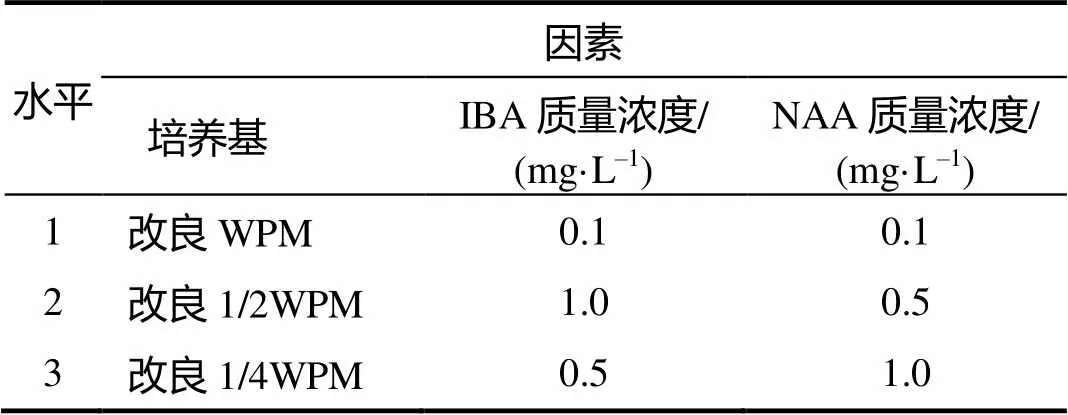
表1 生根培养正交试验的因素与水平
1.2.6组培苗炼苗与移栽
在室温环境下,将生根培养50 d后的组培瓶瓶盖揭开,向瓶中加入适量无菌水进行炼苗。炼苗4 d后,将组培苗根部的培养基用自来水洗净除掉,之后将组培苗分别移栽于3种不同栽培基质中,每天喷适量自来水保持基质湿润。30 d后统计组培苗移栽成活率及植株生长情况。3种栽培基质分别为:1)体积比1∶1的河沙和草炭土;2)体积比1∶1的菜园土和草炭土;3)体积比1∶1的蛭石和草炭土。
1.2.7统计分析
用SPSS 22软件和Excel 2013进行数据分析。
2 结果与分析
2.1 外植体消毒结果
由表2不同消毒处理对蓝莓外植体消毒的效果可见,当5% NaClO溶液和0.1% HgCl2溶液对外植体的消毒处理时间较短时,外植体的污染率较高,存活率较低;随着5% NaClO溶液和0.1% HgCl2溶液消毒处理时间的增加,外植体的污染率随之下降;但当对外植体的消毒处理时间过长时,外植体的存活率随之下降。在9个消毒处理方式中,当5% NaClO溶液处理时间为15 min、0.1% HgCl2溶液处理时间为7 min时蓝莓外植体的污染率最低,为30.11%,但此时外植体的存活率并非最高,为57.82。当5% NaClO溶液处理时间为10 min、0.1% HgCl2溶液处理时间为7 min时蓝莓外植体的存活率最高,达66.47%,因此认为此方式是适宜消毒方式。

表2 不同消毒方式的消毒效果
2.2 诱导培养结果
由表3可见:当6–BA浓度从0.5 mg/L增大至3.0 mg/L时,丛生芽平均增殖倍数呈先升高后降低趋势,平均芽高亦呈现出先升高后降低的趋势;当6–BA浓度为1.0 mg/L时,丛生芽的平均增殖倍数达3.26,平均芽高为12.4 mm,丛芽较高,量较多,长势良好;当ZT浓度从0.5 mg/L增大至4.0 mg/L时,丛生芽平均增殖倍数明显升高,平均芽高亦保持在较高水平;当ZT浓度为4.0 mg/L时,丛生芽的平均增殖倍数达3.86(所有处理中最高)平均芽高达19.4 mm,丛生芽高,量多且长势好。当TDZ浓度从0.005 mg/L增大至1.000 mg/L时,丛生芽平均增殖倍数明显降低,平均芽高亦明显降低;当TDZ浓度为0.005 mg/L时,丛生芽的增殖倍数为3.21,平均芽高为11.5 mm,丛芽较高,量多,长势良好。当TDZ浓度大于0.050 mg/L时有无效芽产生。
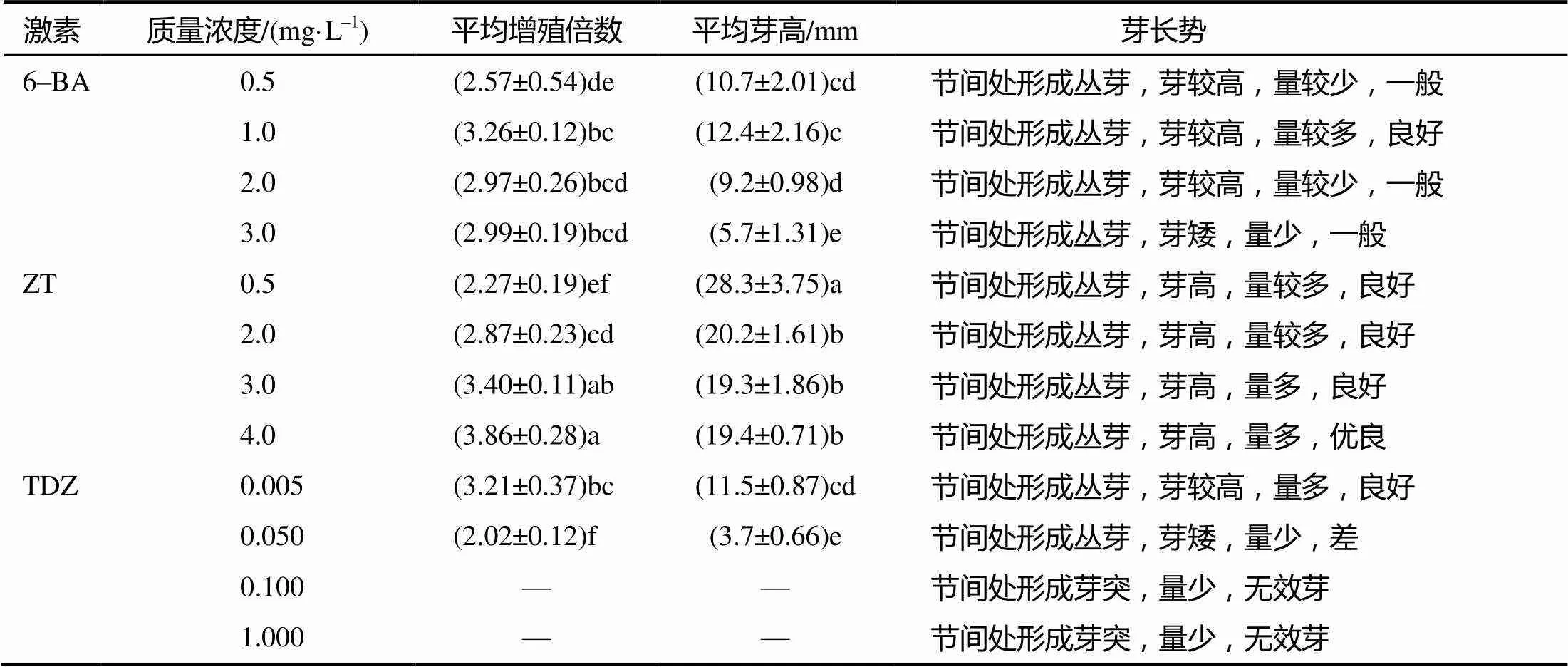
表3 不同激素处理蓝莓丛生芽的诱导效果
同列数据后小写字母示<0.05水平差异。
由图1可以看出,随着6–BA浓度的增加,诱导出丛生芽的数量呈现先增加后减少的趋势,且丛生芽的高呈递减趋势。由图2可以看出,4种不同浓度的ZT所诱导的丛生芽形态相近,株高接近,节间长,生长势旺,但丛生芽数量随着ZT浓度的升高而增多,高浓度ZT促进蓝莓茎段丛生芽的诱导和生长。由图3可以看出,随着TDZ浓度的增加,诱导出丛生芽的数量急剧减少,芽高呈快速递减趋势;当TDZ浓度大于0.050 mg/L时只可见一些小芽突形成的无效芽,高浓度的TDZ抑制蓝莓茎段丛生芽的诱导和生长。
当6–BA浓度为1.0 mg/L时,蓝莓丛生芽增殖倍数较高,长势优良;随着6–BA浓度升高,丛生芽明显矮化,增殖倍数降低(图1)。随着ZT浓度的升高,丛生芽增殖倍数有所增加,长势也有所提升;当ZT浓度为4.0 mg/L时,丛生芽的长势最好,植株健壮(图2)。随着TDZ浓度的升高,丛生芽生长明显受到抑制,逐渐矮化,在基部形成愈伤组织(图3)。综合考虑丛生芽诱导的增殖倍数和长势,本试验中较适宜的蓝莓诱导培养基为改良WPM + ZT 4.0 mg/L。

A、B、C、D分别为6–BA 质量浓度0.5、1.0、2.0、3.0 mg/L。

A、B、C、D分别为ZT质量浓度0.5、2.0、3.0、4.0 mg/L。

A、B、C、D分别为TDZ质量浓度0.005、0.050、0.100、1.000 mg/L。
2.3 继代培养结果
由表4可以看出,继代培养中随着6–BA浓度的增加,蓝莓组培苗平均增殖倍数升高,但增殖组培苗的平均株高递减;当6–BA浓度为0.25 mg/L时,增殖组培苗的平均株高达各处理的最大值,为28.0 mm,但组培苗基部有少量丛芽生成,植株较矮,长势一般。随着ZT浓度的增加,蓝莓组培苗平均增殖倍数升高,增殖组培苗的平均株高先上升后降低;当ZT质量浓度为1.00 mg/L时,平均株高达到最大值,为44.7 mm,植株基部有较多丛芽,组培苗健壮,长势优良;随着TDZ浓度的增加,蓝莓组培苗平均增殖倍数明显升高,但增殖组培苗的平均株高明显降低,长势变差;当TDZ浓度为0.001 0 mg/L,平均株高为33.9 mm,植株分枝数较多,较高,长势良好,但当TDZ浓度大于0.001 0 mg/L时,植株平均株高快速降低,长势差。较低浓度的6–BA、ZT和TDZ都有利于提高蓝莓组培苗的质量。综上所述,本试验中较适宜的蓝莓继代培养基是改良WPM+ ZT 1.00 mg/L。

表4 不同激素处理下蓝莓继代增殖的效果
同列数字后英文字母示<0.05水平差异。
2.4 生根培养
将继代后的蓝莓组培苗段接种于生根培养基上,培养10 d后基部切口处开始膨大,产生少量愈伤组织并有根形成。培养60 d后观察组培苗生长状况,统计相关数据。从表5可知,当培养基为改良WPM时,无论培养基中激素如何改变,蓝莓组培苗的生根率都很低,且在基部形成大量愈伤组织,根系短、弱、少。当培养基浓度降低至改良1/2 WPM和改良1/4 WPM的浓度时,生根率有明显提升,组培苗都能很好地生根且长势良好(图4)。

表5 蓝莓生根培养正交试验结果

A 改良WPM+IBA 0.5 mg/L +NAA 1.0 mg/L;B 改良1/2 WPM+IBA 1.0 mg/L +NAA 1.0 mg/L;C 改良1/4 WPM+IBA 0.5 mg/L +NAA 0.5 mg/L。
由表5生根率极差分析结果可知,试验因素培养基、IBA浓度、NAA浓度对蓝莓组培苗‘南金’生根率的影响依次减小。较佳的生根培养试验组合为1/4WPM(培养基)+IBA 0.5 mg/L+NAA 1.0 mg/L。
由表6方差分析结果可知,培养基对蓝莓组培苗生根率的影响很大,具有极显著差异(<0.01);IBA浓度、NAA浓度对蓝莓组培苗生根率的影响不大(>0.05)。通过比较值可知,培养基、IBA浓度、NAA浓度对生根率的影响依次减小。

表6 单变量多因素试验的方差分析
综上可知,最适宜蓝莓组培苗生根的培养基组合是改良1/4 WPM+IBA 0.5 mg/L +NAA 1.0 mg/L。
2.5 炼苗与移栽结果
蓝莓组培苗经炼苗移栽后培养30 d,以移栽基质蛭石+草炭土(体积比1∶1)的移栽成活率最高,达96.95%,蓝莓苗叶色浓绿,长势健壮;菜园土+草炭土(体积比1∶1)的次之,为94.64%,蓝莓苗长势良好;河沙+草炭土(体积比1∶1)的最差,为88.96%,蓝莓苗长势较好,但有少量植株叶色泛黄。可见,蛭石+草炭土(体积比1∶1)为蓝莓组培苗的较佳移栽基质。
3 结论与讨论
目前,部分蓝莓的组培快繁体系已经在MS、WPM、改良WPM等基本培养基基础上成功建立。高丛蓝莓‘Bluecrop’在WPM培养基上有较高的增殖系数和株高[9]。改良WPM具有更好的增殖效果[10–12],所以,本试验中采用改良WPM作为基本培养基。
选择适宜的消毒剂种类和消毒时间是获得良好消毒效果的重要因素。以蓝莓茎段为外植体,先用75%乙醇消毒15 s,再用0.1% HgCl2消毒8 min,蓝莓茎段成活率最高,达85.7%[13]。蓝莓外植体采用70%乙醇浸泡30 s,2% NaClO溶液浸泡10 min,0.1% HgCl2溶液浸泡10 min后,污染率最低,成活率最高[14]。NaClO溶液属于绿色消毒剂,对外植体的损伤小,易清洗掉,但对病菌的杀灭能力不强,消毒时间过短对病菌杀灭不彻底;升汞是外植体消毒中最常用的消毒试剂,毒力强,对病菌有强大杀灭作用,但升汞消毒时间过长,易损伤、杀死外植体,且消毒后难以去除残余的汞[15]。本研究中采用5% NaClO溶液和0.1% HgCl2溶液作为组合消毒剂,随着这2种消毒剂消毒时间的延长,外植体污染率均下降,且0.1% HgCl2溶液的消毒时间对污染率的影响明显,但消毒时间过长时出现外植体褐化死亡,存活率降低,故认为5% NaClO溶液消毒10 min、0.1% HgCl2溶液消毒7 min时蓝莓外植体的消毒效果最好。
细胞分裂素对蓝莓组培苗腋芽的诱导及继代培养起重要作用[16]。本试验中,6–BA对促进蓝莓生长、增殖的效果不明显。这与李森等的研究结论[17]一致。TDZ作为一种人工合成激素,主要是通过调节内源激素起作用[18],具有细胞生长素和分裂素的双重功能。TDZ对不定芽的诱导、增殖和愈伤组织形成等具有明显的促进作用[19–20],且TDZ具有最适浓度效应,浓度过低时作用效果不明显,浓度过高时易产生毒害[21–22]。本研究结果表明,较低浓度的TDZ对蓝莓的诱导和继代能产生明显的促进作用。低浓度的TDZ可能通过去除顶端优势诱导器官发生,从而使得不定芽或侧芽直接在培养的茎尖上形成[23]。在本试验诱导培养过程中,TDZ的最适浓度为0.005 mg/L;在继代培养过程中,TDZ的最适浓度为0.001 mg/L。高于这2个最适浓度时,蓝莓丛生芽过度地呈簇状生长,且植株明显矮化,甚至在外植体基部形成大量愈伤组织,生长停滞。这可能是由过高浓度的TDZ使得植物体内细胞分裂素与生长素失衡所致[24]。可见,在蓝莓腋芽诱导、继代培养时,使用较低浓度的TDZ就可以达到预期目标。ZT对蓝莓丛生芽的诱导和增殖具有显著效果。ZT的使用一般可以让植株长势更为优良,如玉米素能明显影响蓝莓离体繁殖的增殖效率和植株长势[25–26]。本研究结果表明,最适宜的蓝莓丛生芽诱导培养基是改良WPM+ZT 4.0 mg/L,最适宜的蓝莓继代增殖培养基是改良WPM+ZT 1.0 mg/L。
生根难是蓝莓组织培养过程中经常面临的一个关键问题。影响蓝莓生根培养的因素有很多,比如基础培养基组分、激素种类与浓度、光温条件等,各因素间的作用复杂多变[27]。试验结果表明,采用改良1/2 WPM、改良1/4 WPM培养基时的生根效果明显好于改良WPM,这可能是由于过高浓度的盐离子造成了较高的渗透压,从而影响了植物细胞的分裂分化[17,28–29]。除培养基种类外,培养基中生长素的种类、浓度对组培苗生根也具有重要作用。本试验中,IBA和NAA对蓝莓生根都有一定的影响,IBA相比NAA更利于蓝莓组培苗的生根。这和郑理乔等的结论[30]相似。本研究中经正交试验优化筛选后得到的最适蓝莓组培苗生根培养基组合是改良1/4 WPM+IBA 0.5 mg/L+NAA 1.0 mg/L。
[1] 代汉萍,刘海广,李亚东.小浆果安全生产技术指南[M].北京:中国农业出版社,2012:1–5.
[2] 杨喜平,张胜利,王琚钢,等.我国蓝莓研究[J].内蒙古林业科技,2012,38(3):55–58.DOI:10.3969/j.issn. 1007–4066.2012.03.015.
[3] 乌凤章.不同类型蓝莓种子形态及萌发特性研究[J].北方园艺,2013(21):32–35.
[4] 王朝文,和志娇,杨燕林,等.兔眼越橘嫁接试验初报[J].江西农业学报,2014,26(3):18–21.DOI:10.3969/j. issn.1001–8581.2014.03.006.
[5] 王雪娇.蓝莓组培苗扦插繁殖技术与生根机理的研究[D].哈尔滨:东北农业大学,2016.
[6] 刘静宇.不同蓝莓基因型的组织培养技术研究[J].中国林业产业,2016(2):81.
[7] 欣荣蓝莓.南金[EB/OL].(2014–10–26).http://www. boomberry.cn/index.aspx.
[8] 涂俊凡,秦仲麒,李先明,等.兔眼蓝莓组织培养与快繁技术研究[J].安徽农业科学,2012,40(28):13725–13728.DOI:10.3969/j.issn.0517–6611.2012.28.016.
[9] WOLFE D E,ECK P,CHIN C K.Evaluation of seven media for micro–propagation of high bush blueberry[J]. Hori Science,1983,18:703–705.
[10] CAO X,FORDHAM I,DOUGLASS L,et al.Sucrose level influences micropropagation and gene delivery into leaves frompropagated high bush blueberry shoots[J].Plant Cell Tissue Organ Culture,2003,75:255–259.
[11] 姜燕琴,於虹,陈静波.不同基本培养基对南高丛越橘优选系增殖的影响[J].吉林农业大学学报,2009,31(5):532–537.
[12] 阳翠,王军,补学梅,等.蓝莓莱格西组培苗繁殖技术研究[J].现代农业科技,2016(2):100–101.DOI:10. 3969/j.issn.1007–5739.2016.02.053.
[13] 房小晶,李永霞,文光琴,等.蓝莓组培与快繁技术研究[J].种子,2014,33(9):118–120.DOI:10.3969/j. issn.1001–4705.2014.09.031.
[14] 陶兴魁,高贵珍,赵亮,等.几种方法对蓝莓外植体消毒的比较研究[J].淮北师范大学学报(自然科学版),2013,34(2):39–41.DOI:10.3969/j.issn.2095–0691. 2013.02.010.
[15] 周权男,姜泽海,李哲,等.植物组织培养中污染控制技术的研究现状[J].热带农业科学,2012,32(9):53–56.DOI:10.3969/j.issn.1009–2196.2012.09.013.
[16] DEBNATH S C.A two–step procedure for adventitious shoot regeneration on excised leaves of lowbush blueberry[J].Cellular & Developmental Biology –Plant,2009,45(2):122–128.DOI:10.1007/s11627– 008–9186–2.
[17] 李森,高丽霞,刘念,等.高丛越橘‘奥尼尔’的组织培养[J].北方园艺,2016(9):102–105.DOI:10.11937/ bfyy.201609027.
[18] 陈肖英,叶庆生,刘伟.TDZ 研究进展[J].亚热带植物科学,2003,32(3):59–63.
[19] 吴光洪,孙英坤,陈林敬,等.兔眼蓝莓‘粉蓝’叶片直接诱导丛生芽再生技术体系的建立[J].植物生理学报,2016,52(3):372–380.
[20] 韩婷婷,孙周平.矮丛蓝莓叶片的愈伤组织诱导及植株再生[J].西北植物学报,2010,30(3):615–620.
[21] 张小红,张红燕,武军,等.TDZ对香椿愈伤组织诱导及芽增殖生长等的影响[J].西北农林科技大学学报(自然科学版),2002,30(5):35–39.DOI:10.3321/j.issn: 1671–9387.2002.05.008.
[22] 王勇,任淼,杨元.噻苯隆(TDZ)在红掌组织培养中的应用[J].天津农业科学,2013,19(9):12–14.DOI:10. 3969/j.issn.1006–6500.2013.09.004.
[23] LU C Y.The use of thidiazuron in tissue culture[J].Cellular & Developmental Biology – Plant,1993,29(2):92–96.DOI:10.1007/bf02632259.
[24] 王洪霞,郭尚敬.TDZ对甜椒不定芽分化的影响[J].北方园艺,2012(3):104–106.
[25] 李丽容,金开正,赖联森.玉米素对蓝莓组培增殖生长的影响研究[J].安徽农业科学,2013,41(30):11961– 11962.DOI:10.3969/j.issn.0517–6611.2013.30.008.
[26] 郑伟尉,吕锡山,慎家辉,等.兔眼蓝莓“园蓝”离体培养增殖技术研究[J].中国南方果树,2013,42(1):89–91.
[27] 阳翠,王军,董顺文,等.培养基组分对蓝莓组培苗瓶内生根的影响[J].植物生理学报,2016,52(9):1438–1442.
[28] 邢文,蔡梦颖,曾雯,等.山月桂‘奥运圣火’的组织培养与高效生根[J].云南农业大学学报(自然科学版),2017,32(1):89–94.
[29] 赵伟,李谦盛,周纯亮,等.疏花唇柱苣苔组培快繁及遗传稳定性分析[J].分子植物育种,2017,15(1):250–257.
[30] 郑理乔,黄成林,刘华,等.兔眼蓝莓组织培养过程中褐化与生根问题的探讨[J].安徽农业大学学报,2012,39(5):777–782.
责任编辑:王赛群
英文编辑:王库
Rapid propagation system establishment for southern highbush blueberry
JIN Ruyi, GUO Chongyan#, WANG Zhilong*, CHEN Qiuhong*, HU Fangzhi
(College of Agricultural, Hunan Agriculture University, Changsha 410128, China)
In order to figure out the best experimental conditions and to establish a complete and efficient system for rapid propagation of blueberry, a series of experiments were conducted on explant sterilization, buds induction, subculture of tissue–cultured seedlings, rooting and transplanting of tissue–cultured seedlings by employed twigs of ‘South Golden’, a variety of southern highbush blueberries, stems with axillary buds were used as explants. The results indicated that the explants soaked in 5% NaClO solution for 10 min, then in 0.1% HgCl2solution for 7 min displayed the best effect in disinfection. Modified WPM with 4.0 mg/L ZT was the best medium for inducing buds, and the multiplication coefficient reached to 3.86, the average height of buds was 19.4 mm; modified WPM with 1.0 mg/L ZT was the best subculture medium, the multiplication coefficient was 1.82 and the average height of seedlings on this medium reached to 44.7 mm; modified 1/4WPM with 0.5 mg/L IBA and 1.0 mg/L NAA was considered as the best medium for inducing roots of tissue–cultured seedlings; vermiculite mixed with peat soil (the proportion of them was 1∶1) was the most appropriate substrate for transplanting and cultivating tissue–cultured seedling, the survival rate reached up to 96.95%.
southern highbush blueberry; induced culture; subculture; rooting culture; phytohormone
S663.9
A
1007-1032(2017)05-0504-08
2017–03–14
2017–05–05
教育部创新团队发展计划项目(IRT1239)
金如意(1990—),女,湖北黄梅人,硕士研究生,主要从事植物分子生物学及遗传转化研究,jry813@yeah.net;#共同第一作者,郭崇炎(1991—),男,江西赣州人,硕士研究生,主要从事植物遗传学及分子生物学研究,2413254779@qq.com;*通信作者,王志龙,博士,教授,主要从事水稻分子生物学及植物遗传转化研究,zhilongwang@126.com;*通信作者,陈秋红,博士,讲师,主要从事植物分子生物学及遗传转化研究,cqh924@163.com
投稿网址:http://xb.hunau.edu.cn

