基于木糖异构酶途径的木糖发酵酿酒酵母菌株构建研究进展
李云成 孟凡冰 苟敏 孙照勇 汤岳琴
(1. 成都大学药学与生物工程学院,成都 610106;2. 四川大学建筑与环境学院,成都610207)
基于木糖异构酶途径的木糖发酵酿酒酵母菌株构建研究进展
李云成1孟凡冰1苟敏2孙照勇2汤岳琴2
(1. 成都大学药学与生物工程学院,成都 610106;2. 四川大学建筑与环境学院,成都610207)
通过异源表达木糖代谢途径,构建能高效发酵木糖产乙醇的工业酿酒酵母菌株,对木质纤维素燃料乙醇的开发具有重要意义。与氧化还原途径相比,木糖异构化途径的表达不会因辅酶不平衡而造成中间产物木糖醇的累积,因此被视为是理想的木糖代谢途径。在木糖异构途径的表达过程中,选择工业酿酒酵母作为出发菌株进行木糖异构酶途径的表达具有突出优势。同时,提高木糖异构酶基因xylA的表达效率对木糖异构菌株的构建至关重要。另外,在对XI菌株进行代谢工程改造时,GRE3的敲除、木糖转运的提升、木糖代谢途径的定向改造等均能有效改善菌株发酵木糖产乙醇的能力。除此之外,进化工程也是提升XI菌株木糖发酵效率的重要方法之一。而在相关机理阐释和改造策略的制定过程中,组学技术已显示出强大的功能。综述了近年来木糖异构酶途径在酿酒酵母中的表达研究进展,同时还对相关研究存在的问题进行了分析。
酿酒酵母;燃料乙醇;木糖异构酶;菌株构建
以农林废弃物为代表的木质纤维素生物质(Lignocellulosic biomass)是一种重要的可再生资源。农林废弃生物质主要由纤维素(Cellulose)、半纤维素(Hemicellulose)和木质素(Lignins)构成,可经生物转化生产多种生物燃料,如燃料乙醇、生物柴油和甲烷等。其中,燃料乙醇(Fuel ethanol)是一种典型的可替代运输燃油的重要液体燃料[1-2]。发酵法是目前燃料乙醇的主要生产方法,酿酒酵母(Saccharomyces cerevisiae)是燃料乙醇工业化生产中普遍使用的微生物。酿酒酵母具有较强的产乙醇能力,且对木质纤维素水解抑制物具有较好的耐受能力[2-4],因此被视为纤维素乙醇生产的首选微生物。然而,天然酿酒酵母不能利用木质纤维素水解所产生的戊糖(主要为木糖)进行生长和发酵。因此,开发能同时发酵葡萄糖和木糖的工业酿酒酵母菌株,对推进和加快纤维素乙醇的工业化,促进农林废弃物资源的高效利用具有重要意义。
目前有两条木糖代谢途径能够在酿酒酵母中表达[3]:氧化还原途径和异构化途径(图1)。在能利用木糖的大多数真菌和酵母中木糖可被NADH/NADPH依赖型木糖还原酶(Xylose reductase,XR)还原为木糖醇,然后被NAD+依赖型木糖醇脱氢酶(Xylitol dehydrogenase,XDH)氧化为木酮糖,再磷酸化后进入戊糖磷酸途径(Pentose phosphate pathway,PPP)。然而,XR主要为NADPH依赖型酶,XDH则是严格的NAD+依赖型,不同的辅酶亲和性导致重组酿酒酵母体内的辅酶不平衡,使菌株大量积累中间代谢产物木糖醇,大大降低了乙醇的产量[5]。
在一些细菌和厌氧真菌中,存在木糖异构酶(Xylose isomerase,XI),可直接将木糖异构化为木酮糖,然后磷酸化进入PP途径[2-3]。由于XI途径不需要辅酶参与,故不会因辅酶不平衡而导致中间产物木糖醇累积,因此被视为理想的木糖代谢途径[2]。然而,从目前研究来看,无论何种来源的XI基因(xylA)在酿酒酵母中表达,所构建的重组菌株木糖发酵效率仍达不到工业化生产的要求[6]。要想构建基于XI途径的高效木糖发酵菌株,还有很多的技术难题亟待突破。因此,本文就近年来木糖异构酶途径在酿酒酵母中的表达进行了综述,同时还对相关研究存在的问题进行了简要分析,以期为今后相关工作的开展提供参考。
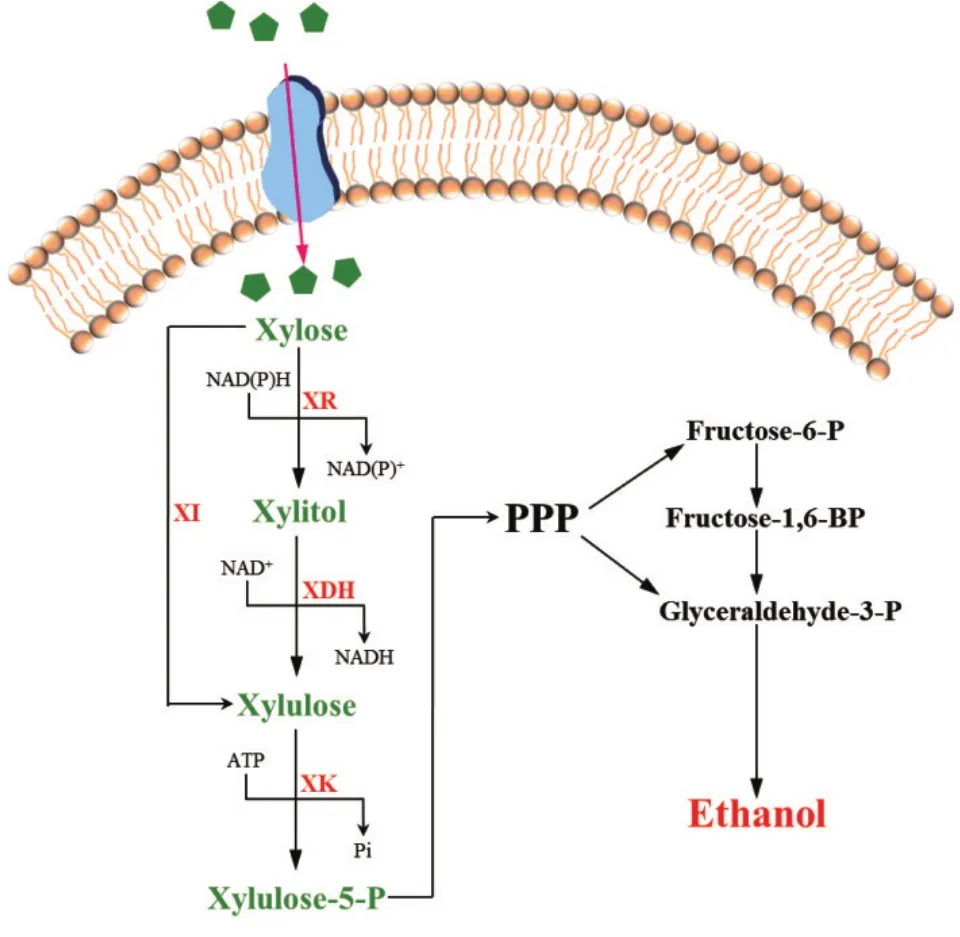
图1 重组酿酒酵母中的木糖代谢途径
1 XI途径在酿酒酵母中的表达
1.1 出发菌株的选择
在基因的异源表达过程中,同一个基因在不同遗传背景的出发菌株中表达,所构建的工程菌株的发酵性能差异较大[3,7],即所谓的宿主依赖性(Host dependence)[8]。目前,有关 XI菌株构建的相关研究,大多选择了实验室酵母作为出发菌株[3,9],虽然实验室酵母遗传背景清晰,容易对其进行代谢工程改造,但由于实验室菌株本身具有无法克服的脆弱性,很难将其应用于工业化生产。同时,由于菌株构建过程存在宿主依赖性,利用实验室酵母得到的研究结果,再次应用到工业酵母时,可能并不能达到预期效果。因此,在燃料乙醇工业化生产过程中,选择合适的工业酿酒酵母作为出发菌株有着举足轻重的作用。通常情况下,工业酿酒酵母比实验室酵母具有更好的乙醇耐受能力,对木质纤维素水解液中的抑制物耐受性也更强[3,6,9]。表1对比了近年报道的不同XI菌株的木糖发酵结果,可以看出,以工业酿酒酵母作为出发菌株,进行XI途径表达,所构建的菌株无论是在单一木糖条件下,还是在木糖/葡萄糖混合发酵条件下,其在木糖代谢速率、乙醇生成速率、和乙醇收率等方面均表现出了一定的优势。当然,工业酿酒酵母大多为同宗配合型,很难通过产孢子得到单倍体,因此在进行遗传操作时较实验室酵母复杂。
1.2 xylA基因的异源表达
从目前研究来看,从木糖利用微生物中获得的xylA在酿酒酵母中异源表达时,其表达效率往往较低,直接原因之一可能与物种的密码子偏好(Codon bias)有关。密码子偏好,即编码同一个氨基酸的不同密码子,在不同物种中的使用频率不同[17]。因此在xylA表达前,可对其密码子进行适当优化,消除稀有密码子、调整GC含量、简化二级结构,以提升xylA在酿酒酵母中的表达效果。Brat等[18]对比了来自Clostridium phytofermentans的xylA密码子优化前后在酿酒酵母中的表达效果,结果表明,密码子优化可直接降低XI酶的米氏常数Km值,提高反应速率Vmax,进而使菌株在木糖培养基上的生长和发酵效率远高于表达了原始xylA的菌株。然而,并不是所有的xylA密码子优化都能直接提升XI菌株在木糖培养基上的生长,Hector等[12]和Li等[19]研究表明,对来自 Prevotella ruminicola和Orpinomyces sp.的xylA的密码子进行优化并表达在酿酒酵母中,与表达了原始xylA的菌株相比,密码子优化表达菌株的生长和发酵性能并没有提升,反而稍有降低。不过,进一步的研究却显示,优化表达的菌株在适应性驯化过程中,生长和发酵能力的提升幅度更大[19]。因此,密码子优化在xylA的表达过程中还是有必要的。
影响重组酿酒酵母XI酶活的另外一个直接原因可能与xylA的拷贝数有关。利用多拷贝质粒对xylA进行表达,经过适应性驯化后,发现菌株体内的xylA的拷贝数增多[5,12],因此在利用基因组整合的方式表达xylA时,往往会采用多位点整合,以提高xylA的拷贝数,如在酵母的δ区整合xylA基因[20]。然而,并不是xylA的拷贝数越多越好,过多的xylA进入酿酒酵母之后,可能会造成转录负担和代谢负担[15,21],反而使菌株的木糖发酵效率降低。研究发现,将进化工程获得的突变型xylA表达在酿酒酵母中,在较低的xylA的转录水平上就能获得较高的XI酶活,进而使菌株具有较高的木糖发酵效率[15]。
2 XI菌株的代谢工程改造
2.1 内源性木糖还原酶基因GRE3的敲除
酿酒酵母虽然不能利用木糖发酵产乙醇,但存在GRE3基因编码木糖还原酶,可将少量的木糖转化为木糖醇。一方面会造成碳的损失,降低了乙醇的收率;更为重要的是,木糖醇的存在会严重抑制XI的酶活[22-23],造成菌株的木糖发酵效率大大降低[20]。特别是在偏酸性条件下,木糖醇等其他多元醇会与XI酶上的氨基酸残基形成氢键相互作用,从而阻碍了木糖与XI酶的结合。但这种相互作用在碱性(生理)条件下并未观察到[22]。不同来源的xylA受木糖醇抑制的作用不同,研究表明,木糖醇对来自Piromyces sp.的XI酶的抑制作用要远大于来 自 Clostridium phytofermentans的 XI酶[18], 而 来自Bacteroides stercoris的XI酶活几乎不受木糖醇的抑制[24]。尽管如此,为了尽量减少副产物生成,在xylA的表达过程中,敲除宿主菌中的GRE3基因仍是有必要的。
2.2 木糖转运的提升
无论是在XR-XDH菌株还是在XI菌株中,木糖转运均是非常重要的技术难题。酿酒酵母可依赖自身己糖转运子(Hexose transporters,Hxt)来转运木糖,但己糖转运子对葡萄糖具有高亲和力,当培养基存在葡萄糖时,木糖转运就会受到抑制,从而造成木糖发酵滞后[3,9,25-26]。Hamacher等[27]将酿酒酵母的己糖转运子HXT1-17和GAL2全部敲除,使菌株不能利用葡萄糖和木糖进行生长和发酵,然后分别将这些基因重新进行表达发现,表达HXT4、HXT5、HXT7、或GAL2后,菌株在木糖培养基上的生长得到恢复。利用类似的方法,Saloheimo等[28]发现HXT1和HXT2也具有转运木糖的功能。因此,研究者们希望通过高表达这些具有木糖亲和力的己糖转运子来提高菌株对木糖的转运能力,如Subtil等[29]研究表明,高表达HXT7或GAL2基因,可在一定程度上提升菌株的木糖发酵速率。然而,由于这些转运子对木糖的亲和力远远低于对葡萄糖的亲和力,通过简单的高表达并不能有效的解决葡萄糖/木糖共发酵时木糖代谢滞后的问题。因此,研究者们试图通过其他方式提升菌株的木糖转运能力,例如通过适当突变改变己糖转运子的亲和力,使其亲和葡萄糖的能力降低,亲和木糖的能力升高[30-33]。Farwick等[33]将 HXT7和 GLA2的葡萄糖 C6结合区附近的氨基酸进行突变,可增加它们对木糖的亲合性,降低甚至消除对葡萄糖的亲合性。另外,对HXT7的第79位的苯丙氨酸突变为丝氨酸,同样可以增加其对木糖的亲合性[30]。报道显示,通过适应性驯化后,木糖菌株的己糖转运子HXT36的第36位天冬酰胺突变为丙氨酸,可使菌株的木糖转运显著加强[31]。

表1 不同XI菌株木糖发酵性能对比
通过异源表达其他物种的高亲和力木糖转运子也可提高菌株的木糖转运能力。目前为止,已有30多个糖转运子被鉴别出具有转运木糖的能力[34],其中关注最多的有来自Sch.stipitis[35-37]的SUT1、XUT1-7, 以 及 来 自 Candida intermedia[36,38-40]的GXF1、GXS1。然而,从目前报道来看,有些转运子在酿酒酵母中异源表达后可在一定程度上提升菌株的木糖发酵,但仍没有转运子能够同时转运葡萄糖和木糖,或显著提升菌株的木糖发酵[34]。因此在未来的研究中,还需要继续挖掘能在酿酒酵母中成功表达的木糖转运子,或通过基因工程等手段对现有的转运子进行适当改造。
2.3 木糖代谢途径的定向改造
同XR-XDH菌株一样,XI菌株的木糖代谢途径调控主要涉及木酮糖激酶(XK)的高表达,PPP途径代谢能力的提升等。酿酒酵母自身的XK活性比较低,会限制木糖发酵速率[3],高表达酿酒酵母自身的XKS1基因,或异源高表达来自Sch. Stipitis的XK基因 XYL3,可有效提升菌株的木糖发酵效率。因此在进行xylA表达时,一般都会同时对XK的活性进行提升(表1)。然而,XK的酶活并不是越高越好[3,41]。如异源高表达了XYL3的XI菌株H131-A3经过多轮适应性驯化后,XKS1的拷贝数降低,但mRNA量升高,XK酶活有所下降[5],说明菌株在驯化过程中进行了适度调节。在进行xylA表达时,XK的需求量需要根据XI活性及PPP等下游途径的代谢通量进行调整,如可以选择不同的启动子可对XKS1(或XYL3)的表达水平进行调节[15]。
非氧化PPP途径是酿酒酵母中木糖代谢的必经之路,由于酿酒酵母主要利用葡萄糖进行乙醇发酵,因此其PPP途径的代谢效率一般较低[3]。另外,PPP途径中的某些中间代谢产物也是菌株合成代谢的前体物,如核糖-5-磷酸(Ribose-5-phosphate,R5P)是合成5-磷酸核糖-1-焦磷酸(Phosphoribosyl pyrophosphate,PRPP)的前体物,而PRPP可参与某些核苷酸、辅酶、氨基酸的合成。因此,适当调节非氧化PPP途径中的相关基因,如转醛醇酶基因TAL1、转酮醇酶基因TKL1、5-磷酸核酮糖异构酶基因RPE1及核糖-5-磷酸异构酶基因RKI1,对提高菌株木糖发酵效率具有重要作用。研究表明,高表达非氧化PPP途径中的TAL1、TKL1、RPE1、RKI1基因的XI菌株SyBE002要比其出发菌株SyBE001的木糖消耗速率提高1.19倍[15]。在PPP途径的基因中,关注最多的基因就是TAL1。Vilela等[14]研究发现,XI菌株在经过多轮适应性驯化后,木糖消耗速率大大提升,定量PCR显示,驯化菌株的TAL1表达水平比出发菌株提高了3倍。然而,非氧化PPP途径的这些基因的表达水平并非越高越好,不同菌株PPP途径的代谢效率可能有所差别。Zhou等[5]同源高表达了XI菌株的TKL1、RPE1、RKI1基因,以及异源高表达来自Sch. Stipitis的TAL1基因,通过进化工程驯化后,TAL1基因的表达水平下降到与其他3个基因的表达水平接近。说明PPP途径中各基因的表达水平需要与XKS、xylA,以及自身途径中各基因的表达水平达到平衡,才能使整个代谢途径通畅的流通。同样,TKL1高表达的XI菌株,在适应性驯化过程中,其表达水平也会适当下调,以使整个PPP途径保持平衡[15]。另外值得注意的是,在进行葡萄糖/木糖混合发酵时,酿酒酵母自身的PPP相关基因容易受到葡萄糖的抑制,异源高表达来自其他物种的基因可能会缓解这一问题,如Sch.Stipitis的TAL1基因在酿酒酵母中表达后就不容易受到葡萄糖抑制[42]。
3 进化工程育种
除上述代谢工程外,进化工程也是提升XI菌株木糖发酵效率的重要方法之一[3,9]。进化工程是利用自然选择的原理,通过模拟自然进化中的变异和选择过程,以实现对目标微生物的快速进化,从而获得具有目标性状的菌株[43]。由于木糖异构酶基因在酿酒酵母表达后,即使通过代谢工程对菌株的木糖转运和代谢进行定向调控,其在木糖培养基上的生长和发酵效率一般都较低,因此常通过进化工程手段来提升菌株的发酵性能[5,10-12,44]。进化工程主要是从细胞全局上提升菌株发酵性能,对于其分子机制尚不是很清楚,但可以知道,驯化过程改变了木糖的转运和代谢相关基因的表达水平,或使相关基因发生突变,改变对应酶的特性。例如,通过适应性驯化,XI菌株的己糖转运基因HXT7的第79位氨基酸发生突变,使其对葡萄糖的亲和力下降,对木糖的亲和力上升[30];同样通过驯化后,具有木糖亲和的转运基因HXT2的表达显著提高[14]。驯化过程除了增强了菌株的木糖转运外,还会对菌株的木糖代谢途径进行调整,特别是对 xylA[5,12,15]、XKS1(或 XYL3)[5,15]、PPP 途径[14-15],以及糖酵解等途径[15]中的基因表达的调整。Qi等[15]的研究表明,当XI菌株经过适应性驯化和筛选后,其木糖异构酶基因xylA表达下调,木酮糖激酶基因XKS1表达上调,PPP途径中的大部分基因表达变化不显著,但糖酵解途径中的大部分基因表达下调,说明驯化菌株中的基因表达更加平衡,从而使菌株发酵木糖产乙醇的途径更加通畅。
XI菌株进化工程育种过程中,选择合适的驯化方式和条件十分重要,不同的驯化条件下驯化的周期和效果不同[13]。从现有报道来看,反复批次驯化是应用最多的驯化方式。在反复批次驯化过程中,接种量和转接时间是两个非常重要的参数,Lee等[13]的研究结果表明,采用低接种量(0.5%)进行驯化时的驯化效果要比高接种量(1%和5%)的驯化效果好,这可能是因为接种量越大,对于单个菌株的自然选择压力相对变小,从而不利于快速筛选出有利突变。另外,该研究还发现,当菌体生长到对数期进行转接时,要比在稳定期进行转接的效果好,可能是因为对数期的菌株生长旺盛且突变正在进行,此时进行转接,则有利于巩固有利突变;如果当菌株生长到稳定期时,不利突变大量积累,此时进行转接,也不易获得有利突变[13]。另外,在驯化培养基的选择方面,XI菌株的驯化采用最多的培养基为基本培养基(也即 YNB 培养基)[8,15,30,45],只有少数的研究采用了营养培养基(YP培养基)[12,41]和完全补充混合培养基(CSM培养基)[46],虽然目前尚无研究表明哪一种培养基更适合菌株的适应性驯化,但它应该受到关注。
由于xylA在酿酒酵母表达活性较低,所构建的XI菌株在以木糖为单一碳源的培养基上有氧生长较缓慢,因此驯化过程可采用“分段式驯化”法:首先在有氧条件下驯化其生长能力,然后再转移到微氧或厌氧条件下驯化其发酵能力[8,12,41,47]。除此之外,通过改变碳源组成,可以有效驯化改善菌株对混合糖的发酵能力。如Wisselink等[44]将XI菌株在葡萄糖/木糖/阿拉伯糖培养基上进行驯化一段时间,然后转到木糖/阿拉伯糖培养基上,最后在只含阿拉伯糖的培养基上驯化,这样逐步提升菌株对木糖和阿拉伯糖的利用能力。
单独使用驯化工程手段对菌株木糖代谢能力的提升效率不高,将驯化工程与代谢工程或基因突变相结合,往往效果更佳。例如在驯化前,一般会将菌株的木糖转运、木酮糖磷酸化、PPP途径等进行定向改造[10,45]。将XI菌株首先进行随机诱变,提高突变几率,然后再用进化工程进行定向选择,能够较易获得目标性状菌株[11,13,45]。Lee 等[45]利用随机诱变结合进化工程的方法分离出的XI菌株,其XI酶活较出发菌株提升了77%;Demeke等[11]利用随机诱变、genome shuffling、进化工程对XI菌株木糖发酵能力进行提升,得到的工程菌株在接种量为1.3 g DCW/L时,13 h内就能同时发酵36 g/L的葡萄糖和37 g/L的木糖,其乙醇收率和产率分别达到0.46g/g-consumed sugar和2.58 g/(L·h),同时具有较好的发酵木质纤维素水解液产乙醇的能力,为同类菌株中的翘楚,其方法也值得借鉴。
4 组学技术的应用
传统的菌株改造方法主要通过多次随机诱变和定向筛选,或通过驯化获得优良菌株,这些方法改造过程随机性大,费时费力,并且对性能提高的机制认识不足[48-49]。基因组学、转录组学、蛋白组学、流量组学等组学技术的发展可使人们在不同层次上更加系统深入地了解生物复杂网络的代谢及调控机理,识别目标基因、挖掘新的代谢途径等[6,50],从而使研究工作更具靶向性和明确性,更加易于获得目标性状,并大大缩短育种周期。无论是在XI菌株,还是其他酿酒酵母代谢调控方面,组学技术在机理阐述方面的应用较多,也已经显示出了强大的功能。例如通过代谢流量组学分析,可以预测整个木糖代谢网络的变化,包括pp途径、糖酵解途径、产乙醇途径等各代谢节点的流量情况,为进一步的代谢调控提供依据。然而,由于组学分析数据量大,如何在海量的数据中筛选出有效信息,是研究的难点,亟待进一步突破。因此真正运用组学技术制定代谢调控策略的报道并不多。Hou等[51]利用基因组测序,识别出XI菌株经驯化后ASK10基因发生突变,突变型Ask10p通过影响分子伴侣的高表达进而影响了XI的表达效率。
5 结语
与XR-XDH途径相比,XI途径在酿酒酵母中的表达不需要辅酶参与且没有中间产物木糖醇生成,因此XI菌株在木糖发酵过程中有更高的乙醇收率。虽然从目前的研究结果来看,XI菌株的木糖代谢速率仍较低,但随着研究的深入,XI菌株的构建在最近两年已经取得了很大的进展,显现出很好的应用前景。未来在XI菌株构建过程中,应关注以下方面:(1)提高xylA的表达活性。目前在xylA表达过程中,主要靠提高拷贝数来提高XI的活性。然而,大量的拷贝数进入到酿酒酵母体内,可能会产生转录负担和代谢负担,反而阻碍菌株对木糖的代谢,因此如何让xylA在较低拷贝数下保证较高的表达活性,是研究的重点。(2)多种育种手段组合使用。在XI菌株的构建过程中,单一的菌株选育手段得到的XI菌株木糖代谢能力提升有限,利用多手段,如基因工程、酶工程、进化工程、genome shuffling等手段结合起来,对菌株进行改造,往往效果更佳。(3)组学技术的应用。组学技术对于代谢机理的阐释和改造靶点的识别方面逐渐显现出强大的功能,因此在XI菌株木糖改造策略的制定方面会应用的越来越多。
[1] Zhao X, Xiong L, Zhang M, et al. Towards efficient bioethanol production from agricultural and forestry residues:Exploration of unique natural microorganisms in combination with advanced strain engineering[J]. Bioresour Technol, 2016, 215:84-91.
[2] Moyses DN, Reis VC, De Almeida JR, et al. Xylose fermentation by Saccharomyces cerevisiae:challenges and prospects[J]. Int J Mol Sci, 2016, 17(3):207.
[3] Matsushika A, Inoue H, Kodaki T, et al. Ethanol production from xylose in engineered Saccharomyces cerevisiae strains:current state and perspectives[J]. Appl Microbiol Biot, 2009, 84(1):37-53.
[4] 刘贺, 朱家庆, 纵秋瑾, 等. 生物质转化工程酿酒酵母的研究进展[J]. 生物技术通报, 2017, 33(1):93-98.
[5] Zhou H, Cheng JS, Wang BL, et al. Xylose isomerase overexpression along with engineering of the pentose phosphate pathway and evolutionary engineering enable rapid xylose utilization and ethanol production by Saccharomyces cerevisiae[J]. Metab Eng, 2012, 14(6):611-622.
[6] Sato TK, Tremaine M, Parreiras LS, et al. Directed evolution reveals unexpected epistatic interactions that alter metabolic regulation and enable anaerobic xylose use by Saccharomyces cerevisiae[J]. PLoS Genet, 2016, 12(10):e1006372.
[7] Matsushika A, Inoue H, Murakami K, et al. Bioethanol production performance of five recombinant strains of laboratory and industrial xylose-fermenting Saccharomyces cerevisiae[J]. Bioresour Technol, 2009, 100(8):2392-2398.
[8] Feng X, Zhao H. Investigating host dependence of xylose utilization in recombinant Saccharomyces cerevisiae strains using RNA-seq analysis[J]. Biotechnol Biofuels, 2013, 6(1):96.
[9] Cai Z, Zhang B, Li Y. Engineering Saccharomyces cerevisiae for efficient anaerobic xylose fermentation:reflections and perspectives[J]. Biotechnol J, 2012, 7(1):34-46.
[10] Diao L, Liu Y, Qian F, et al. Construction of fast xylose-fermenting yeast based on industrial ethanol-producing diploid Saccharomyces cerevisiae by rational design and adaptive evolution[J]. BMC Biotechnol, 2013, 13(1):1-9.
[11] Demeke MM, Dietz H, Li Y, et al. Development of a D-xylose fermenting and inhibitor tolerant industrial Saccharomyces cerevisiae strain with high performance in lignocellulose hydrolysates using metabolic and evolutionary engineering[J]. Biotechnol Biofuels,2013, 6(5):89-89.
[12] Hector RE, Dien BS, Cotta MA, et al. Growth and fermentation of D-xylose by Saccharomyces cerevisiae expressing a novel D-xylose isomerase originating from the bacterium Prevotella ruminicola TC2-24. Biotechnol Biofuels, 2013, 6:84(16):195-200.
[13] Lee S M, Jellison T, Alper HS. Systematic and evolutionary engineering of a xylose isomerase-based pathway in Saccharomyces cerevisiae for efficient conversion yields[J]. Biotechnol Biofuels,2014, 7(1):122.
[14] Vilela LD, De Araujo VPG, Paredes RD, et al. Enhanced xylose fermentation and ethanol production by engineered Saccharomyces cerevisiae strain[J]. AMB Express, 2015, 5(1):16.
[15] Qi X, Zha J, Liu GG, et al. Heterologous xylose isomerase pathway and evolutionary engineering improve xylose utilization in Saccharomyces cerevisiae[J]. Front Microbiol, 2015, 6 :1165.
[16] Bamba T, Hasunuma T, Kondo A. Disruption of PHO13 improves ethanol production via the xylose isomerase pathway[J]. AMB Express, 2016, 6(1):4.
[17] Madigan MT, Martinko JM, Stahl DA, et al. Brock Biology of microorganisms. 13th ed[M]. New York:Benjamin Cummings,2010:177.
[18] Brat D, Boles E, Wiedemann B. Functional expression of a bacterial xylose isomerase in Saccharomyces cerevisiae[J]. Appl Environ Microbiol, 2009, 75(8):2304-2311.
[19] Li YC, Li GY, Gou M, et al. Functional expression of xylose isomerase in flocculating industrial Saccharomyces cerevisiae strain for bioethanol production[J]. J Biosci Bioeng, 2016, 121(6):685-691.
[20] Tanino T, Hotta A, Ito T, et al. Construction of a xylose-metabolizing yeast by genome integration of xylose isomerase gene and investigation of the effect of xylitol on fermentation[J]. Appl Microbiol Biot, 2010, 88(5):1215-1221.
[21] Rensburg EV, Haan RD, Smith J, et al. The metabolic burden of cellulase expression by recombinant Saccharomyces cerevisiae Y294 in aerobic batch culture[J]. Appl Microbiol Biot, 2012, 96(1):197-209.
[22] Kovalevsky A, Hanson BL, Mason SA, et al. Inhibition of D-xylose isomerase by polyols:atomic details by joint X-ray/neutron crystallography[J]. Acta Crystallogr D Biol Crystallogr, 2012, 68(Pt9):1201-1206.
[23] Yamanaka K. Inhibition of D-xylose isomerase by pentitols and D-lyxose[J]. Arch Biochem Biophy, 1969, 131(2):502-506.
[24] Ha SJ, Kim SR, Choi JH, et al. Xylitol does not inhibit xylose fermentation by engineered Saccharomyces cerevisiae expressing xylA as severely as it inhibits xylose isomerase reaction in vitro[J]. Appl Microbiol Biot, 2011, 92(1):77-84.
[25] Hohenschuh W, Hector R, Murthy GS. A dynamic flux balance model and bottleneck identification of glucose, xylose, xylulose cofermentation in Saccharomyces cerevisiae[J]. Bioresour Technol,2015, 188:153-160.
[26] Nogué VS, Karhumaa K. Xylose fermentation as a challenge for commercialization of lignocellulosic fuels and chemicals[J].Biotechnol Lett, 2015, 37(4):761-772.
[27] Hamacher T, Becker J, Gardonyi M, et al. Characterization of the xylose-transporting properties of yeast hexose transporters and their influence on xylose utilization[J]. Microbiol, 2002, 148(Pt9):2783-2788.
[28] Saloheimo A, Rauta J, Stasyk OV, et al. Xylose transport studies with xylose-utilizing Saccharomyces cerevisiae strains expressing heterologous and homologous permeases[J]. Appl Microbiol Biot, 2007, 74(5):1041-1052.
[29] Subtil T, Boles E. Competition between pentoses and glucose during uptake and catabolism in recombinant Saccharomyces cerevisiae[J]. Biotechnol Biofuel, 2012, 5 :14.
[30] Apel AR, Ouellet M, Szmidt-Middleton H, et al. Evolved hexose transporter enhances xylose uptake and glucose/xylose coutilization in Saccharomyces cerevisiae[J]. Sci Rep, 2016, 6 :19512.
[31] Nijland JG, Shin HY, Jong RMD, et al. Engineering of an endogenous hexose transporter into a specific D-xylose transporter facilitates glucose-xylose co-consumption in Saccharomyces cerevisiae[J]. Biotechnol Biofuel, 2014, 7(1):168.
[32] Bergdahl B, Sandström AG, Borgström C, et al. Engineering yeast Hexokinase 2 for improved tolerance toward xylose-induced inactivation[J]. PLoS One, 2013, 8(9):e75055.
[33] Farwick A, Bruder S, Schadeweg V, et al. Engineering of yeast hexose transporters to transport D-xylose without inhibition by D-glucose[J]. PNAS, 2014, 111(14):5159-5164.
[34] Kim S R, Ha SJ, Wei N, et al. Simultaneous co-fermentation of mixed sugars:A promising strategy for producing cellulosic ethanol[J]. Trend Biotechnol, 2012, 30(5):274-282.
[35] Katahira S, Ito M, Takema H, et al. Improvement of ethanol productivity during xylose and glucose co-fermentation by xyloseassimilating S. cerevisiae via expression of glucose transporter Sut1[J]. Enzyme Microb Tech, 2008, 43(2):115-119.
[36] Runquist D, Hahn-Hägerdal B, Rådström P. Comparison of heterologous xylose transporters in recombinant Saccharomyces cerevisiae[J]. Biotechnol Biofuel, 2010, 3:5.
[37] Du J, Li S, Zhao H. Discovery and characterization of novel D-xylose-specific transporters from Neurospora crassa and Pichia stipitis[J]. Mol Biosyst, 2010, 6(11):2150-2156.
[38] Runquist D, Fonseca C, Rådström P, et al. Expression of the Gxf1 transporter from Candida intermedia improves fermentation performance in recombinant xylose-utilizing Saccharomyces cerevisiae[J]. Appl Microbiol Biot, 2008, 82(1):123-130.
[39] Zhang J, Zhang B, Wang D, et al. Improving xylitol production at elevated temperature with engineered Kluyveromyces marxianus through over-expressing transporters[J]. Bioresource Techn,2015, 175:642-645.
[40] Young EM, Alice T, Hang B, et al. Rewiring yeast sugar transporter preference through modifying a conserved protein motif[J].PNAS, 2014, 111(1):131-136.
[41] Kim SR, Park YC, Jin YS, et al. Strain engineering of Saccharomyces cerevisiae for enhanced xylose metabolism[J]. Biotechnol Adv, 2013, 31(6):851-861.
[42] Jin YS, Alper H, Stephanopoulos G. Improvement of xylose uptake and ethanol production in recombinant Saccharomyces cerevisiae through an inverse metabolic engineering approach[J]. Appl Environ Microb, 2005, 71(12):8249-8256.
[43] 巩继贤, 郑辉杰, 郑宗宝, 等. 微生物进化工程育种技术进展与展望[J]. 生物加工过程, 2010(2):69-76.
[44] Wisselink H, Toirkens M, Wu Q, et al. Novel evolutionary engineering approach for accelerated utilization of glucose, xylose,and arabinose mixtures by engineered Saccharomyces cerevisiae strains[J]. Appl Environ Microb, 2009, 75(4):907-914.
[45] Lee SM, Jellison T, Alper HS. Directed evolution of xylose isomerase for improved xylose catabolism and fermentation in the yeast Saccharomyces cerevisiae[J]. Appl Environ Microb, 2012,78(16):5708-5716.
[46] Peng B, Huang S, Liu T, et al. Bacterial xylose isomerases from the mammal gut Bacteroidetes cluster function in Saccharomyces cerevisiae for effective xylose fermentation[J]. Microb Cell Fact,2015, 14:70.
[47] Parreiras LS, Breuer RJ, Narasimhan RA, et al. Engineering and two-stage evolution of a lignocellulosic hydrolysate-tolerant Saccharomyces cerevisiae strain for anaerobic fermentation of xylose from AFEX pretreated corn stover[J]. PLoS One, 2014, 9(9):e107499.
[48] 李云成, 汤岳琴, 木田建次. “组学”技术在燃料乙醇生产用酿酒酵母菌株构建中的应用[J]. 中国生物工程杂志, 2014,34(2):118-128.
[49] 赵心清, 白凤武, 李寅. 系统生物学和合成生物学研究在生物燃料生产菌株改造中的应用[J]. 生物工程学报, 2010, 26(7):880-887.
[50] Mukhopadhyay A, Keasling JD. Importance of systems biology in engineering microbes for biofuel production[J]. Curr Opin Biotech, 2008, 19(3):228-234.
[51] Hou J, Jiao C, Peng B, et al. Mutation of a regulator Ask10p improves xylose isomerase activity through up-regulation of molecular chaperones in Saccharomyces cerevisiae[J]. Metab Eng, 2016, 38:241-250.
Research Progresses on Strain Construction of Xylose Isomerase-based Recombinant Xylose-fermenting Saccharomyces cerevisiae
LI Yun-cheng1MENG Fan-bing1GOU Min2SUN Zhao-yong2TANG Yue-qin2
(1. College of Pharmacy and Bioengineering,Chengdu University,Chengdu 610106 ;2. College of Architecture and Environment,Sichuan University,Chengdu 610207)
It is of utmost significant to construct industrial xylose-fermenting Saccharomyces cerevisiae strains for lignocellulosic bioethanol production through the heterologous expression of xylose metabolic pathway. Xylose isomerase pathway is regarded as the most promising pathway expressing in S. cerevisiae,since there is no xylitol accumulation resulted from the coenzyme imbalance in xylose redox pathway. In heterologous expression of xylose isomerase,selecting an industrial S. cerevisiae strain as initial strain is of outstanding advantages for lignocellulosic bioethanol production. Concurrently,improving the expression efficiency of xylose isomerase gene(xylA)is vital for constructing a robust xylose fermentation strain. In addition,the deletion of GRE3,strengthening of xylose transport and rational modification of xylose metabolic pathway during the metabolic modification of strain XI effectively improved the xylose fermentation capacity of the recombinant strains. Besides,evolutionary engineering also increased the xylose fermentation efficiency of XI strains. Furthermore,the omics technologies have presented their power in explaining the mechanism and developing the modification strategies of xylose metabolism. This paper reviews the research progresses on the expressions of xylose isomerase pathway in S. cerevisiae and analyzes the issues in the relevant studies.
Saccharomyces cerevisiae;fuel ethanol;xylose isomerase;strain construction
10.13560/j.cnki.biotech.bull.1985.2017-0448
2017-05-30
四川省科技创新苗子工程重点项目(2017RZ0021),成都大学校青年基金项目(2017XJZ18)
李云成,男,博士,讲师,研究方向:微生物代谢调控;E-mail:liyunchengs@126.com
汤岳琴,女,博士,教授,研究方向:环境生物工程;E-mail:tangyq@scu.edu.cn
(责任编辑 狄艳红)

