响应面法优化龙井茶中黄酮化合物提取工艺
陈根生 许勇泉 高 颖 刘 阳 嵇伟彬 尹军峰
(1.中国农业科学院茶叶研究所,国家茶产业工程技术研究中心,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,浙江杭州310008)
响应面法优化龙井茶中黄酮化合物提取工艺
陈根生 许勇泉 高 颖 刘 阳 嵇伟彬 尹军峰*
(1.中国农业科学院茶叶研究所,国家茶产业工程技术研究中心,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,浙江杭州310008)
对龙井茶中的黄酮化合物提取工艺进行研究。通过单因素系列试验分别研究了甲醇浓度(体积比)、提取时间、提取温度对龙井茶黄酮类化合物浸出量的影响。在单因素试验基础上,利用Design-Expert 7.0软件和Box-Behnken设计原理设计响应面试验,并通过方差分析回归建立数学模型。实验结果表明,龙井茶中黄酮化合物的最佳提取工艺条件:甲醇体积分数61.68%、提取温度61.54℃、提取时间82.79 min,在此条件下,黄酮化合物含量(占干茶)为 4.876 mg/g。
黄酮化合物;龙井茶;提取条件;响应面法
黄酮化合物多为亮黄色粉末固体,一般游离态的苷元难溶于水、非极性有机溶剂,易溶于甲醇、乙醇、乙酸乙酯等有机溶液及碱性溶液[11-12]。根据黄酮化合物中间三碳链结构及氧化程度,B环衍生基团(图1)及位置可分为:黄酮及黄酮醇类、异黄酮类、及二氢异黄酮类、黄烷醇类、双黄酮类、二氢黄铜及二氢黄酮醇类、查尔酮及花色苷等十余类[13],黄酮苷类化合物是由黄酮及黄酮醇与糖基结合而成的。最常见的黄酮苷元有芹菜素(apigenin)、木犀草素(luteolin),常见的黄酮醇则有槲皮素(quercetin)、杨梅素(myricetin)、山奈酚(kaempferol)和异槲皮素(isoquercetin)等;衍生糖基团主要有葡萄糖、鼠李糖、半乳糖、芸香糖、阿拉伯糖[14]。茶叶中的黄酮化合物多数以糖苷类形式存在、少数以苷元形式存在。

图1 黄酮化合物的基本结构
近几年,有关植物黄酮化合物提取工艺的研究较为热门。如石雪萍等[15]研究了不同提取条件对南京雨花茶中的黄酮化合物含量的影响,结果表明,以70%乙醇为溶剂,70~80℃温度下提取2 h效果较好。宾冬梅等[16]采用微波辅助法提取藤茶黄酮,发现100℃的温度下浸提时间60 min,中高档微波加热120 s的条件下,藤茶总黄酮的得率最高。但很少看到在龙井茶中多种黄酮醇及其糖苷类化合物的研究和分析。刘阳等人[17]仅通过纯水冲泡的方式对龙井茶汤中的黄酮化合物浸出特性进行研究,但未对龙井茶中的黄酮化合物的提取工艺进行优化和成分进行分析。因此,本研究拟在单因素实验基础上,采用响应面分析方法对龙井茶中黄酮化合物提取参数进行优化,意在于黄酮化合物的检测分析和开发利用。
1 材料与方法
1.1 材料与设备
试验材料:龙井茶茶样购于杭州龙冠实业有限公司。干茶样经磨碎处理过40目筛后装于密封袋内,放置于超低温冷冻冰箱中保存待测。
主要设备:岛津LC20-AD高效液相色谱仪(岛津企业管理(中国)有限公司);Milli-RO PLUS 30纯水机(Millipore公司);电子分析天平(德国Sartorius公司);Symmetry® C184.6 mm×250 mm色谱柱(Waters公司);电热恒温水浴器(上海精宏,DKS26)。
1.2 试剂与药品
主要试剂:乙腈为色谱纯(德国默克公司),甲醇为色谱纯(德国默克公司),甲酸为分析纯(国药集团化学试剂有限公司),去离子水等。
标准物质:(1)黄酮苷化合物,山柰酚-3-O-芸香糖苷(Kae-rut)、山柰酚-3-O-葡萄糖苷(Kae-glu)、山柰酚-3-O-半乳糖苷(Kae-gal)、槲皮素-3-O-葡萄糖苷(Que-glu)、槲皮素-3-O-半乳糖苷(Que-gal),槲皮素-3-O-芸香糖苷(Que-rut)、槲皮素-3-O-鼠李糖苷(Que-rha)、杨梅素-3-O-鼠李糖苷(Myr-rha)、杨梅素-3-O-半乳糖苷(Myr-gal)、牡荆素-2-O-鼠李糖苷(Vit-rha);(2)黄酮苷元化合物,杨梅素(Myr)、槲皮素(Que)、山柰酚(Kae)、牡荆素(Vit);均购于Sigma-Aldrich公司。
1.3 单因素实验
1.3.1 不同体积分数甲醇溶液(v∶v)提取研究准确称取待测茶粉2.5 g,分别加入100 mL的0%~90%的等梯度浓度(v∶v)的10份甲醇水溶液,于水浴锅内70℃的条件下,浸提90 min,冷却离心(8000 r·min-1,10 min),过滤定容至 100 mL,滤液过0.22μm膜,采用高效液相法测定黄酮化合物不同组分的浓度,研究黄酮化合物浸出含量的影响,实验重复3次。
2007年央行宣布将人民币兑美元汇率日波动区间从0.3%扩大至0.5%后,人民币升值幅度反而提升。此次升值对进出口贸易、外汇储备、物价均带来了显著的负向冲击,特别是对于宏观经济整体增长率有明显的负向影响。
1.3.2 不同提取温度的研究 准确称取粉碎待测茶粉2.5 g,以一定体积分数的甲醇溶液作为溶剂,于20、30、40、50、60、70℃温度下分别浸提 90 min,冷却离心(8000 r·min-1,10 min),上清液过滤定容至100 mL,滤液过0.22μm膜,采用高效液相法测定黄酮化合物不同组分的含量,研究不同浸提温度对黄酮化合物浸出含量的影响,实验重复3次。
1.3.3 不同浸提时间的研究 准确称取粉碎待测茶粉2.5 g,以一定体积分数的甲醇水溶液作为溶剂,于 0、10、20、30、40、50、60、70、80、90 min,在相同温度下浸提,冷却离心(8000 r·min-1,10 min),上清液过滤定容至100 mL,滤液过0.22 um膜,采用高效液相法测定黄酮化合物不同组分的含量,研究不同浸提温度对黄酮化合物浸出含量的影响,实验重复3次。
1.4 响应面实验
基于龙井茶中黄酮类化合物单因素提取试验,应用Design Expert 7.0试验设计,进行多因素响应面研究试验,并根据最优化后的浸提条件,进行验证试验,影响因素与不同水平因子设计见表1。

表1 响应面试验因素与水平
1.5 黄酮化合物测定
黄酮化合物含量RP-HPLC检测条件参考江和源、吴春燕、刘阳[18-20]等的方法:Symmetry® C18色谱柱(5μm,4.6 mm×250 mm,Waters公司);流动相 A相(V乙腈∶V甲酸∶V水=3∶0.2∶96.8),B相(V乙腈∶V甲酸∶V水=30∶0.2∶69.8)。流动相洗脱梯度:0~25min,100%A;25~30 min,100% ~50%A;30~40 min,50% ~37.5%A;40~45 min,37.5% ~20%A;45~48min,20% ~0%A;48~78 min,0%A;78~80min,0% ~100%A。流速为 0.8mL·min-1,柱温25℃,进样量20μL,检测波长λ=360 nm。
2 结果与分析
2.1 HPLC方法分离黄酮类化合物效果

图2 黄酮化合物标准品HPLC色谱图,λ=360 nm
2.2 单因素实验
2.2.1 不同体积分数甲醇溶液(v∶v)的影响研究
不同浓度的甲醇水溶液对黄酮化类合物的提取结果(见图3)表明:当甲醇体积分数低于60%时,黄酮苷总量随甲醇体积分数增加而增加,甲醇体积分数高于60%时,黄酮苷含量呈下降趋势,而黄酮苷元含量持续增加;当甲醇体积分数达到80%时,黄酮苷元含量达到最大,因此黄酮苷元在高浓度的甲醇溶液更容易浸出。11种黄酮苷组分含量的变化与黄酮苷总量的变化相一致,3种黄酮苷元的提取率的变化与黄酮苷元总量的变化相一致(见表2),其中提取液中含量较高的黄酮苷单体有槲皮素-3-O-半乳糖苷、槲皮素-3-O-芸香糖苷、杨梅素-3-O-半乳糖苷、牡荆素,约占到黄酮总量的70%左右,是影响黄酮总量的主要化合物,而三种黄酮苷元含量占总量的5%左右,综合考虑甲醇体积分数为60%为优选。
2.2.2 不同提取温度的效果比较 图4显示,随着提取温度变化,黄酮苷含量与黄酮苷元含量的变化趋势相一致。提取温度从20℃到70℃之间,黄酮化合物在甲醇溶液中的浸出量随着温度升高而增加,60℃提取黄酮化合物含量相比20℃提取的含量增加0.559 mg/g,主要原因是温度升高后溶液的活度增加,扩散系数的增加,促进更多的黄酮化合物的溶出。当提取温度达到70℃时,黄酮化合物浸出含量有下降的变化趋势,因为温度过高会造成黄酮化合物的分解,其中主要成分槲皮素-3-O-半乳糖苷、槲皮素-3-O-芸香糖苷、杨梅素-3-O-半乳糖苷、杨梅素-3-O-鼠李糖苷、牡荆素均有下降(见表3),综合因素考虑,浸提温度选择60℃为宜。
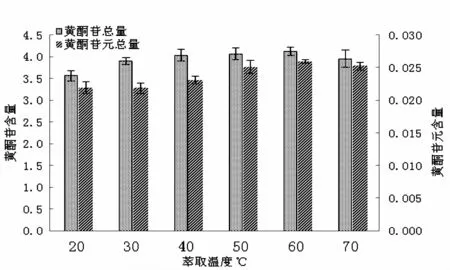
图4 不同温度的物提取效果

表2 不同体积分数甲醇对龙井茶叶中黄酮苷提取的影响(占干物质含量)mg/g
2.3 不同提取时间的效果比较
从图5中可看出,黄酮苷总量与黄酮苷元总量的变化趋势相同,黄酮化合物浸出量随着提取时间延长而增加,提取时间在70~90 min之间,提取液中的黄酮化合物含量达到平衡,黄酮苷总量达到4.43~4.74 mg/g,黄酮苷元总量达到 0.025 mg/g,提取时间达到90 min时,黄酮化合物含量略有降低,因此选择提取时间在80 min为优。
2.3 响应面分析法优化
2.3.1 响应面试验结果 根据响应面(Box-Behnken)的设计中心组合试验设计原理,综合参考单因素试验结果,选取不同浓度甲醇体积分数(A)、提取时间(B)、提取温度(C)对黄酮化合物提取影响显著的3个因素,试验分析结果(见表4)显示,依据龙井茶样不同条件提取的黄酮化合物含量进行回归分析,可求出影响因素的一次效应、二次效应及交互效应的关联方程[21-22]:黄酮化合物含量 =4.563+0.087A+0.089B+0.147C-0.082AB+0.006AC-0.005BC-0.225A2-0.239B2-0.263C2。

图5 不同提取时间对黄酮化合物浸出效果

表4 不同提取条件黄酮化合物含量
此方程表达了实验用龙井茶样经不同的提取条件处理后,黄酮化合物含量与所选取的3个因素之间的对应关系。对所建模型的失拟值分析表明(表5),对所建立模型项的 P=0.0281(P<0.05时,显著水平),达到显著水平,失拟值为0.8178(不显著),显示出较好的拟合度。
2.3.2 响应面曲面分析 应用Desing-Expert 7.0软件对3个提取因子的设计及实验结果(见表4)进行分析做响应曲面图和等高线图(见图6),甲醇体积分数(A)、提取温度(B)、提取时间(C)对黄酮化合物含量影响显著,表现为曲面相对光滑,斜率较大。根据本模型,对二次曲面求极大值,极大值最佳点的甲醇体积分数为61.68%、提取温度61.54℃、提取时间82.79min,在此条件下提取的黄酮化合物含量为5.000mg/g。进行近似验证试验,在最优的提取条件下,进行HPLC测定分析(见图7),平行3次,测得黄酮化合物含量为4.876mg/g,与理论预测值相比较,其相对误差2.47%,优化结果可靠。

表5 回归方程方差分析表
3 讨 论
本实验液相测定方法参考了江和源、吴春燕、刘阳等人的研究结果,通过适当的校正,能有效、准确分离茶叶中的14种黄酮化合物,其中10种黄酮苷类物质,4种黄酮醇苷元[23]。
关于黄酮化合物的提取试剂选择,因黄酮化合物结构呈极性,所以采用甲醇等极性试剂提取;另外,大多数黄酮化合物以2-苯基色原酮(flavone)结构为基础,能与强酸成盐,表现为弱碱性,因此提取环境尽可能呈中性,可增进黄酮化合物的提取过程中的稳定性。
黄酮苷类物质和黄酮苷元均溶于甲醇溶液,但溶解度存在较大差异。相比游离状态的黄酮苷元,黄酮苷类物质的更易溶于低浓度的甲醇溶液,主要因为黄酮类化合环上的羟基糖苷化是分子整体发生极化,提高了溶解度。相关文献报道,黄酮苷类化合物的糖苷键链接的糖基越长,在水中的溶解性越强[24],本实验表明,黄酮苷类化合物的浸出速率略快于黄酮苷元物质,并通过响应面优化提取最优的甲醇水溶液体积分数为61.68%。
在提取温度研究中,考虑到60%和70%的甲醇溶液的沸点分别是74.2℃和72℃,温度不宜过高,一方面会造成甲醇溶液快速挥发,另一方面高温也会加速黄酮化合物氧化分解,通过优化后提取温度为61.54℃,能够更好保留浸出液中的黄酮化合物。
在提取时间研究结果看,提取时间并非越长越好,时间过长导致黄酮化合物氧化分解,在本实验中通过响应面优化,提取时间应采用82.79 min。
经分析,确定了采用甲醇水溶液作为提取溶液,得到了龙井茶中的黄酮化合物工艺的较优条件,并拟合了龙井茶中黄酮化合物含量与各提取因子的数学模型,该数学模型回归性显著,拟合度较好。在提取条件优化后,提取液中的黄酮化合物总量达到4.876 mg/g。
1 王玮,王琳,等.黄酮化合物的研究进展.沈阳医学院学报,2002,(2):115-119.
2 肖常厚.中药化学.上海∶上海科学技术出版社,1997:265.
3 唐叔南,黄维等.甘草中异戊烯基黄酮类化合物抗肿瘤活性构效关系初步研究.Journal of Chinese Pharmaceutical Sciences,2016,25(1):23-29.
4 杨意诚.绿茶饮料苦涩味控制技术研究.杭州:浙江大学,2008:28-29.
5 李云飞.绿茶主要化学物质与汤色劣变的相关性研究.合肥:安徽农业大学,2012:13-25.
6 朱博,夏涛,高丽萍,等.绿茶茶汤中黄酮醇及其苷类的测定方法以及对茶汤色度的影响.食品与发酵工业,2009,(2):146-150.
7 Scharbert S,Hofmann T.Molecular definition of black tea taste by means of quantitative Studies,taste reconstitution and omission experiments.Journal of Agricultural and Food Chemistry,2005,53(13):5377-5384.
8 Scharbert S,et al.Identification of the astringent taste compounds in black tea infusions by combining instrumental analysis and human bioresponse.Journal of Agricultural and Food Chemistry,2004,52(11):3498-3508.
9 张英娜,陈根生,刘阳,等.烘青绿茶苦涩味及其滋味贡献物质分析.茶叶科学,2015(4):377-383.
10 蒲晓亚,等.茶叶的主要呈味物质综述.天水师范学院学报,2011,(2):40-44.
11 陶锋,李向荣,占洁.黄酮醇类化合物提取分离方法的研究进展.中药材,2008,(10):1586-1589.
12 王秋安,周冰,单杨.天然黄酮类化合物的抗氧化活性和提取技木研究进展.化工生产与技术,2004,(5):29-56.
13 William F,Hodnick E.B.MllosavljeviC,J.H.Nelson,and Ronald S.Pardini.Electrochemistry of flavonoids:Relationships between redox potentials, inhibition of mitochondrial respiration, and production of oxygen radicals by flavonoids.Biochemical Pharmacology,1988,37(13):2607-2611.
14 Finger,A., Ulrich H.Engelhardt, and V.Wray.Flavonol glycosides in tea-kaempferol and quercetin rhamnodiglucosides.Journal of the Science of Food and Agriculture,1991,55(2):313-321.
15 石雪萍,李小华,杨爱萍.南京雨花茶中总黄酮提取以及DPPH自由基.江苏农业科学,2013,6(41):238-340.
16 宾冬梅,易诚,颜彩虹.微波辅助法提取藤茶黄酮.安徽农业科学,2014,42(27):9320-9321.
17 刘阳,等.冲泡过程中西湖龙井茶黄酮苷类浸出特性及滋味贡献分析.茶叶科学,2015,35(3):217-224.
18 Heyuan Jiang,et al.Determination of flavonol glycosides in green tea,oolong tea and black tea by UHPLC compared to HPLC.Food Chemistry 2015,183:30-35.
19 Chunyan Wu,Hairong Xu et al.Determination of catechins and flavonol glycosides in Chinese tea varieties.Food Chemistry 2012,132:144-149.
20 刘阳.龙井茶加工过程中黄酮苷动态变化及其浸出特性.杭州:中国农业科学院茶叶研究所,2015,8-9.
21 欧阳玉祝,朱露,李雪锋.响应面优化葛根总黄酮的钙离子沉淀分离工艺.食品科学,2014,35(4):35-38.
22 李莉,张赛,何强,胡学斌.响应面法在试验设计与优化中的应用.实验室研究与探索,2015,(8):41-45.
23 宛晓春.茶叶生物化学.中国农业出版社.2003.
24 张纪宁,杨洁.黄酮类化合物的生物活性研究进展.伊犁师范学院学报(自然科学版),2009,(2):29-31.
Optim ization of flavonoids extraction from Longjing tea by response surfacemethodology
CHEN Gensheng,XU Yongquan,GAO ying,LIU Yang,JIweibin,YIN Junfeng*
(Tea Research Institute,Chinese Academy of Agricultural Sciences,Key Laboratory of Tea Processing Engineering of Zhejiang Province,National Engineering Technology Research Center of Tea Industry,Hangzhou 310008,China)
To optimize the process for extracting flavonoids from Longjing tea,a series of single factor experimentsweremade to investigate the effects ofmethanol volume fraction,extraction temperature and extraction duration on flavnonoids content.On the basis of single factor experiment,a 17-run response surface design involving 3 factors at 3 levels each was generated by the Design-Expert 7.0 software and Box-Behnken design principle.Quadratic regression analysis was used to create a mathematicalmodel for describing flavnonoids extraction.The optimal extraction conditionswere found to be:methanol volume fraction of 61.68%,extraction temperature of 61.54℃ and extraction duration of 82.79 min.Under these conditions,the yield of flavonoidswas 4.876 mg/g.
Flavonoids;Longjing-tea;extracting conditions;response surfacemethodology
TS272.5+1;Q946.8
A
0577-8921(2017)03-146-07
黄酮类化合物(Flavonoids),又称黄酮化合物,广泛存在于植物的茎、叶、花、果实等组织中,属于植物次生代谢产物,是一类低分子量的多酚化合物,大多以糖苷形式存在,少部分以游离的苷元形式存在[1]。
现代研究证明黄酮化合物是重要的抗氧化剂,有抗菌消炎、抑制肿瘤细胞和保肝等作用[2-3]。黄酮化合物不仅在生理活性方面有重要作用,而且在风味化学方面也发挥重要贡献。相关研究表明黄酮醇糖苷类化合物是茶汤苦涩味和色泽形成的重要因子[4-6],Scharbert等人[7]通过滋味稀释技术和滋味重组试验研究认为14种黄酮苷组分是红茶茶汤涩味的主要贡献物质。相关研究表明,黄酮类化合物是红茶茶汤呈现涩味的主要物质,并且增强苦味在口腔中的表现;黄酮类化合物虽然在茶叶中的含量较低(占干物质重量的3%~4%),但其呈味阈值非常低,但是对茶汤滋味贡献作用较大[8-10]。
2017-08-13
浙江省分析测试基金(2015C37073);中国农业科学院科技创新工程创新团队项目(CAAS-ASTIP-2014-TRICAAS)
陈根生(1986年-),男,工程师,主要研究茶叶深加工及检测分析。

