大孔吸附树脂纯化海地瓜总皂苷的研究
,,
[1.福建省南安市食品药品监督管理局,福建 南安 362300;2.福建省水产研究所,国家海水鱼类加工技术研发分中心(厦门),福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013]
2017-08-09
基金顼目:福建省海洋高新产业发展专项项目〔2013〕026号;福建省省属公益类科研院所基本科研专项(2016R1003-12).
阮伟达(1987-),男,硕士,研究方向:生物活性物质开发.E-mail:469904432@qq.com
阮伟达,刘秋凤,苏永昌.大孔吸附树脂纯化海地瓜总皂苷的研究[J].渔业研究,2017,39(5):357-364.
大孔吸附树脂纯化海地瓜总皂苷的研究
阮伟达1,刘秋凤2,苏永昌2
[1.福建省南安市食品药品监督管理局,福建 南安 362300;2.福建省水产研究所,国家海水鱼类加工技术研发分中心(厦门),福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013]
本文研究了海地瓜总皂苷的纯化工艺,并采用3种大孔吸附树脂对海地瓜皂苷的吸附作用进行了比较分析,筛选出最佳的吸附树脂,并对该树脂对海地瓜皂苷的静态吸附和动态吸附效果进行测定。结果表明,筛选出的D101大孔树脂为最合适的树脂型号;以D101大孔树脂静态吸附条件进行纯化,获得皂苷纯度为51.4%;以D101大孔树脂对海地瓜粗提液进行动态吸附研究,获得皂苷纯度达71.3%。因此,D101大孔树脂能够有效地应用于海地瓜总皂苷的富集和纯化。
海地瓜;皂苷;大孔树脂;纯化
大孔吸附树脂是用于分离纯化新技术的一种有机高分子聚合物,具有物理化学稳定性高、比表面积大、吸附容量大、吸附速度快、选择性好、解析条件温和、再生处理方便、使用周期长、易于构成闭路循环、节省费用等诸多优点[1]。其吸附力是基于范德华力或氢键作用力的结果,吸附的实质是一种物质表面分子受作用力不均或高度分散而产生的表面吸附现象,并且由于树脂的孔状结构使其对分子量大小不同的物质具有了筛选作用[2]。海参皂苷经粗提后存在大量色素、多糖、糖蛋白等杂质,需要进一步分离纯化以获取高纯度的海参皂苷[3]。大孔树脂吸附法是分离纯化海参总皂苷常用的方法,其优点是有机溶剂耗费量低、成本低,可以通过梯度洗脱去除杂质,产品纯度高,纯化效果比有机溶剂萃取好。目前已有较多文献关于采用大孔树脂吸附法对海参总皂苷进行富集纯化的报道。袁文鹏等以海参加工废液为原料,利用AB-8型大孔树脂提取海参皂苷[4];樊廷俊等利用大孔树脂分离不同乙醇洗脱组分海参皂苷,发现70%洗脱组分肿瘤抑制活性最强[5];丛日山等采用大孔吸附树脂法提取水溶性海参皂苷,测定发现纯化的海参皂苷具有一定的抗菌活性[6]。
海地瓜(Acaudinamolpadioides)是棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、芋参目(Molpadida)、尻参科(Caudinidae)、海地瓜属(Acaudina)动物,俗称海茄子、香参[7]。海地瓜中不仅含有蛋白质、氨基酸等常见营养物质,还含有皂苷、多糖、多肽等多种生物活性物质[8]。海地瓜食用性较差,价格低廉,因此其适合作为海参活性物质的开发利用原料。目前,对海地瓜的研究主要集中于营养成分、多肽、多糖方面,未见针对海地瓜皂苷的提取与富集的系统研究工作。本文以海地瓜为原料,通过筛选分离纯化海地瓜总皂苷效果最好的大孔树脂型号,探讨大孔树脂对海地瓜总皂苷的静态吸附和动态吸附效果,从而获得大孔树脂纯化皂苷的最佳工艺,制备较高纯度的海地瓜总皂苷产品,为海地瓜皂苷进一步的开发利用奠定基础。
1 材料和方法
1.1实验材料
海地瓜粗皂苷提取液(2.05 mg/mL),利用海地瓜(福建宁德海域)进行乙醇浸提、冻干获得的海地瓜粗皂苷粉末配制[9];人参皂苷Re标准品:中国药品生物制品检验所;甲醇、石油醚、香草醛、高氯酸、冰乙酸等均为国产分析纯;D101、AB-8、DM130型号大孔吸附树脂:河北沧州宝恩化工厂。
1.2主要仪器
DHG-9076A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;721PC型紫外可见分光光度计:上海光谱仪器有限公司;DKB-501A型超级电热恒温水浴锅:上海精宏实验设备有限公司;KQ100DB超声波振荡器:昆山市超声仪器有限公司;RE52CS型旋转蒸发器:上海亚荣生化仪器厂;KYC-100C空气恒温摇床:上海新苗医疗器械制造有限公司;AL204型十万分之一天平:瑞士梅特勒-托利多公司。
1.3实验方法
1.3.1 大孔树脂的预处理
分别称取3种不同型号大孔树脂(AB-8、D101、DM130),分别用70%乙醇、HCl、NaOH处理后,洗至中性备用[3]。
1.3.2 大孔树脂静态吸附量测定
准确称取已处理好的3种不同型号大孔树脂(真空抽滤)1.0 g,2.05 mg/mL海地瓜粗皂苷提取液50 mL,置于恒温摇床中(25℃,120 r/min)静态吸附12 h,测定总皂苷浓度,计算各树脂的皂苷吸附量[10]。
1.3.3 大孔树脂解吸率的测定
取上述吸附饱和的大孔吸附树脂1.0 g,用蒸馏水洗至洗脱液无色,真空抽滤吸干树脂表面残留的溶液,加入75%乙醇溶液50 mL,置于摇床中(25℃,120 r/min)进行静态解吸6 h,将树脂滤出,测定滤液中总皂苷浓度,计算解析量和解吸率[7]。
1.3.4 D101树脂的静态吸附
1)D101大孔树脂最大吸附量
称取D101大孔树脂1.0 g,共5份,依次加入2.05 mg/mL海地瓜粗皂苷提取液15、30、45、60、75 mL,放入恒温摇床中(25℃,120 r/min)振荡吸附6 h,充分吸附后,真空抽滤得滤液,测定吸附前后溶液中对应的皂苷含量,计算其吸附率。
2)不同浓度对静态吸附作用的影响
称取D101大孔树脂1.0 g,共5份,配制质量浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL的海地瓜粗皂苷提取液,各取50 mL依次加入三角瓶中。放恒温摇床中(25℃,120 r/min)振荡吸附6 h,充分吸附后,真空抽滤得滤液,测定吸附前后溶液中对应的皂苷含量,计算其吸附量。
3)乙醇解析浓度的确定
称取D101大孔树脂1.0 g,共7份,各加入2.05 mg/mL海地瓜粗皂苷提取液50 mL,于恒温摇床中(25℃,120 r/min)振荡吸附6 h,吸附饱和后抽滤。树脂用蒸馏水反复冲洗,真空抽滤,然后分别加入30%、40%、50%、60%、70%、80%、90%的乙醇各50 mL,于恒温摇床中(25℃,120 r/min)振荡解析6 h,将解析液进行抽滤,取样检测解析液中皂苷含量,计算其解析量。
4)乙醇解析用量的确定
称取D101大孔树脂1.0 g,共5份,各加入2.05 mg/mL海地瓜粗皂苷提取液50 mL,于恒温摇床中(25℃,120 r/min)振荡吸附6 h,吸附饱和后抽滤。树脂用蒸馏水反复冲洗,真空抽滤,然后依次加入80%的乙醇15、30、45、60、75 mL,于恒温摇床中(25℃,120 r/min)振荡解析6 h,将解析液进行抽滤,取样检测解析液中皂苷含量,计算其解析量。
5)D101树脂吸附和解析时间
称取经预处理的D101大孔树脂5.0 g,加入2.05 mg/mL海地瓜粗皂苷提取液120 mL,于恒温摇床中(25℃,120 r/min)振荡吸附,分别在10、20、30、60、90 min时取0.2 mL样液检测,计算其吸附量。树脂用蒸馏水反复冲洗,用真空抽滤后,准确称取4.0 g进行解析,解析用80%乙醇150 mL,于10、20、30、60、90 min时取0.2 mL解析液检测,计算其解析量。
1.3.5 D101树脂的动态吸附
1)吸附阶段的考察
将预处理好的D101大孔树脂装入洗净的层析柱中(Ø 1.6 cm×30 cm),柱床体积约47 mL。取1.65 mg/mL海地瓜粗皂苷提取液通过大孔树脂吸附柱,以2.5 mL/min的流速过柱,每3 mL收集1管,共收集25管,测定流出液中皂苷的浓度,绘制吸附曲线,得出D101大孔树脂吸附皂苷的泄漏点和饱和点。
2)不同上样流速对动态吸附效果的影响
取1.65 mg/mL海地瓜粗皂苷提取液100 mL,以1.0、1.5、2.0、2.5、3.0、4.0 mL/min 5种不同的流速通过大孔树脂吸附柱,收集过柱后样液,检测样液中皂苷含量,绘制上样流速对动态吸附影响曲线。
3)上样浓度对动态吸附作用的影响
分别配制质量浓度为0.225、0.45、0.9、1.8、3.6 mg/mL的海地瓜粗皂苷提取液,上样于5根规格相同的D101大孔树脂吸附柱进行动态吸附,保持各上样液中皂苷总量相同,流速为2.5 mL/min,待全部样液上样完后,收集过柱后样液,检测样液中皂苷含量,绘制上样浓度对D101大孔树脂动态吸附影响的曲线。
1.3.6 D101大孔树脂的动态洗脱实验
1)不同浓度解吸剂的洗脱效果
取1.80 mg/mL海地瓜粗皂苷提取液150 mL通过D101大孔树脂吸附柱,待吸附达到饱和点后,先用3倍柱体积(3 BV)去离子水过柱,然后用3 BV 40%、50%、60%、70%、80%、90%的乙醇溶液对树脂柱进行解析,解析流速为1.5 mg/mL,分别收集每种洗脱情况下的浓组分,测定解吸液皂苷浓度,比较不同浓度乙醇溶液对树脂解析效果的影响。
2)不同用量的解吸剂的洗脱效果
取1.80 mg/mL海地瓜粗皂苷提取液150 mL通过D101大孔树脂吸附柱,待吸附达到饱和点后,先用去离子水过柱(3 BV),再用80%乙醇溶液(3 BV)对树脂柱进行解析,解析流速为1.5 mg/mL,收集解吸液测定皂苷浓度,比较不同乙醇用量对树脂解析效果的影响。
3)不同解吸流速下的洗脱效果
分别取1.80 mg/mL海地瓜粗皂苷提取液各150 mL,通过5根规格相同的D101大孔树脂吸附柱,待各柱吸附达到饱和点后,先用去离子水过柱(3 BV),再用80%乙醇溶液(3 BV)对树脂柱进行解析,各柱解析流速分别为0.5、1.0、1.5、2.0、2.5、3.0 mL/min,收集解析液,测定解吸液皂苷浓度,比较不同解析流速对洗脱效果的影响。
1.3.7 纯度测定
收集解析液,经旋转浓缩及真空干燥后成干品,按香草醛-冰醋酸-高氯酸显色法测定皂苷含量,并计算纯度[11]。
2 结果与分析
2.1大孔树脂型号筛选
D101、AB-8、DM130是三种常见的大孔树脂型号,广泛应用于生物有效成分如皂苷类、黄酮类、生物碱类等的提取制备,具有操作简便、成本较低、树脂可反复使用等优点,适于工业化规模生产[12-13]。由表1可以看出,3种型号树脂对海地瓜总皂苷都具有较为良好的吸附-解析能力,其中DM130对皂苷的吸附率最高,但D101解析率最高。实验发现D101吸附杂质较弱,抗机械强度好,乙醇洗脱时气泡较少,纯化效果最为理想。因此,结合3种型号树脂的理化性质,选择D101作为分离纯化海地瓜总皂苷的最佳树脂型号。

表1 不同型号树脂对总皂苷静态吸附和解析能力
2.2 D101树脂的静态吸附考察
2.2.1 不同样液量对D101大孔树脂静态吸附率的影响
由图1可以看出,D101大孔树脂的静态吸附率随着样液量的增加而增加,到60 mL时达到最高,75 mL时反而下降。因此认为在60 mL时溶液即达吸附-溶出动态平衡,此时树脂吸附饱和,吸附率为53.0%。因此,后续试验选择60 mL为最大样液量。

2.2.2 不同皂苷浓度对D101大孔树脂静态吸附量的影响
从图2可以看出,随着样液中皂苷浓度的增加,大孔树脂静态吸附量也随之增加。但实际上,由于海地瓜粗提液中皂苷浓度不是很高,常常需要先浓缩一下再进行吸附,这样也导致杂质含量的浓缩,并且溶液会变得黏稠,对产品纯度会有影响,因此从提高产品纯度考虑,选择4.0 mg/mL为合适浓度。

2.2.3 不同乙醇浓度对D101大孔树脂静态解析量的影响
由图3可以看出,D101大孔树脂静态解析量随着乙醇解析浓度的升高而升高,40%之前浓度解析液基本检测不到海地瓜皂苷,90%乙醇解析液中皂苷含量最高,这可能是因为乙醇浓度越高,树脂膨胀得越厉害,树脂充分溶胀有利于被吸附在内部的皂苷分子被剥离,从而被乙醇水溶液析出,提高解析量。但乙醇浓度太高,会导致杂质解析量增加,不利于提高皂苷纯度,而且也增加了成本。因此,静态解析宜采用80%乙醇浓度进行解析。

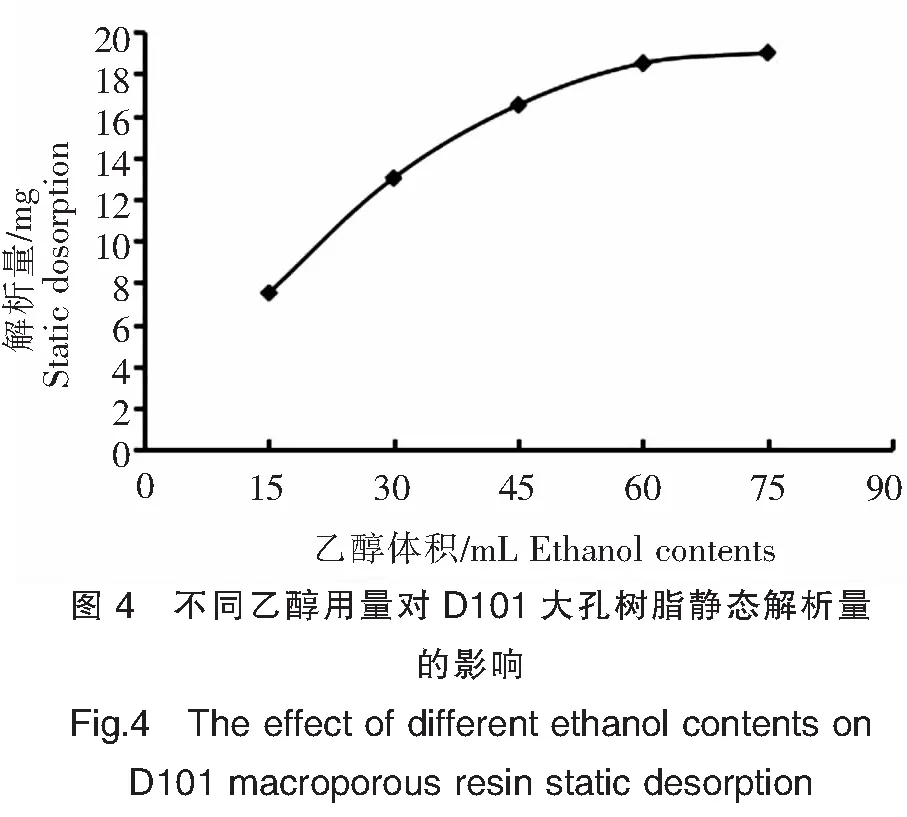
2.2.4 不同乙醇用量对D101大孔树脂静态解析量的影响
由图4可以看出,D101大孔树脂的静态解析量随着乙醇用量的增加而增加,当乙醇用量由60 mL增加到75 mL时,解析量上升平缓。因此可认为在60 mL时树脂中的皂苷已基本被解析出来。从节省成本考虑,以60 mL为乙醇最大解析用量。
2.2.5 D101树脂静态吸附和解析时间考察
由图5可以看出,D101大孔树脂静态吸附量随吸附时间的增加而增加,60 min后吸附速度明显变得缓慢,90 min时已基本接近饱和状态,因此为了节约时间,静态吸附时间定为90 min。

由图6可以看出,用乙醇解析海地瓜皂苷时,解析速度在前30 min很快,而后随着时间的增加速度放缓,在120 min时解析量基本达到最大量,因此将静态解析时间定为120 min。

2.3 D101树脂的动态吸附考察
2.3.1 吸附饱和阶段的考察
由图7可以看出,前5管收集液中没有海地瓜皂苷泄漏,从第6管开始检测到流出液中含有皂苷,即上样37.5 mL后树脂柱开始发生泄漏,因此泄漏点为37.5 mL(泄漏点是指该处泄漏液皂苷的浓度值为上柱前样液皂苷浓度值的1/10)。曲线为缓慢向上图形,表明泄漏时间较长,树脂柱在第22管之后曲线基本不再上升,此时可认为树脂柱已吸附饱和,即上样165 mL为吸附饱和点。

2.3.2 不同上样流速对D101大孔树脂吸附的影响
由图8可以看出,D101大孔树脂动态吸附量在流速1.0~1.5 mL/min变化不大,在流速大于1.5 mL/min时随上样流速的增加先上升后下降,在上样流速2.5 mL/min时吸附量达到最大。其原因可能是样品达到一定的流速时,皂苷样品可将树脂孔隙中的水分充分交换出来,增加了皂苷的吸附量;而流速过高时,有些皂苷来不及进入树脂孔隙内部即被洗下,造成浪费,因此上样流速必须保持一定值才能获得最佳效果,以2.5 mL/min为最佳上样流速。

2.3.3 不同上样浓度对D101大孔树脂动态吸附作用的影响
由图9可以看出,不同上样浓度对D101大孔树脂吸附的影响较大,上样液浓度高,树脂吸附量增加;上样液浓度低,树脂吸附量下降。这是因为高浓度皂苷在树脂空隙附近的比重增大,被空隙交换的概率增加,因此被吸附的可能性大大增加。但皂苷浓度高的上样液,其杂质含量也相对较大,且杂质对皂苷会产生竞争性吸附,因而树脂对杂质的吸附量也随皂苷浓度的增加而增加。这一方面会使皂苷的纯度降低,另一方面对树脂的再生和使用次数也会造成影响。而浓度过低则需增加上样量才能使树脂吸附充分饱和,这既造成浪费又延长吸附时间,增加生产周期。因此,为使纯化工艺达到最佳效果,上样液应保持合适的浓度,以3.6 mg/mL为最佳上样浓度。

2.3.4 不同乙醇浓度对D101大孔树脂洗脱效果的影响
由图10可以看出,D101大孔树脂动态解析量随乙醇浓度的增加而上升,同静态解析一样,40%之前浓度的解析液几乎检测不到海地瓜皂苷,但实验发现能将大部分糖类、色素等杂质洗脱掉,因此后期实验可用30%乙醇去除杂质,大大提高了洗脱液皂苷纯度。90%乙醇浓度的解析液洗脱量最大,因此以90%乙醇作为大孔树脂洗脱剂。

2.3.5 不同乙醇用量对D101大孔树脂洗脱效果的影响
在确定解吸剂洗脱的浓度后,还需要对解吸剂的最佳用量进行确定,其原则是在充分洗脱所吸附的海地瓜皂苷的前提下,尽量节省洗脱剂的用量。由图11可以看出,D101大孔树脂动态解析量随乙醇用量的增加而上升,达到3 BV后,解析量几乎不随乙醇用量的增加而增加,考虑到尽量节约洗脱剂用量,可认为3 BV 90%乙醇已将树脂柱吸附的绝大部分海地瓜皂苷洗脱下来,因此确定洗脱剂最大用量为3 BV。

2.3.6 不同解吸流速对D101大孔树脂洗脱效果的影响
解吸流速一般都要求慢,这是因为流速过快,洗脱性能差,洗脱带宽,且拖尾严重,洗脱不完全;流速过慢,会延长生产周期。由图12可以看出,D101大孔树脂动态解析量随解析流速的增加先上升而后下降,在流速为1.5 mL/min时解析量达到最大值,一方面可能流速快有利于海地瓜皂苷克服吸附力,从而更快地被洗脱下来,另一方面流速过快会造成解析液与树脂内部接触不够充分,需增加乙醇用量才能洗脱完全,造成乙醇浪费,从节省时间和资源的角度出发,以1.5 mL/min流速为最佳解析流速。

2.4重复验证试验
综上所述,以D101型号大孔树脂对海地瓜粗提液静态吸附-解析工艺进行研究,得出最佳条件为:称取已处理过的经真空抽滤的D101大孔树脂1.0 g,加入质量浓度为4.0 mg/mL样品液60 mL,放入恒温摇床中(25℃,120 r/min)振荡吸附90 min,过滤,树脂用蒸馏水反复冲洗,真空抽滤,先加入30%乙醇去除杂质,过滤,再用60 mL浓度为80%的乙醇进行解析,于恒温摇床中(25℃,120 r/min)振荡120 min。所得皂苷纯度约为51.4%。
以D101型号大孔树脂对海地瓜粗提液动态吸附-解析工艺研究,得出最佳条件为:取3.6 mg/mL海地瓜皂苷粗提液160 mL上柱,上样流速为2.5 mL/min,依次用140 mL(3 BV)去离子水洗去水溶性杂质,140 mL(3 BV)30%乙醇溶液去除杂质,150 mL(约3 BV)90%乙醇溶液洗脱海地瓜总皂苷,洗脱流速均为1.5 mL/min。平行操作3次,实验结果最终解析量为54.6 mg,纯度达71.3%,说明采用动态吸附法富集、纯化海地瓜总皂苷是可行的,能获得较高纯度的海地瓜皂苷。
3 讨论
海参皂苷是海参的次生代谢产物之一,是海参重要的生物活性物质组成成分。近年来关于海参皂苷的研究表明,海参皂苷具有抗肿瘤[14]、提高免疫力[15]、抗真菌[16]、降血糖[17]等生物活性。目前,海参皂苷的开发应用水平还较低,其原因主要是海参皂苷的含量较低,而海参原料成本较高,从而使海参皂苷的提取制备成本增加;此外,海参皂苷是一类结构十分相似的化合物,由于其结构复杂,分离纯化困难,需要运用多种手段对皂苷进行分离纯化[18]。为解决海参皂苷的规模化制备难题,本研究开展了以低值海参品种海地瓜为原料,利用大孔树脂对海参皂苷进行吸附和富集工作。采用海地瓜作为海参皂苷的提取原料,能够有效地降低海参皂苷规模化制备成本;应用大孔树脂不仅能够对皂苷组成成分进行选择性地吸附和富集,而且具有性质稳定、可再生的优点,适用于皂苷的规模化制备和生产[19]。本研究运用动态吸附法对皂苷进行富集,制备获得的海地瓜皂苷纯度可达71.3%,说明D101型号大孔树脂对海地瓜皂苷具有较好的吸附和富集作用,也表明了应用海地瓜进行海地瓜皂苷的规模化提取制备具有较高的可行性。研究结果还表明,不同的吸附和洗脱方法对海地瓜皂苷的富集作用也具有较大影响。因此,在运用不同型号大孔树脂进行皂苷吸附时,要选择适当的方法和合适条件进行皂苷的纯化,才能获得较好的效果。
[1]娄嵩,刘永峰,白清清,等.大孔吸附树脂的吸附机理[J].化学进展,2012,24(8):1427-1436.
[2]龚行楚,闫安忆,瞿海斌.大孔树脂分离纯化中草药中皂苷类成分的研究进展[J].世界科学技术-中医药现代化,2013,15(2):329-334.
[3]于林芳,王超,王玉明,等.大孔树脂纯化革皮氏海参总皂苷工艺[J].食品科学,2011,32(12):1-4.
[4]袁文鹏,刘新,樊廷俊,等.仿刺参加工废液中几种海参皂苷化合物的分离鉴定[J].山东大学学报(理学版),2011,46(7):17-34.
[5]樊廷俊,袁文鹏,丛日山,等.仿刺参水溶性海参皂苷的分离纯化及其抑瘤活性研究[J].药学学报,2009,44(1):25-31.
[6]丛日山,袁文鹏,樊廷俊,等.仿刺参水溶性海参皂苷的分离制备及抗真菌活性的研究[J].中国海洋大学学报(自然科学版),2006,36(6):959-964.
[7]廖玉麟.中国动物志棘皮动物门海参纲[M].北京:科学出版社,1997:247.
[8]罗先群,王新广,杨振斌.海地瓜的开发和利用[J].食品研究与开发,2000,21(3):34-35.
[9]苏永昌,刘淑集,阮伟达,等.响应面法优化海地瓜皂苷提取工艺[J].食品工业科技,2016,37(21):205-209.
[10]孙亦群,黄可儿.大孔吸附树脂纯化黄芪总皂苷的工艺优化研究[J].中成药,2011,33(11):1911-1915.
[11]中华人民共和国卫生部.保健食品检验与评价技术规范实施手册[M].北京:清华同方电子出版社,2003:1241.
[12]张旭,王锦玉,仝燕,等.大孔树脂技术在中药提取纯化中的应用及展望[J].中国实验方剂学杂志,2012,18(6):286-290.
[13]吴春蕾,刘圆,张志锋,等.大孔吸附树脂富集纯化白花刺参总皂苷的工艺研究[J].中草药,2011,42(6):1130-1134.
[14]尹一恒,章翔,程光,等.海参皂苷抑制人脑胶质母细胞瘤U251细胞生长实验研究[J].中华神经外科疾病研究杂志,2009,8(1):19-22.
[15]王静凤,傅佳,王玉明,等.革皮氏海参皂苷对小鼠免疫功能的调节作用[J].中国海洋大学学报(自然科学版),2010,40(2):28-32.
[16]韩华,易杨华,喇明平,等.糙海参皂苷Scabraside A、B的抗真菌和抗肿瘤活性[J].中国药理学通报,2008,24(8):1111-1112.
[17]温敏,王佳慧,刘丰海,等.海参皂苷对自发性糖尿病小鼠的降血糖作用[J].食品工业科技,2013,34(22):149-152.
[18]孙鹏,易杨华,李玲,等.海参皂苷的生源分类和化学结构特征(楯手目)[J].中国天然药物(英文版),2007,5(6):463-469.
[19]董漪,吴虹.大孔吸附树脂提取及纯化中药研究进展[J].安徽中医药大学学报,2012,31(3):76-78.
MacroporousresinpurificationofsaponinsfromtheseacucumberAcaudinamolpadioides
RUANWeida1,LIUQiufeng2,SUYongchang2
[1.Nan’an Food and Drug Administration,Nan’an 362300,China; 2.National Research and Development Center for Marine Fish Processing(Xiamen),Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province,Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources,Fisheries Research Institute of Fujian,Xiamen 361013,China]
The method of purification of total saponins fromAcaudinamolpadioideswith macroporous resin was studied.Through the comparison of 3 types of macroporous resins,the optimal absorbent material was screened and the adsorption and desorption capacity towards total saponins were investigated.The results showed that D101 macroporous resin was screened for the most suitable resin type to purify total saponins.The best condition of static adsorption-elution technology of D101 macroporous resin was obtained and the saponins purity was 51.4%.The best condition of dynamic adsorption-elution technology of D101 macroporous resin was also investigated,and the saponins purity was 71.3%.It was suggested that the method of D101 macroporous resin to adsorb and purify total saponins inAcaudinamolpadioideswas feasible and effective.
Acaudinamolpadioides;saponins;macroporous resin;purification
R931.77
B
1006-5601(2017)05-0357-08

