10种免疫相关基因在斜带石斑鱼组织中的表达分析
,, ,,, ,,, ,
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
2017-09-15
基金顼目:厦门南方海洋研究中心项目(14GZP75NE39);产学研协同创新及科技合作项目(3502Z20172001);
省属公益类科研院所基本科研专项(2014R1003-11);福建省海洋高新产业发展专项(2014NO.21).
葛 辉(1984-),男,助理研究员,从事水产生物疾病研究.E-mail:gehuizlj@163.com
林克冰(1964-),女,研究员,从事海洋生物病害防治技术研究.E-mail:kebingl@sina.com
葛 辉,林克冰,周 宸,等.10种免疫相关基因在斜带石斑鱼组织中的表达分析[J].渔业研究,2017,39(5):379-385.
10种免疫相关基因在斜带石斑鱼组织中的表达分析
葛辉,林克冰,周宸,吴建绍,朱志煌,陆振,郑乐云,吴水清,林琪,黄种持
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
采用相对实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)技术,以β-肌动蛋白(β-actin)的表达量作为内参,对健康养殖斜带石斑鱼(Epinepheluscoioides)不同组织(头肾、心脏、肝脏、脾脏、鳃、肌肉、鳍、眼、肠道)中的10种免疫相关基因:免疫球蛋白(IgM)、CD4、MHCIIa、TCRβ、CD8a、MHCIa、ISP16、Mx、TNFR14、HSP90的mRNA表达量进行了研究。结果显示,10种免疫相关基因在斜带石斑鱼的10种组织中均有表达。其中体液免疫相关基因[免疫球蛋白(IgM)、CD4和MHCIIa]在鳃中的表达量最高,在其他组织部位的表达量相对较少。细胞免疫相关基因(TCRβ、CD8a和MHCIa)也是在鳃中的表达量最高,在眼、肌肉、肝和肠的部位表达量相对较少。ISP16在鳃和肝中的表达量较高,在肌肉和肠中的表达量较低。Mx在鳃中的表达量较高,在肌肉和肠的表达量较低。TNFR14在眼的表达量较高,在肠的表达量较低。HSP90在鳃和肝中的表达量相对较高,在心和肌肉的表达量较低。
斜带石斑鱼;实时荧光定量PCR(qRT-PCR);免疫基因
斜带石斑鱼(Epinepheluscoioides)属于鮨科(Serranidae),石斑鱼属(Epinephelus),属广盐性鱼类。2014年全国石斑鱼的产量为88 130 t,其中广东、海南和福建的产量分别为36 138 t、24 783 t和24 676 t。随着石斑鱼养殖产量的急剧增加,而养殖户缺乏科学的病害防治技术,导致石斑鱼的病害问题日趋严重。对石斑鱼的疾病防治除了要保持良好的养殖水环境、合理的养殖密度和药物治疗外,增强石斑鱼自身的免疫能力具有其独特的优越性。近年来,学者们陆续开展了益生菌、拮抗蛋白等研究来提高石斑鱼的免疫能力。因此,开展石斑鱼的免疫学相关的基础研究具有很大的实践意义[1-7]。
免疫(Immunity)是指机体对抗病原体引起疾病的能力,免疫系统是防御和维护自身稳定的一个防卫系统。鱼类免疫系统包括免疫组织和器官、免疫细胞和体液免疫因子3大类。鱼类的免疫相关器官和组织主要包括胸腺、肾脏、脾脏和粘膜相关淋巴组织等[8-9]。免疫球蛋白(IgM)、CD4和MHCIIa是体液免疫相关基因,TCRβ、CD8a和MHCIa是细胞免疫相关基因,ISP16、Mx和肿瘤坏死因子(TNFR14)是抗病毒通路相关蛋白,HSP90是分子伴侣。免疫组织和细胞是鱼类防御系统的基础,是鱼类抵御病原入侵的最初防线,体液免疫因子作为免疫应答的效应分子对病原具有直接的防御作用[10-11]。本研究应用相对定量RT-PCR技术对健康斜带石斑鱼的不同组织(头肾、心脏、肝脏、脾脏、鳃、肌肉、鳍、眼、肠道)中10种免疫相关基因[免疫球蛋白(IgM)、CD4、MHCIIa、TCRβ、CD8a、MHCIa、ISP16、Mx、TNFR14、HSP90]的mRNA表达水平进行研究,希望在分子水平上为斜带石斑鱼的免疫学研究提供基础资料。
1 材料和方法
1.1材料
实验所用斜带石斑鱼来源于漳州漳浦海区网箱养殖,选择20尾体色正常、体质健壮、体表无损伤,平均体重在(80±3)g,养殖周期相同的个体用于实验研究。采集时间为2016年3月18日。
1.2试剂、耗材和仪器
无菌水;0.9%生理盐水;75%酒精;无菌吸管;解刨工具;冻存管;qPCR仪器,匀浆机。
1.3取样方法
在取样前,将取回的斜带石斑鱼暂养在实验室,暂养用水取自其养殖场。取样解剖前饥饿24 h。从养殖箱中随机选取10尾石斑鱼,解剖前测量体长、体重。先用无菌生理盐水冲洗实验用石斑鱼体表,无菌条件下,用灭菌剪刀剪开鱼体璧,分别取出头肾、心脏、肝脏、脾脏、鳃、肌肉、鳍、眼、肠道,置于1.5 mL冻存管内,并立刻将其放入液氨中保存。
1.4 RNA提取
将样品置于1 mL Trizol试剂(Qiagen)中,并分别匀浆。按照Trizol试剂使用说明书,从不同组织提取总RNA,并在1.5%变性琼脂糖凝胶上电泳以测试完整性。使用Nanodrop ND-1000UV分光光度计(Nanodrop TM)测定RNA的数量和质量(Technologies,Wilmington,DE,USA)。
1.5实时荧光定量核酸扩增反应(qRT-PCR)
根据制造商的方案,使用QuantScript RT Kit(TIANGEN)进行cDNA合成,然后将cDNA储存在-20℃下备用。三个重复的反应以总体积为25 μL进行,其中含有12.5 μL 2×SYBR Premix Ex Taq II(Perfect Real Time)(TaKaRa,Japan)、1.0 μL cDNA模板、0.8 μL 10 μmol·L-1每个正向和反向引物以及9.9 μL Milli-Q水。
PCR程序是:95℃进行5 min,然后是95℃持续10 s、退火温度58℃持续20 s和72℃持续30 s的40个循环。在每次运行结束时,对PCR产物进行熔解曲线分析(60~95℃),以确保单个产物被扩增。使用cDNA的稀释系列监测每个引物对的扩增效率。所有放大效率在98%和101%之间。用比较Ct法2△△Ct法计算靶基因的相对表达,用β-actin标准化。采用SPSS 20.0对实验所得数据进行单因素方差分析和Duncan氏多重检验(P<0.05)。
使用Primer Express 2.0软件(Applied Biosystems,Foster City,CA,USA)并从Invitrogen公司合成所有引物(表1)。

表1 实验所用引物

续表1
2 结果
如图1所示,本文通过qRT-PCR技术分析10种体液、细胞和先天免疫相关的基因,观察其在健康斜带石斑鱼不同组织中的免疫力。其中免疫球蛋白(IgM)、CD4和MHCIIa在鳃中的表达量最高,与其他组具有明显的统计学差异(P<0.05),在其他组织部位的表达量相对较少。TCR-β、CD8a和MHCIa也是在鳃中的表达量最高,在眼、肌肉、肝和肠的部位表达量相对较少。ISP16在鳃和肝中的表达量较高,在肌肉和肠中的表达量较低。Mx在鳃中的表达量较高,在肌肉和肠的表达量较低。TNFR14在眼的表达量较高,在肠的表达量较低。HSP90在鳃和肝中的表达量相对较高,在心和肌肉的表达量较低。

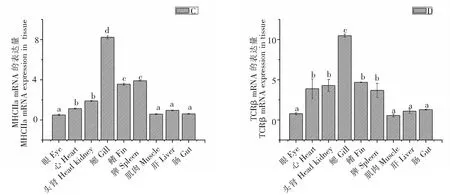
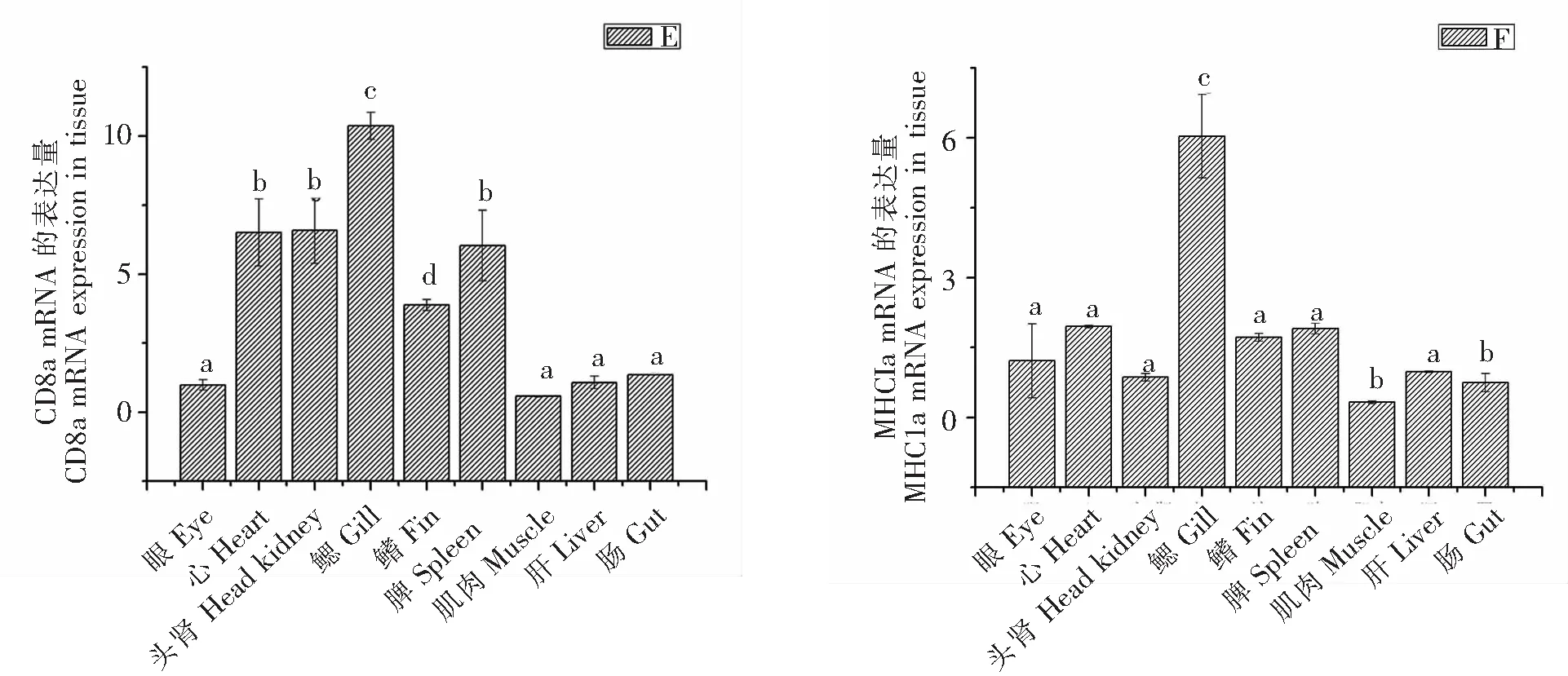


A:IgM mRNA; B:CD4 mRNA;C:MHCIIa mRNA;D:TCRβ mRNA ;E:CD8a mRNA;F:MHCIa mRNA;G:ISP16 mRNA ;H:Mx mRNA ;I:TNFR14 mRNA ;J:HSP90 mRNA
注:具有不同字母的值在0.05的显着性水平上表示显着差异(P<0.05)。
Note:Values with different letters represented significant difference at the significance level of 0.05(P<0.05).
3 讨论
近年来受养殖密度不断增大和水质污染的影响,斜带石斑鱼的病害明显增多。斜带石斑鱼病害的防治,除了需要良好的养殖环境和药物治疗外,还需要提高鱼体自身的免疫能力,特别对于与病毒相关的病害,更需要卓有成效的免疫防治。因此有必要进行与免疫相关的基础研究。目前对斜带石斑鱼的基础免疫学研究报道较少,所以本研究选用斜带石斑鱼为实验对象,分析了10种免疫相关基因的转录表达,结果发现体液免疫相关基因[免疫球蛋白(IgM)、CD4和MHCIIa]的表达量在各组织中高低不一,在鳃中的表达量相对较高,在肌肉、肝和肠的表达量相对较低。这可能与鳃是斜带石斑鱼的呼吸器官,接触水环境较多有关,且鳃是血液丰富的部位,所以体液免疫相关基因在鳃中的表达量相对较高。CD4、MHCIIa和某些免疫球蛋白通常用作体液免疫的标志物,IgM是肿瘤免疫的直接指标[12]。在本研究中,CD4、MHCIIa和IgM在鳃、头肾和脾脏中均表现出大量的转录表达。当石斑鱼、鲈鱼和大西洋大比目鱼患有β-亚麻病毒感染时,研究者发现IgM也大量表达[13-15]。所以可根据IgM在石斑鱼抵抗病毒感染时会大量表达的现象来进行病害防御。鳃、头肾和脾脏是表达IgM的活跃组织。
与体液免疫相似,细胞免疫在宿主抗病毒反应中起到重要作用。TCR-β是一种重要的T细胞标记,通常与CD8/MHCIa复合物配合以介导细胞毒性T淋巴细胞反应[16-18]。曾有研究报道感染期间TCR-β、CD8a和MHCIa的表达上调[19-23],表明这些分子可能在抗病毒免疫中起重要作用。因此,本研究观察到在鳃、头肾、脾脏和心中,TCR-β、CD8a和MHCIa的相对表达量较高,表明这几个部位可能是斜带石斑鱼抵抗病毒进行细胞免疫的主要器官。
通常,当脊椎动物遭受病毒感染时,干扰素信号通路首先被激活。在神经坏死病毒(NNV)感染斑马鱼的实验中,干扰素途径涉及急性和持续性感染[24]。Mx和ISP16是表现出抗病毒活性的干扰素途径因子[25-26]。在甜菜碱病毒感染几种鱼类过程中观察到Mx的mRNA表达量剧烈上调[27]。此外,注射干扰素可以拯救感染神经坏死病毒(NNV)的鱼[24]。在本研究中,ISP16在心、鳃、脾脏和肝脏中的相对表达量较高,Mx在眼、心脏、头肾、鳃、脾脏和肝脏中的表达量较高,TNFR14在眼和鳃中的表达量较高。表明当斜带石斑鱼遭受病毒感染时,干扰素途径将会为这些组织器官提供保护。在斜带石斑鱼的应激过程中,一些病毒会引起热休克反应,HSP90通常参与应激诱导的细胞保护作用[27]。在本研究中HSP90在多个组织中均有表达,在眼、鳃、鳍、肝和肠的表达量相对较高。多个研究报道说明当宿主感染病毒时HSP90会大量表达,表明HSP90在宿主体内抗病毒的重要作用[28-29]。
[1]胡云凤.斜带石斑鱼(Epinepheluscoioides)IL-8基因cDNA的克隆及组成型表达分析[D].广州:暨南大学,2010.
[2]林超辉.斜带石斑鱼的生物学特性及养殖技术[J].北京水产,2007,(5):206-207.
[3]刘秀珍,李家炳.海水网箱养殖石班鱼病原菌研究[J].热带海洋学报,1994,13(1):81-86.
[4]Hansen N E.Plasma lysozyme-a measure of neutrophil turnover.An analytical review[J].Ser Haematol,1974,7(1):1-87.
[5]Harikrishnan R,Kim J S,Kim M C,et al.Molecular characterization,phylogeny,and expression pattern of c-type lysozyme in kelp grouper,Epinephelusbruneus[J].Fish & Shellfish Immunology,2011,31(4):588-594.
[6]林克冰,葛辉,林琪,等.斜带石斑鱼TLR5S基因结构及功能分析[J].厦门大学学报(自然版),2013,52(1):109-115.
[7]林克冰,吴建绍,黄兆斌,等.一株斜带石斑鱼(Epinepheluscoioides)病原菌的分离与鉴定[J].福建水产,2014,36(6):419-427.
[8]李晓萌,戴伟,方珍珍,等.3种非特异性免疫相关基因在点带石斑鱼组织中的mRNA表达分析[J].天津农学院学报,2015,(1):1-5.
[9]Murphy P M,Baggiolini M,Charo I F,et al.International union of pharmacology.XXII.Nomenclature for chemokine receptors[J].Pharmacological Reviews,2000,52(1):145.
[10]Lai Y X,Jin B L,Xu Y,et al.Immune responses of orange-spotted grouper,Epinepheluscoioides,against virus-like particles of betanodavirus produced inEscherichiacoli[J].Veterinary Immunology & Immunopathology,2014,157(1-2):87.
[11]Liu W,Hsu C H,Chang C Y,et al.Immune response against grouper nervous necrosis virus by vaccination of virus-like particles[J].Vaccine,2006,24(37-39):6282-6287.
[12]Bowen D G,Walker C M.Adaptive immune responses in acute and chronic hepatitis C virus infection[J].Nature,2005,436(7053):946-952.
[13]Wu M S,Chen C W,Lin C H,et al.Differential expression profiling of orange-spotted grouper larvae,Epinepheluscoioides(Hamilton),that survived a betanodavirus outbreak[J].Journal of Fish Diseases,2012,35(3):215-225.
[14]Scapigliati G,Buonocore F,Randelli E,et al.Cellular and molecular immune responses of the sea bass (Dicentrarchuslabrax) experimentally infected with betanodavirus[J].Fish & Shellfish Immunology,2010,28(2):303-311.
[15]Grove S,Johansen R,Reitan L J,et al.Quantitative investigation of antigen and immune response in nervous and lymphoid tissues of Atlantic halibut (Hippoglossushippoglossus) challenged with nodavirus[J].Fish & Shellfish Immunology,2006,21(5):525-539.
[16]Nakanishi T,Aoyagi K,Xia C,et al.Specific cell-mediated immunity in fish[J].Veterinary Immunology & Immunopathology,1999,72(1-2):101-109.
[17]Nakanishi T,Toda H,Shibasaki Y,et al.Cytotoxic T cells in teleost fish[J].Developmental & Comparative Immunology,2011,35(12):1317-1323.
[18]Randelli E,Buonocore F,Scapigliati G.Cell markers and determinants in fish immunology[J].Fish & Shellfish Immunology,2008,25(4):326-340.
[19]Somamoto T,Yoshiure Y,Sato A,et al.Expression profiles of TCRβ and CD8α mRNA correlate with virus-specific cell-mediated cytotoxic activity in ginbuna crucian carp[J].Virology,2006,348(2):370-377.
[20]Utke K,Bergmann S,Lorenzen N,et al.Cell-mediated cytotoxicity in rainbow trout,Oncorhynchusmykiss,infected with viral haemorrhagic septicaemia virus[J].Fish & Shellfish Immunology,2007,22(3):182-96.
[21]Boudinot P,Boubekeur S,Benmansour A.Rhabdovirus infection induces public and private T cell responses in teleost fish[J].Journal of Immunology,2001,167(11):6202-6209.
[22]Landis E D,Purcell M K,Thorgaard G H,et al.Transcriptional profiling of MHC class I genes in rainbow trout infected with infectious hematopoietic necrosis virus[J].Molecular Immunology,2008,45(6):1646-1657.
[23]Gullian M,Thompson F,Rodriguez J.Selection of probiotic bacteria and study of their immunostimulatory effect inPenaeusvannamei[J].Aquaculture,2004,233(1-4):1-14.
[24]Lu M W,Chao Y M,Guo T C,et al.The interferon response is involved in nervous necrosis virus acute and persistent infection in zebrafish infection model[J].Molecular Immunology,2008,45(4):1146-1152.
[25]Chen Y M,Su Y L,Shie P S,et al.Grouper Mx confers resistance to nodavirus and interacts with coat protein[J].Developmental & Comparative Immunology,2008,32(7):825-836.
[26]Chin K C,Cresswell P.Viperin (cig5),an IFN-inducible antiviral protein directly induced by human cytomegalovirus[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(26):15125-15130.
[27]Sreedhar A S,Kalmár E,Csermely P,et al.Hsp90 isoforms:functions,expression and clinical importance[J].Febs Letters,2004,562(1-3):11-15.
[28]Chase G,Deng T,Fodor E,et al.Hsp90 inhibitors reduce influenza virus replication in cell culture[J].Virology,2008,377(2):431-439.
[29]Burch A D,Weller S K.Herpes Simplex Virus Type 1 DNA Polymerase Requires the Mammalian Chaperone Hsp90 for Proper Localization to the Nucleus[J].Journal of Virology,2005,79(16):10740-10749.
mRNAexpressionoftenimmunegenesintissuesofEpinepheluscoioides
GEHui,LINKebing*,ZHOUChen,WUJianshao,ZHUZhihuang,LUZhen,ZHENGLeyun,WUShuiqing,LINQi,HUANGZhongchi
(Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian, Fisheries Research Institute of Fujian Province,Xiamen 361013,China)
In this study,β-actin mRNA expression was used as the internal reference,the mRNA expression of ten immune genes[(IgM),CD4,MHCIIa,TCRβ,CD8a,MHCIa,ISP16,Mx,TNFR14,HSP90]were analyzed in tissues (head kidney,heart,liver,spleen,gill,muscle,fin,eye and intestine) ofEpinepheluscoioideswith quantitative Real-time PCR.The results showed that mRNA expressions of ten genes were observed in all of the above tissues.And the humoral immunity factors (IgM,CD4,MHCIIa) showed a highest expression in the gill,cellular immunity factors (TCR-β,CD8a and MHCIa) also showed a higher expression in the gill and lower in the eyes,muscles,liver and intestine.The expression of ISP16 in gill and liver was higher,and lower in muscle and intestine.TNFR14 in the eye was higher and the expression level in the intestine was lower.The expression of HSP90 in the gills and liver was relatively high,while the expression of HSP90 was lower in the heart and muscle.
Epinepheluscoioides;quantitative Real-time PCR;immune genes
S917.4
A
1006-5601(2017)05-0379-07

