骨代谢标志物、血脂水平与原发性骨质疏松症的相关性研究
,
骨代谢标志物、血脂水平与原发性骨质疏松症的相关性研究
张玲,曹艮元
目的探讨骨代谢标志物、血脂水平与原发性骨质疏松症的相关性。方法收集2014年1月—2016年6月就诊我院确诊为原发性骨质疏松症病人136例(骨质疏松症)和我院体检中心健康人群 143名(对照组)的临床资料,包括一般资料、既往史、家族史、月经史(女性),空腹生化指标包括血脂胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),骨代谢标志物包括I型前胶原氨基端延长肽(TP1NP)、骨钙素(BGP)、I型胶原羧基端肽β特殊序列(β-CTX)、血清25羟维生素D3[25-(OH)-D3],并分析两组人群骨代谢标志物、血脂水平与骨质疏松相关性。结果骨质疏松症组TC、TG、LDL-C明显高于对照组,HDL-C水平低于对照组,差异有统计学意义(P<0.05)。骨质疏松症组T-P1NP、BGP及25-(OH)-D3均低于对照组,差异有统计学意义(P<0.05),β-CTX高于对照组,差异有统计学意义(P<0.05)。骨密度与T-P1NP、BGP及25-(OH)-D3呈正相关,与β-CTX呈负相关,差异均有统计学意义(P<0.05)。结论骨标志物作为反应骨代谢的血清学指标,能更早期发现骨质疏松,从而弥补骨密度检查的不足。临床中可通过动态监测该标志物可了解成骨细胞活性及骨形成情况,有利于早期发现骨形成能力下降,从而尽早干预以预防骨质疏松的发生。脂代谢障碍与骨质疏松症的发病有一定相关性,TC、TG 和 LDL-C可能是诱发或加重骨质疏松的危险因素,因此骨质疏松病人更应注意血脂的监测及治疗。
骨质疏松症;骨代谢标志物;血脂;I型前胶原氨基端延长肽
骨质疏松症(osteoporosis,OP)是一种以骨量降低和骨组织微结构破坏为特征,导致骨脆性增加和易于骨折的全身性骨病[1]。该病起病隐匿,轻者无症状,早期症状不明显甚至缺乏特异性,直至出现骨痛、肌无力、骨折、身材缩短、驼背、胸廓畸形等才被发现。病人一旦骨折或者出现因驼背、胸廓畸形致胸闷、气短、呼吸困难等并发症,生活质量明显下降,加之长期卧床极易并发肺部感染、泌尿系感染及压疮等疾病,给社会及家庭带来沉重经济负担[2]。随着我国人口老龄化加重、骨质疏松症患病率逐年升高,因此早期发现骨质疏松具有重要意义[3]。临床工作中以骨量减少、骨密度(BMD)下降及(或)发生脆性骨折等为依据,发生脆性骨折即可诊断为骨质疏松[4]。但骨密度的变化相对缓慢,不利于早期诊断及评估疗效。近年来研究显示血清骨代谢标志物较骨密度变化更早更敏感,同时发现骨质疏松病人常并发血脂代谢异常[5-6]。因此,本研究通过探讨骨代谢标志物及血脂与骨质疏松症的相关性,为骨质疏松病人的早期诊断与治疗提供实验室依据。
1 资料与方法
1.1 研究对象 收集2014年1月—2016年6月在我院确诊为骨质疏松症病人136例(骨质疏松症)和我院体检中心健康人群 143名(对照组)的临床资料。包括一般资料、既往史、家族史、月经史(女性),空腹生化指标包括胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),骨代谢标志物包括I型前胶原氨基端延长肽(TP1NP)、骨钙素(BGP)、I型胶原羧基端肽β特殊序列(β-CTX)、血清25羟维生素D3[25-(OH)-D3]。排除标准:各种继发性骨质疏松症如慢性肝病、慢性肾病、风湿系统疾病、内分泌系统疾病、恶性肿瘤和影响骨代谢的神经、肌肉疾病。骨质疏松症组中男56例,女80例,年龄57.9岁±5.9岁,所有病人均符合 WHO 对骨质疏松症的诊断标准。对照组中男63例,女80例,年龄56.7岁±6.0岁。
1.2 研究方法 空腹采集静脉血,三酰甘油、总胆固醇、低密度脂蛋白、高密度脂蛋白采用贝克曼全自动生化分析仪检测;TP1NP采用RIA-ECLIA检测,BGP采用IRMA-ECLIA检测,β-CTX采用EIA-ECLIA检测,25-(OH)-D3利用全自动电化学发光仪检测。
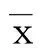
2 结 果
2.1 两组血脂指标比较 骨质疏松症组TC、TG、LDL-C明显高于对照组,HDL-C水平低于对照组,差异有统计学意义(P<0.05)。详见表1。
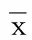
表1 两组血脂指标比较(±s) mmol/L
2.2 两组骨密度及骨代谢标志物指标比较 骨质疏松症组T-P1NP、BGP及调节骨代谢激素25-(OH)-D3低于对照组,BMD、β-CTX高于对照组,差异有统计学意义(P<0.05)。详见表2。
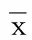
表2 两组人群骨密度及骨代谢标志物比较(±s)
2.3 两组人群骨密度与骨代谢标志物相关性分析(见表3)

表3 两组人群骨密度与骨代谢标志物相关性分析
3 讨 论
骨质疏松症分为原发性和继发性2类。原发性骨质疏松症包括绝经后骨质疏松症(Ⅰ型)、老年骨质疏松症(Ⅱ型)及特发性骨质疏松症(Ⅲ)。继发性骨质疏松症是指影响骨代谢的疾病或药物所致的骨质疏松症。本研究所涉及的研究对象均为原发性骨质疏松症。
目前临床工作中骨密度的评估以双能X线吸收测定法(DXA)测量值作为诊断骨质疏松的金标准,≤2.5倍标准差即可诊断[4],但是有文献报道约50%的女性骨质疏松病人BMD值在世界卫生组织(WHO)规定的正常范围内,加之不同仪器检测的BMD值有一定差值,而且DXA为静态下测量,并不能反映骨代谢的动态变化过程,不利于临床早期发现及治疗后评估,具有一定局限性[7]。骨标志物作为反映骨代谢的血清学指标,因具有高敏感、高特异性、高稳定性特点,可弥补BMD的不足,因此已广泛地应用于骨质疏松症的诊断及药物疗效监测,临床中常用检测骨代谢标志物有:
3.1 骨形成标志物
3.1.1 总I型前胶原氨基端延长肽 即总I型前胶原N端前肽,成骨细胞合成Ⅰ型胶原纤维前首先合成前胶原,前胶原分子先被N端蛋白酶切除两端的前肽,然后由成骨细胞分泌到细胞外基质参与骨骼形成,I型前胶原N端前肽即是被N端蛋白酶切除两端的前肽,反映成骨细胞活性[8]。当成骨细胞活性增强时,前胶原合成增多,I型前胶原N端前肽在血液中的水平随之增高。
3.1.2 骨钙素 又称骨谷氨酰胺基蛋白,由成骨细胞特异性合成,合成以后大部分进入骨骼沉积在骨基质,少部分入血并快速分解,因其半衰期短,可直接反映即刻成骨细胞的活性与数量变化,成为新近骨形成理想指标。Vergnaud等[9]研究还表明BGP水平与老年女性髋部骨折呈负相关,Clemens等[10]研究发现其在类固醇激素导致的骨质疏松亦有一定作用。本研究结果显示:与对照组比较,骨质疏松组血清TP1NP、BGP水平明显减低,且与骨密度水平呈正相关,而对照组骨密度与骨形成标志物无明显相关性。因此,临床中可通过动态监测该标志物了解成骨细胞活性及骨形成情况,有利于早期发现骨形成能力下降,从而尽早干预以预防骨质疏松的发生。
3.2 骨吸收标志物 Ⅰ型胶原羧基端肽β特殊序列:由成熟Ⅰ型胶原降解产生,是反映破骨细胞活性,是敏感且特异的骨吸收指标。骨质疏松病人因骨吸收增强,I型胶原的降解也增多,其降解产生的片段也随之升高,因此通过检测β-CTX水平,可了解骨转换的程度[11]。本研究发现,骨质疏松人群血清β-CTX明显高于健康人群,差异有统计学意义,同时骨质疏松人群中该指标与骨密度呈负相关,骨吸收增加进一步导致骨密度下降。这一结论与骨吸收抑制剂治疗骨质疏松病人能取得一定疗效相符合。
3.3 与骨代谢相关激素 维生素D在维持钙磷平衡及骨矿化平衡中起着关键作用,活性维生素D是目前公认的监测维生素D水平的最好指标[12]。25-(OH)-D3在小肠促进肠钙结合蛋白及刷状缘中ATP酶的合成,增加肠道钙、磷吸收,在骨组织参与成骨细胞合成及分泌骨钙素,加速骨矿化促进骨形成。本文研究结果表明骨质疏松人群中活性维生素D水平明显低于正常人群,同时与骨密度呈正相关,差异有统计学意义,这与国内外研究结果一致[13-14]。
3.4 骨质疏松与血脂 血液中的脂肪具有沉积作用,当机体脂代谢或转运发生异常时,脂质会沉积于骨髓中,骨髓被脂肪填满从而导致骨折流式,同样,骨髓中成骨和成脂是相关的,当骨髓基质细胞向脂肪细胞的分化增多时,分化成骨细胞则受到抑制,从而影响骨代谢[15-16]。本研究中骨质疏松症组TC、TG 和 LDL-C明显高于对照组,HDL-C水平低于对照组,说明脂代谢障碍与骨质疏松症的发病有一定相关性,TC、TG 和 LDL-C可能是诱发或加重骨质疏松的危险因素,因此骨质疏松病人更应注意血脂的监测及治疗。
综上所述,骨质疏松病人骨标志物水平较正常人群有明显变化,可以较好地反映骨吸收及骨形成情况,比骨密度能更及时、敏感反映出骨代谢变化,因此血清骨标志物的检测有助于骨质疏松的早期诊断及治疗。同时在临床中应评估病人的整体情况,积极寻找骨质疏松的原因或危险因素,对于高脂血症的病人,即使骨密度检查正常,也应行骨标志物的检测并定期追踪,以便于早期防治,对于骨质疏松合并高脂血症的病人,积极纠正脂代谢异常亦有利于骨质疏松症的治疗。
[1] Cole ZA,Dennison EM,Cooper C.Osteoporosis epidemiology update[J]. Curr Rheumatol Rep,2008,10(2):92-96.
[2] 王亮,马远征,张妍,等.北京海淀地区中老年妇女骨质疏松性骨折情况调查研究[J].中国骨质疏松杂志,2016,22(5):580-582.
[3] 中国健康促进基金会骨质疏松防治中国白皮书编委会.年骨质疏松症中国白皮书[J].中华健康管理学杂志,2009,3(3):148-154.
[4] 中国老年学学会骨质疏松委员会.中国人骨质疏松症诊断标准专家共识(第三稿2014版)[J].中国骨质疏松杂志,2014(9):1007-1010.
[5] Kovacs CS,Ralston SH.Presentation and management of osteoporosis presenting in association with pregnancy or lactation[J].Osteoporos Int,2015,26(9):2223-2241.
[6] 蔡晓燕,董光富.脂代谢及血清骨钙素水平与骨质疏松症的相关性分析[J].中国骨质疏松杂志,2016,22(6):711-712.
[7] Nguyen ND,Eisman JA,Center JR,et al.Risk factors for fracture in nonosteoporotic men and women[J].J Clin Endocrinol Metab,2007,92:955-962.
[8] 谈志成,侨海龙, 白人骁,等.骨质疏松症与骨代谢生化测定指标[J].中国骨质疏松杂志,2006,12(1):89-93.
[9] Vergnaud P,Garnero P,Meunier PJ,et al .Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: The EPIDOS Study[J].J Clin Endocrinol Metab,1997,82:719-724.
[10] Clemens TL,Karsenty G.The osteoblast:an insulin target cell controlling glucose homeostasis[J].J Bone Miner Res,2001,26:677-680.
[11] 黎卓华,崔敏涛,吴丽川,等.3种骨标志物在绝经后妇女骨质疏松诊断中的研究[J].国际检验医学杂志,2014,35(7):914-915.
[12] Bischoff-Ferrari HA,Giovannucci E,Willett WC,et al.Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes[J].Am J Clin Nutr,2006,84(1):18-28.
[13] Nakamura K,Tsugawa N,Saito T,et al.Vitamin D status,bone mass,and bone metabolism in home-dwelling postmenopausal Japanese women: Yokogoshi Study[J].Bone,2008,42 (2):271-277.
[14] 周华,赵清, 谢念伶,等,重庆地区骨质疏松病人25-羟维生素D与骨代谢的相关性分析[J].国际检验医学杂志,2017,38(2):163-165.
[15] Wang PY,Wei B.Advance research of the relationship between lipid metabolic disturbance and Steroid-induced Avascular Necrosis of the Femoral Head[J].Shandong Medical Journal,2014,54(10):100-102.
[16] Li T,Cui L.Lipid metabolic disturbance and osteoporosis[J].Chinese Journal of Osteoporosis,2008,14(6):428-432.
山西省临汾市第二人民医院(山西临汾 041000),E-mail:315044390@qq.com
信息:张玲,曹艮元.骨代谢标志物、血脂水平与原发性骨质疏松症的相关性研究[J].中西医结合心脑血管病杂志,2017,15(19):2510-2512.
R681 R259
B
10.3969/j.issn.1672-1349.2017.19.048
1672-1349(2017)19-2510-03
2017-01-28)
(本文编辑 郭怀印)

