紫山药抗消化淀粉的制备及水解特性
李 涛 黄 群, 宋洪波, 王艺伟, 安凤平, 滕 慧(福建农林大学食品科学学院,福州 35000)(福建省特种淀粉品质科学与加工技术重点实验室,福州 35000)
紫山药抗消化淀粉的制备及水解特性
李 涛1黄 群1,2宋洪波1,2王艺伟1,2安凤平1,2滕 慧1
(福建农林大学食品科学学院1,福州 350002)(福建省特种淀粉品质科学与加工技术重点实验室2,福州 350002)
以酶解-压热法制备紫山药抗消化淀粉,考察了淀粉乳浓度、普鲁兰酶用量、酶解时间、压热时间对制备淀粉中抗消化淀粉含量的影响,通过正交试验和方差分析明确影响因素的重要性并优化工艺条件;比较分析了糊化淀粉、压热淀粉以及酶解-压热法制备淀粉的水解动力学。结果表明:酶解-压热法制备紫山药抗消化淀粉的含量随各因素水平的增加呈先增加后减小的趋势,优化的条件为:淀粉乳质量分数20%、普鲁兰酶用量8 U/g、酶解12 h、以120 ℃压热处理40 min 2次时,制备抗消化淀粉样品纯度为96.67%,其中抗消化淀粉含量为47.85%;水解特性研究表明:与糊化、压热法相比,酶解-压热法制备抗消化淀粉的水解率、水解指数与血糖指数均显著降低,具有更好的抗消化性。
紫山药 酶解 压热 抗消化淀粉 水解
紫山药(PurpleDioscoreaalataL),又称紫莳药、紫淮山药,为多年生藤本植物薯蓣(DioscoreaalataL)的块茎,紫红色肉质中富含色素[1]。我国南方地区广泛种植紫山药,具有滋肺益肾、健脾止泻、降压利肝等功效[2-3]。紫山药富含淀粉,约占生物总量的16%~20%,因此,开发利用紫山药淀粉具有重要意义。
Englyst等[4]和Berry等[5]发现,淀粉中存在一部分能抵抗酶水解的淀粉,将其命名为抗消化淀粉RS。因对淀粉分解酶有抗性,在一般蒸煮中不易受破坏,故可实现工业化生产并作为添加剂添加到传统食品中,商业价值高,前景广阔[6]。抗消化淀粉RS的制备方法主要有物理法、酶解法以及复合法等。采用压热、超声波、超高压、挤压、微波膨化、单酶酶解等传统的方法,虽然方法简单、处理时间短,但制备的产品抗消化淀粉含量低[7];采用压热-冷却处理与酶解法相结合的方法,可以明显提高抗消化淀粉RS含量。Zhao等[8]通过普鲁兰酶脱支处理压热糊化的玉米淀粉后,再以压热、冷却循环处理2次,RS质量分数可达32.4%;Chagam等[9]报道魔芋淀粉在压热、冷却处理前先经普鲁兰酶脱支处理,RS质量分数可达36.27%;Pramila等[10]研究表明马铃薯淀粉经普鲁兰酶脱支处理后压热、冷却可将RS质量分数提高到29.35%。目前,国内关于抗消化淀粉水解特性的研究甚少[11]。Rosida等[12]以生鲜紫山药块茎为原料,利用压热-冷却循环法制备抗消化淀粉并分析了其消化性,结果表明增加循环次数,可提高抗消化淀粉的抗消化性。
本研究以紫山药淀粉为原料,采用酶解-压热法制备抗消化淀粉,研究不同工艺条件对紫山药抗消化淀粉含量的影响及其水解特性,旨在为开发出具有较好消化抗性的淀粉提供参考。
1 材料与方法
1.1 材料与试剂
紫山药:品种为紫玉淮山,产自福建省三明市建宁县。普鲁兰酶(2 800 U/g):美国Sigma公司;D-葡萄糖检测试剂盒:爱尔兰Megazyme公司;柠檬酸、氯化钠、异抗坏血酸钠、无水乙醇、磷酸氢二钠、氢氧化钙均为国产分析纯。
1.2 仪器与设备
DHG-9003A型热风干燥箱:上海精宏试验设备有限公司;MJ-60BM01A美的搅拌机:广东美的生活电器制造有限公司;SYQ-DSX-280B型高压灭菌锅:上海申安医疗器械厂;UV-1100型紫外可见分光光度计:上海美谱达仪器有限公司;TDL-5-A型低速离心机:上海安亭科学仪器厂;THZ-82型水浴恒温振荡器:金坛市精达仪器制造有限公司。
1.3 方法
1.3.1 紫山药淀粉制备
紫山药淀粉的制备参考Jiang等[13]方法。
1.3.2 抗消化淀粉含量测定
样品中快速消化淀粉(RDS)、缓慢消化淀粉(SDS)、抗消化淀粉(RS)含量的测定采用Zeng等[16]的方法。
1.3.3 紫山药抗消化淀粉的制备
糊化法:参考Zeng等[14]的方法制备。
压热法:参考Asima等[15]的方法制备。
酶解-压热法:取10 g紫山药淀粉(干基),加磷酸缓冲液(0.2 mol/L,pH 5.0)配制一定浓度的淀粉乳,置于250 mL锥形瓶中,100 ℃糊化30 min,降温至58 ℃,加入一定量的普鲁兰酶,酶解一定的时间后,以100 ℃灭酶10 min;4 000 r/min离心15 min,去除上清液,向沉淀物加入去离子水,在高压灭菌锅中120 ℃处理一定时间,冷却到室温,4 ℃环境中放置24 h进行老化。将老化的样品再进行1次如前述条件的重复的压热-老化循环处理后,40 ℃烘干含水量10%以下,粉碎过100目筛。
单因素试验:以淀粉乳质量分数、普鲁兰酶用量、酶解时间、压热处理时间作为考察因素,各因素的水平为:淀粉乳质量分数为10%、15%、20%、25%、30%、35%,普鲁兰酶用量(以淀粉干基为基准)为2、4、6、8、10、12 U/g,酶解时间为6、8、10、12、14、16 h,压热处理时间5、10、20、30、40、60 min。按1.3.2的方法测定样品中抗消化淀粉含量,重复测定3次,取平均值。
正交试验:在单因素试验基础上,采用L9(34)正交表进行四因素三水平的正交试验,试验因素水平设计见表1。

表1 因素水平表
1.3.4 化学成分分析
样品中淀粉、蛋白质、脂肪、灰分和粗纤维含量的测定分别按照GB/T 5009.9—2008、GB/T 5009.5—2010、GB/T 5009.6—2003、GB/T 5009.4—2010和GB/T 5009.10—2003,重复测定3次,取其平均值。
1.3.5 水解特性测定1.3.5.1 水解率的测定
分别测定淀粉乳水解10、20、30、40、60、90、120、180 min时的葡萄糖含量。以水解样品中葡萄糖的含量占水解前样品中总淀粉质量百分比表示水解率:
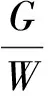
(1)
式中:HR为水解率/%;G为不同时间水解后的葡萄糖含量/mg;W为样品的质量/mg。
1.3.5.2 水解指数与血糖指数测定
采用Goni的体外消化动力学方法,模拟人体肠道体系[17]。淀粉水解曲线遵循一级反应方程C=C(1-e-kt),水解曲线下面积(Area under curve,AUC)按式(2)计算:
AUC=C(tf-t0)-{1-exp[-k(tf-t0)]}
(2)
式中:AUC为水解曲线面积;C∞为平衡浓度/%;k为反应动力学常数/min-1;tf为反应终止时间,180 min;t0为反应初始时间,0 min。
以白面包的水解曲线面积为标准,样品水解指数(HI)为样品水解曲线面积与白面包水解曲线积分面积(AUC)比值的百分数。样品血糖指数(GI)按式(3)[17]计算而得:
GI=39.71+0.549HI
(3)
1.3.6 统计分析
应用DPS V 7.65软件分析差异显著性(P<0.05),使用Microsoft Excel 2003进行数据统计分析,采用OriginPro 8.0软件绘制水解率曲线图。
2 结果与分析
2.1不同因素对酶解-压热法制备紫山药抗消化淀粉的影响
2.1.1 淀粉乳质量分数的影响
测定不同淀粉乳浓度对酶解-压热法制备紫山药抗消化淀粉的影响,结果见表2。
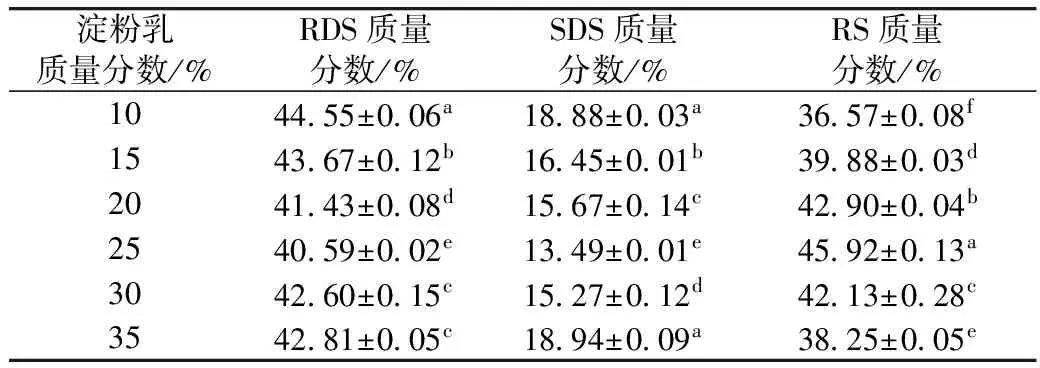
表2 淀粉乳浓度对酶解-压热法制备紫山药抗消化淀粉的影响
注:数据表示为平均值±标准差(n=3);同一列肩标字母中,相同表示差异不显著(P>0.05),不同表示差异显著(P<0.05),余同。
由表2可知,随着淀粉乳浓度的增大,RS含量呈现出先增大后减小的趋势,而RDS、SDS含量则先降低后升高。当淀粉乳质量分数为25%时,RS质量分数达到最大45.92%,这说明淀粉乳浓度过高或过低都不利于RS的形成。吴红引等[18]研究压热-酶解法制备碎米抗消化淀粉亦得出相似的结论。这可能是因为淀粉乳浓度低时,直链淀粉分子间接触少不易形成抗消化淀粉结晶,大部分形成了不完美的结晶[19],从而使RDS、SDS含量提高;淀粉乳浓度过大时,由于体系的黏度过大而造成淀粉分子不易移动而阻碍直链淀粉结晶的形成,另外其支链淀粉α-1,6-糖苷键的接近也会阻碍淀粉链的运动,从而阻挡其形成双螺旋结构,RS含量则显著降低[20]。
2.1.2 普鲁兰酶用量的影响
测定不同普鲁兰酶用量对酶解-压热法制备紫山药抗消化淀粉的影响,结果见表3。

表3 普鲁兰酶用量对酶解-压热法制备紫山药抗消化淀粉含量的影响
由表3可以看出,RDS、SDS含量随普鲁兰酶用量的升高呈先减小后增加的趋势,RS含量则表现为先增大后减小。当普鲁兰酶用量为10 U/g时,RS含量达到最高,相对于其他普鲁兰酶用量有显著差异。Wu等[21]研究酶解-压热法制备玉米抗消化淀粉,结果表明在普鲁兰酶用量为10 U/g时,制备样品的抗消化效果最佳,这与本研究所得的结论一致。由于当酶用量过大时,会使淀粉分子脱支过度形成短的直链淀粉分子链及低聚糖,无法形成RS,结晶程度降低从而使RDS与SDS含量增大;而当酶用量不足时,淀粉分子脱支不完全,支链淀粉的支叉结构阻碍直链淀粉分子互相接近,降低抗消化淀粉的含量[22]。
2.1.3 酶解时间的影响
测定不同酶解时间对酶解-压热法制备紫山药抗消化淀粉的影响,结果见表4。
由表4可知,RS含量随着酶解时间的升高呈先增加后减小的趋势,而RDS、SDS则相反。在不同酶解时间下RDS、SDS和RS含量差异显著,其中酶解时间为12 h,紫山药抗消化淀粉含量达到最高。淀粉的结晶过程和双螺旋结构形成过程中均需要合适的链长,脱支时间过短,普鲁兰酶作用不充分,可最大限度得到RDS、SDS[23];脱支时间过长,淀粉脱支过度,也会降低RS的含量,而脱支降解产生的大量短直链淀粉在后续缓慢冷却过程中促进了RDS、SDS的形成,即太短或太长的分子链均不利于RS的生成[24]。
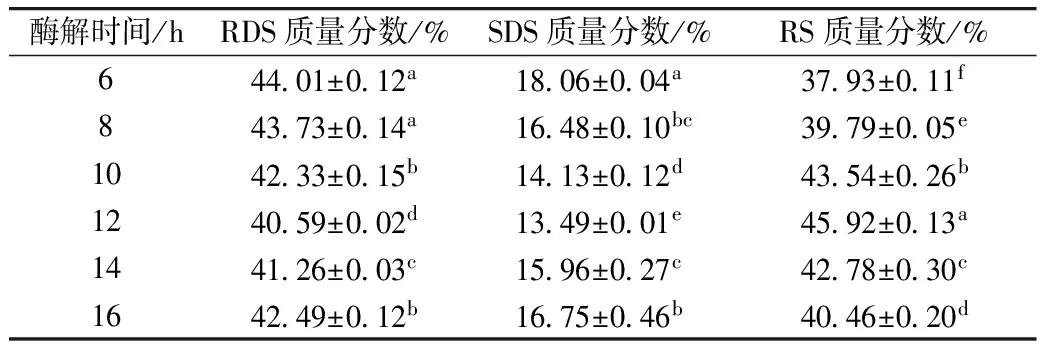
表4 酶解时间对酶解-压热法制备紫山药抗消化淀粉含量的影响
2.1.4 压热时间的影响
测定不同压热时间对酶解-压热法制备紫山药抗消化淀粉的影响,结果见表5。
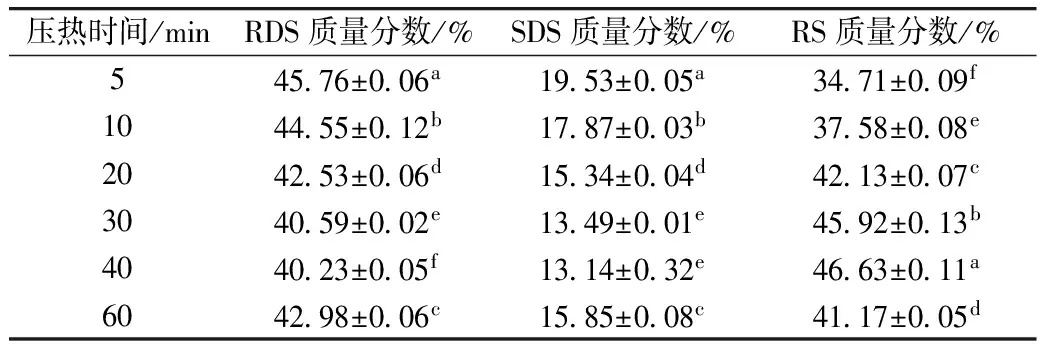
表5 压热时间对酶解-压热法制备紫山药抗消化淀粉含量的影响
由表5可知,随着压热时间的增加,RS含量逐渐增加后减小,与吴津蓉等[25]制备小麦抗消化淀粉时的变化趋势一致。当压热时间为40 min时,紫山药抗消化淀粉含量达到最高。压热时间过短时,直链淀粉分子不易接近或没有完全游离出来;压热时间过长时,淀粉分子会过度降解,形成短直链淀粉,这些短直链淀粉分子运动比较激烈,较难聚集形成晶体,不利于抗消化淀粉的形成或形成的抗消化淀粉抗酶解性不强,使其含量下降[26]。故当压热时间大于40 min时,RS含量呈下降趋势。随着压热处理时间的增加会造成淀粉分子之间形成致密的晶体,表现为RS含量增加,过长的压热时间使淀粉分子降解,产生的一些小分子量的短直链淀粉分子不易形成牢固的晶体而使RDS、SDS含量增加。
2.1.5 正交试验
根据表6确定试验方案,以RS的含量为评价指标进行正交试验,试验数据如表6所示。
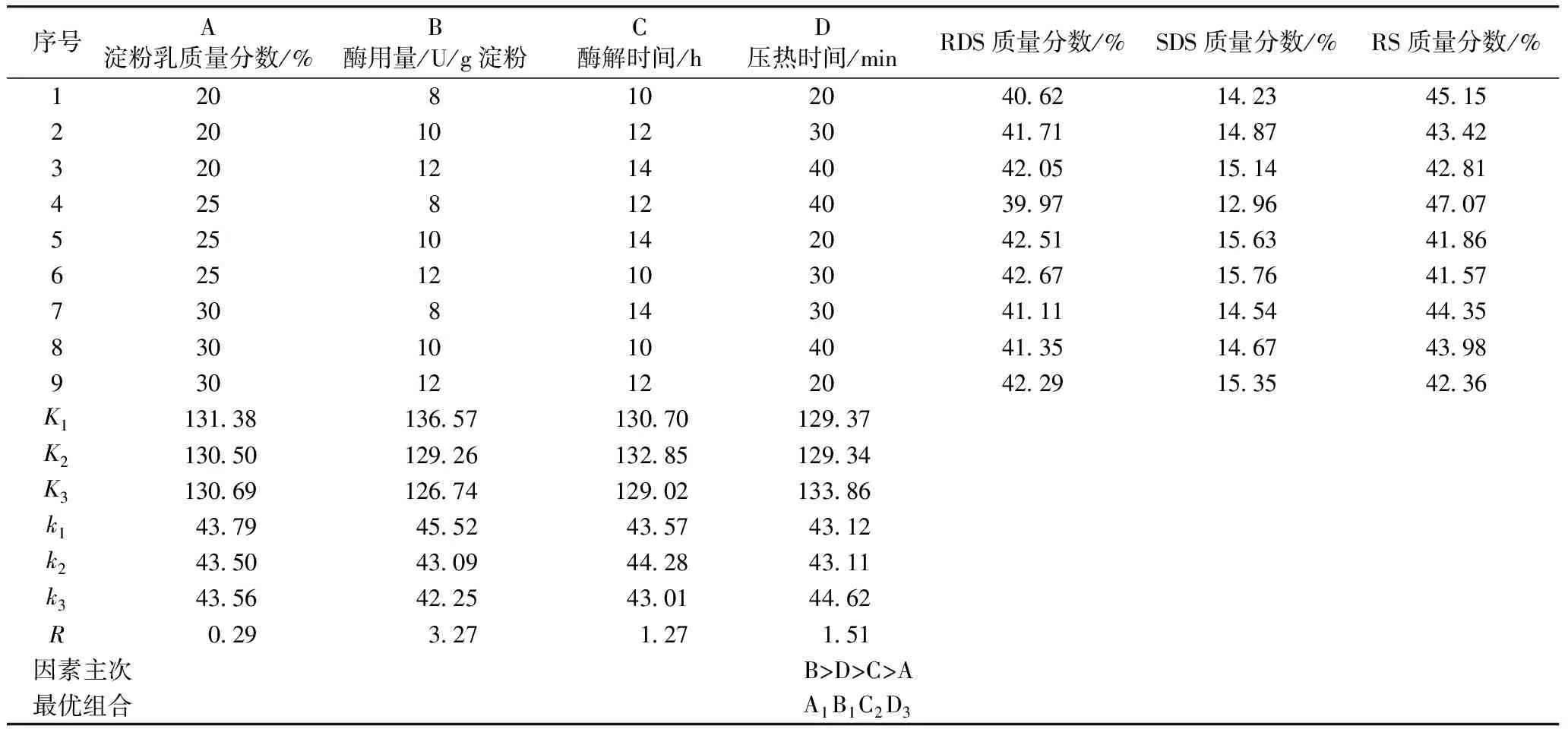
表6 正交试验结果
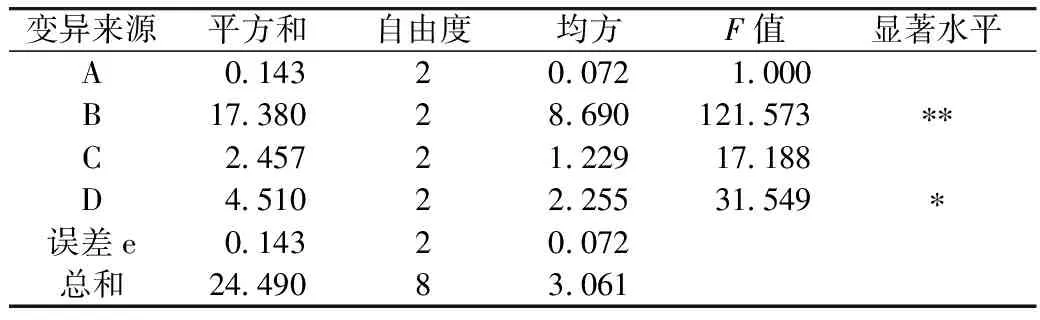
表7 正交试验方差分析表
注:F0.05(2,2)=19.00;F0.01(2,2)=99.00;**、*分别表示差异达到0.01和0.05显著水平。
由表6可以看出,紫山药抗消化淀粉最高含量可达到47.07%。影响酶解-压热法制备紫山药抗消化淀粉的反应条件中各因素主次为:B(酶用量)>D(压热时间)>C(酶解时间)>A(淀粉乳质量分数),最佳因素组合为A1B1C2D3,即淀粉乳质量分数20%、酶用量8 U/g淀粉、酶解时间12 h、压热时间40 min。由表7可知,普鲁兰酶用量的影响达到极显著水平,压热时间的影响达到显著水平,而酶解时间和淀粉乳浓度影响不显著。
将优化条件的试验号设置为10号,并与正交试验中RS含量最高的试验4号作对照。由表8可知,正交优化条件下10号试验较4号所得的RS含量更高,证明此参数组合确为最佳工艺。
2.2 不同方法制备紫山药抗消化淀粉品质比较
2.2.1 主要成分
紫山药原淀粉以及糊化淀粉、压热淀粉和优化的酶解-压热条件下制备的抗消化淀粉主要成分如表9所示。
由表9可知,各淀粉样品中的淀粉含量均大于96.67%,差异不显著,说明制备的淀粉样品纯度高。酶解-压热法制备抗消化淀粉中的蛋白质含量显著高于原淀粉、糊化淀粉与压热淀粉中的,这是由于经淀粉酶酶解,淀粉酶进入淀粉颗粒内部,可能部分淀粉酶残余在其中[27]。原淀粉经改性处理后,脂肪、灰分、粗纤维含量有所降低,但差异不显著,这与Rosida等[12]研究压热处理紫山药淀粉得出的结果一致。热处理改变了淀粉的物化特性,大分子物质遭到破坏,从而降低样品中蛋白质和脂肪的含量,但这种改变是轻微的[28]。

表8 正交试验的验证
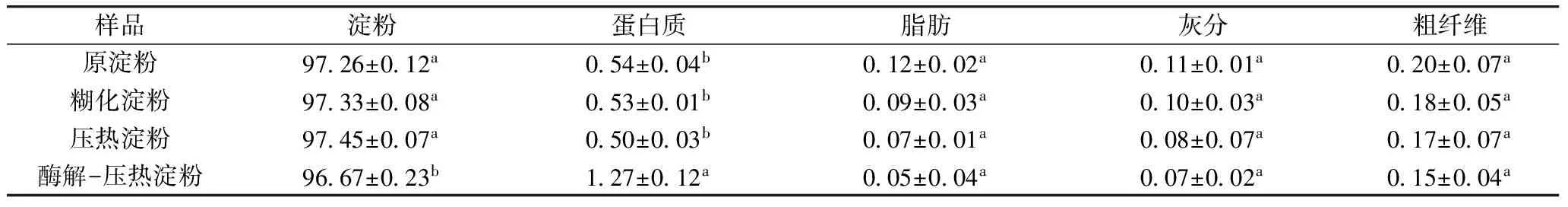
表9 紫山药淀粉的主要化学成分/g/100 g干物质
2.2.2 内在品质
紫山药原淀粉以及糊化淀粉、压热淀粉和优化的酶解-压热条件下制备的抗消化淀粉品质分析见表10。
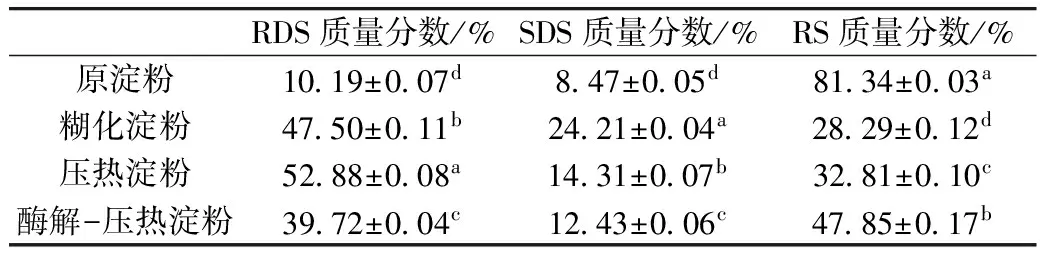
表10 不同方法制备紫山药抗消化淀粉品质分析
由表10可知,紫山药淀粉经不同方法处理后快速消化淀粉(RDS)、缓慢消化淀粉(SDS)和抗消化淀粉(RS)含量差异显著。具体表现为原淀粉在糊化、压热处理后,RDS、SDS含量显著增加,而RS含量则明显降低;与糊化、压热淀粉相比,酶解-压热淀粉中RDS、SDS含量显著降低,RS含量则明显增加。由于原淀粉颗粒大、表面光滑且致密和结晶度大等原因,导致RDS、SDS含量较少,而RS含量很高;热处理使原淀粉的颗粒破裂,淀粉链段部分裂解,淀粉内部的有序程度变小,无定型区域增大,淀粉更易与酶结合而发生水解,从而RDS、SDS含量显著增加[29]。原淀粉经酶解-压热处理后,产生大量游离的直链淀粉,直链淀粉间通过氢键形成结晶度较高的晶体,对酶具有高度的抗性,因此采用酶解-压热法制备紫山药抗消化淀粉的品质最佳。
2.3 水解特性
2.3.1 水解率
不同淀粉的体外水解速率曲线如图1所示。在0~60 min的时间内水解率快速升高,60~180 min水解率缓慢增加并趋于平衡值。水解至180 min时,糊化淀粉的水解率为72.95%,压热淀粉的水解率为69.04%,而酶解-压热后的淀粉水解程度较低,为52.85%,而原淀粉的水解率仅为19.24%,表明水解率与RS含量呈负相关。由于原淀粉颗粒大、结构完整且致密、结晶度高,酶不易与淀粉结合而发生水解[30],因此水解率较低;原淀粉经热处理后,颗粒遭到破坏,结晶度降低,结构松弛,使得淀粉更易与酶结合,水解率较高;而淀粉经普鲁兰酶酶解后生成大量的直链淀粉,压热老化后重结晶具有较高的抗消化性,因此水解率较糊化、压热淀粉显著降低。
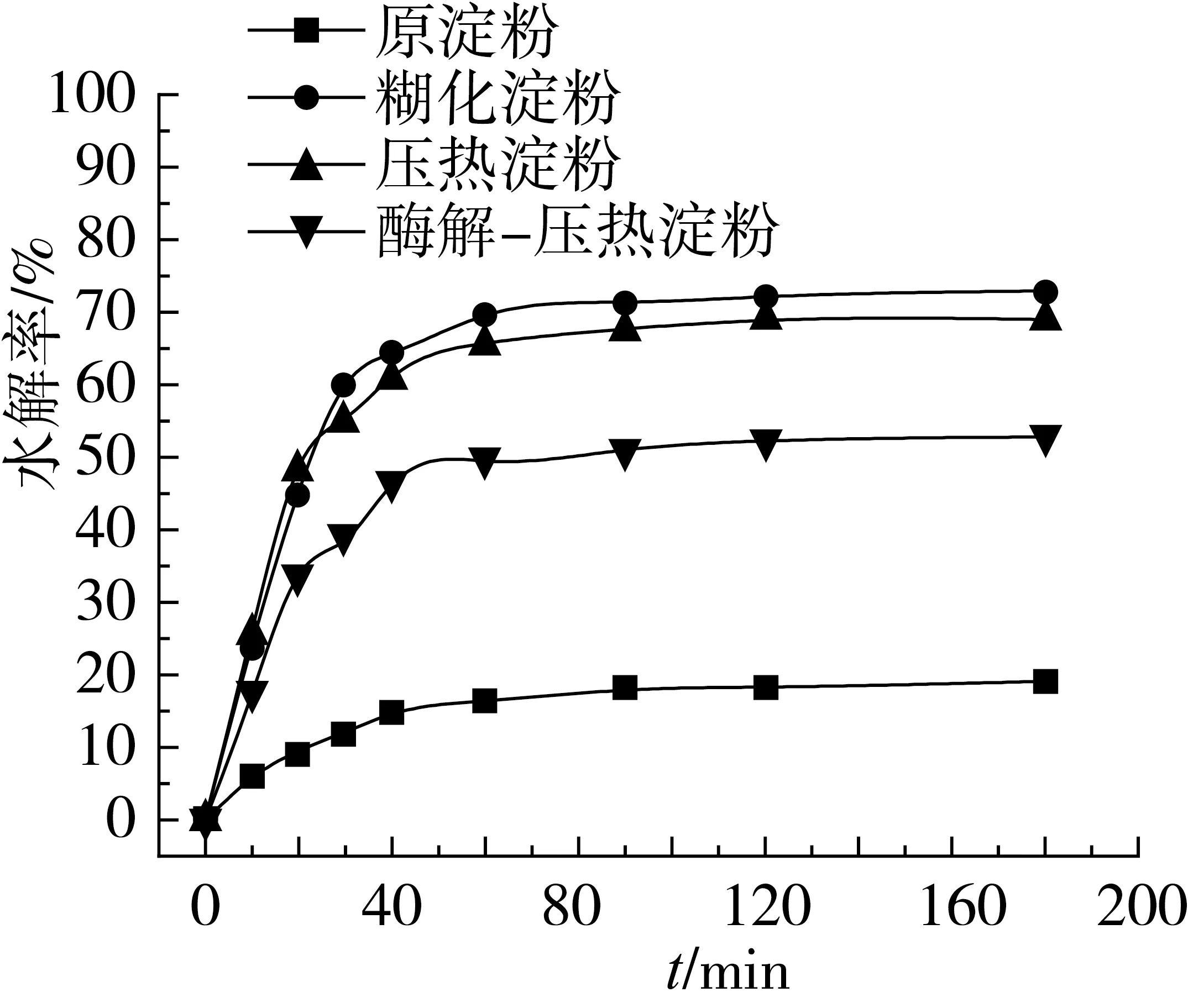
图1 不同淀粉的体外水解动力学
2.3.2 水解指数与血糖指数
如表11所示,糊化淀粉的水解平衡浓度最高,不同淀粉样品之间平衡浓度差异显著,原淀粉平衡为18.47%,而酶解-压热淀粉平衡浓度较糊化、压热淀粉显著降低。动力学常数K大小反映淀粉体外消化速度快慢。原淀粉的体外消化速度最慢,糊化淀粉、压热淀粉和酶解-压热淀粉的水解动力学常数K之间的差异不显著,水解速度均显著大于原淀粉的。淀粉经糊化处理后,较易溶于水中,所以容易被酶作用,到达最大水解率的时间相应缩短;而经压热处理的淀粉,颗粒表面结构更加疏松,更易被淀粉酶结合利用,达到最大水解率的时间也相应缩短[31]。淀粉的水解指数与血糖指数是反应淀粉消化速率的主要指标,表中各淀粉的水解指数HI及血糖指数GI之间的差异均显著。与糊化淀粉相比,压热淀粉和酶解-压热淀粉的水解指数及血糖指数显著降低,其中以酶解-压热淀粉最低,分别为52.84%和68.72%,由此可见,酶解-压热淀粉具有最佳的抗消化性。
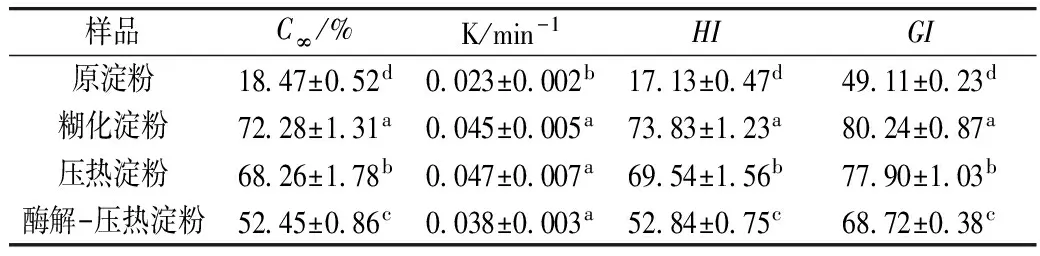
表11 紫山药抗消化淀粉水解动力学平衡浓度(C∞)、动力学常数(K)、水解指数(HI)及血糖指数(GI)
3 结论
3.1 采用酶解-压热法制备紫山药抗消化淀粉时,普鲁兰酶用量、压热处理时间对抗消化淀粉得率的影响分别达到极显著和显著水平,酶解时间和淀粉乳浓度影响不显著。优化的工艺参数为:淀粉乳质量分数20%、酶用量8 U/g淀粉、酶解时间12 h、压热(120 ℃)处理40 min;经过压热处理2次,制备的紫山药抗消化淀粉得率为47.85%。
3.2 与糊化法、压热法相比酶解-压热法制备的抗消化淀粉的水解速度相当,但水解率显著降低,达52.45%,水解指数和血糖指数显著降低,分别为52.84%和68.72%,因此,酶解-压热制备的抗消化淀粉具有良好的抗消化性。
[1]Guo X X,Sha X H,Cai S B,et al.Antiglycative and antioxidative properties of ethyl acetate fraction of Chinese purple yam(DioscoreaalataL)extracts[J].Food Science and Technology Research,2015,21(4),563-571
[2]Ma C,Wang W,Chen Y Y,et al.Neuroprotective and antioxidant activity of compounds from the aerial parts ofdioscoreaopposite[J].Journal of Natural Products,2005,68(8):1259-1261
[3]Yin J M,Yan R X,Zhang P T,et al.Anthocyanin accumulation rate and the biosynthesis related gene expression inDioscoreaalata[J].Biologia Plantarum,2015,59(2):325-330
[4]Englyst H N,Trowell H,Cumming J H,et al.Dietary fiber and resistant starch[J].American Journal of Clinical Nutrition,1987,46(6):873-874
[5]Berry C S.Resistant starch:formation and measurement of starch that survives exhaustive degesting with amylolitic enzyme during the determination of dietary fiber[J].Journal of Cereal Science,1986,4(4):301-314
[6]赵凯.淀粉非化学改性技术[M].北京:化学工业出版社,2008:99-100
Zhao K.Non chemical modification technology of starch[M].Beijing:Chemical Industry Press,2008:99-100
[7]李宝瑜,郑宝东,曾绍校,等.压热-酶法制备紫薯抗性淀粉的工艺优化[J].热带作物学报,2015,36(7):1330-1335
Li B Y,Zheng B D,Zeng S X,et al.Preparation of resistant starch from purple sweet potato by autoclave combined with enzyme method[J].Chinese Journal of Tropical Crops,2015,36(7):1330-1335
[8]Zhao X H,Lin Y.The impact of coupled acid or pullulanase debranching on the formation of resistant starch from maize starch with autoclaving-cooling cycles[J].European Food Research and Technology,2009,230:179-184
[9]Chagam K R,Sundaramoorthy H,Noor M A,et al.Preparation and characterization of resistant starch III from elephant foot yam(Amorphophalluspaeonifolius)starch[J].Food Chemistry,2014,155:38-44
[10]Chagam K R,Pramila S,Sundaramoorthy H.Pasting,textural and thermal properties of resistant starch prepared from potato(Solanum tuberosum)starch using pullulanase enzyme[J].Journal of Food Science and Technology,2015,52(3):1594-1601
[11]唐晓婷,刘骞,孔保华,等.压热-冷却循环工艺对淀粉理化特性及消化动力学的影响[J].中国食品学报,2016,16(4):113-121
Tang X T,Liu Q,Kong B H,et al.The effect of autoclaving-cooling treatment on physicochemical properti-es and digestion kinetics of starch[J].Journal of Chinese Institute of Food Science and Technology,2016,16(4):113-121
[12]Rosida,Harijono,Estiasih T,et al.Physicochemical properties and starch digestibility of autoclaved-cooled water yam(DioscoreaalataL.)flour[J].International Journal of Food Properties,2015,19(8):1659-1670
[13]Jiang Q,Gao W,Shi Y,et al.Physicochemical properties and in vitro digestion of starches from differentDioscoreaplants[J].Food Hydrocolloids,2013,32(2):432-439
[14]Zeng H,Chen H Q,Kong F S,et al.Structure and digestibility of debranched and repeatedly crystallized waxy rice starch[J].Food Chemistry,2015,187(15):348-353
[15]Asima S,Farooq A M,Adil G,et al.In-vitro digestibility,rheology,structure,and functionality of RS3 from oat starch[J].Food Chemistry,2016,212:749-758
[16]Zeng F,Zhu S M,Chen F Q,et al.Effect of different drying methods on the structure and digestibility of short chain amylose crystals[J].Food Hydrocolloids,2016,52:721-731
[17]Goni I,Alonso A G,Calixto F S.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437
[18]吴红引,王泽南,张秋子,等.压热-酶法制备碎米抗性淀粉的工艺及其结构特性的研究[J].现代食品科技,2011,27(2):166-169
Wu H Y,Wang Z N,Zhang Q Z,et al.Enzymatic pressure-heating preparation of broken rice resistant starch and its structural properties[J].Modern Food Science and Technology,2011,27(2):166-169
[19]王萍,陈磊,曹建伟.大米缓慢消化淀粉的制备[J].中国粮油学报,2007,22(3):62-64
Wang P,Chen L,Cao J W.Preparation of slowly digestible starch from rice[J].Journal of the Chinese Cereals and Oils Association,2007,22(3):62-64
[20]邬应龙,王瑶.抗性淀粉的结构及生理功能研究[J].中国粮油学报,2009,23(3):63-72
Wu Y L,Wang Y.Studies on structure of resistant starch[J].Journal of the Chinese Cereals and Oils Association,2009,23(3):63-72
[21]Wu S J,Chen H Q,Tong Q Y,et al.Preparation of maltotriose by hydrolyzing of pullulan with pullulanase[J].European Food Research and Technology,2009,229(5):821-824
[22]张晓,任清.压热酶脱支重结晶法制备甜荞抗性淀粉的工艺优化及颗粒形貌[J].食品科学,2013,34(8):64-69
Zhang X,Ren Q.Optimization of reaction conditions for buckwheat resistant starch preparation by autoclaving enzymatic debranching recrystallization and its granular morphology[J].Food science,2013,34(8):64-69
[23]Guraya H S,James C,Champagne E T.Effect of enzyme concentration and storage temperature on the formation of slowly digestible starch from cooked disbranched rice starch[J].Starch-Stärke,2001,53(3-4):131-139
[24]Zhang H X,Jin Z Y.Preparation of resistant starch by hydrolysis of maize starch with pullulanase[J].Carbo-hydrate Polymers,2011,83:865-867
[25]吴津蓉,党建磊.压热-酶法提高小麦中抗性淀粉及其在蛋糕中应用研究[J].粮食与油脂,2016,29(2):38-41
Wu J R,Dang J L.Study on improvement of resistant starch from wheat powders by autoclaving-qnzyme methods and it’s application on cake-making[J].Grain and Oil,2016,29(2):38-41
[26]杨晓惠,潘元风,刘以娟,等.不同压热条件对木薯抗性淀粉制备的影响[J].食品与发酵工业,2010,36(11):58-62
Yang X H,Pan Y F,Liu Y J,et al.Effect of autoclaving and steaming processing on the formation of cassava resistant[J].Food and Fermentation Industries,2010,36(11):58-62
[27]汪颖.莲子抗性淀粉制备、性质及其对双歧杆菌增殖效应的研究[D].福州:福建农林大学,2013
Wang Ying.Preparation and properties of Lotus seeds resistant starch,and its proliferation effects onBifidobacteriumadolescence[D].Fuzhou:Fujian Agriculture and Forestry University,2013
[28]Sugiyono S,Pratiwi R,Faridah D N.Arrowroot(MaranthaArundinacea)starch modification through autoclaving-cooling treatment to produce resistant starch type III[J].Jurnal Teknologi dan Industri Pangan,2010,20(1):17-24
[29]贺永朝,吴枭锜,宋洪波,等.高压均质改性淮山药淀粉及其消化性的研究[J].现代食品科技,2016,32(4):227-233
He Y Z,Wu X Q,Song H B,et al.Effect of high-pressure homogenization on the properties and digestibility ofDiscoreaopposita starch[J].Modern Food Science and Technology,2016,32(4):227-233
[30]Hoover R,Sosulski F.Studies on the functional characteristics and digestibility of starches from phaseolus vulgaris biotypes[J].Starch-Stärke,1985,37(6):181-191
[31]赵娜.阴米淀粉的理化性质、体外消化性以及老化动力学研究[D].武汉:华中农业大学,2010
Zhao N.Study on the physicochemical properties,in vitro digestibility and degradation kinetics of starch separated fromyinmi[D].Wuhan:Huazhong Agricultural University,2010.
Preparation of Purple Yam Resistant Starch and Its Hydrolysis Properties
Li Tao1Huang Qun1,2Song Hongbo1,2Wang Yiwei1,2An Fengping1,2Teng Hui1
(College of Food Science,Fujian Agriculture and Forestry University1,Fuzhou 350002)(Fujian Provincial Key Laboratory of Quality Science and Processing Technology in Special Starch2,Fuzhou 350002)
The effect of starch concentration,dosage of pullulanase,enzyme digestion time and autoclaving time on the yield of purple yam resistant starch prepared by enzyme-autoclaving method were studied and the importance of influence factors and process conditions were optimized through orthogonal tests and variance analysis.The hydrolysis kinetics of resistant starch produced by gelatinate,autoclave and enzyme-autoclaving method were compared and analyzed.The results showed that the content of resistant starch increased first and then decreased with the increase of the factor levels.The optimum preparation conditions of purple yam resistant starch were starch concentration of 20%,pullulanase dosage of 8 U/g,enzyme digestion time of 12 h,two autoclaving-cooling cycles(120 ℃/40 min).Purity,yield of resistant starch were 96.67% and 47.85%,respectively.Hydrolysis properties experiments showed that the hydrolysis rate,hydrolysis index and estimated glycemic index of resistant starch prepared by enzyme-autoclaving method significantly decreased and had better digestion resistibility compared to gelatinized and autoclaved starches.
purple yam,enzymolysis,autoclaving,resistant starch,hydrolysis
TS231
A
1003-0174(2017)09-0160-07
福建省星火计划(2014S0001),福建农林大学高水平大学建设项目(612014042)
2016-10-14
李涛,男,1992年出生,硕士,粮食、油脂及植物蛋白工程
宋洪波,男,1966年出生,教授,食品科学与工程

