盐胁迫下泛菌属内生细菌对杂交狼尾草发芽及生理的影响
傅 蕾,李 霞,高 璐,蒋建雄,孙建中
(江苏大学生物质能源研究所,江苏大学环境与安全工程学院, 国家能源非粮生物质原料研发中心华东分中心,江苏 镇江 212013)
盐胁迫下泛菌属内生细菌对杂交狼尾草发芽及生理的影响
傅 蕾,李 霞,高 璐,蒋建雄,孙建中
(江苏大学生物质能源研究所,江苏大学环境与安全工程学院, 国家能源非粮生物质原料研发中心华东分中心,江苏 镇江 212013)
内生细菌作为一种宝贵的天然微生物资源,在植物防病、杀虫、促生、耐盐及耐干旱能力等方面具有广阔的应用前景。本研究分析了泛菌属内生细菌(Pantoeasp.)PP04对不同盐浓度胁迫下杂交狼尾草(Pennisetumamericanum×P.purpureum)种子萌发及幼苗生长的影响。结果表明,该内生细菌在低(100 mmol·L-1)、中(200 mmol·L-1)度盐浓度下,对杂交狼尾草种子的萌发率、发芽指数及胚芽长度都有明显增益作用,增幅分别达10.75%、28.57%和300%。进一步研究发现,在不同浓度的盐胁迫下,内生细菌PP04通过诱导杂交狼尾草不同的抗氧化保护酶活性,从而减少膜脂过氧化作用,降低丙二醛(MDA)的含量。在低、中浓度盐胁迫下,PP04能显著提高杂交狼尾草超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸酶(APX)的活性。其中SOD和POD活性在低盐胁迫下增幅最高,可达64.17%和73.14%;而CAT和APX酶活性在高盐(300 mmol·L-1)胁迫下增幅最大,可达160.57%和73.38%。说明该内生细菌菌株可通过缓解氧化胁迫对植物造成的损伤,显著提高植物对盐胁迫的耐受性,具有良好的开发应用前景。
内生细菌;杂交狼尾草;盐胁迫;种子萌发;幼苗生长;氧化胁迫
杂交狼尾草(Pennisetumamericanum×P.purpureum)属多年生草本C4植物,它是以象草(Pennisetumpurpureum)为父本,美洲狼尾草(Pennisetumamericanum)为母本育成的杂交种。杂交狼尾草杂交优势明显,具有高效的光合作用,较高的纤维素、半纤维素含量和生物量,较强的抗逆性等优良性状。作为新型能源作物,杂交狼尾草具有良好的开发和应用潜力。同时,杂交狼尾草也作为一种优质的动物饲料而被广泛种植[1-3]。随着我国经济的快速发展,土地资源缺失的矛盾不断加剧,盐碱地、荒地、贫瘠地等边际性土地利用价值受到人们越来越多的重视,并逐渐被开发成为一些耐盐性植物的栽培用地,以期实现沿海滩涂盐碱地改造和多元化利用[4]。目前,虽有研究表明,杂交狼尾草具有一定的耐盐能力,其耐盐阈值可达到100 mmol·L-1,但若继续升高盐浓度,极易发生严重的毒害作用,甚至无法继续生长[5]。因此,如何增强杂交狼尾草在盐碱地土壤环境下的生存能力,提高其耐盐性,增加其生物产量,对杂交狼尾草作为能源植物和动物饲料的产业化种植具有十分重要的现实意义,已逐渐成为杂交狼尾草研究的热点之一。
植物内生细菌广泛存在于植物的组织或器官中,与植物在长期共同进化过程中形成了密切的互惠共生关系。内生细菌作为一种宝贵的天然微生物资源,在宿主防病、杀虫、促生、耐盐及耐干旱等能力提升方面也得了到国内外学者的广泛关注[6-7]。目前,国内外的科研工作者已经筛选出促进水稻(Oryzasativa)、玉米(Zeamays)、小麦(Triticumaestivum)、甘蔗(Saccharumofficinarum)、苹果(Maluspumila)、柑橘(Citrusreticulata)、高丛蓝莓(Vacciniumcorymbosum)、桑葚(Morusalba)和杏(Armeniacavulgaris)生长,并提高其产量的根际内生菌,它们在正常或胁迫条件下均能显著促进植物的健康生长,提高其产量和耐盐能力[8-10]。因此,利用植物内生菌的独特功能及与植物的相互作用,有可能提高杂交狼尾草植物对盐胁迫的耐受能力及生物产量。同时,在盐碱土改良与植物生态修复方面,内生菌也可能具有一定的应用潜力。大量研究还表明,植物内生细菌可以显著提高植物在逆境条件下的适应能力,包括抗病虫害、抗干旱以及抗盐胁迫的多种优良特性[11-14],这些内生菌的研究结果与优良特性正受到越来越多科学家的密切关注,成为近年来的研究热点方向之一。
已有研究从象草根部成功筛选到了大量内生细菌菌株,完成了初步鉴定并研究了其中4种优良菌株对杂交狼尾草的促生机制[15]。其中,泛菌属内生细菌(Pantoeasp.)PP04在100 mmol·L-1盐胁迫下对杂交狼尾草具有明显的促生作用与效果,但是,内生菌增强耐盐性的机制仍未有明确的结论。研究PP04对植物体内抗氧化酶活性的影响和作用机制,是解析内生菌提高植物耐盐能力的一项重要基础研究。因此,本研究试图明确该内生细菌在盐胁迫条件下对杂交狼尾草种子萌发、幼苗的生长和抗氧化酶活性的影响机制,阐明内生菌是如何帮助杂交狼尾草缓解逆境下的氧化胁迫,以期为有益内生细菌和杂交狼尾草在盐碱地产业化开发和推广中的应用提供理论基础。
1 材料和方法
1.1试验材料
杂交狼尾草种子由江苏省农科院畜牧研究所提供,内生菌为泛菌属细菌Pantoeasp.,菌株编号PP04,分离自象草根部,保存于江苏大学生物质能源研究所-70 ℃冰箱[15]。
1.2试验方法
1.2.1菌液制备 取出保存在-70 ℃冰箱中的PP04菌株,在LB平板上划线,放置于30 ℃恒温培养箱中培养24 h,挑取单菌落于装有1 mL 液体LB培养基的EP管中,30 ℃下200 r·min-1震荡培养10 h,将活化的菌液按照1∶100的比例倒入100 mL的液体培养基中,30 ℃下200 r·min-1培养至对数期(OD600=1.0,106cfu·mL-1),将菌悬液倒入灭菌的离心管中,4 ℃下4 500 r·min-1离心10 min,用吸水纸吸干残余的培养基,并用无菌水及NaCl溶液重悬,配制成菌体重悬液(OD600=1.0)待用。
1.2.2种子萌发及生长 种子的萌发及生长试验,挑选无破损、大小一致的杂交狼尾草种子,用0.5%的次氯酸钠消毒10 min,蒸馏水冲洗3~5次,用滤纸吸干附着水。设置对照组(E-,未添加内生细菌)和试验组(E+,添加内生细菌),并分别设置0(无盐)、100 mmol·L-1(低盐)、200 mmol·L-1(中盐)、300 mmol·L-1(高盐)共4个NaCl浓度梯度,将3层滤纸作为发芽床置于直径为12 cm的培养皿中,E-组每皿用5 mL 4种浓度的盐溶液润湿滤纸,E+处理组每皿用5 mL相应浓度的盐溶液配制的菌体重悬液润湿滤纸。将大小基本一致的种子均匀放置在湿润的滤纸上,每皿20粒。每个处理设置4个重复。每天加入适量蒸馏水和盐水以保持滤纸的湿度。从种子置床之后的第2天开始观察,以胚根长0.2 cm作为发芽标准,每日统计萌发种子数,至第6天,每个处理随机选5株测其胚芽长度。
侵染3 d后,每个处理随机取萌发的种子3粒,进行内生菌菌株的回收及分子鉴定,以确定内生菌侵染到种子内部。取出侵染后种子,用0.5%的次氯酸钠消毒10 min,蒸馏水冲洗3~5次,置于无菌吸水纸上,吸干残留的水分;将种子置于无菌的研钵中,加入适量的石英砂研磨,转移至适量的PBS缓冲液中;取100 μL研磨液涂布于LB固体培养基上;30 ℃下培养48 h。根据每个培养基上生长的菌落数,计算每克鲜重组织中的细菌数(cfu·g-1)。随机挑取单菌落进行16S rDNA分子鉴定[16]。
1.2.3内生细菌侵染及盐胁迫处理 首先挑选饱满的杂交狼尾草种子浸泡在蒸馏水中24 h,然后将种子单层、分散地铺在浓度为1.5%的琼脂培养基上,于28 ℃黑暗条件下催芽24 h。待种子开始露白后,再将其种植在放有浮板的一次性纸杯内,用Hoagland营养液于光照培养箱内培养(白天26 ℃,晚上22 ℃,光照时间为16 h,光照强度为4 000 lx)10 d。待植物幼苗长至二叶一心期时进行内生菌和盐胁迫处理,选取长势一致的杂交狼尾草幼苗分为两组:实验组(E+)将内生菌液加入杂交狼尾草Hoagland营养液中,对照组(E-)则不加菌液。侵染3 d后,每个处理随机取幼苗3株,进行内生菌菌株的回收及分子鉴定,以确定内生菌成功侵染到幼苗内(方法同1.2.2)。两组同时用0、100、200、300 mmol·L-14个NaCl浓度处理,每个处理设6个重复。接下来每隔4 d添加一次50 mL对应盐溶液,保持持续的盐胁迫。培养21 d后,对杂交狼尾草幼苗的丙二醛含量和抗氧化酶活性进行测定。
1.3测定项目与方法
1.3.1种子发芽指标的测定 从种子置床之后的第2天开始观察,每日记录发芽种子数直至发芽试验结束,观察种子的发芽形态,及测量其胚芽长度。
1.3.2丙二醛(MDA)含量及抗氧化酶活性测定 准确称取0.5 g杂交狼尾草叶片于预冷的组织粉碎机中,加一定量的缓冲溶液研磨成匀浆,冷冻离心,上清即为酶提取液。超氧化物岐化酶(SOD)活性测定采用NBT氧化还原法[17];过氧化氢酶(CAT)和过氧化物酶(POD)活性测定参照李高杰等[18]的方法;抗坏血酸酶(APX)活性的测定参照孙云[19]的方法;丙二醛(MDA)含量的测定采用硫代巴比妥酸法[20]。
1.4分析方法及数据处理
记录和统计种子的发芽形态,发芽率、胚芽长度、发芽指数。
种子发芽率=发芽的种子粒数/供试种子粒数×100%;
胚芽长度直接用尺子测量胚芽基部到胚芽顶部的距离;
发芽指数(GI)=∑(Dg/Dt);
其中:Dt为相应的发芽日数,Dg为逐日发芽数。
采用Excel 2003进行数据的收集,统计数据利用Origin软件进行作图,运用SPSS 24.0软件对各处理组的数据进行单因素ANOVA检验,选择S-N-Ka均数比较法在P=0.05水平上进行比较分析。
2 结果与分析
2.1泛菌属PP04在植物体内的侵染率
在侵染3 d后的杂交狼尾草种子和幼苗内,均验证并检测到了内生菌,经16S rDNA分子鉴定,证实这些细菌就是侵染所用的泛菌属内生细菌PP04。该菌株对种子的侵染效率较高,在0、100、200、300 mmol·L-1NaCl浓度下,分别达442 107.99、459 974.47、282 451.92、1 526.47 cfu·g-1,以100 mmol·L-1NaCl浓度处理最高。
2.2泛菌属PP04对不同盐浓度下杂交狼尾草种子萌发的影响
2.2.1种子萌发的形态特征 不同的盐浓度条件下,胚芽和胚根生长的表现形态也不尽相同(图1)。随着盐浓度的升高,植物的胚芽和胚根长度越来越短。在0和200 mmol·L-1盐浓度下,E-组的胚芽高度和胚根长度都相对降低,植株相对矮小瘦弱,叶片狭窄。但在300 mmol·L-1的高盐浓度下,E+组与E-组植物的胚芽和胚根的生长情况基本无差异,胚芽长度小于胚根,胚芽短小甚至无胚芽长出。说明在高盐浓度(300 mmol·L-1)条件下,PP04内生细菌对杂交狼尾草种子的萌发无明显缓解盐胁迫的作用。

图1 泛菌属PP04侵染7 d后对盐胁迫条件下杂交狼尾草幼苗形态特征的影响Fig. 1 Effect of Pantoea sp. PP04 on the morphological characteristics of seedlings Pennisetum americanum×P. purpureum after 7 days under salinity stress
注:E-,未添加内生菌对照组,E+,添加内生菌处理组。下同。
Note: E-, Endophyte-free plant group; E+, Endophyte-inoculated plant group; similarly for the following figures.
2.2.2种子萌发率 随着盐浓度的升高,E-组杂交狼尾草的种子萌发率均呈下降趋势(图2),可见盐胁迫会抑制杂交狼尾草种子的发芽率。无盐胁迫时,种子萌发率为90.00%,100 mmol·L-1的盐浓度使发芽率降低了16.67百分点,200 mmol·L-1降低了34.72百分点,300 mmol·L-1降低了59.72百分点;E+组植物的发芽率也随盐浓度的增加而降低,无盐胁迫时,种子萌发率为97.5%,100 mmol·L-1的盐胁迫使其降低了6.41百分点,200、300 mmol·L-1分别使其减少了26.92百分点和64.10百分点。在100和200 mmol·L-1盐处理下,E+组较E-组的增幅分别为21.28百分点和21.67百分点,两组之间具有显著性差异(P<0.05)。
2.2.3发芽指数 E-组植物发芽指数在无盐胁迫的情况下,达到38.82,在100、200、300 mmol·L-1盐浓度条件下,种子的发芽指数分别降为27.47、15.94和9.70(图3)。E+组种子的发芽指数随盐浓度的升高迅速降低,且各盐浓度之间,发芽指数均有显著差异(P<0.05)。在0、100和200 mmol·L-1时,E+处理的植物种子发芽指数都显著高于E-组(P<0.05)。但在300 mmol·L-1的高浓度的盐处理条件下,E+与E-组无显著差异(P>0.05)。在中、低的盐浓度胁迫下,内生菌PP04能够有效提高杂交狼尾草种子的发芽指数,但在高盐浓度胁迫下,内生菌对杂交狼尾草种子的发芽指数的提升作用不明显。
2.2.4胚芽生长 E+组和E-组植物的胚芽长度均随盐浓度的升高而逐渐降低,且在200 mmol·L-1盐浓度条件下,降低效果更明显(图4)。E-组植物在无盐胁迫的条件下,胚芽长度可达5.44 cm,而当盐浓度升高到100mmol·L-1时,胚芽长度仅下降为5.39cm,与无盐胁迫相比,差异并不显著(P>0.05);因此,较低的盐胁迫对杂交狼尾草种子的胚芽生长影响较小。但在200 mmol·L-1盐浓度条件下,胚芽长度仅为0.58 cm,比无盐处理下降了89.33%,两者间差异显著(P<0.05);在300 mmol·L-1盐浓度时,胚芽长度极短,约为0.20 cm。通过内生菌的处理后,对于0、100和200 mmol·L-1处理组,E+组的植物胚芽长度都要明显大于E-组,差异显著(P<0.05),增加幅度分别为23.83%、20.98%和241.38%。但在最高盐浓度300 mmol·L-1条件下,内生菌处理的种子胚芽长度与E-组无明显差异。
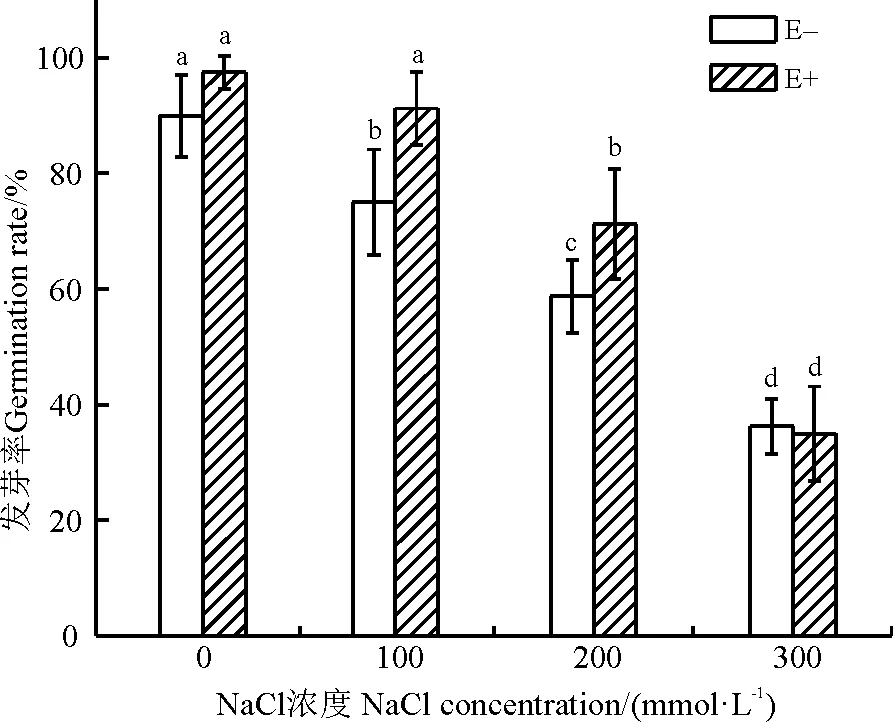
图2 泛菌属PP04侵染对盐胁迫下杂交狼尾草种子发芽率的影响Fig. 2 Effect of Pantoea sp. PP04 on the germination rate of Pennisetum americanum×P. purpureum seeds under salinity stress
注:不同字母表示不同处理间差异显著(P>0.05),下同。
Note: Different lowercase letters within the same cultivar and same salinity level indicate significant difference at the 0.05 level. similarly for the following figures.

图3 泛菌属PP04侵染对盐胁迫下杂交狼尾草种子发芽指数的影响Fig. 3 Effect of Pantoea sp. PP04 on the germination index of Pennisetum americanum×P. purpureum under salinity stress
2.3泛菌属PP04对盐胁迫条件下杂交狼尾草丙二醛含量的影响
在无盐及各盐浓度胁迫下,接种内生细菌PP04都能够有效降低丙二醛的含量(图5)。随着盐浓度的升高,E-植物体内丙二醛的含量呈显著升高趋势,在盐浓度为100、200及300 mmol·L-1时,与无盐胁迫相比,其相对增幅分别为88.86%、149.20%和307.14%;E+组的植物体内丙二醛含量虽然也随着盐浓度升高而逐渐升高,但显著低于E-组(P<0.05),3种盐浓度下,降低幅度分别为49.47%、27.32%和17.36%。
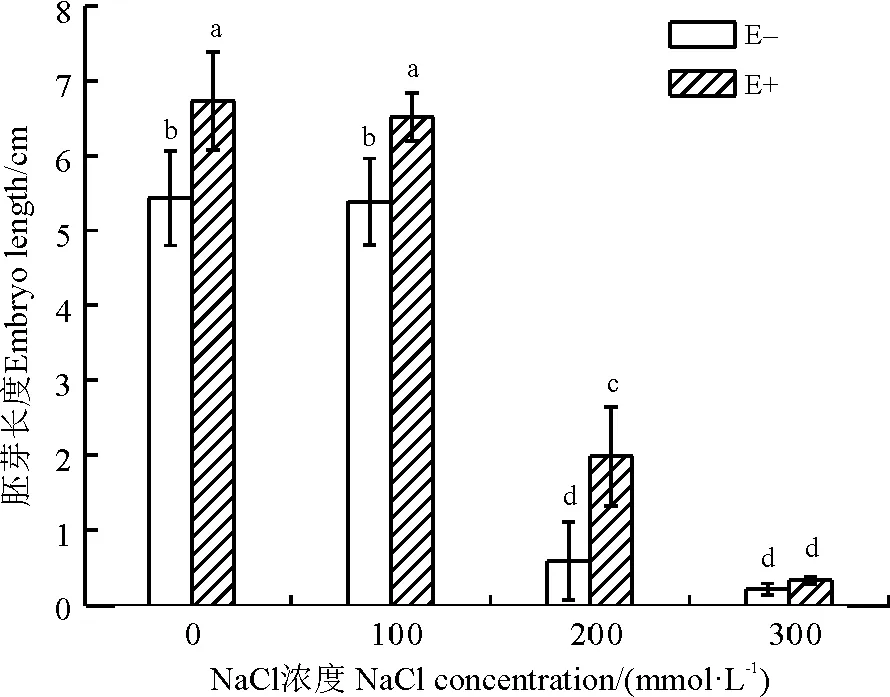
图4 泛菌属PP04侵染对盐胁迫下杂交狼尾草种子胚芽生长长度的影响Fig. 4 Effect of Pantoea sp. PP04 on the length of Pennisetum americanum×P. purpureum embryo under salinity stress

图5 泛菌属PP04侵染对盐胁迫下杂交狼尾草幼苗叶片中丙二醛含量的影响Fig. 5 Effect of Pantoea sp. PP04 on the MDA content of Pennisetum americanum×P. purpureum leaves under salinity stress
2.4泛菌属PP04对盐胁迫条件下杂交狼尾草抗氧化酶活性的影响
在盐胁迫条件下,施加内生菌能明显提高杂交狼尾草体内SOD、POD、CAT、APX 4种保护酶的活性(图6)。E-组SOD酶的活性均随盐浓度的升高先升高,在100 mmol·L-1时达到最大,然后在200和300 mmol·L-1盐浓度下,SOD酶的活性保持不变。E+组SOD酶的活性随盐浓度的升高呈先升高后下降的趋势,也在100 mmol·L-1时达到最大,然后在200 mmol·L-1和300 mmol·L-1盐浓度下,SOD酶的活性显著降低。在100和200 mmol·L-1盐浓度条件下, E+组SOD酶的活性均显著高于E-组,增高幅度分别可达64.17%和28.04%。
E-组POD的活性随盐浓度的升高先显著升高,在200 mmol·L-1时达到最大,到300 mmol·L-1时POD酶的活性略有降低(P>0.05)。E+组POD酶的活性随盐浓度的升高呈先显著升高后显著下降的趋势,也在200 mmol·L-1时达到最大,在300 mmol·L-1盐浓度下,POD酶的活性显著降低。E+组POD酶活性在100、200 mmol·L-1都显著高于E-组,增幅分别为73.14%、63.48%。
在不同盐浓度胁迫下,E-组和E+组CAT的活性都随盐浓度的升高呈先升高后下降的趋势,也在100和200 mmol·L-1时达到最大,在300 mmol·L-1盐浓度下,CAT酶的活性显著降低。E+组的杂交狼尾草CAT的活性都显著高于E-组,在高盐浓度(300 mmol·L-1)时,对比差异更显著,增长幅度可达160.57%。
APX的活性变化趋势与CAT相似,随盐浓度的升高呈先升高后下降,在200 mmol·L-1时达到最大。且E+组APX的活性较E-组均有显著差异,增加幅度分别为83.86%(0 mmol·L-1)、65.41%(100 mmol·L-1)、47.14%(200 mmol·L-1)和73.38%(300 mmol·L-1)。

图6 泛菌属PP04侵染对盐胁迫下杂交狼尾草叶片内抗氧化酶活性的影响Fig. 6 Effect of Pantoea sp. PP04 on the antioxidase activities of Pennisetum americanum×P. purpureum leaves under salinity stress
3 讨论
盐胁迫对于种子萌发影响的研究已经有不少报道,但不管对于盐生植物和非盐生植物,都会造成种子发芽率下降,种子初始萌发的时间推迟或延长[21]。刘玉艳等[22]发现盐胁迫对二色补血草(Limoniumbicolor)种子的萌发具有明显的抑制作用,种子萌发率与盐浓度之间呈显著的负相关关系。本研究也发现,盐胁迫对杂交狼尾草种子萌发具有明显抑制作用,随着盐浓度的升高,种子萌发率、发芽指数显著下降,胚芽和胚根长度越来越短。说明虽然杂交狼尾草具有一定的耐盐能力(耐盐阈值达100 mmol·L-1),但其种子对NaCl盐胁迫反应敏感。因为对于很多物种来说,种子萌发和早期幼苗生长期是对盐胁迫最敏感的阶段[23]。甚至大部分盐生植物,在无NaCl时种子萌发率达到最大,而种子萌发和早期发育阶段对盐浓度的升高非常敏感[24]。这可能是由于盐胁迫下的渗透效应,抑制了种子萌发过程的水分正常吸入,也可能是由于NaCl的离子积累导致的营养吸收不平衡和毒害作用[25-26]。所以,在实际的杂交狼尾草育苗生产中,要尽量避免盐胁迫对种子萌发的影响。但是,也有研究表明,低浓度的盐胁迫反而能促进种子的萌发。如,低浓度(0.4%,68.4 mmol·L-1NaCl)盐胁迫能促进荆条(Viternegundo)种子和白蜡(Fraxinusvelutina)种子的萌发[27]。小于50 mmol·L-1浓度NaCl能促进罗布麻(Apocynumvenetum)种子的萌发[28]。低浓度盐(25.6 mmol·L-1NaCl)对杂交狼尾草发芽率无明显影响,但对发芽指数有显著提高[29]。可能因为本研究设定的盐浓度较高(大于100 mmol·L-1NaCl),所以并未观察到盐胁迫对种子萌发的增益作用。要了解低浓度盐对种子的影响,需要设置更低浓度的盐胁迫试验进行进一步研究。
内生菌作为一种促进植物生长发育、增强宿主抗逆性的天然资源,对盐胁迫下植物种子的萌发具有显著促进作用。如,钮旭光等[30]发现内生芽孢杆菌SE48和SE4能显著提高小麦在盐胁迫下种子的萌发率。王楠等[31]用氢氧化细菌WMQ7菌悬液浸种小麦,其发芽粒数、发芽率、发芽势、发芽指数、胚芽、胚根长均有明显的改善和提高,而且在低盐胁迫下的效果比高盐胁迫下的效果好。在本研究中,象草PP04内生菌能够有效缓解中(200 mmol·L-1)、低(100 mmol·L-1)盐浓度胁迫对杂交狼尾草种子萌发的毒害作用,对种子的发芽率、发芽指数、胚芽长度都有显著的增益和改善作用。然而,在高盐(300 mmol·L-1)胁迫条件下,内生菌缓解盐胁迫的毒害能力作用下降或不明显,这与前人的研究结果基本一致。有研究推测其机制是,在一定的盐胁迫下,施加内生细菌可以促进植物对矿质营养元素的吸收;改变植物体内离子平衡;增加植物对水分的吸收和利用能力,从而增强种子萌发各指标,但过高的盐胁迫容易引发种子胚细胞膜破裂,植物体内的代谢失调,造成蛋白合成受阻及毒素积累等,从而导致内生菌缓解盐胁迫的能力受限[32-33]。但本研究中象草PP04内生细菌促进中、低盐浓度胁迫下杂交狼尾草种子的萌发机制,还需进一步深入研究。
植物在非生物胁迫条件下会形成过量的活性氧自由基(ROS),对细胞膜系统具有破坏作用[34]。通常植物体内的SOD、POD、CAT和APX等保护酶能够清除多余的自由基,保护细胞膜结构,从而减少逆境胁迫带来的伤害[35-36]。所以,保护酶的活性大小可以间接反映植物的抗逆能力[37-38]。而丙二醛(Malondialdehyde,MDA)作为脂质过氧化的产物,其含量的多少可代表细胞膜的受损程度[39]。本研究发现,随盐浓度升高,杂交狼尾草体内的MDA含量显著升高,细胞膜受损;保护酶SOD、POD活性升高,然后保持较高的活性;CAT 和APX活性先增加后降低。这说明杂交狼尾草在低、中度盐胁迫下,脂质发生过氧化作用,细胞膜系统受到损伤,而体内的保护酶系统活性升高将体内过多的自由基清除,降低盐胁迫对膜系统的损伤。但是当NaCl浓度高于200 mmol·L-1时,脂质发生更加严重的过氧化反应,此时SOD、POD活性保持不变,而CAT 和APX活性下降。高浓度盐胁迫下,体内的保护酶系统组成比例发生变化,杂交狼尾草主要通过SOD和POD保护酶来清除体内的自由基。
有研究表明,内生菌能通过诱导抗氧化保护酶活性,从而清除活性氧,增加植物抗逆性[40]。丛枝菌根真菌(Glomusmosseae)通过诱导保护酶系统,减少盐对柑橘幼苗的胁迫作用[41]。 GM-1菌株(F.verticillioidesRK01)通过提高CAT、POD和SOD的活性,减少细胞膜氧化,促进大豆种子萌发率和植株的生长发育[42]。Ghorbanli等[43]也发现,在盐胁迫下,菌根植物体内SOD和POD酶活性较非菌根植物有显著提高。本研究也表明,在不同浓度盐胁迫下,PP04内生菌能够有效增加杂交狼尾草体内SOD、POD、CAT和APX活性,减少膜脂过氧化产物MDA的积累,从而缓解盐环境对杂交狼尾草造成的氧化胁迫,增强其耐盐能力。但是,在不同盐浓度下,各种酶活力水平不同。在无盐胁迫时,PP04内生细菌能够增加杂交狼尾草体内CAT和APX的活性,从而保护细胞膜,降低MDA积累。在100 mmol·L-1盐胁迫下,PP04能够显著提高各保护酶的活性,但是SOD活性最高;当盐浓度升高到200 mmol·L-1,SOD活性降低,而POD活性升高;当盐浓度到300 mmol·L-1时,SOD和POD活性继续降低,与E-差别不大;而CAT 和APX在低、中、高浓度盐胁迫下一直保持较高的活性。这可能说明在不同浓度的盐胁迫下,内生菌PP04诱导不同的保护酶活性。但是关于内生细菌PP04如何在不同盐胁迫水平下,诱导不同的保护酶活性的调节机制需要进一步研究。
4 结论
本研究中,象草内生细菌PP04能促进低、中度盐胁迫下狼尾草种子的萌发;并通过诱导杂交狼尾草抗氧化保护酶活性,降低细胞膜损伤,增强其耐盐能力,是开发生物肥料的优良目标菌株,显示出良好的应用前景。但是关于该内生菌如何促进狼尾草种子的萌发,诱导保护酶活性,增强其耐盐能力的机制需要进一步深入研究。另外,由于本研究是在实验室条件下开展的,但实际上盐土常含多种盐分,不同无机离子之间存在着相互作用,且在逆境中还存在各种其他环境胁迫(干旱、病虫害、金属离子胁迫等),都会影响杂交狼尾草的生长乃至生存。因此,关于象草内生细菌对杂交狼尾草在实际盐碱土壤条件乃至其他多逆境条件下的促生作用尚需做进一步的田间验证。
References:
[1] 胡桂萍,郑雪芳,尤民生,刘波.植物内生菌的研究进展.福建农业学报,2010,25(2):226-234.
Hu G P,Zheng X F,You M S,Liu B.Recent advances in research on endophytes.Fujian Journal of Agricultural Sciences,2010,25(2):226-234.(in Chinese)
[2] 邱雁斌,秦向东,赵艳,杨姝,杨扬,李泽,赵红梅.杂交狼尾草碱预处理研究.云南化工,2016,43(1):11-15.
Qiu Y B,Qin X D,Zhao Y,Yang S,Yang Y,Li Z,Zhao H M.Study on different alkali pretreatment of hybridPennisetum.Yunnan Chemical Technology,2016,43(1):11-15.(in Chinese)
[3] 范希峰,侯新村,朱毅,武菊英.杂交狼尾草作为能源植物的产量和品质特性.中国草地学报,2012,34(1):48-52.
Fan X F,Hou X C,Zhu Y,Wu J Y.Biomass yield and quality of hybridPennisetum.Chinese Journal of Grassland,2012,34(1):48-52.(in Chinese)
[4] 费世民,张旭东,杨灌英,周金星,刘福云.国内外能源植物资源及其开发利用现状.四川林业科技,2005,26(3):20-26.
Fei S M,Zhang X D,Yang G Y,Zhou J X,Liu F Y.On domestic and international situation of energy plant resources and their exploitation.Journal of Sichuan Forestry Science and Technology,2005,26(3):20-26.(in Chinese)
[5] 王殿,袁芳,王宝山,陈敏.能源植物杂交狼尾草对NaCl胁迫的响应及其耐盐阈值.植物生态学报,2012,36(6):572-577.
Wang D,Yuan F,Wang B S,Chen M.Response of plant biofuel hybridPennisetumto NaCl stress andits salinity threshold.Chinese Journal of Plant Ecology,2012,36(6):572-577.(in Chinese)
[6] 王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义.微生物学通报,2015,42(2):349-363.
Wang Z W,Ji Y L,Chen Y G.Studies and biological significances of plant endophytes.Microbiology China,2015,42(2):349-363.(in Chinese)
[7] 李娇,张宝龙,赵颖,辛士刚,陈强,宋宁宁,李雪梅.内生菌对提高植物抗盐碱性的研究进展.生物技术通报,2014(4):14-18.
Li J,Zhang B L,Zhao Y,Xin S G,Chen Q,Song N N,Li X M.Progress in endophyte improving plant salt and alkali resistance.Biotechnology Bulletin,2014(4):14-18.(in Chinese)
[8] Kloepper J W.Plant growth-promoting rhizobacteria(other systems)Azospirillum.Plant Associations,1994:137-166.
[9] Silva A,Patterson K,Rothrock C.Growth promotion of highbush blueberry by fungal and bacterial inoculants.Hortscience,2000,35(7):1228-1230.
[10] Puri A,Padda K P,Chanway C P.Seedling growth promotion and nitrogen fixation by a bacterial endophytePaenibacilluspolymyxaP2b-2R and its GFP derivative in corn in a long-term trial.Symbiosis,2016,69(2):1-7.
[11] Iqbal N,Masood A,Nazar R,Syeed S,Khan N A.Photosynthesis,growth and antioxidant metabolism in mustard (BrassicajunceaL.) cultivars differing in cadmium tolerance.Journal of Integrative Agriculture,2010,9(4):519-527.
[12] Lugtenberg B,Kamilova F.Plant-growth-promoting rhizobacteria.Annual Review of Microbiology,2009,63:541-561.
[13] Rolli E,Marasco R,Vigani G,Ettoumi B,Mapelli F,Deangelis M L,Gandolfi C,Casati E,Previtali F,Gerbino R,Pierotti Cei F,Borin S,Sorlini C,Zocchi G,Daffonchio D.Improved plant resistance to droughtis promoted by the root-associated microbiome as a water stress-dependenttrait.Environmental Microbiology,2015,17(2):316-331.
[14] Maldonado-González M M,Schilirò E,Prieto P,Mercado-Blanco J.Endophytic colonization and biocontrol performance ofPseudomonasfluorescensPICF7 in olive (OleaeuropaeaL.) are determined neither by pyoverdine production nor swimming motility.Environmental Microbiology, 2015,17(9):3139-3153.
[15] Li X,Geng X Y,Xie R R,Fu L,Jiang J X,Gao L,Sun J Z.The endophytic bacteria isolated from elephant grass (PennisetumpurpureumSchumach) promote plant growth and enhance salt tolerance of hybridPennisetum.Biotechnology for Biofuels,2016,9:190-201.
[16] 耿小燕.象草内生菌的筛选鉴定及促生机制研究.镇江:江苏大学硕士学位论文,2014.
Geng X Y.Screening and characterization of plant growth promoting endophytic bacteria from elephant grass(Pennisetumpurpureum).Master Thesis.Zhenjiang:Jiangsu University,2014.(in Chinese)
[17] Broxton C N,Culotta V C.SOD enzymes and microbial pathogens:Surviving the oxidative storm of infection.PLoS Pathog,2016,12(1):1371-1376.
[18] 李高杰,柳竹青,陈昭晶,曹梦梅,汤善亮,户安鹏.猕猴桃保鲜过程中CAT、SOD、POD活性变化的研究.山东化工,2011,40(10):13-16.
Li G J,Liu Z Q,Chen Z J,Cao M M,Tang S L,Hu A P.Changes of activities of CAT,POD and SOD during the preservation process of Chinese gooseberry.Shandong Chemical Industry,2011,40(10):13-16.(in Chinese)
[19] 孙云.茶叶抗坏血酸过氧化物酶(APX)的生理学与分子生物学研究.福州:福建农林大学博士学位论文,2009.
Sun Y.Studies on physiology and molecular biology of tea (Camelliasinensis) ascorbate peroxidase (APX).PhD Thesis.Fuzhou:Fujian Agriculture and Forestry University,2009.(in Chinese)
[20] 张海平,程小爱.水涝胁迫下欧李丙二醛和氧自由基的变化.天津农业科学,2015,21(12):15-20.
Zhang H P,Cheng X A.Changes of malondialdehyde and oxygen free radicals inPrunushumilisbungeleaves under water-logging stress.Tianjin Agricultural Sciences,2015,21(12):15-20.(in Chinese)
[21] 沈禹颖,王锁民,陈亚明.盐胁迫对牧草种子萌发及其恢复的影响.草业学报,1999,8(3):54-60.
Shen Y Y,Wang S M,Chen Y M.The effect of saline condition on the germination and its recovery of pasture species.Acta Prataculturae Sinica,1999,8(3):54-60.(in Chinese)
[22] 刘玉艳,王辉,于凤鸣,李淑洁.盐胁迫对二色补血草种子萌发的影响.生态学杂志,2009,28(9):1794-1800.
Liu Y Y,Wang H,Yu F M,Li S J.Effects of salt stress onLimoniumbicolorseed germination.Chinese Journal of Ecology,2009,28(9):1794-1800.(in Chinese)
[23] Li Y.Effect of salt stress on seed germination and seedling growth of three salinity plants.Pakistan Journal of Biological Sciences Pjbs,2008,11(9):1268-1272.
[24] Khan M A,Ungar I A,Showalter A M.Effects of sodium chloride treatments on growth and ion accumulation of the halophyteHaloxylonrecurvum.Communications in Soil Science and Plant Analysis,2000,31:2763-2774.
[25] Shokohifard G,Sakagami K,Hamada R,Matsumoto S.Effect of amending materials on growth of radish plant in salinized soil.Journal of Plant Nutrition,1989,12(10):1195-1214.
[26] Khajeh-Hosseini M,Powell A A,Bimgham I J.The interaction between salinity stress and seed vigor during germination of soybean seeds.Seed Science and Technology,2003,31:715-725.
[27] 张洁明,孙景宽,刘宝玉,刘新成,张文辉.盐胁迫对荆条、白蜡、沙枣种子萌发的影响.植物研究,2006,26(5):595-599.
Zhang J M,Sun J K,Liu B Y,Liu X C,Zhang W H.Effect of salt stress on seed germination ofVitexnegundo,FraxinusvelutinaandElaeagnusangustifolia.Bulletin of Botanical Research,2006,26(5):595-599.(in Chinese)
[28] 张秀玲,李瑞利,石福臣.盐胁迫对罗布麻种子萌发的影响.南开大学学报(自然科学版),2007,40(4):13-18.
Zhang X L,Li R L,Shi F C.Effect of salt stress on the seed germination ofApocynumvenetum.Acta Scientiarum Naturalium Universitatis Nankaiensis,2007,40(4):13-18.(in Chinese)
[29] 覃广泉,陈平,苏东海.盐胁迫对4种禾本科牧草种子萌发幼苗生长的影响.中国农学通报,2005,21(3):205-207.
Qin G Q,Chen P,Su D H.Effect of salt stress on seed germination and seedling growth of 4 graminaceous pasture cultivars.Chinese Agricultural Science Bulletin,2005,21(3):205-207.(in Chinese)
[30] 钮旭光,韩梅,宋立超,肖亦农.翅碱蓬内生细菌鉴定及耐盐促生作用研究.沈阳农业大学学报,2011,42(6):698-702.
Niu X G,Han M,Song L C,Xiao Y N.Identification of endophytic bacteria and preliminary research on their growth-promoting effect under salt stress inSuaedaheteropteraKitag.Journal of Shenyang Agricultural University,2011,42(6):698-702.(in Chinese)
[31] 王楠,王卫卫,张洁,郭欣.盐胁迫对氢氧化细菌WMQ7浸种小麦萌发和生长的影响.西北植物学报,2011,31(10):2065-2070.
Wang N,Wang W W,Zhang J,Guo X.Effect of salt stress on the germination and growth of wheat seeds soaked with hydrogen-oxidizing bacteria WMQ7.Acta Botanica Boreali-Occidentalia Sinica,2011,31(10):2065-2070.(in Chinese)
[32] 郑元元,岳海涛,石在强,李晖,李春.盐胁迫下解盐促生细菌Rs-5和Rs-198促进棉花种子发芽的机理探讨.中国农业科学,2008,41(5):1326-1332.
Zheng Y Y,Yue H T,Shi Z Q,Li H,Li C.Physiochemical characters and ability to promote cotton germinaton of bacteria strains Rs-5 and Rs-198 under salt stress.Scientia Agricultura Sinica,2008,41(5):1326-1332.(in Chinese)
[33] Mayak S,Tirosh T,Glick B R.Plant growth-promoting bacteria confer resistance in tomato plants to salt stress.Plant Physiology and Biochemistry,2004,42:565-572.
[34] Larkindale J,Huang B.Thermo-tolerance and antioxidant systems inAgrostisstoloifera:Involvement of salicylic acid,abscisic acid,calcium,hydrogen peroxide,and ethylene.Journal of Plant Physiology,2004,161(4):405-413.
[35] Esfandiari E,Shekari F,Shekari F,Esfandiari M.The effect of salt stress on antioxidant enzymes’ activity and lipid peroxidation on the wheat seedling.Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2007,35(1):48-56.
[36] Schippers J H M,Schmidt R.The role of ROS and redox signaling during the initial cellular response to abiotic stress.11 Redox State as A Central Regulator of Plant-cell Stress Responses.Springer International Publishing,2016:253-273.
[37] Lin J P, Zhu J K.Proline accumulation and salt stress induced gene expression in a salt hypersensitive mutant ofArabidopsis.Journal of Plant Physiology,1997,114:591-596.
[38] 杨远昭.新疆三种盐生植物种子萌发对主要生态因子响应的研究.乌鲁木齐:新疆农业大学硕士学位论文,2007.
Yang Y Z.The responds of three halophytic species speed germination to main ecological factors in Xinjiang.Master Thesis.Urumqi:Xinjiang Agricultural University,2007.(in Chinese)
[40] 李少锋,李志辉,刘友全,何友军.水分胁迫对椿叶花椒抗氧化酶活性等指标的影响.中南林业科技大学学报,2008,28(2):29-34.
Li S F,Li Z H,Liu Y Q,He Y J.Effect of water stress on activities of anti-oxidase and several physiological indexes ofZanthoxylumailanthoidesSieb.et Zucc.Journal of Central South University of Forestry & Technology,2008,28(2):29-34.(in Chinese)
[41] Wu Q S,Zou Y N,Liu W,Ye X F,Zai H F,Zhao L J.Alleviation of salt stress in citrus seedlings inoculated with mycorrhiza:Changes in leaf antioxidant defense systems.Plant Soil Environment,2010,56(10):470-475.
[42] Radhakrishnan R,Khan A L,Lee I J.Endophytic fungal pre-treatments of seeds alleviates salinity stress effects in soybean plants.Journal of Microbiology,2013,51(6):850-857.
[43] Ghorbanli M,Ebrahimzadeh H,Sharifi M.Effects of NaCl and mycorrhizal fungi on antioxidative enzymes in soybean.Biologia Plantarum,2004,48(4):575-581.
EndophyticbacteriacanmitigatesalinitystressonseedgerminationandphysiologyinhybridPennisetum
Fu Lei, Li Xia, Gao Lu, Jiang Jian-xiong, Sun Jian-zhong
(Biofuels Institute, School of Environmental and Safety Engineering, Jiangsu University, East China Branch, National Energy R & D Center for Non-food Biomass, Zhenjiang 212013, Jiangsu, China)
Endophytic bacteria have a broad spectrum of applications such as in plant disease prevention, pest insect suppression, plant growth promotion, and plant salt and drought tolerance; they, therefore, provide a valuable natural resource. This investigation was conducted to determine the influence of the endophytic bacteriumPantoeasp. PP04 on seed germination and seedling growth of hybridPennisetumunder low (100 mmol·L-1), medium (200 mmol·L-1), and high (300 mmol·L-1) salinity stress. The analysis showed that the endophyte PP04 had a significant positive impact on seed germination rate, germination index, and lengths of embryos under low and medium salinity stress, which would enhance their germination rate at 10.75%, 28.57%, and 300%, respectively. We also found that under different levels of salinity stress, this endophytic bacterium reduced lipid peroxidation of cell membranes in hybridPennisetumby inducing different antioxidant protective enzyme activities. As a consequence, the content of malondialdehyde (MDA) decreased. Under low and medium salinity stress, the endophytic bacterium significantly increased activity of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), and ascorbate peroxidase (APX) in hybridPennisetum. The greatest increases in SOD (64.17%) and POD (73.14%) activities occurred under low salinity stress. The largest increases in CAT (160.57%) and APX (73.38%) occurred under high salinity stress. Our results indicated that the endophyte PP04 significantly mitigated the damage caused by oxidative stress from salinity and improved the tolerance of plants to a salt stress environment. These results suggest that the endophyte PP04 has promising characteristics for future applications.
endophyte; hybridPennisetum; salinity stress; seed germination; seedling growth; oxidative stress
Sun Jian-zhong E-mail:jzsun1002@ujs.edu.cn
10.11829/j.issn.1001-0629.2016-0634
傅蕾,李霞,高璐,蒋建雄,孙建中.盐胁迫下泛菌属内生细菌对杂交狼尾草发芽及生理的影响.草业科学,2017,34(10):2099-2108.
Fu L,Li X,Gao L,Jiang J X,Sun J Z.Endophytic bacteria can mitigate salinity stress on seed germination and physiology in hybridPennisetum.Pratacultural Science,2017,34(10):2099-2108.
S543+.901;Q945.78
A
1001-0629(2017)10-2099-10
2017-03-03
2017-05-04
江苏省农业自主创新资金(CX(15)-1005);江苏省自然科学基金青年基金项目(BK20160508);江苏大学高级人才启动基金项目(11JBG076);江苏省自然科学基金青年基金项目(BK20130499);国家自然科学基金青年项目(31601380);国家自然科学基金面上项目(31671754)
傅蕾(1991-),女,江苏镇江人,在读硕士生,主要从事植物内生菌研究。E-mail:18252585831@163.com
共同第一作者:李霞(1981-),女,山东济宁人,助理研究员,博士,主要从事能源植物遗传改良及微生物肥料的开发。
E-mail:lixia1069@ujs.edu.cn
孙建中(1958-),男,江苏南通人,教授,博导,博士,主要从事消化木质纤维素类自然生物系统的生物过程仿生、新型生物基材料以及草本能源植物研究。E-mail:jzsun1002@ujs.edu.cn
(责任编辑 王芳)

