盐碱互作胁迫对高丹草叶片叶绿素荧光参数的影响
金微微,张会慧,滕志远,孟祥馨悦,张书博, 张秀丽,许 楠,3,孙广玉
(1.东北林业大学生命科学学院, 黑龙江 哈尔滨 150040; 2.东北农业大学资源与环境学院, 黑龙江 哈尔滨150030; 3.黑龙江省科学院自然与生态研究所, 黑龙江 哈尔滨 150040)
盐碱互作胁迫对高丹草叶片叶绿素荧光参数的影响
金微微1,张会慧2,滕志远1,孟祥馨悦2,张书博1, 张秀丽1,许 楠1,3,孙广玉1
(1.东北林业大学生命科学学院, 黑龙江 哈尔滨 150040; 2.东北农业大学资源与环境学院, 黑龙江 哈尔滨150030; 3.黑龙江省科学院自然与生态研究所, 黑龙江 哈尔滨 150040)
为明确高丹草Sorghumbicolor×S.sudanense在盐碱互作胁迫下的生理响应及耐受特点,以两种中性盐NaCl和Na2SO4以及两种碱性盐Na2CO3和NaHCO3按不同比例配成50、100、150和200 mmol·L-14个盐浓度,并且每个盐浓度分别设7.0、8.0、9.0和10.0共4个pH梯度的盐碱互作组合,研究了在盐碱互作胁迫对高丹草叶片的叶绿素荧光参数的影响。结果表明,高丹草叶片的各生理参数受高盐浓度以及溶液中各离子浓度的影响较大,其中影响较大的为CO32-浓度和总盐浓度。低盐浓度下,不同pH对高丹草叶片叶绿素荧光参数的影响相对较小,并且低于100 mmol·L-1的盐浓度下高丹草叶片PSⅡ反应中心的光化学活性无明显影响,即高丹草具有一定的抗盐碱性能力。但在高盐高pH条件下,高丹草叶片PSⅡ光化学效率的降低,并且此时随着pH的增加,高丹草叶片的PSⅡ反应中心活性降低幅度增大。高丹草在一定碱性盐浓度范围内可以通过提高非化学淬灭系数(NPQ)及时耗散过剩的光能,但在高盐浓度下高丹草叶片通过NPQ来耗散过剩光能的保护能力下降,并且高pH下降低幅度更为显著。盐和pH对高丹草叶片的各生理参数影响过程中存在明显的交互作用,并且随着盐浓度的增加,交互作用逐渐变大,即低盐浓度下,受pH的影响相对较小,但随着盐浓度的增加,pH的影响变大。高丹草叶片具有一定的耐盐碱能力,但在盐浓度较高地区推广高丹草要注意碱化度的影响。
高丹草;光系统Ⅱ;盐胁迫;碱性盐胁迫;盐碱互作;pH;叶绿素荧光参数
土壤盐碱化是影响植物生长及分布的重要因素之一,我国存在较大面积的盐碱化土壤,严重制约着当地农林和畜牧业的发展[1-2]。自然环境中土壤中的盐分及比例是比较复杂的,往往不是单一盐类存在,常见的盐类主要有中性盐NaCl和NaSO4以及碱性盐Na2CO3和NaHCO3等。不同种类的盐胁迫对植物生长及生理特性的影响明显不同,另外,不同植物种类对不同盐类的耐受性也明显不同,较多的研究均发现碱性盐对植物的影响程度明显大于中性盐[3-4]。高丹草(Sorghumbicolor×S.sudanense)为高粱(S.bicolor)与苏丹草(S.sudanense)的杂交种,不但具有高梁茎粗、叶宽、产量高的特点[5-6],并且具有苏丹草分蘖力和再生力强、耐刈割、适口性好等优点[7-8],高丹草不但对干旱[9]、盐碱[10-11]等逆境具有一定的耐受性,还可以忍耐一定浓度的多环芳烃菲[12],去除土壤中的芘[13-14]。高丹草是一种C4高光效植物[15],在光合能力方面也具有明显的杂种优势[16]。因此,高丹草不但是发展畜牧业的首先牧草品种之一[17-18],而且对环境修复具有重要的作用,是一种重要的牧草兼退化生态修复植物。但是,目前关于高丹草对盐胁迫的响应研究主要集中在中性盐,对于混合盐碱胁迫下虽已有高丹草种子萌发和幼苗生长的响应研究[19],但对于混合盐碱胁迫下高丹草生理响应方面研究较少。为此,本研究以不同种类和浓度的盐按不同比例混合,模拟不同的盐碱环境,探讨盐碱互作胁迫下高丹草叶片水分、叶绿素含量和叶绿素荧光参数的变化,并且通过分析不同参数与各胁迫因素之间的相关性,揭示盐碱互作胁迫下影响高丹草生理特性的主导因素,为高丹草在盐碱地区种植推广提供一些基础数据。
1 材料与方法
1.1试验材料及处理
试验于2016年在东北林业大学植物生理实验室进行。供试材料苏丹草种子由黑龙江省农业科学院提供。挑选质量优良、大小均一、成熟饱满的种子均匀地种播种于直径12 cm、高15 cm的培养钵中,覆土约1 cm,每钵播种12 粒种子,培养基质采用充分混匀的草炭土与蛭石,比例2∶1(体积比)。在温度25/23 ℃(光/暗)、光照强度400 μmol·(m2·s)-1、光周期12/12 h(光/暗),相对湿度75%左右的人工气候箱中培养,定期浇水和苗期管理。待植株长至约40 cm高时,进行盐碱处理。按照石德成等[20]的方法分别以不同比例的两种中性盐NaCl和Na2SO4以及两种碱性盐Na2CO3和NaHCO3按不同比例配成50、100、150、200 mmol·L-14个盐浓度,并且每个盐浓度分别设7.0、8.0、9.0和10.0共4个pH梯度的不同比例盐碱互作组合,不同溶液中的pH分别用低浓度的HCl和NaOH进行精确调节。将长势相对一致的植株48钵分为16组,即16个处理,每个处理3钵,处理前2 d停止浇水,分别将配好的不同盐溶液500 mL(每钵)均匀地浇于培养基钵中,以培养钵渗出少量溶液为准,每个培养钵下接一塑料托盘,防止盐溶液的流失,通透到托盘中的溶液待培养基质稍干后反浇回培养基质中。浇盐溶液后3 d待不同处理植株观察出现差异后进行各生理指标的测定。
1.2测定项目和方法
叶片相对含水率采用烘干称重法,将不同处理植株叶片采收后,称其鲜重,放入铝盒内杀青(105 ℃,30 min)、烘干(60 ℃,30 h)至恒重后称其干重,叶片相对含水率=(叶片鲜重-叶片干重)/叶片鲜重×100%。叶绿素含量的测定采用丙酮∶无水乙醇∶蒸馏水=4.5∶4.5∶1(体积比)提取液过夜浸泡法,每次测定重复3次。
叶绿素荧光参数的测定:不同处理后的高丹草倒数第2片完全展开叶片利用暗适应夹进行30 min暗适应后,采用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国)测定不同处理的初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)。然后测定光适应下的最大荧光(Fm′)、光适应下的最小荧光(Fo′)及稳态荧光(Fs),计算PSⅡ实际光化学效率(ФPSⅡ)、电子传递速率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ)等,其中ФPSⅡ=(Fm/Fs)/Fm′;ETR=0.5×0.85×ФPSⅡ×PFD;qP=(Fm′-Fs)/(Fm′-Fo′);NPQ=(Fs/Fm′)-(Fs/Fm),式中:0.5为光能在PS Ⅱ和PS Ⅰ两个光系统之间的分配比例,0.85为叶片的光能吸收系数,PFD为光照强度[μmol·(m2·)s-1][21],测定均重复3次。
1.3数据处理方法
运用Excel和DPS(7.05)软件对测定数据进行统计分析,并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与分析
2.1盐碱互作胁迫对高丹草叶片相对含水率和叶绿素含量的影响
随着盐浓度的增加,高丹草叶片相对含水率整体呈降低趋势,在盐浓度为50、100和150 mmol·L-1时,不同pH下高丹草叶片相对含水率均无显著差异(P>0.05),盐浓度为200 mmol·L-1时,pH 9.0和10.0下叶片相对含水率分别较pH 7.0降低了3.07%(P>0.05)和8.67%(P<0.05)。在盐浓度为50、100和150 mmol·L-1范围内,不同pH下高丹草叶片的叶绿素含量随着盐浓度的增加呈降低趋势,但仅在盐浓度为150 mmol·L-1、pH 9.0和10.0下的降低幅度较其他处理明显,当盐浓度增加到200 mmol·L-1时,pH 7.0和8.0下高丹草叶片叶绿素含量较150 mmol·L-1相比仍呈下降低趋势,而pH 9.0和10.0下较150 mmol·L-1相比却呈增加趋势,并且pH 10.0处理的增加幅度更大。
2.2盐碱互作胁迫对高丹草叶片暗反应下叶绿素荧光参数的影响
高丹草叶片的Fm和Fv/Fm在盐碱互作胁迫下表现出相同的变化趋势,整体表现为不同pH下均随着盐浓度的增加而降低,不同盐浓度下随着pH的升高也呈明显的降低趋势,并且随着盐浓度的增加,pH的影响作用变大(图2)。盐浓度为50和100 mmol·L-1时,不同pH下高丹草叶片的Fm和Fv/Fm均无显著差异(P>0.05),而当盐浓度增加到150 mmol·L-1时,pH 9.0和10.0下的Fm以及pH 8.0、9.0和10.0下的Fv/Fm均显著低于pH 7.0,并且当盐浓度增加到200 mmol·L-1时,不同pH下高丹草叶片的Fm和Fv/Fm差异程度进一步增加,pH 8.0、9.0和10.0下的Fm分别低于pH 7.0(P<0.05)下11.40%(P>0.05)、31.32%(P<0.05)和73.86%(P<0.05),而Fv/Fm分别低于pH 7.0下10.06%(P<0.05)、16.49%(P<0.05)和36.79%(P<0.05)。
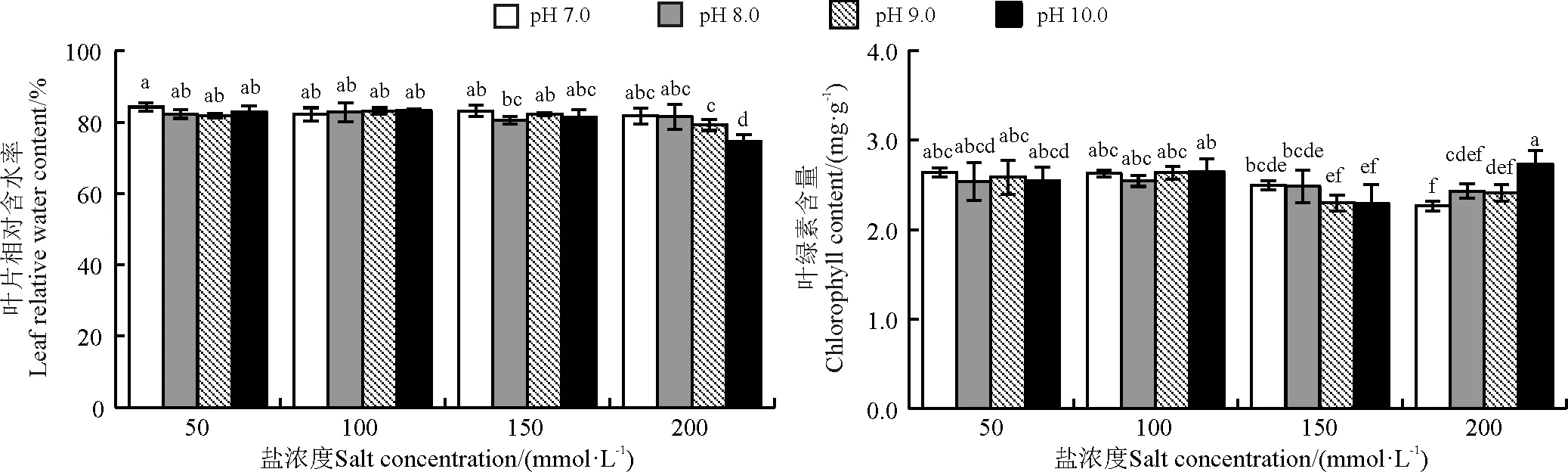
图1 盐碱互作胁迫对高丹草叶片相对含水率和叶绿素含量的影响Fig. 1 Effect of salt and alkali interaction stress on relative water and chlorophyll content in leaves of Sorghum bicolor×S. sudanense
注:图中不同小写字母表示处理之间差异显著(P<0.05)。
Note:Different lowercase letters indicate significant difference among different treatments at the 0.05 level.
2.3盐碱互作胁迫对高丹草叶片光反应下叶绿素荧光参数的影响
盐碱互作胁迫下高丹草叶片的ФPSⅡ和ETR变化规律基本相似,在盐浓度为50和100 mmol·L-1时,不同pH下高丹草叶片的ФPSⅡ和ETR均无显著差异(P>0.05),并且不同盐浓度处理之间差异也不显著(图3)。当盐浓度增加到150 mmol·L-1时,仅pH10.0下高丹草叶片的ФPSⅡ和ETR降低幅度较大,但与其他pH处理之间仍无显著差异,但是当盐浓度增加到200 mmol·L-1时,pH 8.0和9.0下高丹草叶片的ФPSⅡ较与pH 7.0下仍无显著差异(P>0.05),而pH 10.0下高丹草叶片的ФPSⅡ较pH 7.0降低了59.93%(P<0.05),pH 8.0、9.0和10.0下的ETR分别较pH 7.0处理降低了11.69%(P>0.05)、36.84%(P<0.05)和83.52%(P<0.05)。
2.4盐碱互作胁迫对高丹草叶片qP和NPQ的影响
随着盐浓度的增加,高丹草叶片的qP整体呈降低趋势,并且不同盐浓度下qP也随着pH的增加而降低(图4)。但不同盐浓度下pH的影响程度明显不同,其中,50和100 mmol·L-1的盐浓度下,不同pH下的qP均无显著差异(P>0.05),在盐浓度增加到150 mmol·L-1时也仅pH 10.0与pH 7.0之间差异显著(P<0.05),但当盐浓度增加到200 mmol·L-1时,pH 9.0和10.0分别较pH 7.0降低了25.05%(P<0.05)和69.69%(P<0.05)。随着盐浓度的增加,不同pH下的高丹草叶片的NPQ均呈先增加后降低的趋势,但不同pH下的最高值出现时间不同,其中,pH 7.0和8.0处理下高丹草叶片的NPQ最大值出现在盐浓度为150 mmol·L-1时,而pH 9.0和10.0时的最大值出现在盐浓度为100 mmol·L-1时。另外,在盐浓度为50和100 mmol·L-1时不同pH处理下的NPQ无明显差异,但当盐浓度增加到150和200 mmol·L-1时,高丹草叶片的NPQ随着pH的增加明显降低,并且高pH下的降低幅度更大。
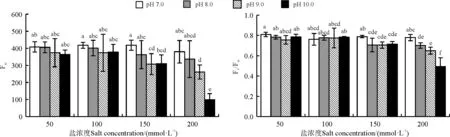
图2 盐碱互作胁迫对高丹草叶片Fm和Fv/Fm的影响Fig. 2 Effect of salt and alkali interaction stress on Fm and Fv/Fm in leaves of Sorghum bicolor×S. sudanense

图3 盐碱互作胁迫对高丹草叶片ФPSⅡ和ETR的影响Fig. 3 Effect of salt and alkali interaction stress on ФPSⅡ and ETR in leaves of Sorghum bicolor×S. sudanense

图4 盐碱互作胁迫对高丹草叶片qP和NPQ的影响Fig. 4 Effect of salt and alkali interaction stress on qP and NPQ in leaves of Sorghum bicolor×S. sudanense
2.5盐碱互作胁迫下高丹草叶片各测定参数之间的相关分析
除叶片的总叶绿素含量与其叶片相对含水率和叶绿素荧光参数之间无显著的相关性外(P>0.05),叶片相对含水率与各叶绿素荧光参数之间的相关性均大于样本数为16时的极显著正相关系数基准值0.57,均存在极显著的正相关关系(P<0.01),而叶绿素荧光参数与总叶绿素含量之间无显著相关性(P>0.05)。
2.6盐碱互作胁迫下高丹草叶片各测定参数与各胁迫因素之间的相关分析
盐碱互作胁迫下高丹草叶片的相对含水率、叶绿素含量以及各叶绿素荧光参数均明显受到各胁迫因素的影响,但不同胁迫因素对各参数的影响程度明显不同(表2)。整体来看,各测定参数与SO42-、Cl-和HCO3-浓度之间的相关性较其他胁迫因素之间低,并且与SO42-和HCO3-浓度均未达显著水平(F0.05=0.45,n=16)。叶片相对含水率和各叶绿素荧光参数与各胁迫因素之间的相关系数均较大,但除NPQ与CO32-浓度之间呈显著负相关关系外(P<0.05),总叶绿素含量和NPQ与各胁迫因素之间均未达显著水平(P>0.05)。
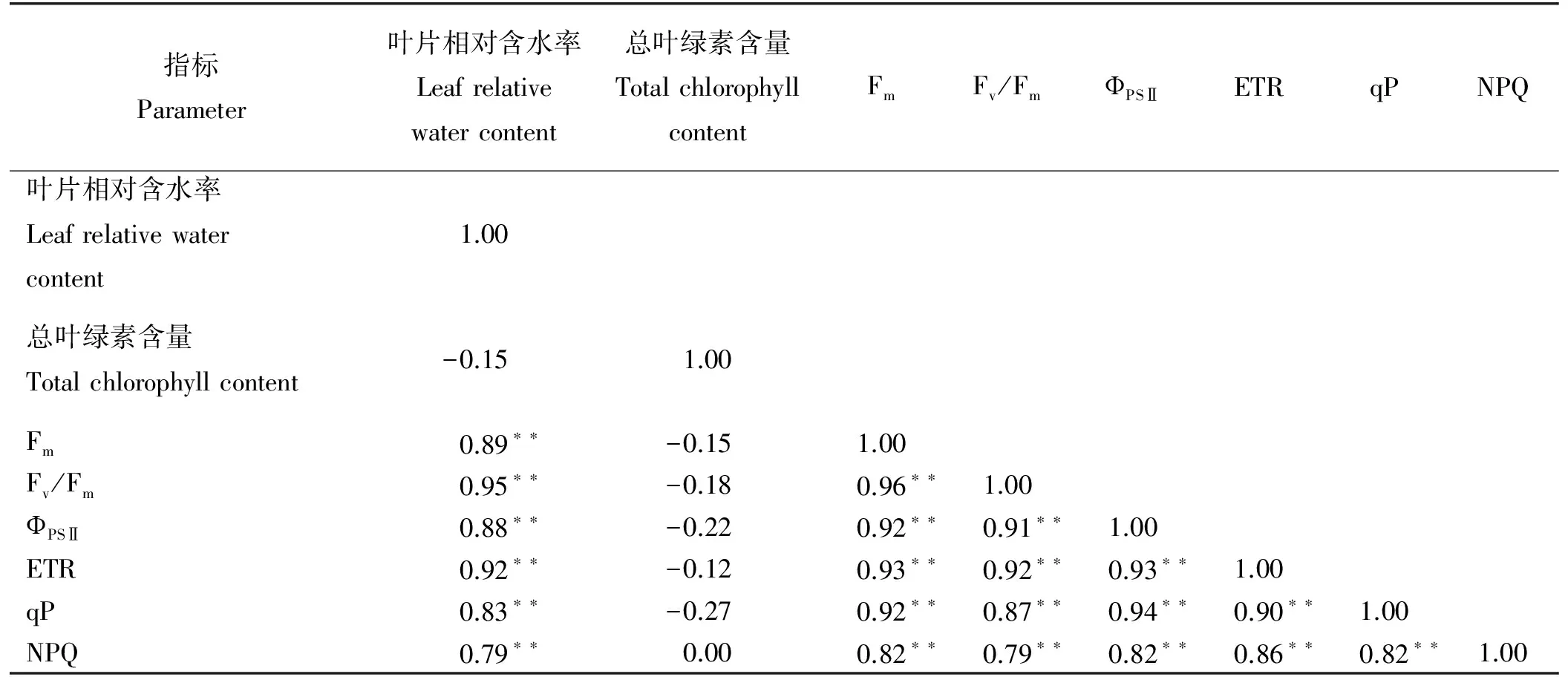
表1 盐碱互作胁迫下各测定参数之间的相关性Table 1 Correlation between coefficient under salt and alkali interaction stress
注:*与**分别表示显著(P<0.05)与极显著(P<0.01)相关。
Note:* and ** indicate significant difference at 0.05 and 0.01 levels, respectively.

表2 各胁迫因素与各测定参数之间的相关分析Table 2 Correlation coefficients between stress factors and chlorophyll fluorescence indexes
3 讨论
盐碱互作胁迫下高丹草叶片的相对含水率与叶绿素荧光参数之间均存在极显著的正相关关系,仅总叶绿素含量与其他参数之间相关性较低,其原因主要是总叶绿素含量的测定标准是以单位质量进行计算的,不但受其自身代谢水平的影响,而且受相对含水率的影响极大,而其他参数的测定中却不受此因素的限制。另外,高丹草的各参数在盐碱互作胁迫下不但受其处理溶液总盐浓度的影响,而且受处理溶液中其他离子水平及pH的影响,相比较而言,处理溶液中CO32-浓度对各参数的影响最大,总盐浓度、Na+和Cl-的影响次之,而受SO42-和HCO3-浓度的影响相对较小。
盐胁迫对植物的危害除了离子的毒害作用外[22-23],土壤中的盐分引起的次生渗透胁迫也会影响植物的根系吸水困难,引起植物的水分胁迫[24]。本研究中,盐浓度50和100 mmol·L-1时,不同pH处理下高丹草叶片相对含水率均无显著差异,说明低盐浓度下高丹草叶片相对含水率对pH的变化不敏感。但当盐浓度增加到150 mmol·L-1,特别是200 mmol·L-1时,高pH(9.0和10.0)处理下高丹草叶片的相对含水率明显降低,说明高丹草叶片相对含水率不但受土壤盐浓度的影响,而且在高盐浓度下,pH的增加也明显降低了高丹草的叶片相对含水率。高盐低pH处理下高丹草叶片相对含水率的降低可能主要是由于盐浓度增加的渗透胁迫引起的,而高盐高pH处理则可能伤害了高丹草根系或叶片的组织结构,造成根系吸水困难。
较高的叶绿素含量是植物在逆境下维持正常光合作用的基础,大量的研究表明盐碱胁迫下降低植物叶片的叶绿素含量[25]。本研究中,盐浓度低于150 mmol·L-1时,高丹草叶片的叶绿素含量随着盐浓度的增加整体呈降低趋势,即盐胁迫抑制了高丹草叶片的叶绿素合成或加速了叶绿素的降解,但当盐浓度增加到200 mmol·L-1时,pH 9.0和10.0处理下高丹草叶片的叶绿素含量却呈上升的趋势,由于本研究的叶绿素含量测定时是由单位质量为单位进行测定的,且此时高丹草叶片相对含水量明显降低,从而导致其单位质量叶绿素含量的增加,这与在桑树(Morusalba)盐碱胁迫研究中的表现规律相似[26]。
逆境下,植物叶片相对含水率和叶绿素含量的降低常导致植物的光合作用受到抑制,叶绿素荧光技术在分析光合作用中光能的吸收和利用待方面发挥着重要的作用[27]。盐胁迫对植物PSⅡ功能的影响在不同植物上的表现不同,有研究认为盐胁迫明显抑制了植物的PSⅡ活性,也有研究认为盐胁迫对植物PSⅡ功能无明显的影响[28-29]。本研究中,随着盐浓度的增加,高丹草叶片的Fm、Fv/Fm、ФPSⅡ、ETR和qP均呈降低趋势,并且在不同盐浓度下上述各叶绿素荧光参数也随着pH的升高而呈明显的降低趋势,即高丹草叶片的PSⅡ反应中心活性对盐和碱的响应比较明显。但在低盐浓度下高丹草叶片的Fm、Fv/Fm、ФPSⅡ、ETR和qP在不同pH下的变化较小,说明高丹草叶片的叶绿素荧光参数在低盐浓度下受pH的影响较小,但当盐浓度增加到150和200 mmol·L-1时,高丹草叶片的各叶绿素荧光参数不但随着盐浓度的增加而降低,并且随着pH增加而明显降低,即在高盐和高pH作用下,高丹草叶片的PSⅡ光化学活性和电子传递受到抑制,PSⅡ反应中心开放程度降低,叶片发生了明显光抑制现象。在低盐浓度下,盐和pH互作效应较小,而在高盐浓度下存在明显的交互作用,即高pH加剧了高盐胁迫下高丹草叶片的PSⅡ反应中心活性抑制程度。逆境下,植物叶片NPQ作为一个重要的去激途径[30],在降低PSⅡ反应中心的压力,有效保护PSⅡ反应中心免受过剩激发能和活性氧的伤害,提高逆境下植物的光合能力具有重要的作用[31-32]。随着盐浓度的增加,不同pH下的高丹草叶片的NPQ均呈先增加后降低的趋势,即在低盐胁迫下高丹草叶片启动了依赖于NPQ的能量耗散机制来提高PSⅡ的耐盐性,但在高盐浓度下这种保护机制受到明显的抑制。但不同pH下NPQ在不同盐浓度下出现的时间不同,其中,pH 7.0和8.0处理下高丹草叶片的NPQ最大值出现在盐浓度为150 mmol·L-1时,而pH 9.0和10.0时的最大值出现在盐浓度为100 mmol·L-1时,即高pH与低pH相比,高丹草叶片的这种热耗散保护机制更容易受到抑制,加剧盐胁迫的伤害程度。这同样也说明了盐和pH对高丹草叶片PSⅡ反应中心光化学活性的影响存在明显的交互作用。
4 结论
高丹草叶片的各生理指标受盐碱互作胁迫下各胁迫因素的影响显著,CO32-浓度对各参数的影响最大,总盐浓度、Na+和Cl-的影响次之。低于100 mmol·L-1的盐浓度下高丹草叶片PSⅡ反应中心的光化学活性无明显影响。随着盐浓度的增加,高丹草叶片PSⅡ光化学效率的降低。高丹草在一定碱性盐浓度范围内可以通过提高NPQ及时耗散过剩的光能,但在高盐浓度下高丹草叶片通过NPQ来耗散过剩光能的保护能力下降,并且高pH下降低幅度更为显著。总之,高丹草叶片的光合能力具有一定的耐盐碱能力,但在盐浓度较高的地区推广高丹草要注意碱化度的影响。
References:
[1] 张会慧,张秀丽,李鑫,丁俊男,朱文旭,齐飞,张婷,田野,孙广玉.NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响.应用生态学报,2012,23(3):625-631.
Zhang H H,Zhang X L,Li X,Ding J N,Zhu W X,Qi F,Zhang T,Tian Y,Sun G Y.Effects of NaCl and Na2CO3stresses on the growth and photosynthesis characteristics ofMorusalbaseedlings.Chinese Journal of Applied Ecology,2011,33(6):121-126.(in Chinese)
[2] Zhu J K.Plant salt tolerance.Trends in Plant Science,2001,6(2):66-71.
[3] 张会慧,张秀丽,朱文旭,许楠,李鑫,岳冰冰,王良再,孙广玉.桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应.北京林业大学学报,2011,33(6):121-126.
Zhang H H,Zhang X L,Zhu W X,Xu N,Li X,Yue B B,Wang L Z,Sun G Y.Responses of photosystem Ⅱ in leaves of mulberry to NaCl and Na2CO3stress.Journal of Beijing Forest University,2011,33(6):121-126.(in Chinese)
[4] Yang C W,Jianar A,Li C Y,Shi D C,Wang D L.Comparison of the effects of salt-stress and alkali-stress on photosynthesis and energy storage of an alkali-resistant halophyteChlorisvirgata.Photosynthetica,2008,46(2):273-278.
[5] 温莹,逯晓萍,任锐,米福贵,韩平安,薛春雷.高丹草EST-SSR标记的开发及其遗传多样性.遗传2013,35(2):225-232.
Wen Y,Lu X P,Ren R,Mi F G,Han P A,Xue C L.Development of EST-SSR marker and genetic diversity analysis inSorghumbicolor×Sorghumsudanenes.Hereditas,2013,35(2):225-232.(in Chinese)
[6] 李源,游永亮,赵海明,刘贵波,武瑞鑫,杨建忠.种植密度对高丹草农艺性状及饲用品质的影响.草业科学,2017,34(8):1686-1693.
Li Y,You Y L,Zhao H M,Liu G B,Wu R X,Yang J Z.Effect of plant density on agronomic traits and forage quality forSorghumbicolor×S.sudanense.Pratacultural Science,2017,34(8):1686-1693.(in Chinese)
[7] 张晓艳,刘锋,王风云,张吉旺,叶梅,董树亭.施氮对杂交苏丹草植株硝态氮累积及产量的影响.草地学报,2009,17(3):327-332.
Zhang X Y,Liu F,Wang F Y,Zhang J W,Ye M,Dong S T.Effects of nitrogen application on nitrate nitrogen accumulation and forage yield ofSorghumbicolor×S.sudanense.Acta Agrestia Sinica,2009,17(3):327-332.(in Chinese)
[8] 于卓,刘永伟,赵晓杰,马艳红,李小雷,赵娜.高粱11A与3种苏丹草杂交种F1的农艺特性及细胞遗传学研究.草业学报,2006,15(1):90-96.
Yu Z,Liu Y W,Zhao X J,Ma Y H,Li X L,Zhao N.Study on the agronomic characters and cytogenetics of Flhybrids between 11A ofSorghumbicolorand 3 kinds ofSorghumsudanense.Acta Agrestia Sinica,2006,15(1):90-96.(in Chinese)
[9] 李源,谢楠,赵海明,刘贵波.不同高丹草品种对干旱胁迫的响应及抗旱性评价.草地学报,2010,18(6):891-895.
Li Y,Xie N,Zhao H M,Liu G B.Evaluations of drought resistance among differentSorghumbicolor×S.sudanensevarieties.Acta Agrestia Sinica,2010,18(6):891-895.(in Chinese)
[10] 李燕青,孙文彦,许建新,李志杰,尹红娟,Lee K B,徐明岗,武海雯,张会民.华北盐碱地耐盐经济作物筛选.华北农学报,2013,28 (增刊):227-232.
Li Y Q,Sun W Y,Xu J X,Li Z J,Yin H J,Lee K B,Xu M G,Wu H W,Zhang H M.The evaluation of salt tolerant cash crops in northern China.Acta Agriculturae Boreali-Sinica,2013,28(S):227-232.(in Chinese)
[11] 赵娜,于卓,马艳红,李小雷,周亚星.高丹草幼苗抗旱和耐盐性的品种间差异.中国草地学报,2007,29(3):39-44.
Zhao N,Yu Z,Ma Y H,Li X L,Zhou Y X.Study on difference of drought resistance and salt tolerance among Pacetter varieties at seedling stage.Chinese Journal of Grassland,2007,29(3):39-44.(in Chinese)
[12] 丁俊男,张会慧,迟德富.土壤菲胁迫对高丹草幼苗叶片光合机构功能的影响.草业科学,2014,31(9):1732-1738.
Ding J N,Zhang H H,Chi D F.Response of photosynthesis in leaves ofSorghumbicolor×S.sudanenseseedlings to phenanthrene polluted soils.Pratacultural Science,2014,31(9):1732-1738.(in Chinese)
[13] 贾婵,呼世斌,张春慧,韩玉婕,王效国,程志文.苏丹草对镉-芘复合污染土壤的修复作用.农业环境科学学报,2014,33(6):1139-1145.
Jia C,Hu S B,Zhang C H,Han Y J,Wang X G,Cheng Z W.Phytoremediation of cadmium and pyrene co-polluted soil by Sudan grass (SorghumvulgareL.).Journal of Agro-Environment Science,2014,33(6):1139-1145.(in Chinese)
[14] 袁馨,魏世强,潘声旺.苏丹草对土壤中菲芘的修复作用.农业环境科学学报,2009,28(7):1410-1415.
Yuan X,Wei S Q,Pan S W.The remediation of phenanthrene and pyrene in soil by Sudan grass(SorghumvulgareL.).Journal of Agro-Environment Science,2009,28(7):1410-1415.(in Chinese)
[15] 庞立东,李卫军,朱进忠.追施氮肥对苏丹草光合特性及种子产量的影响.草业科学,2014,31(12):2286-2292.
Pang L D,Li W J,Zhu J Z.Effects of topdressing nitrogen fertilizer on photosynthetic characteristics and seed yields of Sudangrass.Pratacultural Science,2014,31(12):2286-2292.(in Chinese)
[16] 张会慧,张秀丽,胡彦波,许楠,李鑫,田野,张婷,孙广玉.高粱-苏丹草杂交种的生长特性和光合功能研究.草地学报,2012,20(5):881-887.
Zhang H H,Zhang X L,Hu Y B,Xu N,Li X,Tian Y,Zhang T,Sun G Y.Growth characteristics and photosystemⅡfunctions ofSorghumbicolor×S.sudanenseseedlings under drought stress.Acta Agrestia Sinica,2012,20(5):881-887.(in Chinese)
[17] 詹秋文,林平,李军,钱章强.高粱-苏丹草杂交种研究与利用前景.草业学报,2001,10(2):56-61.
Zhan Q W,Lin P,Li J,Qian Z Q.Research and prospect of hybrid between Sorghum (Sorghumbicolor) and Smut (Sorghumsudanense).Acta Prataculturae Sinica,2001,10(2):56-61.(in Chinese)
[18] 李源,赵海明,游永亮,刘贵波,翟兰菊,武瑞鑫.海河低平原区施氮磷肥对高丹草生产性能及饲用品质的影响.草业科学,2017,34(2):369-377.
Li Y,Zhao H M,You Y L,Liu G B,Zhai L J,Wu R X.Effects of nitrogen and nhosphate fertilizer application on production performance and forage quality forSorghumbicolor×S.sudanensein Haihe lowland plain.Pratacultural Science,2017,34(2):369-377.(in Chinese)
[19] 田祺,张会慧,孙广玉.高丹草种子萌发和幼苗生长对模拟盐碱互作胁迫的响应.安徽农业科学2014,42(6):1707-1710,1736.
Tian Q,Zhang H H,Sun G Y.Effects of simulated salt and alkali interaction stress on the germination and seedlings growth at germination stage ofSorghumbicolor×S.sudanenseseeds.Journal of Anhui Agricultural Sciences,2014,42(6):1707-1710,1736.(in Chinese)
[20] 石德成,盛艳敏,赵可夫.复杂盐碱条件对向日葵胁迫作用主导因素的实验确定.作物学报,2002,28(4):461-467.
Shi D C,Sheng Y M,Zhang K F.Dominant acting factors determination for salt and alkali mixed stresses in the seedlings of sunflower.Acta Agronomic Sinica,2002,28(4):461-467.(in Chinese)
[21] 张会慧,张秀丽,胡彦波,许楠,李鑫,孙广玉.中碱钠盐胁迫对桑树幼苗生长及光合特性的影响.南京林业大学学报(自然科学版),2013,37(1):217-222.
Zhang H H,Zhang X L,Hu Y B,Xu N,Li X,Sun G Y.Effects of NaCl and Na2CO3stresses on growth and photosynthetic characteristics of mulberry seedlings.Journal of Nanjing Forestry University(Nature Science Edition),2013,37(1):217-222.(in Chinese)
[22] Parida A K,Das A B.Salt tolerance and salinity effects on plants:A review.Ecotoxicology and Environmental Safety,2005,60:324-349.
[23] Yan S,Ji J,Wang G.Effects of salt stress on plants and the mechanism of salt tolerance.World Science-Technology Rearch & Development,2006,28(4):70-76.
[24] Munns R,James R A.Approaches to increasing the salt tolerance of wheat and other cereals.Journal of Experimental Botany,2006,57:1025-1043.
[25] Khalid Al-aghabary,Zhu Z J,Shi Q H.Influence of silicon supply on chlorophyll content,chlorophyll fluorescence,and antioxidative enzyme activities in tomato plants under salt stress.Journal of Plant Nutrition,2005,27(12):2101-2115.
[26] 张会慧,张秀丽,李鑫,田野,王娟,孙广玉.桑树幼苗叶片叶绿素荧光特性对不同pH值碱性盐胁迫的响应.华北农学报,2013,8(12):64-69.
Zhang H H,Zhang X L,Li X,Tian Y,Wang J,Sun G Y.Responses of chlorophy Ⅱ fluorescence characteristics in leaves of mulberry seedlings to alkaline salt stress with different pH value.Acta Agriculturae Boreali-Sinica,2013,8(12):64-69.(in Chinese)
[27] 许楠,张会慧,谷思玉,李鑫,朱玉伟,杨艳,刘昆,张秀丽.增施硝态氮对Na2CO3胁迫下桑树幼苗叶片PSⅡ功能的影响.草业科学,2017,34(1):67-74.
Xu N,Zhang H H,Gu S Y,Li X,Zhu Y W,Yang Y,Liu K,Zhang X L.Effects of increased NO-3-N application on PSⅡ function in leaves ofMorusalbaseedlings under Na2CO3stress.Pratacultural Science,2017,34(1):67-74.(in Chinese)
[28] Everard J D,Gucci R,Kann S C,Flore J A,Loescher W H.Gas exchange and carbon partitioning in the leaves of celery (ApiumgraveolensL.) at various levels of root zone salinity.Plant Physiology,1994,106:281-292.
[29] Lu C M,Jiang G M,Wang B S,Kuang T Y.Photosystem Ⅱ photochemistry and photosynthetic pigment composition in saltadapted halophyte Artimisia anethifolia grown under outdoor conditions.Journal of Plant Physiology,2003,160:403-408.
[30] 吴雅娟,查天山,贾昕,秦树高,李媛,王奔.油蒿(Artemisiaordosica)光化学量子效率和非光化学淬灭的动态及其影响因子.生态学杂志,2015,34(2):319-325.
Wu Y J,Cha T S,Jia X,Qin S G,Li Y,Wang B.Temporal variation and controlling factors of photochemical efficiency and non-photochemical quenching inArtemisiaordosica.Chinese Journal of Ecology,2015,34(2):319-325.(in Chinese)
[31] Li X P,Bjorkman O,Shih C,Grossman A R,Rosenquist M,Jansson S,Niyogi K K.A pigment-binding protein essential for regulation of photosynthetic light harvesting.Nature,2000,403:391-395.
[32] 张会慧,张秀丽,李鑫,许楠,孙广玉.盐胁迫下桑树叶片D1蛋白周转和叶黄素循环对PSⅡ的影响.林业科学,2013,49(1):99-106.
Zhang H H,Zhang X L,Li X,Xu N,Sun G Y.Role of D1 protein turnover and xanthophylls cycle in protecting of photosystemⅡfunctions in leaves ofMorusalbaunder NaCl stress.Scientia Silvae Sinicae,2013,49(1):99-106.(in Chinese)
EffectsofsaltandalkaliinteractionstressonchlorophyllfluorescenceinleavesofSorghumbicolor×S.sudanense
Jin Wei-wei1, Zhang Hui-hui2, Teng Zhi-yuan1, Meng Xiang-xin-yue2, Zhang Shu-bo1, Zhang Xiu-li1, Xu Nan1,3, Sun Guang-yu1
(1.College of Life Science, Northeast Forest University, Harbin 150040, Heilongjiang, China; 2.College of resources and environment, Northeast Agricultural University, Harbin 150030, Heilongjiang, China; 3.Natural Resources and Ecology Institute, Heilongjiang Sciences Academy, Harbin 150040, Heilongjiang, China)
In order to identify the physiological responses and tolerance characteristics ofSorghumbicolor×S.sudanenseunder salt and alkali interaction stresses, chlorophyll fluorescence parameters were measured in the leaves. Four salt stresses, 50, 100, 150, and 200 mmol·L-1, were prepared by mixing the neutral salts NaCl and Na2SO4and the alkaline salts Na2CO3and NaHCO3. In addition, 4 pH levels, 7.0, 8.0, 9.0, and 10.0, were used for each salt stress treatment. The analyses showed that physiological parameters inS.bicolor×S.sudanenseleaves were significantly affected by high salt and ion concentrations in the solution and by the concentration of CO32-and total salt concentration. At a low salt concentration, the effects of different pH values on chlorophyll fluorescence parameters were relatively small. When the salt concentration was <100 mmol·L-1, the photochemical activity of the PSⅡ reaction center showed no obvious effect indicating a certain resistance to salt and alkali. But under high salt concentration and high pH conditions, the PSⅡ photochemical efficiency decreased. In addition, the decrease in activity of the PSⅡ reaction center inS.bicolor×S.sudanenseleaves increased with increasing pH values.S.bicolor×S.sudanensecan dissipate excess light energy in a restricted range of salt concentrations by improving non-photochemical quenching (NPQ). However, under high salt concentrations, the protective ability of excess light energy dissipation by NPQ decreased and was further decreased by high pH values. The effects of salt and pH values on physiological parameters inS.bicolor×S.sudanenseleaves showed clear interactions. These interactions increased with the increase in salt concentration, indicating that the influence of pH value was relatively less at low salt concentrations, but the pH effect was greater with the increase in salt concentration. The photosynthetic ability of theS.bicolor×S.sudanenseleaves showed some tolerance to saline and alkali, but the degree of alkalization needs to be taken into consideration when considering growing these plants in high salt concentration areas.
Sorghumbicolor×S.sudanense; PSⅡ; salt stress; alkali salt stress; salt and alkali interaction; pH value; chlorophyll fluorescence
Xu Nan E-mail:xunan0451@126.com
10.11829/j.issn.1001-0629.2017-0065
金微微,张会慧,滕志远,孟祥馨悦,张书博,张秀丽,许楠,孙广玉.盐碱互作胁迫对高丹草叶片叶绿素荧光参数的影响.草业科学,2017,34(10):2090-2098.
Jin W W,Zhang H H,Teng Z Y,Meng X X Y,Zhang S B,Zhang X L,Xu N,Sun G Y.Effects of salt and alkali interaction stress on chlorophyll fluorescence in leaves ofSorghumbicolor×S.sudanense.Pratacultural Science,2017,34(10):2090-2098.
S543+.903.4
A
1001-0629(2017)10-2090-09
2017-02-14
2017-03-24
国家科技支撑项目(2011BAD08B02-3)
金微微(1986-),女,吉林敦化人,在读博士生,主要从事植物生理生态学研究。E-mail:jinwei6677066@163.com
许楠(1982-),男,黑龙江哈尔滨人,助理研究员,博士,主要从事植物生理生态学研究。E-mail:xunan0451@126.com
共同通信作者:孙广玉(1963-),男,黑龙江巴彦人,教授,博士,主要从事植物生理生态学研究。E-mail:sungy@vip.sina.com
Sun Guang-yu E-mail:sungy@vip.sina.com
(责任编辑 张瑾)

