过氧化氢对拟南芥生长素信号转导相关蛋白的影响
刘梦灵, 陈颖华, 张盛春
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
过氧化氢对拟南芥生长素信号转导相关蛋白的影响
刘梦灵, 陈颖华, 张盛春*
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
通过添加外源过氧化氢来探究其对植物生长素信号的影响. 以GUS基因作为报告基因,研究拟南芥中各生长素相关蛋白(生长素含量标志蛋白DR5、输入蛋白AUX1、输出蛋白PIN1和PIN2)对过氧化氢的响应. 结果表明过氧化氢处理后拟南芥呈植株变小、根变短和不定根数目增多的表型;与对照相比,GUS染色后各生长素相关蛋白的表达下降,表明过氧化氢对植物生长素的合成与运输起一定的抑制作用. 在过氧化氢处理的基础上,添加抗氧化物质后发现植株表型有明显恢复,GUS染色也表明相关蛋白的表达量均增加;另外,0.1 nmol/L的外源IAA能恢复过氧化氢处理后拟南芥的表型和生长素相关蛋白的表达. 综上所述,过氧化氢主要通过抑制植物体内的生长素信号来调控植物的生长发育.
拟南芥; 生长素信号; 过氧化氢; 生长发育
Keywords:Arabidopsisthaliana; auxin signal; hydrogen peroxide; growth and development
植物在生长过程中会进行光合作用、呼吸作用以及光呼吸等有氧代谢,这些生理过程均会产生活性氧(Reactive Oxygen Species, ROS),包括超氧阴离子、羟自由基、过氧化氢和单线态氧等[1].
活跃生长组织的质外体专一产生的活性氧可使细胞壁松弛并可代替生长素诱导细胞生长[2]. 叶绿体和线粒体是ROS的主要来源[3]. 植物自身可维持ROS的动态平衡以避免遭受氧化胁迫[4]. 植物在其生长发育过程中,常会经受各种胁迫,植物应对所有这些胁迫的共同特征是产生所谓的活性氧[5-6]. 近年来,ROS特别是H2O2,被认为是重要的信号分子,参与调控一系列重要的植物生理生化过程.
植物激素生长素(Auxin)主要集中在植物幼嫩部位[7],目前认为各种氧化胁迫影响植物生长发育的原因之一是改变植物体内的生长素含量. 植物拥有精细的机制以控制局部生长素稳态,包括控制生长素代谢,亚细胞区室化以及由浆膜驻留转运蛋白介导的定向生长素转运[8-12]. 植物体内生长素在运输过程中需要输入和输出蛋白完成,目前报道得较多的是生长素输入蛋白AUX1[7]、生长素输出蛋白PIN1和PIN2[13-14],PIN蛋白由于其不对称的亚细胞定位而直接限制极性生长素转运[15-17];生长素运输到相应的部位后必须先和靶细胞中的受体结合,再由受体感知激素信号后,把激素信号转导下去,最后引起基因表达,导致一系列的生理生化反应.
对于植物体内H2O2与生长素的相互关系,传统观点认为生长素IAA能够自发地被H2O2所降解. 后期在玉米的研究[18]中发现生长素能够诱导活性氧(ROS)的产生,生长素和重力刺激后玉米根中H2O2含量升高. 近年的研究[19-20]发现氧化还原系统中的某些组分在调控生长素依赖的生物过程中具有主导地位,生长素诱导的反应往往被氧化胁迫所加强. 另外,拟南芥MAPK激酶ANP1抑制生长素响应的过程依赖于H2O2信号[21],并且许多生长素响应基因的表达随着H2O2含量的提高而降低[22-23],为H2O2和生长素信号之间的关系提供了初步的分子证据.
目前对于H2O2是否是通过影响生长素的含量与运输来调控生长素信号进而调控植物生长发育的研究还未见报道. 本论文主要利用模式植物拟南芥研究外源H2O2对生长素含量及运输的影响,以期阐明H2O2调控生长素信号的具体作用机制.
1 材料与方法
1.1 植物材料
本实验采用的5种拟南芥株系包括野生型(WT)、DR5-GUS、AUX1-GUS、PIN1-GUS、PIN2-GUS. 种子洗净后,将其铺于MS板上,4 ℃冰箱放置2 d后,转移至植物培养室培养.
1.2 过氧化氢处理
将培养好的各类拟南芥幼苗分别移植到含0.5 mmol/L H2O2(处理2)的MS培养基中去,每一培养基中移入15株幼苗;移植拟南芥至普通MS培养基中作为对照组(处理1). 对每株拟南芥的原始根长进行标记,放置光下垂直培养,观察拟南芥根的生长情况. 培养5 d后,记下每株幼苗根的总伸长量及不定根的数目,计算经H2O2处理之后每种拟南芥每株幼苗根的日平均伸长量和不定根的平均数目,3次生物学重复.
1.3 GUS组织化学染色及观察
配置GUS染色液,配方为:50 mmol/L磷酸缓冲液(pH为7.0),1 mmol/LEDTA,0.1% Triton X-100,100 mg/L氯霉素,2 mmol/L铁氰化钾,2 mmol/L亚铁氰化钾,加入100 g/L X-Glue母液使其终质量浓度为1 g/L. 取若干支1.5 mL离心管,做好标记,各加入适量的1 mol/L GUS染色液;用镊子夹取各处理条件下培养的拟南芥幼苗若干株分别置于上述离心管中,37 ℃温育3~4 h,期间摇动数次使材料均匀,(如果有GUS基因表达产物,则出现蓝色,肉眼下可以观察染色情况).
显微观察:将染好色的拟南芥在70%酒精下脱色;在玻片上滴加适量的透明液,将拟南芥的根泡在透明液中,盖上盖玻片,显微镜下观察,并分“深色、中间色、浅色、无色”4层次统计好每种拟南芥根的染色情况,并拍照(放大倍数为20倍). 实验进行3次生物学重复.
1.4 抗氧化物质维生素C(Vc)和还原性谷胱甘肽(GSH)处理
将培养好的各类拟南芥幼苗分别移植到含1.25 mg/L Vc(处理3)、1.25 mg/L Vc+0.5 mmol/L H2O2(处理4)、1.25 mg/L GSH(处理5)、1.25 mg/L GSH+0.5 mmol/L H2O2(处理6)的MS培养基中进行培养,统计拍照,GUS染色及显微观察,实验进行3次生物学重复.
1.5 IAA处理
将培养好的各类拟南芥幼苗分别移植到含0.1 nmol/L IAA(处理7)、0.1 nmol/L IAA+0.5 mmol/L H2O2(处理8)、0.5 nmol/L IAA(处理9)、0.5 nmol/L IAA+0.5 mmol/L H2O2(处理10)、1.0 nmol/L(处理11)、1.0 nmol/L IAA+0.5 mmol/L H2O2(处理12)的MS培养基中进行培养,统计拍照,GUS染色及显微观察,3次生物学重复.
2 结果与分析
2.1 H2O2抑制拟南芥根生长及生长素蛋白表达
经0.5 mmol/L H2O2处理5 d后,各种拟南芥与对照组都表现出相似的氧化胁迫表型(图1):根的生长受到明显的抑制,主根变短,不定根数目增多.
与对照组相比,H2O2处理后拟南芥根的生长速度明显减慢(表1),同时,H2O2处理会使各种拟南芥的根(包括主根、不定根)的总数目明显增多,对照组的拟南芥根的数目约2条,但H2O2处理后拟南芥的平均根数达到4条以上.
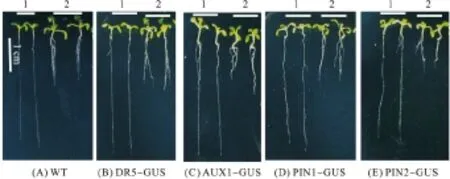
1:对照;2:0.5 mmol/L H2O2处理.
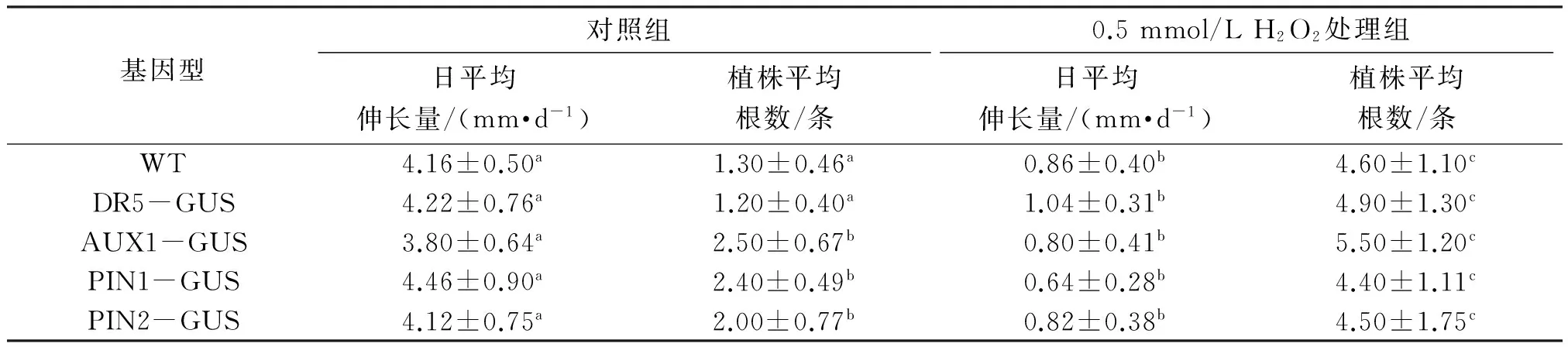
基因型对照组0.5mmol/LH2O2处理组日平均伸长量/(mm·d-1)植株平均根数/条日平均伸长量/(mm·d-1)植株平均根数/条WT4.16±0.50a1.30±0.46a0.86±0.40b4.60±1.10cDR5-GUS4.22±0.76a1.20±0.40a1.04±0.31b4.90±1.30cAUX1-GUS3.80±0.64a2.50±0.67b0.80±0.41b5.50±1.20cPIN1-GUS4.46±0.90a2.40±0.49b0.64±0.28b4.40±1.11cPIN2-GUS4.12±0.75a2.00±0.77b0.82±0.38b4.50±1.75c
注:a、b、c等不同字母表示平均值之间具有显著性差异(P<0.05).
为了探究H2O2处理后拟南芥根的生长受到的抑制作用是否是由生长素信号受到破坏而引起的,研究了生长素相关蛋白在H2O2处理后的表达情况. 选用生长素含量标记蛋白DR5、生长素运输输入蛋白AUX1、生长素运输输出蛋白PIN1和PIN2进行GUS染色. 经过GUS染色后(图2),以上4种蛋白的GUS显色均呈现出深色、中间色、浅色和无色等不同程度的颜色.

图2 H2O2处理后各生长素相关蛋白GUS显色图
H2O2的处理后,蛋白GUS显色中深色所占的比例下降,而且有无色情况的出现,即H2O2处理后,生长素含量标记蛋白DR5、生长素输出蛋白AUX1、生长素输出蛋白PIN1和PIN2的表达量都受到了抑制(表2),从而使得生长素不能正常地起生理效应,最终表现在表型上的变化.
综上所述,H2O2对于各种拟南芥根的生长都表现出较明显的抑制作用,并且根中生长素相关蛋白在H2O2处理后表达明显下降. 所以,H2O2处理可能通过影响植物体内生长素的合成和运输来调控拟南芥根的生长.

表2 H2O2处理后各种拟南芥在GUS染色中显色情况Table 2 Statistical data of the GUS staining results after H2O2 treatment %
2.2 外源抗氧化剂抑制H2O2的作用
H2O2是具有氧化性的物质,理论上添加抗氧化物质可以对H2O2起清除作用,从而减低对植物的危害. 为了研究外源抗氧化剂能够恢复H2O2对植物生长的抑制作用,在H2O2处理的基础上对植物进行了抗氧化剂维生素C(Vc)和还原型谷胱甘肽(GSH)的处理. 结果发现,1.25 mg/L Vc可以促进植物根的生长,表明外源Vc处理可部分恢复H2O2对拟南芥根的抑制(图3).
同样,添加1.25 mg/L GSH处理也可以在一定程度上恢复H2O2处理对拟南芥根生长的抑制作用 (图4).

1:对照;2:0.5 mmol/L H2O2;3:1.25 mg/L Vc;4:1.25 mg/L Vc+0.5 mmol/L H2O2

1:对照;2: 0.5 mmol/L H2O2;5:1.25 mg/L GSH;6:1.25 mg/L GSH+0.5 mmol/L H2O2
对根的具体生长情况进行分析,发现与对照组比较,Vc和GSH处理后能够增加H2O2处理拟南芥根的日伸长量,减少其不定根数(表3),说明Vc或者GSH的添加可以缓解外源H2O2对拟南芥根的胁迫作用,使生长素的合成和运输情况得到了一定的恢复.
结果表明,外源抗氧化剂能够在一定程度上恢复H2O2对根生长的抑制作用,因此进一步研究了外源抗氧化剂对生长素相关蛋白的表达影响. 在添加H2O2处理的基础上,再添加GSH处理后,GUS蛋白均能着色,且深色的比例与H2O2处理相比大大增加. 在添加H2O2处理的基础上,再添加GSH处理也出现类似结果(表4),表明外源抗氧化剂由于还原性可对H2O2起一定的清除作用,从而降低其的抑制作用,使得拟南芥表型和各种生长素相关蛋白表达相对H2O2处理组均有所恢复.

表3 Vc以及GSH处理后拟南芥根的生长情况Table 3 Statistical data of Arabidopsis thaliana roots growth after vitamin C or GSH treatment
注: a、b、c、d等不同字母表示平均值之间具有显著性差异(P<0.05). 处理2~6:0.5 mmol/L H2O2;1.25 mg/L Vc;1.25 mg/L Vc+0.5 mmol/L H2O2;1.25 mg/L GSH;1.25 mg/L GSH+0.5 mmol/L H2O2(表4同).
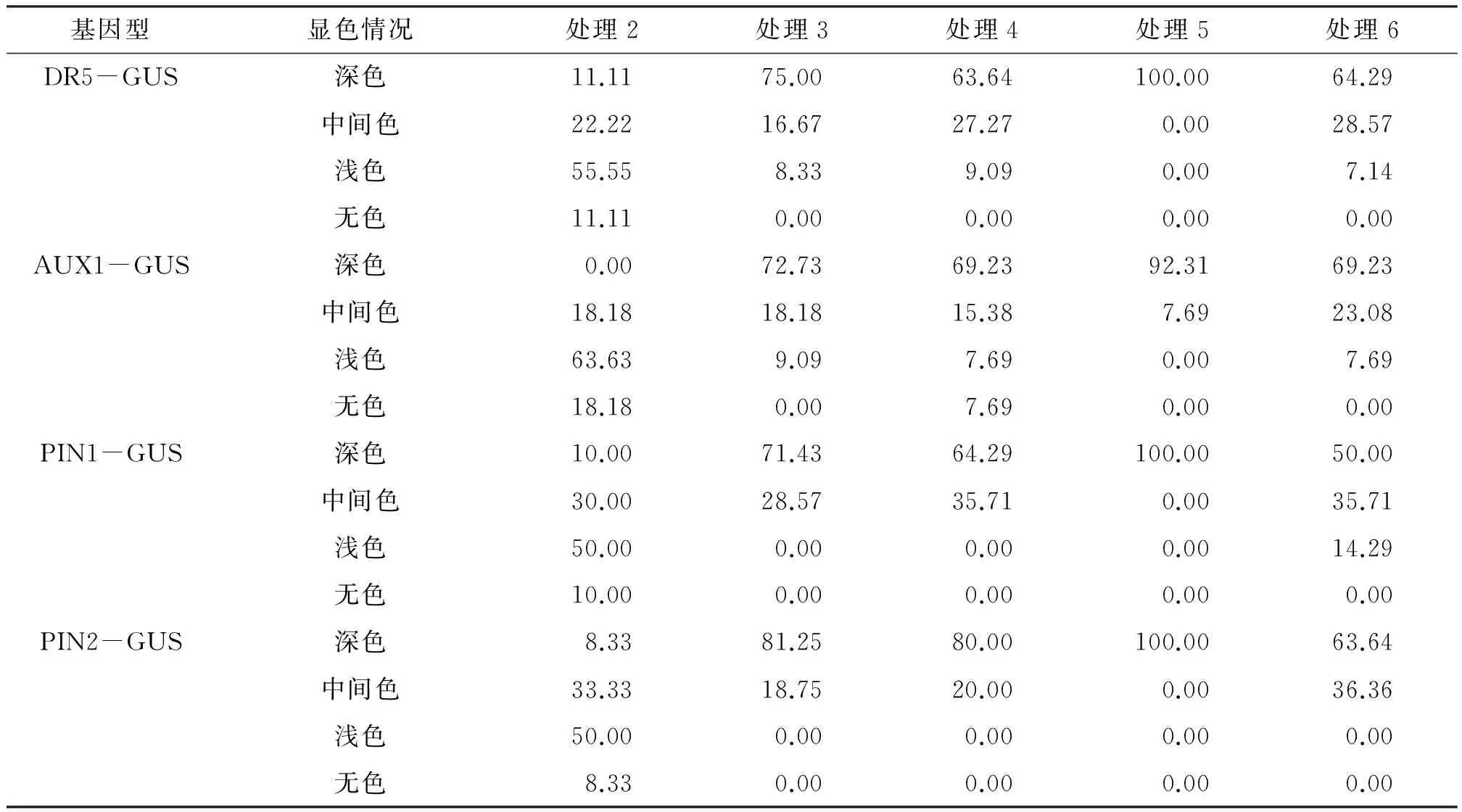
表4 Vc以及GSH处理后GUS染色情况Table 4 Statistical data of the GUS staining results after vitamin C or GSH treatment %
2.3 IAA处理对H2O2作用的影响
从以上结果可知,外源H2O2主要是通过抑制生长素合成和运输来调控植物根的生长发育,那么外源添加生长素能否起一定的恢复作用呢?因此,添加IAA来研究外源生长素IAA能否恢复H2O2处理后拟南芥根的生长及相关蛋白的表达.
选用了0.1、0.5、1.0 nmol/L的IAA进行实验,结果发现外源IAA可对H2O2处理过的拟南芥根生长起到一定的恢复作用,且不同浓度起到的效果不同,其中0.1 nmol/L的IAA效果最为显著(图5).
另外,外源生长素可激发细胞分裂和根原基发生,促进了不定根的形,使拟南芥不定根的数目增加(表5).

1:对照;2:0.5 mmol/L H2O2;7:0.1 nmol/L IAA;8:0.1 nmol/L IAA +0.5 mmol/L H2O2;9:0.5 nmol/L IAA;10:0.5 nmol/L IAA+0.5 mmol/L H2O2;11:1.0 nmol/L IAA;12:1.0 nmol/L IAA+0.5 mmol/L H2O2

图5 不同浓度IAA处理对拟南芥根生长的影响
注: a、b、c、d、e等不同字母表示平均值之间具有显著性差异(P<0.05). 处理2:0.5 mmol/L H2O2;处理7~12:0.1 nmol/L IAA;0.1 nmol/L IAA +0.5 mmol/L H2O2;0.5 nmol/L IAA;0.5 nmol/L IAA + 0.5 mmol/L H2O2;1.0 nmol/L IAA;1.0 nmol/L IAA +0.5 mmol/L H2O2(表6同).
在H2O2处理的基础上,再添加不同浓度IAA处理,结果发现GUS蛋白染色显深色比例上升,并且0.1 nmol/L的IAA的恢复作用最明显(表6),表明添加外源IAA能够恢复生长素相关蛋白的表达.
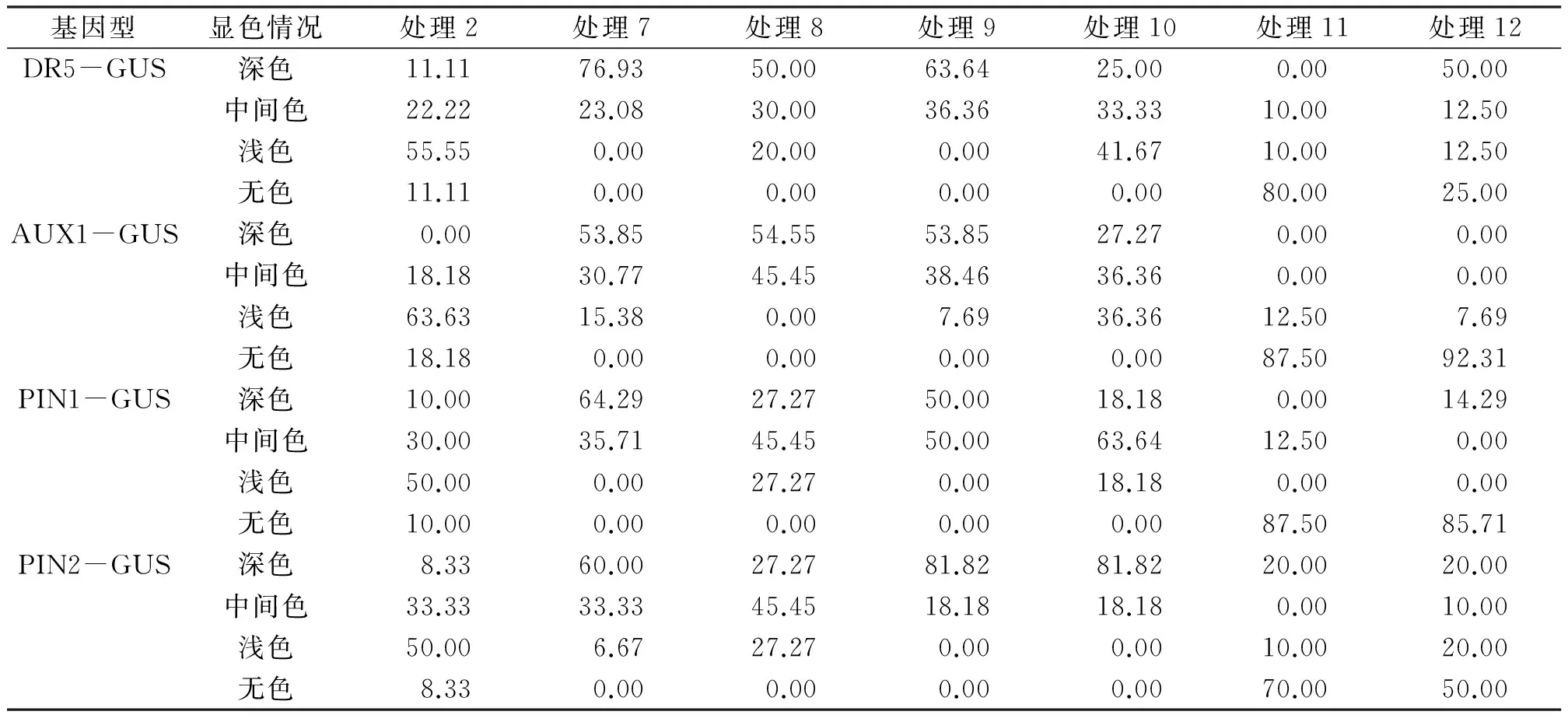
表6 不同浓度IAA处理后GUS染色情况Table 6 Statistical data of A. thaliana roots growth cultured with different concentrations of IAA %
3 讨论
激素从产生到发挥作用都有一个既复杂又完善的过程,生长素也不例外. 在生长素的极性运输中,生长素只能从植物体形态学上端向下端运输[15],原因是携带生长素的载体蛋白位于细胞底部的细胞膜上,顶部则没有,这就促使IAA分子(生长素分子)在薄壁组织中(或韧皮部中)顺序穿过一个个细胞向植株下部运行,不断从细胞底部由载体带出再进入下一个细胞. 植物体内的生长素经过极性运输到达植物体各组织器官起作用的过程中需要各种载体蛋白[11],包括生长素的输入和输出载体,目前发现的输入载体是AUX1膜蛋白,输出载体有PIN和PGP蛋白[18]. 在运输过程中,存在于细胞壁空间的生长素通过扩散作用或输入载体AUX1蛋白的协助作用,从细胞的顶端流入到胞质溶胶;而存在胞质溶胶的生长素又在细胞基部质膜的输出载体PIN和PGP蛋白的协助下进一步输出细胞. 本论文以GUS蛋白作为标记,发现H2O2处理后各种拟南芥中GUS蛋白的显色都相对变浅或是消失,表明输入载体AUX1蛋白与输出载体有PIN蛋白的含量均下降了,植物体内生长素的运输过程受到了抑制. 另外,标志生长素合成量的蛋白DR5的含量也明显减少,表明外源H2O2处理还抑制了植物体内生长素含量. 因此,外源H2O2主要通过抑制生长素的合成和运输来抑制植物体内的生长素信号,最终导致到达作用部位的生长素量较正常时的低,从而影响植物的生长发育.
外源抗氧化物质清除H2O2的抑制作用主要是针对H2O2的氧化性来设计的,已有的研究结果已验证了添加抗氧化剂确实能够降低H2O2的氧化作用. 还原型谷胱甘肽和维生素C都具有还原性,其中还原性谷胱甘肽由于含有巯基(—SH),巯基可与自由基结合,加速自由基的转化,从而起到抗氧化作用;而维生素C的作用机制主要是利用本身的化学特性促使双硫键(—S—S)还原为—SH,从而也有抗氧化作用. 所以添加这2种物质可以对植物体内的H2O2起一定的清除作用,抑制了H2O2对生长素信号的破坏作用,从而使得植物生长受到的影响相对减小. 对于这2种物质起清除、解毒及细胞保护功能作用的内在原因归纳为3种机制: (1)亲核进攻——结合反应;(2)抑制脂质过氧化;(3)清除自由基. 在植物生理、生化过程中,还原性谷胱甘肽和维生素C两者可以运用以上一种或多种机制来对抗有氧化性的物质,从而保护细胞,维持植物的生长.
外源IAA能够在不同程度上抑制外源H2O2对植物生长的抑制作用,主要是因为外源H2O2影响了植物体内生长素的合成和运输,使植物体内的生长素含量和生长素信号不足以维持植物的生长发育,外源IAA则能够弥补植物体内生长素的缺陷,从而恢复植物的生长发育表型.
4 结语
外源H2O2对植物生长发育起调控作用主要是通过调控生长素相关蛋白的表达来起作用,经过H2O2处理后,各生长素相关蛋白包括生长素含量标志蛋白DR5、生长素输入蛋白AUX1、生长素输出蛋白PIN1和PIN2的表达量都下降,这表明H2O2能抑制生长素的合成和运输,这种抑制作用综合表现在植物的表型和相关蛋白表达量的变化;外源抗氧化剂能够抑制H2O2的作用,并且外源生长素能够恢复H2O2处理后植物的生长发育. 但是H2O2影响植物生长素信号的深层分子机制,还有待进一步探究,如如何抑制各种生长素相关蛋白的表达?生长素响应基因如何响应H2O2信号?生长素信号转导能否直接和H2O2信号发生相互作用调控植物的生长发育等等. 这些问题的解决可以为农业、林业生产提供很好的理论依据和应用基础.
[1] RACHANA S,SAMIKSHA S,PARUL P,et al. Reactive Oxygen Species (ROS):beneficial companions of plants’ developmental processes[J]. Frontiers In Plant Science,2016(7):1299.
[2] JUN Y,ZHU L C. ROS regulation during abiotic stress responses in crop plants[J]. Frontiers in Plant Science. 2015(6):1092.
[3] MLLER I,JENSEN P,HANSSON A. Oxidative modifications to cellular components in plants[J]. Annual Review of Plant Biology,2007(58):459-481.
[4] FOYERC H,NOCTOR G. Redox regulation in photosynthetic organisms:signaling,acclimation,and practical implications[J]. Antioxid Redox Signal,2009(11):861-905.
[5] HASANUZZAMAN M,NAHAR K,ALAM M,et al. Physiological,biochemical,and molecular mechanisms of heat stress tolerance in plants[J]. International Journal of Molecular Sciences. 2013,14(5):9643-9684.
[6] SZALONEK M,SIERPIEN B,RYMASZEWSKI W,et al. Potato annexin STANN1 promotes drought tolerance and mitigates light stress in transgenicSolanumtuberosumL. Plants[J]. Plos One,2015,10(7):e0132683.
[7] 李运合,孙光明,吴蓓. 植物生长素的极性运输载体研究进展[J]. 西北植物学报,2009(8):1714-1722.
LI Y H,SUN G M,WU P. Advances in polar transport carrier of plant growth hormone[J]. Northwest Forestry Research,2009(8):1714-1722.
[8] CHENG Y,DAI X,ZHAO Y. Auxin synthesized by the YUCCA flavin monooxygenases isessential for embryo genesis and leaf formation in Arabidopsis[J]. Plant Cell,2007(19):2430-2439.
[9] STEPANOVA A,ROBERTSON-HOYT J,YUN J,et al. TAA1-mediated auxin biosynthesis is essential for hormone crosstalk and plant development[J]. Cell,2008,133(1):177-191.
[10] TAO Y,FERRER J,LJUNG K,et al. Rapid synthesis of auxin via a new tryptophan-dependent pathway is required for shade avoidance in plants[J]. Cell,2008,133(1):164-176.
[11] BARBEZ E,KUBEM,ROLK J,et al,A novel putative auxin carrier family regulates intracellular auxin homeostasis in plants[J]. Nature,2012,485:119-122.
[12] GEISLER M,BLAKESLEE J J,BOUCHARD R,et al. Cellula refflux of auxin catalyzed by the Arabidopsis MDR/PGP transporter AtPGP1[J]. Plant Journal,2005,44:179-194.
[13] 潘建伟,叶晓帆,王超,等. 拟南芥PIN2介导的生长素极性运输调控植物根向地性[J]. 浙江师范大学学报(自然科学版),2010(1):1-6.
PAN J W,YE X F,WANG C,et al. Regulation of polar auxin transport in Arabidopsis plant roots gravitropism PIN2 mediated[J]. Zhejiang Normal University (Natural Science),2010(1):1-6.
[14] MARKUS S,STEFANO M,FRANTISEK B,et al,Aluminium toxicity targets PIN2 in Arabidopsis root apices:effects on PIN2 endocytosis,vesicular recycling,and polar auxin transport[J]. Chinese Science Bulletin,2008(16):2480-2487.
[15] BAND L,WELLS D,FOZARD J,et al,Systems analysis of auxin transport in the Arabidopsis root apex[J]. Plant Cell, 2014,26(3):862-875.
[16] BENNETT T,HINES G,VAN RONGEN M,et al,Connective auxin transport in the shoot facilitates communication between shoot apices[J]. Plos Biology,2016,14(4):e1002446.
[17] REMY E,CABRITO T,BASTER P,et al,A major facilitator superfamily transporter plays a dual role in polar auxin transport and drought stress tolerance in Arabidopsis[J]. Plant Cell,2013,25(3):901-926.
[18] BLAKESLEE J,PEER W,MURPHY A. Auxin transport current opinion in plant biology[J]. Current Opinion in Plant Biology,2005,8(5):494-500.
[19] DUVEZIN-CAUBET S,KOPPEN M,WAGENER J,et al. OPA1 processing reconstituted in yeast depends on the subunit composition of the m-AAA protease in mitochondria[J]. Excerpta Medica Abstract Journal,2007,18(9):3582-3590.
[20] KOLODZIEJCZAK M,GIBALA M,URANTOWKA A,et al. The signifycance of Arabidopsis AAA proteases for activity and assembly/stability of mitochondrial OXPHOS complexes[J]. Physiologia Plant Arum,2010,129(1):135-142.
[21] KOVTUN Y,CHIU W,TENA G,et al. Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(6):2940-2945.
[22] GECHEV T,GADJEV I,HILLE J. An extensive microarray analysis of AAL-toxin-induced cell death inArabidopsisthalianabrings new insights into the complexity of programmed cell death in plants[J]. Cellular & Molecular Life Sciences Cmls,2004,61(10):1185-1197.
[23] GECHEV T,HILLE J. Hydrogen peroxide as a signal controlling plant programmed cell death[J]. Journal of Cell Biology,2005,168(1):17-20.
Effects of Hydrogen Peroxide on Auxin Signal Associated Proteins in Arabidopsis Thaliana
LIU Mengling,CHEN Yinhua,ZHANG Shengchun*
( Guangdong Provincial Key Lab of Biotechnology for Plant Development, School of Life Sciences, South China Normal University, Guangzhou 510631, China)
The effect of exogenous hydrogen peroxide on the auxin signal is studied. TheGUSwas used as the reporter gene to investigate the responses of auxin signaling proteins, including DR5 (a maker of auxin level), AUX1 (auxin input protein), PIN1 and PIN2 (auxin output proteins) to hydrogen peroxide. The results showed thatArabidopsisthalianasdisplayed smaller size, shorter root and increased adventitious root number after hydrogen peroxide treatment. The GUS staining results showed that the expression of auxin-related proteins decreased, and suggested that hydrogen peroxide can inhibit the auxin synthesis and transport. The effects of hydrogen peroxide on the phenotype and the expression of auxin-related proteins inA.thalianacan be restored by some antioxidants, as well as 0.1 nmol/L IAA. The results suggest that the hydrogen peroxide can regulate the plant growth and development by inhibiting the auxin signal.
2015-12-31 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
广东省自然科学基金项目(2014A030313443);2011年广东省教学团队和2013国家级精品课程资源共享课程建设项目(植物生理学)
*通讯作者:张盛春,副教授,Emali:sczhang@scnu.edu.cn.
Q945.3
A
1000-5463(2017)05-0064-08
【中文责编:成文 英文审校:李海航】

