水飞蓟素对大鼠肾脏缺血再灌注损伤的保护作用及机制探讨
董建,杨洁,史国辉
(华北理工大学附属医院 肾内科,河北 唐山 063000)
水飞蓟素对大鼠肾脏缺血再灌注损伤的保护作用及机制探讨
董建,杨洁,史国辉
(华北理工大学附属医院 肾内科,河北 唐山 063000)
目的探索水飞蓟素对大鼠肾脏缺血再灌注损伤(IRI)的保护作用及是否与抑制NF-κB活化有关。方法将30只成年雄性SD大鼠随机为假手术组(S组)、缺血再灌注模型组(IR组)及药物组(SM组)。全自动生化分析仪检测血肌酐、血尿素氮,HE染色检测肾小管损伤程度,免疫组织化学检测肾脏IL-6及NF-κB p65表达,酶联免疫吸附法测定肾组织匀浆上清液NF-κB、IL-6浓度。结果IR组血肌酐、尿素氮、组织匀浆细胞核内NF-κB及细胞浆中IL-6水平较S组升高(P<0.05),SM组较IR组降低(P<0.05),IR组肾小管损伤较重,肾脏IL-6、NF-κB p65表达增强。而给药组肾小管损伤减轻,肾脏IL-6、NF-κB p65表达减弱。结论水飞蓟素对大鼠肾脏缺血再灌注损伤具有保护作用,其与抑制NF-κB活化有关。
水飞蓟素;大鼠;缺血再灌注损伤;NF-κB
急性肾损伤(acute kidney injury,AKI)的发病率及死亡率较高,全球每年超过1 300万患者发病,每年大约可引起170万人死亡[1-2]。肾缺血再灌注损伤(ischemia-reperfusion injury,IRI)是诱发急性肾损伤较为重要的原因,其在休克、肾移植[3-4]、肾动脉血管成形术及造影剂肾病等疾病中较为常见[5-8],并可导致内皮细胞激活及白细胞黏附,影响微血管血流动力学[9]。缺血诱导的炎症应答常常会引起细胞损伤或坏死[10]。肾脏IRI预后常常较差,目前并未有效的治疗方法。核因子 -κB(nuclear factor κB,NF-κB)是在转录过程中RNA聚合酶转录时所需要的一种辅助因子,由调节多种生物应答的转录因子家族构成[11]。NF-κB信号传导通路的改变会引起多种炎症性疾病的发生,其中就可出现在肾脏IRI疾病的炎症反应中[12]。哺乳动物NF-κB家族由5个成员组成:p65(RelA)、c-Rel、RelB、p50/p105(NF-κB1)及 p52/p100(NF-κB2),其形成不同的异源二聚体或同源二聚体[13]。在正常生理状态时,NF-κB与核转录因子κB抑制蛋白(inhibitory kappa B,ⅠκB)在胞质中结合,其活性被抑制,当有外界刺激如创伤、感染等时,ⅠκB会被ⅠκB酶复合物磷酸化而失去抑制作用,ⅠκB开始泛素化,随后被特定蛋白酶降解,NF-κB变成游离状态进入细胞核内[14],结合靶向基因的启动子或增强子区域的特定序列,调节促炎基因等相关基因的转录,进而改变多种炎症相关因子及酶类物质的表达,如白细胞介素6(interleukin-6,IL-6)。同时编码ⅠκB蛋白使细胞恢复稳态[15]。
水飞蓟素是从水飞蓟种子中提取的黄酮类混合物,具有明显的抗炎作用,可以抑制炎症信号的表达和中性粒细胞的迁移,稳定肥大细胞。过去水飞蓟素常常作为保肝药物使用,近些年发现其对其他脏器同样有一定的保护作用。TAN等发现水飞蓟素可以降低肾IRI大鼠血清肌酐、尿素氮水平[16],但相关研究相对较少且其机制尚不明确。鉴于水飞蓟素明显的抗炎作用、本身无毒副作用和对多种器官的保护作用,其对大鼠肾脏IRI的保护作用及其是否与抑制NF-κB活化有关有待于进一步研究。
1 材料与方法
1.1 实验动物
健康成年雄性SD大鼠,无特定病原体(SPF)级环境饲养,体重250~290 g[购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003],购自华北理工大学动物实验中心动物房饲养7 d,以适应环境。12 h光照环境,12 h黑暗环境,可自由获取食物和水。本实验的动物处理方法经华北理工大学医学伦理委员会商议后批准。
1.2 仪器与试剂
Olympus电动正置显微镜(日本奥林巴斯公司),酶标仪(美国BIO-RAD公司),全自动生化检测仪(美国Benckman公司),水飞蓟素胶囊(德国马博士大药厂,生产批号:B1403206),IL-6、NF-κB p65免疫组织化学(免疫组化)试剂盒(购自北京博奥森生物技术有限公司),NF-κB及IL-6酶联免疫吸附测定(ELISA)试剂盒(购自上海酶联生物科技有限公司)。
1.3 方法
选用随机数字法将30只雄性大鼠分为3组,分别为假手术组(S组)、缺血再灌注模型组(IR组)及药物组(SM组)。各组处理情况:S组及IR组术前给予生理盐水灌胃7 d,SM组术前给予水飞蓟素100 mg/(kg·d)灌胃7 d。术前12 h给予禁食水,腹腔缓慢注射10%水合氯醛(300 mg/kg)麻醉大鼠后,仰卧位固定。剑突下至耻骨联合上备皮并用安尔碘消毒3次,充分暴露手术区域,手术器械于高压蒸汽灭菌器内120℃,40 min灭菌。术中使用生理盐水浸湿纱布保护腹腔脏器,同时注意保暖。手术切口3~4 cm,腹中线逐层切开皮肤、皮下组织、肌肉及腹膜,逐层打开腹腔。IR组、SM组结扎右侧输尿管及右侧肾动静脉,摘取右侧肾脏,无创动脉夹阻断左侧肾脏血液供应,夹闭左侧肾动静脉40 min,再灌注24 h后,给予10%水合氯醛腹腔注射再次麻醉大鼠,逐层打开腹腔,留取血液样品及肾组织。S组不给予缺血再灌注处理,其余步骤与其他组相同。取出各组左侧肾脏后分别沿冠状面和矢状面切成4分,一部分立即放入4%多聚甲醛中固定12~24 h,包埋制成蜡块,放于4℃冰箱冷冻中保存。一部分肾脏迅速放入-180℃液氮罐中速冻,后保存在-80℃低温冰箱中,用于组织匀浆的制备,组织匀浆上清液保存于-20℃。用含有促凝集的真空管抽取下腔静脉血3.5 ml,放入4℃冰箱中。应用Benckman全自动生化检测仪测量血清肌酐及尿素氮浓度;HE染色后,在Olympus电动正置显微镜下观察肾病组织病理学改变;免疫组织化学染色检测NF-κB p65在细胞核中的表达及IL-6在细胞浆中的表达;ELISA检测肾组织匀浆细胞核NF-κB及细胞浆IL-6浓度。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肾功能检测结果
各组大鼠肾脏缺血再灌注40 min后,各组大鼠血肌酐浓度变化差异有统计学意义(F=198.993,P=0.000),两两比较经LSD-t检验,IR组血肌酐浓度高于S组(t=19.938,P=0.000),但SM组血肌酐浓度较IR 组低(t=9.377,P=0.000),但高于 S组(t=10.561,P=0.000)。各组大鼠血尿素氮浓度变化差异有统计学意义(F=450.588,P=0.000),IR 组血尿素氮浓度高于 S组(t=30.472,P=0.000),但 SM 组血尿素氮浓度较IR组低(t=20.183,P=0.000)。见表1。
2.2 肾脏病理结果
S组肾小球、肾小管清晰可见,结构完整,无异常改变。IR组镜下可见肾组织皮髓质交界区大量肾小管肿胀、坏死,刷状缘脱落,部分肾小管阻塞,肾间质有大量中性粒细胞浸润。SM组肾小管肿胀较轻,无坏死及未见肾基膜破裂及刷状缘脱落,肾间质仅有少量中性粒细胞浸润。见图1。
2.3 免疫组织化学观察结果
IR组肾组织中包浆IL-6、胞核NF-κB p65表达水平高于S组,SM组包浆IL-6、胞核NF-κB p65表达较IR组降低,但仍高于S组。见图2、3。
表1 各组大鼠血肌酐及血尿素氮浓度比较 (n=10,±s)

表1 各组大鼠血肌酐及血尿素氮浓度比较 (n=10,±s)
注:1)与 S组比较,P <0.05;2)与 IR 组比较,P<0.05
组别血肌酐/(μmol/L)血尿素氮/(mmol/L)S 组(n=10) 46.67±5.20 6.02±0.42 IR 组(n=10) 151.51±15.521) 27.59±2.511)SM 组(n=10) 102.21±12.121) 13.31±1.011)2)F值 198.993 450.588 P值 0.000 0.000
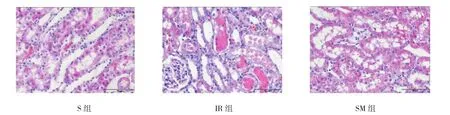
图1 各组大鼠肾小管染色结果比较 (HE×400)
2.4 ELISA检测结果
各组大鼠细胞核NF-κB浓度变化差异有统计学意义(F=95.892,P=0.000),IR 组细胞核 NF-κB浓度高于 S组(t=13.694,P=0.000),但SM组NF-κB浓度较IR组低(t=8.639,P=0.000),但高于S组(t=5.055,P=0.000)。各组大鼠细胞质IL-6浓度变化差异有统计学意义(F=1618.489,P=0.000),IR 组细胞质IL-6浓度高于 S组(t=56.892,P=0.000),SM组 IL-6浓度高于 S组(t=28.022,P=0.000),SM 组IL-6浓度较IR组低(t=28.870,P=0.000)。见表2。

图2 各组大鼠IL-6的表达 (免疫组织化学×400)
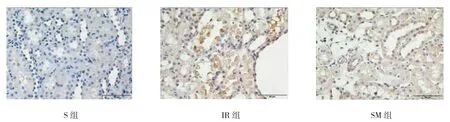
图3 各组大鼠NF-κB p65的表达 (免疫组织化学×400)
表2 各组大鼠肾脏细胞核NF-κB及细胞浆IL-6浓度比较 (n=10,ng/g,±s)

表2 各组大鼠肾脏细胞核NF-κB及细胞浆IL-6浓度比较 (n=10,ng/g,±s)
注:1)与 S组比较,P <0.05;2)与 IR 组比较,P <0.05
组别 NF-κB IL-6 S 组(n=10) 0.62±0.06 144.32±23.91 IR 组(n=10) 1.47±0.211) 1 890.31±97.641)SM 组(n=10) 0.93±0.111)2) 1 004.31±63.431)2)F值 95.892 1618.489 P值 0.000 0.000
3 讨论
在正常肾脏组织中,炎症因子水平较低,但在病理状态下易急剧升高,肾小球滤过率快速下降与肾小管、肾小球的变化伴随间质性炎症有关[17],IRI可以通过诱发内皮细胞功能紊乱、刺激白细胞介导炎症反应、降低微小血管的血流量引起急性肾损伤[18]。建立缺血再灌注损伤模型很多,该损伤均与炎症反应有较为密切的关系。炎症是导致肾脏IRI的主要因素[19],大量的炎症介质与肾脏IRI有关,如IL-6可以激活中性粒细胞、淋巴细胞及单核巨噬细胞等向损伤部位聚集,发生炎症反应损伤肾组织。在缺血再灌注损伤后,TNF-α抑制剂减轻炎症改变[20]。在HgCl2介导的大鼠急性肾损伤模型中,肾脏IL-19的表达水平较高[21]。在遭受IRI的细胞悬液中,模型组中的TNF-α、IL-6和单核细胞趋化蛋白 -1(monocyte chemotactic protein 1,MCP-1)浓度高于对照组[22]。在本实验中,IR组肾组织中IL-6的表达升高,而在SM组IL-6表达降低。
一直以来,NF-κB通路被认为是典型的促炎信号通路,很大程度上被细胞因子、趋化因子及黏附分子等促炎基因的表达影响[23],NF-κB可以被多种致病因素活化,有文献报道,NF-κB在缺血时活化,再灌注12 h开始升高,2~3 d达到顶峰[24]。预先给予大鼠NF-κB抑制剂不仅抑制由IR引起的NF-κB的活化,且阻止MCP-1 mRNA的表达,表明NF-κ B在IRI炎症的开始占有重要角色[25]。转录因子p65是NF-κB家族中的一员,可以调节大多数NF-κB靶基因[26],p65基因敲除大鼠只会有较弱的外周炎症反应[27]。本研究结果显示,术前给予大鼠水飞蓟素灌胃7 d,与IR组相比,SM组降低血清肌酐、血清尿素氮及中性粒细胞的浸润,改善了肾功能,减轻肾小管损伤,免疫组织化学检测细胞核NF-κBp65及细胞浆IL-6表达水平较IR降低,ELISA检测肾组织匀浆细胞核NF-κB及细胞浆IL-6浓度SM组偏低,表明水飞蓟素可以改善肾功能,抑制NF-κB的活化,进而降低IL-6的表达。
综上所述,目前研究可以证实水飞蓟素对大鼠肾脏缺血再灌注损伤具有保护作用其可能与抑制NF-κB活化有关。临床肾缺血再灌注损伤患者病情较为复杂,常常合并多种疾病,且目前并未明确有效保护肾脏IRI的药物应用于临床,而本实验发现水飞蓟素可以改善大鼠肾功能、减轻肾脏损伤,其与抑制NF-κB的活化有关,此外水飞蓟素还对心脏、脑、胃及肠IRI有保护作用,更适合临床应用。但水飞蓟素是否可以通过影响ⅠκB的活性抑制NF-κB活化还需进一步研究。
[1]MEHTA R L,CERD?J,BURDMANN E A,et al.International society of nephrology's 0by25 initiative for acute kidney injury(zero preventable deaths by 2025):a human rightscasefor nephrology[J].Lancet,2015,385(9987):2616-2643.
[2]BELLOMO R,KELLUM J A,RONCO C.Acute kidney injury[J].Lancet,2012,380(9843):756-766.
[3]JANG H R,KO G J,WASOWSKA B A,et al.The interaction between ischemia-reperfusion and immune responses in the kidney[J].J Mol Med(Berl),2009,87(9):859-864.
[4]SEMENTILLI A,FRANCO M.Renal acute cellular rejection:correlation between the immunophenotype and cytokine expression of the inflammatory cells in acute glomerulitis,arterial intimitis,and tubulointerstitial nephritis[J].Transplant Proc,2010,42(5):1671-1676.
[5]FRIEDERICKSEN D V,van DER MERWE L,HATTINGH T L,et al.Acute renal failure in the medical ICU still predictive of high mortality[J].S Afr Med J,2009,99(12):873-875.
[6]MANSANO A M,VIANNA P T,FABRIS V E,et al.Prevention of renal ischemia/reperfusion injury in rats using acetylcysteine after anesthesia with isoflurane[J].Acta Cir Bras,2012,27(4):340-345.
[7]MORGAN C J,GILL P J,LAM S,et al.Peri-operative interventions,but not inflammatory mediators,increase risk of acute kidney injury after cardiac surgery:a prospective cohort study[J].Intensive Care Med,2013,39(5):934-941.
[8]SHIMIZU S,SAITO M,KINOSHITA Y,et al.Nicorandil ameliorates ischaemia-reperfusion injury in the rat kidney[J].Br J Pharmacol,2011,163(2):272-282.
[9]BONVENTRE J V,ZUK A.Ischemic acute renal failure:an inflammatory disease[J].Kidney Int,2004,66(2):480-485.
[10]GLODOWSKI S D,WAGENER G.New insights into the mechanisms of acute kidney injury in the intensive care unit[J].J Clin Anesth,2015,27(2):175-180.
[11]YAN R,LI Y,ZHANG L,et al.Augmenter of liver regeneration attenuates inflammation of renal ischemia/reperfusion injury through the NF-kappa B pathway in rats[J].Int Urol Nephro,2015,47(5):861-868.
[12]FRANTZ S,TILLMANNS J,KUHLENCORDT P J,et al.Tissue-specific effects of the nuclear factor kappa B subunit p50 on myocardialischemia-reperfusion injury[J].Am J Pathol,2007,171(2):507-512.
[13]GHOSH S,HAYDEN M S.Celebrating 25 years of NF-κB research[J].Immunol Rev,2012,246(1):5-13.
[14]HINZ M,ARSLAN S Ç,SCHEIDEREIT C.It takes two to tango:IκBs,the multifunctional partners of NF-κB[J].Immunol Rev,2012,246(1):59-76.
[15]NATOLI G.NF-κB and chromatin:ten years on the path from basic mechanisms to candidate drugs[J].Immunol Rev,2012,246(1):183-192.
[16]TAN J,HU J,HE Y,et al.Protective role of silymarin in a mouse modelofrenalischemia-reperfusion injury[J].Diagn Pathol,2015,10(1):198.
[17]LAMEIRE N H,BAGGA A,CRUZ D,et al.Acute kidney injury:an increasing global concern[J].Lancet,2013,382(9887):170-179.
[18]MUNSHI R,HSU C,HIMMELFARB J.Advances in understanding ischemic acute kidney injury[J].BMC Med,2011,9(1):11.
[19]BONVENTRE J V,WEINBERG J M.Recent advances in the pathophysiology of ischemic acute renal failure[J].J Am Soc Nephrol,2003,14(8):2199-2200.
[20]GERLACH U A,ATANASOV G,WALLENTA L,et al.Shortterm TNF-alpha inhibition reduces short-term and long-term inflammatory changes post-ischemia/reperfusion in rat intestinal transplantation[J].Transplantation,2014,97(7):732-739.
[21]HSU Y H,LI H H,SUNG J M,et al.Interleukin-19 mediates tissue damage in murine ischemic acute kidney injury[J].PLoS One,2013,8(2):e56028.
[22]DONG X,SWAMINATHAN S,BACHMAN L A,et al.Resident dendritic cells are the predominant TNF-secreting cell in early renal ischemia-reperfusion injury[J].Kidney Int,2007,71(7):619-628.
[23]LAWRENCE T.The nuclear factor NF-kappa B pathway in inflammation[J].Cold Spring Harb Perspect Biol,2009,1(6):a001651.
[24]MARKÓ L,VIGOLO E,HINZE C.Tubular epithelial NF-κB activity regulates ischemic AKI[J].J Am Soc Nephrol,2016,27(9):2658-2669.
[25]SUNG F L,ZHU T Y,AU-YEUNG K K,et al.Enhanced MCP-1 expression during ischemia/reperfusion injury is mediated by oxidative stress and NF-kappa B[J].Kidney Int,2002,62(4):1160-1170.
[26]GASPARINI C,FELDMANN M.NF-κB as a target for modulating inflammatory responses[J].Curr Pharm Des,2012,18(35):5735-5745.
[27]LUO J G,ZHAO X L,XU W C,et al.Activation of spinal NF-κB/p65 contributes to peripheral inflammation and hyperalgesia in rat adjuvant-induced arthritis[J].Arthritis Rheumatol,2014,66(4):896-906.
Protective effect of Silymarin on renal ischemia-reperfusion injury in rats
Jian Dong,Jie Yang,Guo-hui Shi
(Department of Nephrology,North China University of Science and Technology Affiliated Hospital,Tangshan,Hebei 063000,China)
ObjectiveTo investigate the protective effect of Silymarin on renal ischemia-reperfusion injury(IRI)and its underlying inhibiting mechanism towards nuclear factor κB(NF-κB).MethodsA total of 30 male sprague-dawley(SD)rats were randomly divided into three groups:sham operation(S)group,IRI (IR)group and IRI plus Silymarin(SM)group.Serum creatinine(Cr)and blood urea nitrogen(BUN)were analyzed with automatic biochemical analyzer.Hematoxylin-eosin (HE)staining was performed for histological grading of kidney injury.Expression of interleukin 6 (IL-6)and NF-κB p65 was identified by Immunohistochemical staining and Enzyme-linked immunosorbent assay (ELISA).ResultsCirculating Cr,BUN,NF-κB and IL-6 were elevated significantly in the IR group compared with those in the S group (P<0.05),and those in the SM group (P<0.05).Animals in the IR group experienced obvious increase of renal tubular damage and expression of IL-6 and NF-κB,which were ameliorated with treatment of Silymarin.ConclusionsInactivation of NF-κB signaling pathway mediates protective effect of Silymarin on renal ischemia-reperfusion.
Silymarin;rat;ischemia-reperfusion injury;NF-κB
R692
A
10.3969/j.issn.1005-8982.2017.24.004
1005-8982(2017)24-0017-05
2017-03-07
史国辉,E-mail:saint40@sina.com
(王荣兵 编辑)

