不同血氧饱和度影响主肺动脉压力变化的离体血管模型研究
温彬,刘垚,孟健,李勇男,唐跃,潘湘斌
不同血氧饱和度影响主肺动脉压力变化的离体血管模型研究
温彬,刘垚,孟健,李勇男,唐跃,潘湘斌
目的:建立不同血氧饱和度影响主肺动脉压力变化的离体模型,为进一步探索肺动脉高压机制提供研究平台。
方法:取新西兰大耳白兔20只,随机选取5只作为正常对照组。其余15只分离肺动脉后将血管置于培养液中,并接入体外循环系统;以新鲜肝素化兔血灌流培养48 h,灌注压力维持40 mmHg(1 mmHg=0.133 kPa);期间通过调节膜肺给氧量控制血氧饱和度,建立3个模型组(n=5):高饱和度组(90%~100%)、中饱和度组(65%~75%)、低饱和度组(40%~50%)。转流结束后获取离体血管和正常对照组兔肺血管行病理形态分析、肺动脉组织IPP6.0定量分析以及匀浆一氧化氮含量分析比较。
结果:3个模型组转机时间均达到48 h,压力稳定控制在40 mmHg,血氧饱和度由高到低分别为(97.94±1.01)%、(72.14±12.85)%、(43.83±8.71)% (P<0.05)。病理分析结果显示:与正常对照组兔肺动脉相比,3个模型组离体培养的肺动脉管壁均明显增厚;随着血氧饱和度降低,3个模型组离体培养的肺动脉弹力纤维逐渐增多、增粗,差异均有统计学意义(P<0.05)。
结论:本实验建立了不同血氧饱和度影响主肺动脉压力变化的离体血管模型。
高血压,肺性;模型,心血管;血氧饱和度
完全型大动脉转位(transposition of great arteries,TGA)是一种左右心室和主动脉、肺动脉位置异常的疾病。我们在临床工作中发现,合并室间隔缺损(vascular septal defect,VSD)的大动脉转位(TGA)所致的肺动脉高压比单纯VSD导致的肺动脉高压具有更好的手术适应证[1]。进一步活检发现,在相同的肺动脉压力下,TGA患者肺血管重构程度较轻[2],可能与TGA患者肺动脉连接于解剖左心室、肺动脉内血氧饱和度异常增高有关。
上述发现为研究肺动脉高压提供了新的方向,但是,难以在人体上进一步探索发生机制,急需构建动物模型提供研究平台。由于TGA患者心脏结构改变巨大,影响肺动脉高压进展的因素极为复杂,目前少有动物模型能够模拟。为了模拟不同血氧饱和度所产生的差异性,我们建立了一种新型离体血管模型,在恒定压力下体外培养主肺动脉,同时通过膜肺给氧调控血氧饱和度,以研究不同血氧饱和度对高压环境下肺动脉重构的影响。
1 材料与方法
实验动物与分组:本实验经由中国医学科学院阜外医院实验动物福利与伦理审查委员会批准,动物实验由心血管植入材料临床前研究评价北京市重点实验室完成(依托单位中国医学科学院阜外医院动物实验中心)。选取成年健康雄性新西兰大耳白兔20只,清洁级,体重2.5 kg左右(北京维通利华实验动物技术有限公司),随机选取5只作为未灌注培养的正常对照组,其余15只依据离体血管培养时的血氧饱和度随机分为3个模型组(n=5):高饱和度组(90%~100%)、中饱和度组(65%~75%)、低饱和度组 (40%~50%)。
离体血管制备:称重,经兔耳缘静脉分别注射1%肝素钠溶液(200 U/kg),3%戊巴比妥钠溶液(1 ml/kg)。麻醉满意后仰卧固定,胸腹部备皮,消毒,剪开腹壁,暴露下腔静脉。16G套管针穿刺下腔静脉,50 ml无菌注射器采血,注入一次性使用塑料血袋(四川南格尔生物科技有限公司)中待用。取血后,向上延长腹部切口,解剖暴露胸腔,迅速联合摘取心肺并置于无菌培养皿中,在此过程中注意不损伤肺动脉。无菌培养皿放入冰盒内,精细分离主肺动脉及左右肺动脉,剪去纤维结缔组织和肺组织。分别经右心室和肺血管分支远端插入一次性动脉插管,插管不宜深入,以免损伤血管内皮,3-0丝线绑扎连接处。弱势血管分支端留置22G套管针并连接powerlab生理记录仪,用于循环压力监测。各分支置管完毕后剪去心脏和其余肺组织。
循环回路构建:离体血管循环系统(图1)包括动物体外循环配套回流室及管路(东莞科威医疗用品公司)、滚压泵(德国Stockert)、特制动物膜肺(东莞科威医疗用品公司)、光学血氧饱和度监测接头(美敦力Biotrend氧饱和度仪)。回流室距离体血管高度约为30 cm,维持压力恒定。滚压泵转速均匀,提供平稳血流。膜肺进气口连接空氧混合器并接入中心供气系统,提供稳定浓度和流量的氧气。离体血管置于DMEM高糖培养液中(包含100 IU/L青霉素、100 mg/L链霉素、10 μg/L的两性霉素B、5%的胎牛血清),并置于二氧化碳恒温培养箱(美国Thermo Fisher Scientific)中,设定温度37℃,二氧化碳浓度为5%。
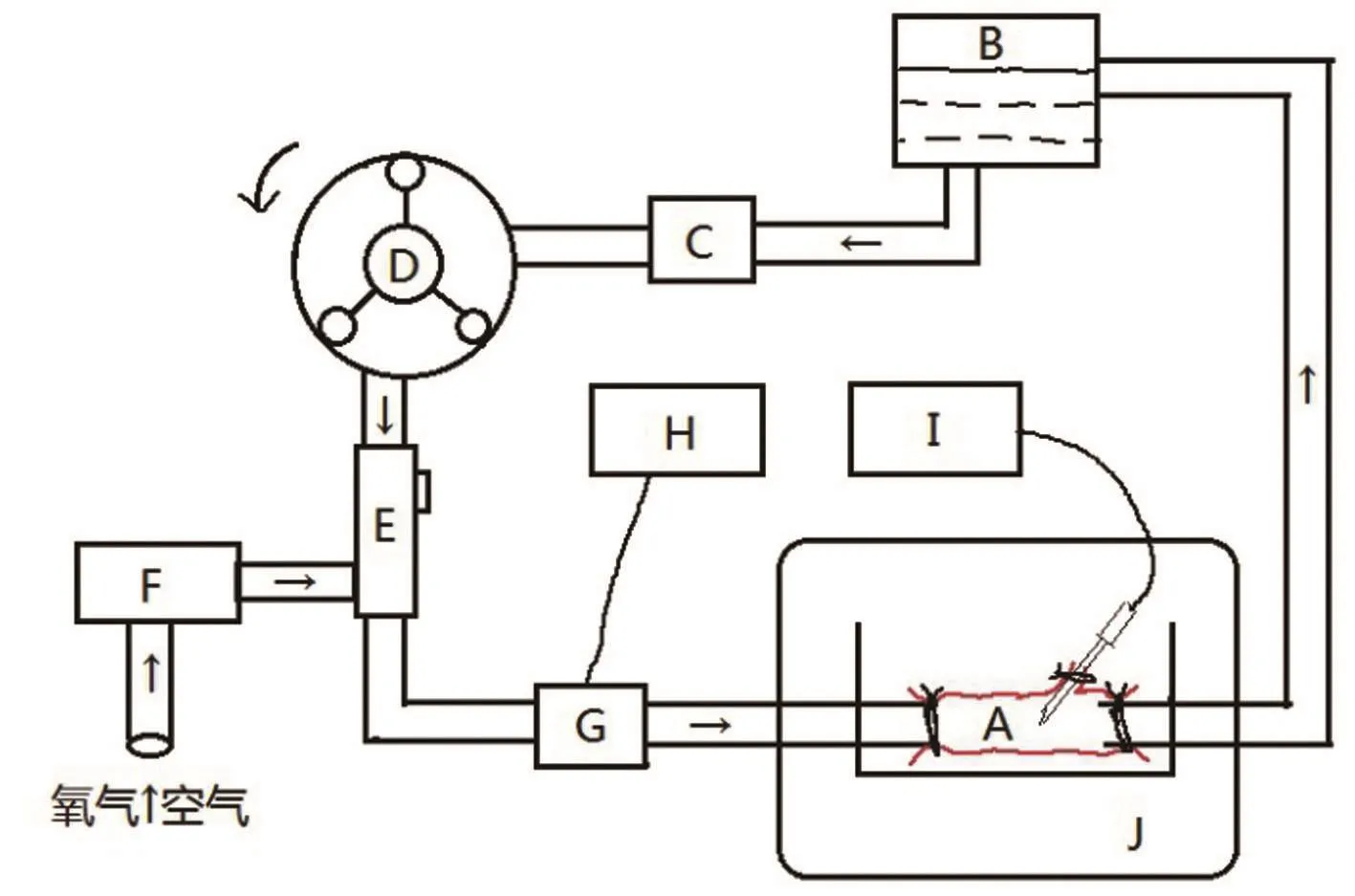
图1 离体血管循环模式图
转流过程:管道连接完毕,1%肝素钠溶液预充排气。接入离体血管,设定灌注压力40 mmHg(1 mmHg=0.133 kPa),经回流室逐步换入新鲜肝素化兔血。如图1所示,滚压泵将血液从回流室泵出,流经血栓过滤器、膜肺、血氧饱和度监测点、离体血管后回流至回流室。根据光学血氧饱和度仪显示数值间断开闭空氧混合器给氧,维持血氧饱和度恒定。每6 h更换全血,每24 h更换培养液。
实验数据采集:转机开始后,每小时于离体血管前三通阀处抽取1 ml血液做血气分析(雅培iStat-300便携式血气分析仪),记录整个转流过程中各时间点血氧饱和度值。
标本采集:持续灌注48 h后,取下离体血管,以4℃磷酸缓冲盐溶液反复冲洗。洗净后,部分管壁组织浸泡于10%中性福尔马林中,固定24 h备用。对固定好的血管组织常规进行蜡块包埋,切片,采用弹力纤维、肌纤维、胶原纤维三色染色,用于评价肺血管重构病变。另取剩余标本匀浆处理后检测一氧化氮含量,检测过程严格按照总一氧化氮检测试剂盒(上海碧云天生物技术有限公司)说明书进行。
统计学方法:应用统计软件SPSS24.0进行处理和数据分析,对转流过程中不同组别的血氧结果采用单因素方差分析,数据用均数±标准差(±s)表示,P<0.05认为差异有统计学意义。
2 结果
3个模型组离体血管转机结果:3组离体血管转机时间均达到48 h,转机过程中无破裂,无漏血渗血,剪开管壁未见附壁血栓形成。
3个模型组血氧饱和度和血氧分压结果(表1):3组血氧饱和度和血氧分压数值之间的差异均有统计学意义(P均<0.05)。血氧饱和度结果符合实验设计,该模型可以建立循环系统内血氧饱和度梯度。
表1 3个模型组血氧饱和度和血氧分压结果(n=5,±s)
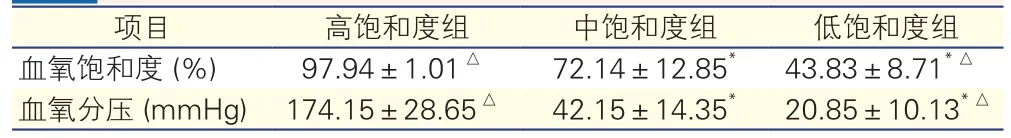
表1 3个模型组血氧饱和度和血氧分压结果(n=5,±s)
注:与高饱和度组比较*P<0.05,与中饱和度组比较△P<0.05;1 mmHg=0.133 kPa
项目 高饱和度组 中饱和度组 低饱和度组血氧饱和度 (%) 97.94±1.01△ 72.14±12.85* 43.83±8.71*△血氧分压 (mmHg) 174.15±28.65△ 42.15±14.35* 20.85±10.13*△
正常对照组兔肺动脉和3个模型组离体培养肺动脉的病理形态分析(图2、表2):肉眼观察:相比于正常对照组兔肺动脉,3个模型组离体培养肺动脉均出现管壁增厚,管壁通透度下降。镜下观察(图2)显示:3个模型组离体培养肺动脉组织以中膜增厚为主。采用自动图像分析软件(Image Pro Plus6.0)进行定量分析显示(表2):随着血氧饱和度降低,3个模型组离体培养肺动脉中膜层弹力纤维(黑色)增多、变粗、变长,分布密集;相比于正常对照组兔肺动脉,3个模型组离体培养肺动脉肌纤维(黄色)、胶原纤维(粉红色)均明显增加(P均<0.05)。
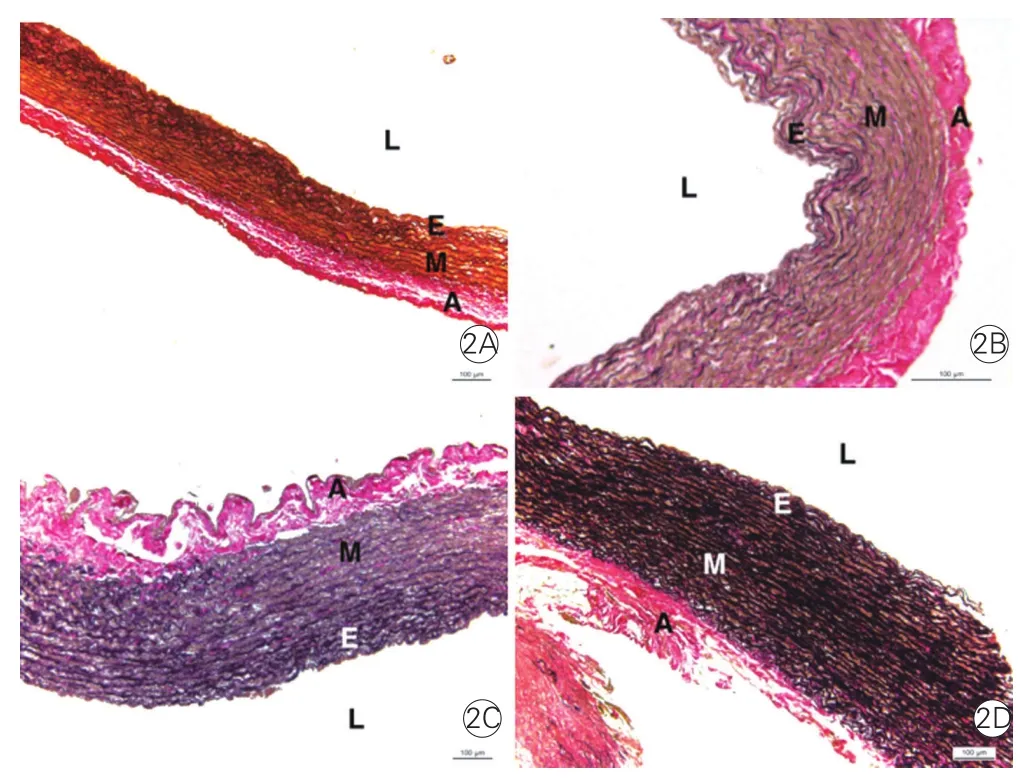
图2 正常对照组兔肺动脉和3个模型组离体培养肺动脉组织病理染色结果(n=5,×20)
表2 正常对照组兔肺动脉和3个模型组离体培养肺动脉组织IPP6.0定量分析结果(n=5,±s)
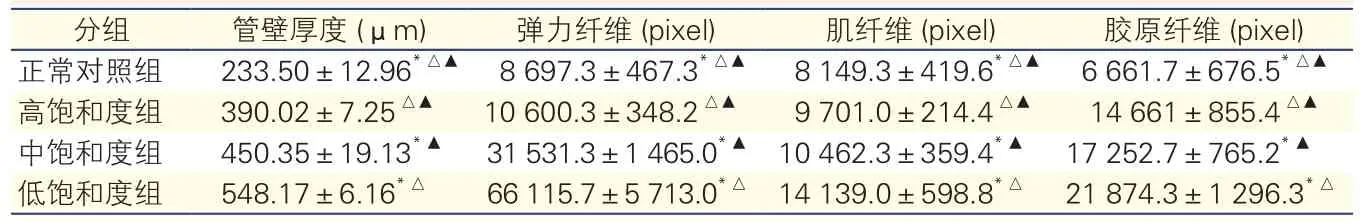
表2 正常对照组兔肺动脉和3个模型组离体培养肺动脉组织IPP6.0定量分析结果(n=5,±s)
注:与高饱和度组比较*P<0.05,与中饱和度组比较△P<0.05,与低饱和度组比较▲P<0.05
分组 管壁厚度 (μm) 弹力纤维 (pixel) 肌纤维 (pixel) 胶原纤维 (pixel)正常对照组 233.50±12.96*△▲ 8 697.3±467.3*△▲ 8 149.3±419.6*△▲ 6 661.7±676.5*△▲高饱和度组 390.02±7.25△▲ 10 600.3±348.2△▲ 9 701.0±214.4△▲ 14 661±855.4△▲中饱和度组 450.35±19.13*▲ 31 531.3±1 465.0*▲ 10 462.3±359.4*▲ 17 252.7±765.2*▲低饱和度组 548.17±6.16*△ 66 115.7±5 713.0*△ 14 139.0±598.8*△ 21 874.3±1 296.3*△
3个模型组离体培养肺动脉组织匀浆一氧化氮含量分析结果(图3):随着血氧饱和度水平降低,高饱和度组、中饱和度组、低饱和度组肺动脉组织匀浆一氧化氮含量逐渐升高,组间差异均有统计学意义(P均<0.05)。
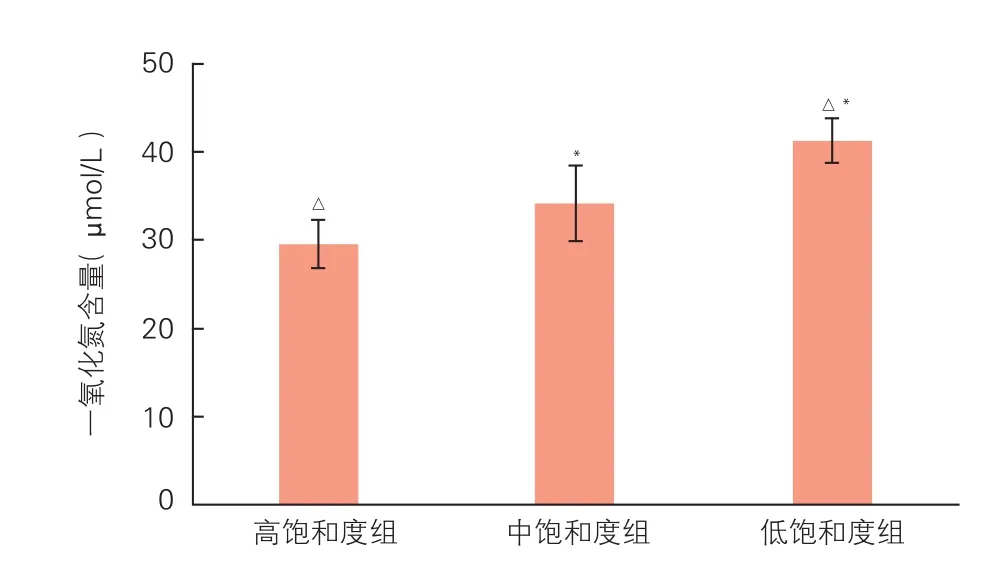
图3 3个模型组离体培养肺动脉组织匀浆一氧化氮含量比较(n=5)
3 讨论
虽然多年来对缺氧或高氧导致的肺动脉高压进行了大量研究,但是血氧饱和度对肺动脉高压的影响与缺氧或高氧对肺动脉高压的影响并不相同。因为即使吸入纯氧,正常肺动脉内的血氧饱和度仍会基本维持在76%的正常水平,不会像TGA那样能增高到接近100%[2]。正常情况下,肺循环和体循环是串联的,而TGA将两个循环变为并联:肺循环的氧合血进行重复循环,可以维持血氧饱和度接近100%;体循环的非氧合血引起组织缺氧,使左右心室负荷加重。合并有VSD或者动脉导管未闭的TGA患者因生后肺动脉压下降,形成体-肺循环分流,肺循环血量逐渐增多,逐渐形成肺动脉高压[3],其病理表现为:肺血管壁明显增厚,尤其以中膜增厚最为明显,弹力纤维增多增粗[4,5]。随着肺血管重构加重,一氧化氮水平升高,可能是离体血管的急性代偿反应[6,7]:饱和度降低导致肺血管重构趋于明显,同时缺氧导致一氧化氮合酶分泌增多[8],管壁代偿性分泌一氧化氮以减轻肺动脉高压形成。
本研究通过构建离体模型模拟类似的病理生理改变,模型由体外组织培养和体外循环灌注两部分构成。组织培养技术至今已成为生物、医学研究中广泛采用的技术方法。将离体组织放入配置好的培养液中,并置于二氧化碳恒温箱内模拟生物体内生长环境,可以维持细胞活性。Lehoux等[9]将离体颈动脉置于DMEM高糖培养液中并给予不同压力灌注,研究了高血压发生机制。另一方面,体外循环技术是心脏外科领域非常成熟的技术。滚压泵可以维持平稳血流和保持压力恒定,膜肺用于氧合血液,同时排除二氧化碳,维持循环内氧饱和度稳定。
本研究通过调节回流室距离离体血管的高度[10]和滚压泵转速两方面维持压力恒定,调节肺血管内压力为40 mmHg。正常兔肺动脉平均压为(11.2±3.2)mmHg,体-肺分流高压模型肺动脉压为(19.2±3.7)mmHg(P<0.05)[11],大于此模型压力可形成肺动脉高压表现,但是压力过高又会增加渗漏风险,无法达到预期灌注时间。本研究多次平衡灌注压力与灌注时间的关系,将压力设定为40 mmHg,属于高压灌注,也可形成类似肺动脉高压的病理表现。
调节血氧饱和度是该模型的关键点及难点,我们在实施本研究前,通过预实验进行了大量的摸索工作,发现调高给氧浓度虽可使血氧饱和度增加,但并不能维持稳定:恒定给氧流量50 ml/min和氧浓度60%通气,血氧饱和度升高至100%,稳定一段时间后(平台期),开始缓慢下降;即使维持流量不变,抬高给氧浓度到100%,血氧饱和度也无法维持在100%,表现为持续更长平台期后逐渐下降;完全关闭给氧,氧饱和度则无上升阶段,逐渐缓慢下降。血氧饱和度降低可能与血细胞自身代谢产生酸性产物积累相关,故需要通过间断开放气体以排除循环内产生的二氧化碳,才可使氧饱和度上升。
本实验成功建立了不同血氧饱和度影响主肺动脉高压发展的离体血管模型,该模型简便、稳定、可靠。该方法可为进一步探索不同血氧饱和度对高压环境下肺动脉重构的影响机制提供基本模型。
[1]刘迎龙, 胡盛寿, 沈向东, 等. 大于6月龄伴室间隔缺损并重度肺动脉高压心室大动脉连接异常的大动脉调转术. 中华胸心血管外科杂志, 2009, 25: 364-367.
[2]Pan X, Zheng Z, Hu S, et al. Mechanisms of pulmonary hypertension related to ventricular septal defect in congenital heart disease. Ann Thorac Surg, 2011, 92: 2215-2220.
[3]罗鹏, 庞玲品, 吴源聪, 等. 先天性心脏病相关性肺动脉高压肺组织芳香烃受体的表达及其与肺血管重构的相关性研究. 中国循环杂志, 2015, 30: 971-975.
[4]潘湘斌, 郑哲, 胡盛寿, 等. 合并室间隔缺损的大动脉转位所致肺动脉高压的可逆性程度及其分子机制. 中华胸心血管外科杂志,2010, 26: 81-85.
[5]马胜军, 刘桂清, 马增山, 等. 先天性心脏病伴重度肺动脉高压患者动脉血气氧分压与肺血管病理改变关系的研究. 中国循环杂志,2004, 19: 300-302.
[6]Hong E, Larios F, Gómez-Viquez NL, et al. Role of alpha adrenoceptors and nitric oxide on cardiovascular responses in acute and chronic hypertension. J Physiol Biochem, 2011, 67: 427-435.
[7]袁杰, 李菊香, 张宝红, 等. 高血压大鼠主动脉一氧化氮合成途径的变化. 高血压杂志, 2002, 10: 463-467.
[8]Hoehn T, Preston AA, Mcphaden AR, et al. Endothelial nitric oxide synthase (NOS) is upregulated in rapid progressive pulmonary hypertension of the newborn. Intens Care Med, 2003, 29: 1757-1762.
[9]Lehoux S, Lemarie CA, Esposito B, et al. Pressure-induced matrix metalloproteinase-9 contributes to early hypertensive remodeling.Circulation, 2004, 109: 1041-1047.
[10]Bardy N, Karillon GJ, Merval R, et al. Differential effects of pressure and flow on DNA and protein synthesis and on fibronectin expression by arteries in a novel organ culture system. Circulation Res, 1995, 77:684.
[11]王伟, 张宜乾, 吴树明. 兔高动力性肺动脉高压模型的建立. 中国病理生理杂志, 2006, 22: 612-617.
An in vitro Vascular Model for Studying the Impact of Different Blood Oxygen Saturation on Main Pulmonary Artery Pressure Changes
WEN Bin, LIU Yao, MENG Jian, LI Yong-nan, TANG Yue, PAN Xiang-bin.
Department of Cardiac Surgery,National Center for Cardiovascular Disease and Fuwai Hospital, CAMS and PUMC, Beijing(100037), China
Corresponding Author: PAN Xiang-bin, Email: xiangbin428@hotmail.com
Objective: To establish anin vitrovascular model to study the impact of different blood oxygen (O2) saturation on main pulmonary artery pressure changes in order to further explore the mechanism of pulmonary hypertension.
Methods: 20 New Zealand white rabbits were randomly divided into 4 groups: Normal control group and 3 experimental groups as High O2(90%-100%)saturation group, Middle O2(65%-75%)saturation group and Low O2(40%-50%) saturation group,n=5 in each group. Thein vitropulmonary artery segments were treated with fresh heparinized rabbit blood and connected to extracorporeal circulation system for 48h at perfusion pressure at 40 mmHg; the condition of O2saturation was regulated by membrane oxygenator. Pathological morphology was compared among different groups.
Results:The bypass time in all 3 groups was 48h and the pressure was stably controlled at 40 mmHg. Blood O2contents in High O2saturation group, Middle O2saturation group and Low O2saturation group were (97.94±1.01) %, (72.14±12.85) %and (43.83±8.71) % respectively,P<0.05. Pathological analysis indicated that compared with Normal control group, 3 experimental groups had increased thickness in pulmonary artery wall; upon O2saturation decreasing, the elastic fibers in pulmonary artery became increasing and more thickening accordingly.
Conclusion: We established anin vitrovascular model to study the impact of different blood O2saturation on main pulmonary artery pressure changes in experimental rabbits.
Hypertension, pulmonary; Model, cardiovascular; Oxygen saturation
(Chinese Circulation Journal, 2017,32:1024.)
国家自然科学基金(81400041);高等学校博士学科点专项科研基金(20131106120006)
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院 心外科
温彬 硕士研究生 主要研究方向:先天性心脏病所致肺动脉高压机制研究 Email:wenbin96723@163.com 通讯作者:潘湘斌Email: xiangbin428@hotmail.com
R54
A
1000-3614(2017)10-1024-04
10.3969/j.issn.1000-3614.2017.10.020
2017-06-08)
(编辑:朱柳媛)

