伊曲康唑、特比萘芬和他克莫司单用及联合对皮炎外瓶霉的体外抗真菌作用
何承彦 孙毅 高露娟 李明 曾同祥
434100湖北荆州,长江大学第二临床医学院 荆州市中心医院皮肤科(何承彦、孙毅、曾同祥);复旦大学附属中山医院皮肤科(高露娟、李明)
伊曲康唑、特比萘芬和他克莫司单用及联合对皮炎外瓶霉的体外抗真菌作用
何承彦 孙毅 高露娟 李明 曾同祥
434100湖北荆州,长江大学第二临床医学院 荆州市中心医院皮肤科(何承彦、孙毅、曾同祥);复旦大学附属中山医院皮肤科(高露娟、李明)
目的探讨他克莫司与伊曲康唑、特比萘芬联合对皮炎外瓶霉的体外抗真菌效果。方法参考美国临床实验室标准化研究所M38⁃A2方案,测定特比萘芬和伊曲康唑对12株皮炎外瓶霉的最低抑菌浓度;利用棋盘法,测定他克莫司和伊曲康唑或特比萘芬的联合抗皮炎外瓶霉效果。结果特比萘芬和伊曲康唑对皮炎外瓶霉最低抑菌浓度范围分别为(0.06~0.125)mg/L和(0.5~1)mg/L。他克莫司和特比萘芬联合对5株皮炎外瓶霉、他克莫司和伊曲康唑联合对10株皮炎外瓶霉有协同作用。两组均无拮抗作用。结论他克莫司在体外与伊曲康唑或特比萘芬联合应用时,能够增加皮炎外瓶霉对伊曲康唑和特比萘芬的敏感性。
伊曲康唑;药物协同作用;体外研究;皮炎外瓶霉;他克莫司;特比萘芬
皮炎外瓶霉是暗色丝孢霉病的主要致病菌之一[1]。它不仅可以引起皮肤、皮下组织感染,还可以引起播散性感染,其中神经系统感染多见,死亡率高达90%[2⁃3]。特比萘芬和伊曲康唑是治疗皮肤及皮下组织真菌感染最常用的系统性抗真菌药物,但对暗色丝孢霉病的疗效较差[3⁃5]。他克莫司是一种钙调磷酸酶抑制剂,多项研究已证实,他克莫司和抗真菌药物联合对烟曲霉、念珠菌、皮肤癣菌、毛霉等多种致病性真菌具有协同效应[6⁃9]。为了开发新型抗真菌联合治疗方案,我们参照美国临床实验室标准化研究所颁布的M38⁃A2方案[10],以微量液基稀释法测定他克莫司、特比萘芬和伊曲康唑对12株皮炎外瓶霉的抗真菌效应;同时利用棋盘法测定他克莫司与该两种抗真菌药物联合的抗皮炎外瓶霉效果。
材料与方法
一、实验菌株
12株皮炎外瓶霉临床株均保存于荆州市中心医院皮肤科真菌实验室,所有菌株均经过形态学及分子生物学鉴定。每株菌在实验前均在马铃薯葡萄糖琼脂培养基斜面上活化(35℃,7 d)。ATCC22019为本药敏试验的质控菌株。
二、抗真菌药物
伊曲康唑(批号84625⁃61⁃6,纯度>99%)、特比萘芬(批号T8826,纯度>99%)和他克莫司(批号F467,纯度>99%)均为美国Sigma公司产品。将药物以分析纯二甲基亚砜溶解成储存液,浓度均为1 600 mg/L。
三、微量液基稀释法
参考美国临床实验室标准化研究所M38⁃A2方案,按照方案推荐方法配制培养基,用经三氮吗啡丙磺酸钠缓冲(pH7.0)的RPMI 1640液体培养基过滤灭菌。收集皮炎外瓶霉孢子,以血细胞计数板调整孢子量为(1~5)×106CFU/ml;然后以RPMI 1640液体培养基稀释100倍,接种终浓度为(1~5)× 104CFU/ml。倍比稀释后,将2倍终浓度的受试药物加入96孔板,每孔加入100 μl,再加入100 μl稀释后的菌悬液,同时设立生长对照(无药孔)和阴性对照(无菌孔),35℃孵育72 h。伊曲康唑和特比萘芬的工作浓度范围均为0.015~2 mg/L,他克莫司为0.125~8 mg/L。肉眼观察判读结果,最低抑菌浓度(MIC)定义为肉眼观察到无真菌生长的最低浓度。所有的药敏试验均重复操作2次。
四、体外联合药物敏感性
药物联合敏感性测试采用棋盘法,即在96孔板中分别加入不同浓度的两种药物。自左向右1~8列为联合区,每孔加入4倍终浓度的药物倍比稀释液各50 μl;第1~8列为特比萘芬或伊曲康唑,药物终浓度为0.015~2 mg/L,每列浓度一致;第1~7行分别加入他克莫司至终浓度为0.125~8 mg/L,每行浓度一致。第9、10列为单独用药区,药物终浓度梯度同联合区。同时设立生长对照和空白对照。接种时除阴性对照孔外其余各孔均加入100 μl的2倍终浓度菌悬液,35℃孵育72 h后观察结果。分数抑菌浓度判定:与生长对照孔相比,生长100%抑制所对应的最低药物浓度,包括各药物单独和联合时的MIC值。联合用药时各药物的MIC值分别除以单独用药时MIC值的商的和,即分数抑菌浓度指数(FICI)=MIC A联合/MIC A单独+MIC B联合/MIC B单独。药物之间相互作用如下:FICl<0.5为协同作用,0.5~4为无相互作用,>4为拮抗作用。
结果
一、单药对皮炎外瓶霉的体外药物敏感性
他克莫司单药对12株皮炎外瓶霉的MIC均>8 mg/L。伊曲康唑对5株皮炎外瓶霉的MIC为0.5 mg/L,7株为1 mg/L。特比萘芬对5株皮炎外瓶霉菌株的MIC为0.125 mg/L,7株为0.06 mg/L。见表1。
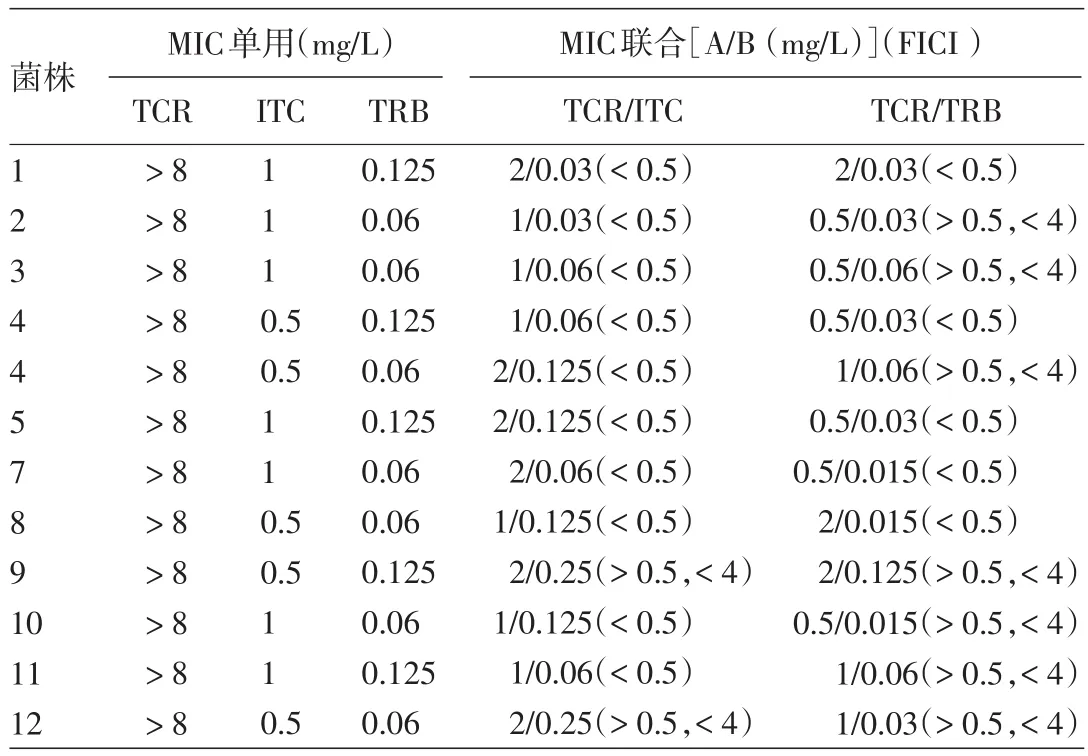
表1 伊曲康唑、特比萘芬和他克莫司单用及联合抗皮炎外瓶霉效应
二、他克莫司联合伊曲康唑或特比萘芬对皮炎外瓶霉的体外药物敏感性
他克莫司与伊曲康唑联合后,伊曲康唑2株0.03 mg/L,4株0.06 mg/L,4株0.125 mg/L,2株0.25 mg/L;他克莫司对皮炎外瓶霉的MIC 6株降至1 mg/L,6株降至3 mg/L;FICI值显示,10株FICI<0.5为协同作用,2株FICI为0.5~4无相互作用。见表1。
他克莫司与特比萘芬联合后,他克莫司对皮炎外瓶霉的MIC 6株降至0.5 mg/L,3株1 mg/L,3株2 mg/L;特比萘芬3株0.015 mg/L,5株0.03 mg/L,3株0.06 mg/L,1株0.125 mg/L;FICI值显示,5株FICI<0.5为协同作用,7株FICI为0.5~4无相互作用。见表1。
讨论
他克莫司是从非致病真菌中提取的大环内酯类免疫抑制剂,作用于钙调磷酸酶,抑制多种蛋白的去磷酸化过程。钙调磷酸酶是钙依赖性信号传导通路,对多种真菌胞壁的完整性、菌丝生长、毒力及真菌对抗真菌药物耐受都具有重要作用,如念珠菌、曲霉、隐球菌等[11]。他克莫司与抗真菌药物联合对曲霉、念珠菌、皮肤癣菌、毛霉等多种致病性真菌具有协同效应[6⁃9]。
皮炎外瓶霉所致皮肤及系统感染治疗棘手。尽管体外药敏提示皮炎外瓶霉抗真菌药物敏感性尚可,但临床疗效较差[3⁃5]。伊曲康唑及特比萘芬是目前使用较广泛的抗真菌药物。本研究结果显示,伊曲康唑及特比萘芬对皮炎外瓶霉的MIC范围分别为0.5~1 mg/L及0.06~0.125 mg/L,两者对皮炎外瓶霉的体外敏感性较好。虽然他克莫司单用对皮炎外瓶霉不敏感,但当与伊曲康唑和特比萘芬联合时,能够增加受试菌株对该两个药物的敏感性。虽然伊曲康唑的MIC均值较特比萘芬高,但他克莫司与伊曲康唑的协同作用比例(10/12)明显高于与特比萘芬的协同作用比例(5/12)。体内外研究显示,抑制钙调磷酸酶可增强麦角固醇合成抑制剂(唑类及特比萘芬)抗须毛癣菌、念珠菌、米根霉等作用[12⁃13]。其潜在机制可能为他克莫司与麦角固醇合成酶抑制剂联合能够增强致病菌对唑类药物敏感性,从抑菌作用转变成杀菌作用;而用麦角固醇抑制剂可导致细胞膜损伤,细胞内他克莫司浓度增加[14⁃15]。此外,他克莫司与棘白菌素类药物联合对耐卡泊芬净念珠菌也具有协同效应[11]。当然,其潜在的机制还需进一步研究。
本研究丰富了他克莫司与抗真菌药物联合作用的数据,同时也为皮炎外瓶霉感染的治疗提供一定的理论基础。当然,由于皮炎外瓶霉体外数据和体内抗感染效果存在一定差异,还需要更多的研究来进一步证实其在临床实践的可行性。
志谢 北京大学第一医院皮肤科李若瑜教授赠予皮炎外瓶霉菌株
[1]Li DM,Li RY,de Hoog GS,et al.FatalExophialainfections in China,with a report of seven cases[J].Mycoses,2011,54(4): e136⁃142.DOI:10.1111/j.1439⁃050 7.2010.01859.x.
[2]Chakrabarti A.Epidemiology of central nervous system mycoses[J].Neurol India,2007,55(3):191⁃197.
[3]Patel AK,Patel KK,Darji P,et al.Exophiala dermatitidisendocarditis on native aortic valve in a postrenal transplant patient and review of literature onE.dermatitidisinfections[J]. Mycoses,2013,56(3):365⁃372.DOI:10.1111/myc.12009.
[4]Kondori N,Gilljam M,Lindblad A,et al.High rate ofExophiala dermatitidisrecovery in the airways of patients with cystic fibrosis is associated with pancreatic insufficiency[J].J Clin Microbiol, 2011,49(3):1004⁃1009.DOI:10.1128/JCM.01899⁃10.
[5]Revankar SG,Sutton DA.Melanized fungi in human disease[J]. Clin Microbiol Rev,2010,23(4):884⁃928.DOI:10.1128/ CMR.00019⁃10.
[6]Steinbach WJ,Singh N,Miller JL,et al.In vitrointeractions between antifungals and immunosuppressants againstAspergillus fumigatusisolates from transplant and nontransplant patients[J]. Antimicrob Agents Chemother,2004,48(12):4922⁃4925.DOI: 10.1128/AAC.48.12.4922⁃4925.2004.
[7]Sun S,Li Y,Guo Q,et al.In vitrointeractions between tacrolimus and azoles againstCandida albicansdetermined by different methods[J].Antimicrob Agents Chemother,2008,52(2):409⁃417.DOI:10.1128/AAC.01070⁃07.
[8]Narreddy S,Manavathu E,Chandrasekar PH,et al.In vitrointeraction ofposaconazolewith calcineurin inhibitorsand sirolimus against zygomycetes[J].J Antimicrob Chemother, 2010,65(4):701⁃703.DOI:10.1093/jac/dkq020.
[9]陈淳,陈启红,孙毅,等.低浓度他克莫司与抗真菌药物联合的体外抗真菌效应[J].中国真菌学杂志,2015,10(4):207⁃209. DOI:10.3969/j.issn.1673⁃3827.2015.04.004.
[10]Clinical and Laboratory Standards Institute.CLSI document M38⁃A2 reference method for broth dilution antifungal susceptibility testing of filamentous fungi:approved standard[S].USA:Wayne PA,2008.
[11]Zhang J,Silao FG,Bigol UG,et al.Calcineurin is required for pseudohyphal growth,virulence,and drug resistance inCandida lusitaniae[J].PLoS One,2012,7(8):e44192.DOI:10.1371/ journal.pone.0044192.
[12]Onyewu C,Eads E,Schell WA,et al.Targeting the calcineurin pathway enhancesergosterolbiosynthesisinhibitorsagainstTrichophyton mentagrophytes in vitroand in a human skin infection model[J].Antimicrob Agents Chemother,2007,51(10):3743⁃3746.DOI:10.1128/AAC.00492⁃07.
[13]Onyewu C,Blankenship JR,Del PM,et al.Ergosterol biosynthesis inhibitors become fungicidal when combined with calcineurin inhibitors againstCandida albicans,Candida glabrata,andCandida krusei[J].Antimicrob Agents Chemother,2003,47(3): 956⁃964.
[14]Uppuluri P,Nett J,Heitman J,et al.Synergistic effect of calcineurin inhibitors and fluconazole againstCandida albicansbiofilms[J].Antimicrob Agents Chemother,2008,52(3):1127⁃1132.DOI:10.1128/AAC.01397⁃07.
[15]Shirazi F,Kontoyiannis DP.The calcineurin pathway inhibitor tacrolimus enhances thein vitroactivity of azoles against Mucorales via apoptosis[J].Eukaryot Cell,2013,12(9):1225⁃1234.DOI:10.1128/EC.00138⁃13.
In vitroantifungal activity of tacrolimus alone or in combination with itraconazole or terbinafine against
Exophiala dermatitidisHe Chengyan,Sun Yi,Gao Lujuan,Li Ming,Zeng Tongxiang
Department of Dermatology,Jingzhou Central Hospital,The Second Clinical Medical College,Yangtze University,Jingzhou 434100,Hubei,China(He CY,Sun Y,Zeng TX);Department of Dermatology,
s:Gao Lujuan,Email:gao_lujuan@163.com;Sun Yi,Email:jzzxyysy@163.com
ObjectiveTo evaluatein vitroantifungal activity of tacrolimus combined with itraconazole or terbinafine againstExophiala dermatitidis(E.dermatitidis).Methods The minimum inhibitory concentrations(MICs)of itraconazole and terbinafine against 12 strains ofE.dermatitidiswere determined using the Clinical and Laboratory Standards Institute(CLSI)broth microdilution susceptibility method(M38⁃A2 Document).A broth microdilution checkerboard method was used to evaluate thein vitroantifungal activity of tacrolimus combined with itraconazole or terbinafine againstE.dermatitidis.ResultsThe MIC ranges of terbinafine and itraconazole againstE.dermatitidiswere 0.060-0.125 mg/L and 0.5-1 mg/L,respectively.The combination of tacrolimus with terbinafine showed synergistic inhibitory effects against 5 strains ofE.dermatitidis,while the combination of tacrolimus with itraconazole revealed synergistic effects against 10 strains ofE.dermatitidis.No antagonism was observed in either of the two combinations.ConclusionIn vitrocombination of tacrolimus with itraconazole or terbinafine can enhance the antifungal activity of itraconazole or terbinafine againstE.dermatitidis.
Itraconazole;Drug synergism;In vitro;Exophiala dermatitidis;Tacrolimus;Terbinafine
高露娟,Email:gao_lujuan@163.com;孙毅,Email:jzzxyysy@163.com
10.3760/cma.j.issn.0412⁃4030.2017.04.011
国家自然科学基金(81401677、31400131);复旦大学附属中山医院优秀青年医师计划(2015ZSYXQN21)
Zhongshan Hospital,Fudan University,Shanghai 200032,China(Gao LJ,Li M)
Fund programs:National Natural Science Foundation of China(31400131,81401677);Outstanding Youth Project of Zhongshan Hospital Fudan University(2015ZSYXQN21)
2016⁃08⁃12)
(本文编辑:吴晓初)

