白细胞介素36α对小鼠银屑病样皮损及趋化因子CCL20的影响
朱超英 温炬 李婷 赵棋楠 秦思 马静 郑荣昌 冯洁莹
510317广州,南方医科大学附属广东省第二人民医院皮肤科
白细胞介素36α对小鼠银屑病样皮损及趋化因子CCL20的影响
朱超英 温炬 李婷 赵棋楠 秦思 马静 郑荣昌 冯洁莹
510317广州,南方医科大学附属广东省第二人民医院皮肤科
目的探讨白细胞介素(IL)36α对小鼠银屑病样皮损及CC趋化因子配体20(CCL20)的影响。方法30只BALB/c雌性小鼠分为3组:凡士林空白对照组(对照组)、咪喹莫特模型组(模型组)以及IL⁃36α实验组(实验组)。用小鼠银屑病皮损面积和疾病严重程度评分(PASI)观察银屑病样小鼠皮损动态变化。光镜下观察皮损组织形态学变化,并测量表皮层厚度。用实时荧光定量PCR、Western印迹检测对照组与模型组小鼠皮损中IL⁃36α表达情况,用实时荧光定量PCR、Western印迹法、免疫组化方法检测小鼠皮损中CCL20的含量变化。结果模型组皮损中IL⁃36α mRNA表达水平明显高于对照组(∆Ct值分别为0.0195±0.0059、0.0012±0.0004,两组比较,P<0.05);模型组皮损中IL⁃36α蛋白表达水平明显高于对照组(分别为3.922±0.248、0.690±0.025,两组比较,P<0.05)。对照组、实验组CCL20 mRNA表达(∆Ct值)分别为0.378±0.075、2.152±0.793,与模型组(0.999± 0.178)比较,差异有统计学意义(P<0.05);对照组、实验组CCL20蛋白表达结果分别为0.025± 0.009、0.397±0.033,与模型组(0.145±0.030)比较,差异有统计学意义(P<0.05)。免疫组化结果表明,实验组皮损中CCL20的含量较模型组显著增加,差异有统计学意义(Z=2.294,P<0.05)。结论IL⁃36α可通过促进CCL20表达,加重银屑病样小鼠皮损病变。
银屑病;疾病模型,动物;趋化因子CCL20;咪喹莫特;白细胞介素36α
白细胞介素(IL)36是一种促炎性因子,属于IL⁃1家族,由IL⁃36α、IL⁃36β及IL⁃36γ组成,其受体为IL⁃36R,主要表达于皮肤组织中,通过与受体结合,激活丝裂原活蛋白激酶(mitogen⁃activated protein kinase p38,MAPK)和核因子κB(NF⁃κB)信号途径在炎症性疾病中发挥重要作用[1]。既往研究表明,Th17细胞及其分泌的炎症因子如,IL⁃17、IL⁃22、IL⁃23直接参与了银屑病皮损及免疫反应,并起到了关键作用[2]。近年研究发现,IL⁃36在银屑病患者皮损及银屑病动物模型中过度表达,敲除基因IL⁃36的咪喹莫特诱导的银屑病小鼠模型比敲除基因IL⁃17的小鼠表现出更大的治疗作用[3⁃4]。Friedrich等[5]发现,IL⁃36是人角质形成细胞分泌CCL20的诱导剂,但对银屑病的作用缺乏充分研究。本研究以CCL20为靶点,通过咪喹莫特诱导构建小鼠银屑病样模型,研究IL⁃36α对银屑病样小鼠皮损中CC趋化因子配体20(CCL20)表达水平的影响。
材料与方法
一、主要试剂及仪器
5%咪喹莫特乳膏(艾达乐,美国3M公司),IL⁃36α(美国R&D公司,2297⁃ML)、CCL20单抗(Cat.ab9829,英国abcam公司)、IL⁃36α抗体(MAB2297,美国RD公司)、反转录试剂盒(DBI⁃2220,美国DBI公司)、荧光定量PCR检测试剂盒(美国DBI公司)。实验动物分组及模型的建立。引物由上海捷瑞生物工程有限公司合成。
二、动物
SPF级雌性BALB/c小鼠30只,6~8周龄,体重18~20 g,购自南方医科大学(合格证号44002100008294),饲养于南方医科大学SPF级动物饲养室,室温20~24℃,照明时间12 h/d,自由取食。30只小鼠编号后分为3组,每组10只,分别单笼饲养。对照组:凡士林乳膏+皮内注射PBS;模型组:咪喹莫特乳膏+皮内注射PBS;实验组:咪喹莫特乳膏+皮内注射IL⁃36α。所有小鼠背部剃毛,面积2 cm×3 cm,外用62.5 mg 5%咪喹莫特乳膏或等量凡士林乳膏,每天1次,连续8 d;同时皮内注射5 μg PBS液或5 μg IL⁃36α,隔日1次共4次。于第8天取小鼠背部皮损进行后续检测。
三、方法
1.小鼠银屑病皮损面积和疾病严重程度评分(PASI):肉眼观察并用相机记录,各组小鼠皮损红斑、鳞屑及浸润增厚分别评分。PASI评0~4分:无计0,轻度计1,中度计2,重度计3,极重度计4。3种积分相加得到总分。各组积分取平均值绘制积分趋势曲线。
2.组织病理学观察:取背部皮损组织1cm×1cm,4%甲醛固定,脱水,石蜡包埋,切片并行HE染色。显微镜下观察皮损增厚程度、炎症细胞浸润情况等,并绘制皮损增厚柱状图。
3.皮损中IL⁃36α、CCL20的实时定量PCR检测:取-70℃冻存组织,加入TRIzol Reagent进行匀浆处理,提取样本中总RNA。按照反转录试剂盒说明书操作。实时荧光定量PCR仪扩增,引物序列如下:CCL20:F:5′⁃AGAGCTATTGTGGGTTTCAC⁃3′,R:5′⁃TCTTCTTGACTCTTAGGCTG⁃3′;IL⁃36α:F:5′⁃ACCT CTACATTTGAGTCTGC⁃3′,R:5′⁃GATGAAGATTTCC CCCAGTT⁃3′;GAPDH:F:5′⁃AGGTCGGTGTGAACG GATTTG⁃3′,R:5′⁃TGTAGACCATGTAGTTGAGGTC A⁃3′。扩增程序:95℃10 min,95℃10 s、60℃30 s共45个循环。用2-△△Ct法进行数据的相对定量分析。
4.皮损中IL⁃36α、CCL20的免疫印迹法检测:RIPA裂解液提取皮肤组织蛋白,BCA蛋白定量试剂测定蛋白浓度,取等量蛋白样品进行SDS⁃PAGE电泳,转NC膜,经3%脱脂牛奶的TBST室温封闭1 h后,稀释一抗(1∶1 000)4℃过夜,加入1∶1 000辣根过氧化物酶标记的羊抗鼠二抗室温孵育1 h,ECL显色,β肌动蛋白为内参照。ImageJ图像分析系统分析条带的吸光度(A值),以相对A值代表蛋白的表达量,相对A值=(目的蛋白A值/β肌动蛋白A值)× 100%。
5.皮损中CCL20的免疫组化检测:石蜡切片脱蜡、水化,抗原修复,滴加一抗(1∶100)4℃孵育过夜,滴加二抗(1∶1 000)4℃孵育50 min,DAB显色,苏木精复染,同步设立阴性对照。结果判定:胞质、胞核内出现淡棕色、淡褐色、棕色、棕褐色以及褐色颗粒为阳性染色。采取双盲法,每张切片在高倍镜(×400)下由两位独立观察者随机观察5个视野。根据切片染色的强度及其中阳性细胞所占百分比综合评分。阳性细胞0~5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。染色强度计分:无着色计0分,淡褐色计1分,棕色计2分,棕褐色计3分。两项相加为综合积分:0分为(-),1~3分为弱阳性(+),4~5分为(++),6~7分为(+++)。
结果
一、临床表现
对照组小鼠背部皮肤未见明显异常;模型组第2天背部皮肤为淡红色,第3天出现红斑、少许鳞屑,随后皮肤逐渐出现皱褶、增厚,第4~6天红斑、鳞屑持续增多,第7、8天呈典型银屑病样改变,第8天部分小鼠开始出现脱屑,可见薄膜现象及点状出血;实验组从第4~8天起出现的红斑、增厚、鳞屑较模型组明显加重(图1)。各组PASI评分见图2。
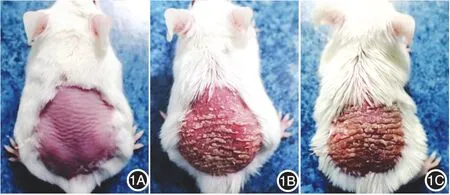
图1 小鼠背部银屑病样皮损形态学观察(第8天) 1A:对照组小鼠皮肤未见明显异常;1B:模型组小鼠出现典型的红斑、鳞屑、增厚;1C:实验组小鼠出现的红斑、鳞屑、增厚较模型组明显
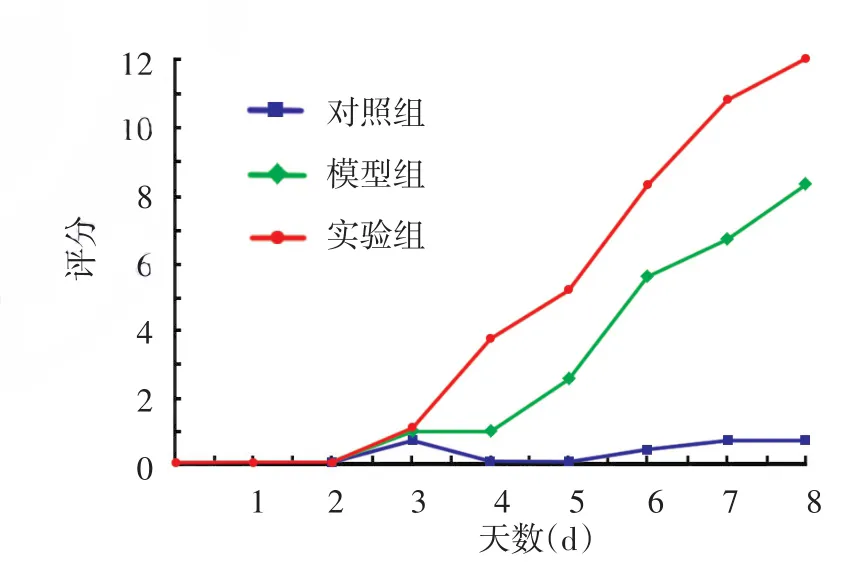
图2 3组小鼠背部皮肤银屑病严重度指数(PASI)评分随时间变化的比较 对照组:凡士林乳膏+皮内注射PBS;模型组:咪喹莫特乳膏+皮内注射PBS;实验组:咪喹莫特乳膏+皮内注射IL⁃36α
二、组织病理学表现
HE染色显示,第8天,对照组小鼠皮肤未见异常;模型组皮损呈银屑病样改变,表皮明显增厚,可见角化不全及Muro微脓肿,棘层增厚明显,表皮突延长,皮下可见炎症细胞浸润;实验组各层改变均较模型组明显,炎症细胞浸润更明显(图3)。测量表皮垂直厚度,对照组为(9.804±1.682)μm,模型组为(68.383±2.499)μm,实验组为(98.519± 3.442)μm,实验组与模型组差异有统计学意义(t= 22.406,P<0.05)。
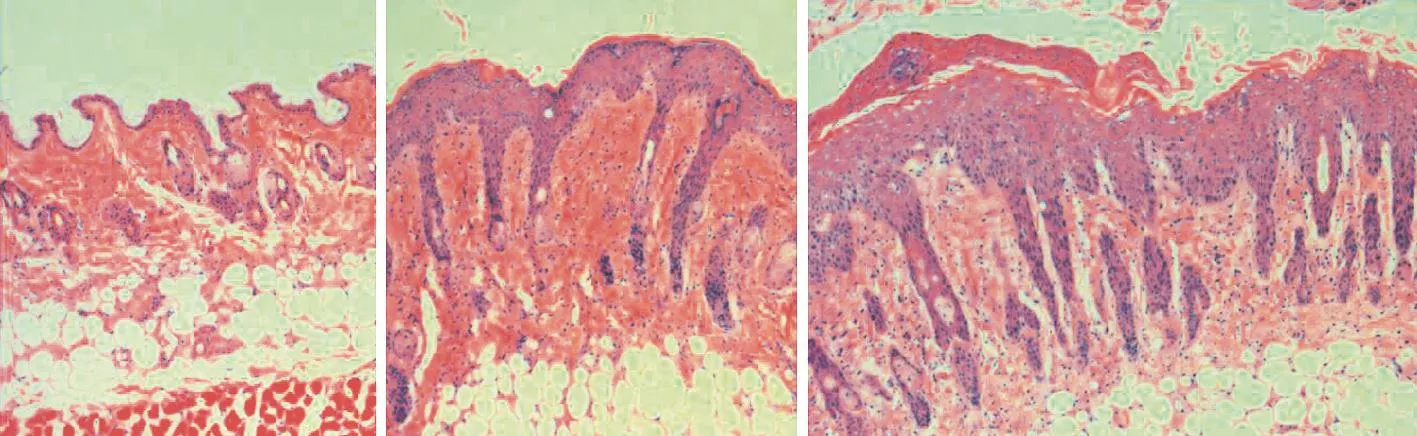
图3 小鼠背部银屑病样皮损组织病理(HE×100) 3A:对照组未见皮肤异常;3B:模型组可见角化不全、角质层增厚、棘层增厚明显、表皮突延长,类似银屑病样病理变化;3C:实验组表皮增厚、角化不全、炎症细胞浸润较模型组明显
三、皮损中 IL⁃36α mRNA及蛋白表达水平
模型组IL⁃36α mRNA的表达(0.020±0.006)显著高于对照组(0.001± 0.001,t=7.523,P<0.05)。免疫印迹结果显示,模型组小鼠皮损中IL⁃36α的蛋白表达(3.922±0.248)较对照组(0.690±0.025)增加,差异有统计学意义(t=31.695,P<0.05)。见图4。
四、皮损中CCL20 mRNA及蛋白表达水平
实时定量PCR结果示,实验组皮损中CCL20 mRNA表达(2.152±0.793)高于模型组(0.999± 0.178),差异有统计学意义(t=4.478,P<0.05),模型组高于对照组(0.378±0.075)(t=10.152,P<0.05)。免疫印迹结果显示,实验组(0.397±0.033)皮损中CCL20的蛋白表达高于模型组(0.145± 0.030),差异有统计学意义(t=17.692,P<0.05),模型组高于对照组(0.025±0.009)(t=11.912,P<0.05)。见图5。
五、皮损中CCL20免疫组化
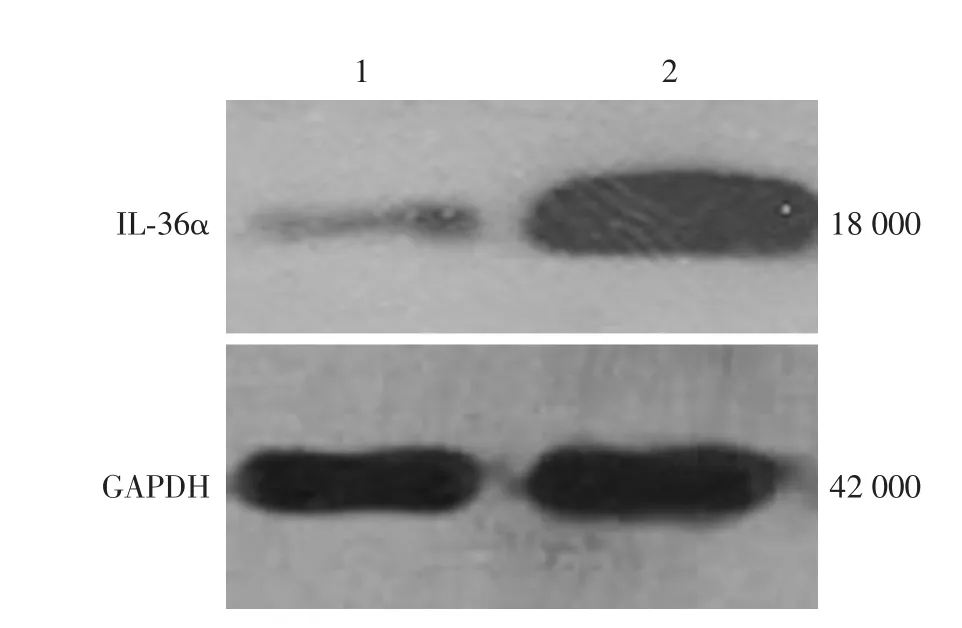
图4 Westerm印迹检测IL⁃36α蛋白的表达 1:对照组;2:模型组

图5 Westerm印迹检测CCL20蛋白的表达 1:对照组;2:模型组;3:实验组
对照组小鼠仅少量或者不表达CCL20;模型组着色细胞层数及数量增多,广泛表达于表皮及真皮;实验组着色细胞数量显著高于模型组,CCL20染色呈棕褐色,分布于真皮及表皮层(图6)。采用非参数检验,实验组、对照组与模型组间表达量差异有统计学意义(均P<0.05)。见表1。

图6 CCL20在小鼠银屑病样皮损中的表达(SP×200) 6A:对照组CCL20表达呈弱阳性,位于表皮层;6B:模型组CCL20表达呈阳性,主要位于表皮层;6C:实验组CCL20表达呈强阳性,主要位于表皮层
讨论
IL⁃36在多种疾病中过表达,如银屑病、干燥综合征、炎症性肠病、肿瘤等[6⁃10]。IL⁃17/IL⁃23轴被认为在银屑病中起主要作用[11],最新研究发现,IL⁃36炎症通路强于该轴在银屑病中的作用,通过构建敲除基因IL⁃23、IL⁃17、IL⁃22、IL⁃36的咪喹莫特银屑病小鼠模型,结果发现,敲除基因IL⁃36的小鼠银屑病皮损较敲除基因IL⁃23、IL⁃17、IL⁃22小鼠轻[4],腹腔注射IL⁃36抗体的小鼠可以使银屑病小鼠皮损减轻[12],提示IL⁃36可能在银屑病中起重要作用。本实验分别用实时定量PCR及免疫印迹法检测对照组与模型组小鼠皮损中IL⁃36α的表达,结果发现,模型组中IL⁃36α的表达水平显著高于对照组(P<0.05),表明IL⁃36α可能在咪喹莫特诱导的银屑病小鼠模型中起重要作用。
咪喹莫特是一种免疫激活剂,通过激活Toll样受体,刺激小鼠产生银屑病样皮损,如红斑、鳞屑、角质形成细胞增生以及大量炎症细胞浸润等,已经广泛应用于银屑病研究[13]。本实验通过直观现象、PASI评分及HE染色发现,模型组与实验组均出现了明显的红斑、鳞屑、增厚现象,并伴有角质层、棘细胞层增厚以及颗粒层消失,而对照组未见明显异常,表明实验小鼠造模成功。既往研究发现,皮内注射IL⁃36α的小鼠背部皮肤出现明显的炎症细胞浸润[14],气管内灌注IL⁃36α的小鼠,肺部出现大量趋化因子、肿瘤坏死因子(TNF)等炎症因子[15],我们通过HE染色发现,实验组较模型组炎症反应更为严重,表明IL⁃36α可以加重银屑病小鼠的炎症反应。趋化因子是一组具有趋化作用的细胞因子,能吸引免疫细胞到免疫应答局部,参与免疫反应。CCL20作为β趋化因子家族中一员,主要由角质形成细胞分泌,研究表明,银屑病皮损中CCL20的表达与银屑病的严重程度相关,并且受多种细胞因子的影响如TNFα、IL⁃1β、IL⁃17等[16]。目前已经证实,CCL20对树突细胞和T细胞有定向迁移作用,作为CCL20的唯一配体,CCR6主要表达于Th17细胞,而
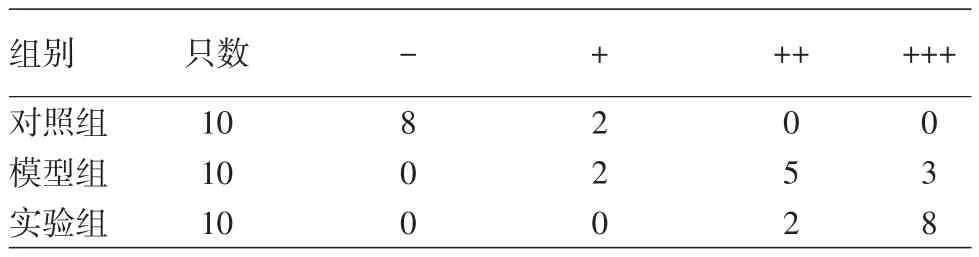
表1 小鼠银屑病样皮损CCL20的表达强度
注:对照组比模型组Z=3.801,P<0.05;模型组比实验组Z= 2.294,P<0.05。对照组:凡士林乳膏+皮内注射PBS;模型组:咪喹莫特乳膏+皮内注射PBS;实验组:咪喹莫特乳膏+皮内注射IL⁃36α CCR6的表达与IL⁃17的产生呈正相关[17]。已有研究发现,IL⁃36可以促进Th17细胞活化,分泌更多IL⁃17[5],Tortola等[4]研究发现,IL⁃36通过活化树突细胞、角质形成细胞,促进CCL20的分泌。本实验通过实时荧光定量PCR和Western印迹,分别从mRNA和蛋白表达水平检测CCL20,结果发现,模型组与实验组CCL20的表达量均明显升高,其中实验组表达量较模型组更明显,表明IL⁃36α可以促进银屑病小鼠CCL20的表达。另外,本研究采用免疫组化发现,空白对照组仅少量表达CCL20,模型组与实验组着色细胞层数及数量较空白对照组增多,其中实验组着色细胞数量显著高于模型组,模型组和实验组小鼠CCL20主要表达于表皮层,且实验组、对照组与模型组间在CCL20表达方面差异有统计学意义(P<0.05)。
综上所述,本研究结果表明,模型组皮损中IL⁃36α的表达较对照组增加,提示IL⁃36α可能参与银屑病的发病机制;皮内注射IL⁃36α不仅可以加重银屑病样小鼠皮损改变,还可促进咪喹莫特银屑病样小鼠CCL20的表达,提示IL⁃36α可能通过促进CCL20的表达而参与银屑病的发生与发展。本研究仅仅对IL⁃36α因子进行了初步探索,未对其抗体进行相关研究。另外,IL⁃36家族对银屑病其他相关协同因子、信号通路以及与Th17细胞相关因子IL⁃17在银屑病作用中的比较尚未进行研究,这些亦是我们下一步要研究的课题。
[1]Nishida A,Hidaka K,Kanda T,et al.Increased expression of interleukin⁃36,a member of the interleukin⁃1 cytokine family,in inflammatory bowel disease[J].Inflamm Bowel Dis,2016,22(2): 303⁃314.DOI:10.1097/MIB.0000000000000654.
[2]El MK,Karbach SH,Huppert J,et al.An alternative pathway of imiquimod⁃induced psoriasis⁃like skin inflammation in the absence of interleukin⁃17 receptor a signaling[J].J Invest Dermatol,2013,133(2):441⁃451.DOI:10.1038/jid.2012.318.
[3]Towne JE,Sims JE.IL⁃36 in psoriasis[J].Curr Opin Pharmacol, 2012,12(4):486⁃490.DOI:10.1016/j.coph.2012.02.009.
[4]Tortola L,Rosenwald E,Abel B,et al.Psoriasiform dermatitis is driven by IL⁃36⁃mediated DC⁃keratinocyte crosstalk[J].J Clin Invest,2012,122(11):3965⁃3976.DOI:10.1172/JCI63451.
[5]Friedrich M,Tillack C,Wollenberg A,et al.IL⁃36γ sustains a proinflammatory self⁃amplifying loop with IL⁃17C in anti⁃TNF⁃induced psoriasiform skin lesions of patients with Crohn′s disease[J].Inflamm Bowel Dis,2014,20(11):1891⁃1901.DOI:10.1097/ MIB.0000000000000198.
[6]Foster AM,Baliwag J,Chen CS,et al.IL⁃36 promotes myeloid cell infiltration,activation,and inflammatory activity in skin[J].J Immunol,2014,192(12):6053⁃6061.DOI:10.4049/jimmunol. 1301481.
[7]Bozoyan L,Dumas A,Patenaude A,et al.Interleukin⁃36γ is expressed by neutrophils and can activate microglia,but has no role in experimentalautoimmune encephalomyelitis[J].J Neuroinflammation,2015,12:173.DOI:10.1186/s12974⁃015⁃0392⁃7.
[8]Ciccia F,Accardo⁃Palumbo A,Alessandro R,et al.Interleukin⁃36α axis is modulated in patients with primary Sjögren′s syndrome[J].Clin Exp Immunol,2015,181(2):230⁃238.DOI: 10.1111/cei.12644.
[9]Lv Z,Fan J,Zhang X,et al.Integrative genomic analysis of interleukin⁃36RN and its prognostic value in cancer[J].Mol Med Rep,2016,13(2):1404⁃1412.DOI:10.3892/mmr.2015.4667.
[10]Lopetuso LR,Chowdhry S,Pizarro TT.Opposing functions of classic and novel IL⁃1 family members in gut health and disease[J].Front Immunol,2013,4:181.DOI:10.3389/fimmu.2013. 00181.
[11]赵京霞,底婷婷,王燕,等.IL⁃23/IL⁃17炎症轴在咪喹莫特诱导的小鼠银屑病样皮肤损害中的作用[J].中国病理生理杂志, 2013,29(6):1086⁃1094.DOI:10.3969/j.issn.1000⁃4718.2013. 06.023.
[12]舒丹,苏飞,晋红中.白介素36与银屑病[J].中华皮肤科杂志,2013,46(7):519⁃522.DOI:10.3760/cma.j.issn.0412⁃4030.2013.07.023.
[13]Gilliet M,Conrad C,Geiges M,et al.Psoriasis triggered by toll⁃like receptor 7 agonist imiquimod in the presence of dermal plasmacytoid dendritic cell precursors[J].Arch Dermatol,2004, 140(12):1490⁃1495.DOI:10.1001/archderm.140.12.1490.
[14]Blumberg H,Dinh H,Dean C,et al.IL⁃1RL2 and its ligands contribute to the cytokine network in psoriasis[J].J Immunol, 2010,185(7):4354⁃4362.DOI:10.4049/jimmunol.1000313.
[15]Ramadas RA,Ewart SL,Iwakura Y,et al.IL⁃36α exerts pro⁃inflammatory effects in the lungs of mice[J].PLoS One,2012,7(9):e45784.DOI:10.1371/journal.pone.0045784.
[16]Sallusto F,Mackay CR,Lanzavecchia A.The role of chemokine receptors in primary,effector,and memory immune responses[J]. Annu Rev Immunol,2000,18:593⁃620.DOI:10.1146/annurev. immunol.18.1.593.
[17]马怡莹,魏志平,刘彦群.卡马拉素对HaCaT细胞体外增殖及对白细胞介素17C、CCL20、NF⁃κB表达的影响[J].中华皮肤科杂志,2015,48(7):475⁃479.DOI:10.3760/cma.j.issn.0412⁃4030.2015.07.009.
Effects of interleukin⁃36α on psoriasiform skin lesions and C⁃C motif chemokine ligand 20 expression in mice
Zhu Chaoying,Wen Ju,Li Ting,Zhao Qinan,Qin Si,Ma Jing,Zheng Rongchang, Feng Jieying
Department of Dermatology,Guangdong No.2 Provincial People′s Hospital,Affiliated to Southern Medical
Wen Ju,Email:wenju3139@163.com
ObjectiveTo evaluate effects of interleukin⁃36α(IL⁃36α)on psoriasiform skin lesions and C⁃C motif chemokine ligand 20(CCL20)expression in mice.MethodsTotally,30 BALB/c female mice were randomly and equally divided into 3 groups:control group treated with topical vaseline cream on the shaved back and intracutaneous injection with phosphate buffer saline(PBS),model group treated with topical imiquimod cream on the shaved back and intracutaneous injection with PBS, experimental group treated with topical imiquimod cream on the shaved back and intracutaneous injection with IL⁃36α solution.Psoriasis area severity index(PASI)was used to evaluate changes of psoriasiform skin lesions in mice,and light microscopy to observe morphological changes of skin lesions and to measure the thickness of the epidermis.Real⁃time fluorescence⁃based quantitative PCR(qRT⁃PCR)and Western blot analysis were performed to determine the expression of IL⁃36α in skin lesions in the control group and model group,and qRT⁃PCR,Western blot analysis and immunohistochemical study to evaluate changes of CCL20 levels in skin lesions.ResultsThe model group showed significantly increased mRNA(∆Ct value:0.0195±0.0059)and protein expression(3.922±0.248)of IL⁃36α compared with the control group(mRNA:0.0012±0.0004,P<0.05;protein:0.690±0.025,P<0.05).The mRNA and protein expression of CCL20 were significantly higher in the experimental group than those in the model group(mRNA:2.152± 0.793vs.0.999±0.178;protein:0.397±0.033vs.0.145±0.030;bothP<0.05),and higher in the model group than those in the control group(mRNA:0.378±0.075;protein:0.025±0.009;bothP<0.05). Immunohistochemical study showed that the expression intensity of CCL20 in skin lesions significantly increased in the experimental group compared with that in the model group(Z=2.294,P<0.05).ConclusionIL⁃36α may aggravate psoriasiform skin inflammation in mice by promoting CCL20 expression.
Psoriasis;Disease models,animal;Chemokine CCL20;Imiguimod;Interleukin⁃36α
温炬,Email:wenju3139@163.com
10.3760/cma.j.issn.0412⁃4030.2017.04.007
广东省中医药局科研课题(20141008)
University,Guangzhou 510317,China
Fund program:Traditional Chinese Medicine Bureau Foundation of Guangdong Province(20141008)
2016⁃08⁃08)
(本文编辑:吴晓初)

