PRiME HLB固相萃取/超高效液相色谱-串联质谱法快速检测牛肝中18种促生长剂类药物残留
王 智,施宗伟,郗存显,曹淑瑞,王国民,唐柏彬,郑 佳 ,母昭德*
(1.重庆医科大学 药学院,重庆 400016;2.重庆出入境检验检疫局 重庆市进出口食品安全工程技术研究中心,重庆 400020;3.重庆市生物化学与分子药理学重点实验室,重庆 400016 )
PRiMEHLB固相萃取/超高效液相色谱-串联质谱法快速检测牛肝中18种促生长剂类药物残留
王 智1,3,施宗伟2,郗存显2,曹淑瑞2,王国民2,唐柏彬2,郑 佳1,3,母昭德1,3*
(1.重庆医科大学 药学院,重庆 400016;2.重庆出入境检验检疫局 重庆市进出口食品安全工程技术研究中心,重庆 400020;3.重庆市生物化学与分子药理学重点实验室,重庆 400016 )
建立了PRiME HLB固相萃取/超高效液相色谱-串联质谱(UPLC-MS/MS)高通量快速检测牛肝中8种激素、6种β-受体激动剂及4种抗生素类促生长剂药物的方法。分别对色谱分离条件、MS/MS检测参数及样品前处理进行了优化。样品经β-葡萄糖醛苷酶/芳基硫酯酶酶解后,以甲醇和乙腈-甲醇(90∶10,体积比)分步提取后,直接通过PRiME HLB净化,收集流出液氮气吹干后以乙腈-水(3∶7,体积比)复溶,供UPLC-MS/MS检测。结果表明18种化合物在1.0~100.0 μg/L范围内线性关系良好,相关系数均大于0.990;方法检出限(LOD)为0.07~0.78 μg/kg,定量下限(LOQ)为0.23~2.58 μg/kg。在3个加标水平下(0.5、1.0、5.0 μg/kg)的回收率为67.5%~102.0%,相对标准偏差(RSD)均小于15%。该方法简单、快速、准确,适用于动物组织中多种促生长剂类药物的同时检测。
超高效液相色谱-串联质谱法;PRiME HLB固相萃取;促生长剂;牛肝
促生长剂(激素、抗生素和受体激动剂等)是一类促进动物生长,提高饲料转化率的药物。激素类药物如睾酮能够促进畜禽生长,提高饲料转化率,有利于蛋白质的沉积,在畜牧业养殖中广泛使用[1]。抗生素类药物最初只是一类抗菌治疗药物,20世纪70年代被发现除了治疗和预防外,还能够杀死肠道类的细菌微生物而明显促进动物的生长,因此此类药物还用作饲料添加剂[2-3];受体激动剂药物俗称“瘦肉精”,因能够提高动物的生长率和瘦肉率常被用于动物的饲养过程[4]。这类药物被大量滥用,最终对食品安全产生极大的威胁。因此我国及欧盟等国家制定了严格规定,建立了相关的限量标准或禁止使用某些副作用极大的药物。
肝脏是药物主要代谢器官,常被作为药物残留监测的最佳靶组织。近年来针对激素、抗生素和受体激动剂等促生长剂残留的检测方法主要包括光激化学发光纳米均相时间分辨荧光免疫法(AlphaLISA)[5]、超高效液相色谱-串联质谱法(UPLC-MS/MS)[6-11]等。虽然AlphaLISA法前处理简单,但该方法局限于某一药物或某几个结构类似化合物的筛查,不能同时进行多种药物残留的定性定量分析,易出现假阳性或假阴性。UPLC-MS/MS因具有良好的分离效能,能够同时对多种药物进行定性定量分析的特点,越来越多的用于各种样品中兽药的残留分析。然而同时检测多种药物时,因为其化学性质差异,在复杂的样品基质中提取净化目标物的前处理过程复杂耗时,因此目前少有报道采用UPLC-MS/MS同时检测牛肝中激素、抗生素和受体激动剂。牛肝是一种极为复杂的基质,为了降低干扰物对目标物的干扰,检测前必须进行净化处理。目前常用的净化方式主要有磁固相萃取[12]和固相萃取[13-15]。磁固相萃取虽然简单、快速,但不能有效去除动物源性食品中脂类、蛋白质类干扰物,且需复杂合成过程,合成条件不易控制,耗时;固相萃取的HLB、MCX和C18柱等常用柱子在使用前需进行平衡活化等处理,过程繁琐,工作量大。新型Oasis PRiME HLB 固相萃取柱无需平衡活化、润洗和洗脱等过程,大大节省了净化时间,并能够有效除去复杂基质中的多种干扰杂质,延长色谱柱使用寿命,已逐渐被用于兽药残留的净化[16-17]。
本试验以牛肝为研究对象,首次以Oasis PRiME HLB为净化手段,采用UPLC-MS/MS同时检测牛肝中18种促生长剂的残留,具有简单、快速、高效、准确和高通量的特点。为食品质量安全的监控提供了新的检测技术选择。
1 实验部分
1.1 仪器与试剂
API5500QTRAP高效液相色谱-串联质谱仪(美国ABsciex公司);LC-30AD超高效液相色谱仪(日本Shimadzu公司);BS224S型天平(德国Sartorius公司);涡旋振荡混合器(江苏康健医疗用品有限公司);3-30K台式高速冷冻离心机(德国Sigma公司);N-EVAP116水浴式氮吹浓缩仪(美国Or-ganomation Associates公司);Milli-Q超纯水系统(美国Millipore公司)。Oasis PRiME HLB固相萃取小柱(3 mL,60 mg,美国Waters公司)。
乙腈、甲醇(色谱纯,美国Tedia公司);甲酸(色谱纯,美国Roe Scientific Ing 公司);β-葡萄糖醛苷酶/芳基硫酯酶(≥100 000 U/mL,Sigma 公司);实验用水为超纯水。
标准品:甲羟孕酮、醋酸甲羟孕酮、醋酸美仑孕酮、丙酸睾酮、17α-羟孕酮、诺龙、睾酮、甲睾酮纯度均≥98%,购自美国Sigma公司或德国Dr.Ehrenstorfer公司。沙丁胺醇、喷布特罗、莱克多巴胺、妥布特罗、克伦特罗、溴布特罗纯度均≥98%,购自德国Dr.Ehrenstorfer公司;竹桃霉素(纯度≥98%)购自英国加拿大Toronto research chemicals inc;林可霉素、红霉素、维吉霉素纯度均≥98%,购自德国Dr.Ehrenstorfer公司。
标准溶液的制备:分别称取适量的标准品,用甲醇配制成质量浓度为1 000 mg/L的标准储备液,-18 ℃储存。分别移取一定量的标准储备液配制成1 mg/L的混合标准工作液及不同质量浓度的单标工作液,储存于-4 ℃冰箱中。
1.2 样品前处理方法
称取2 g(精确至0.01 g)样品于50 mL 具塞离心管中,加入40 μLβ-葡萄糖醛苷酶/芳基硫酯酶和5 mL pH 5.2 的乙酸铵于60 ℃ 以110 r/min酶解1 h。酶解后加入5 mL甲醇振荡提取15 min,8 000 r/min离心3 min,移取上清液,再向离心管中加入10 mL乙腈-甲醇(90∶10,体积比)振荡提取15 min,合并两次上清液涡旋混匀。用移液管取4 mL提取液过Oasis PRiME HLB柱,收集流出液40 ℃ 氮气吹干,0.2 mL 乙腈-水(3∶7,体积比)复溶,涡旋混匀,过0.22 μm微孔滤膜,供UPLC-MS/MS检测。
1.3 色谱及质谱条件
色谱条件:ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相:A为乙腈,B为2 mmol/L乙酸铵水溶液(含0.2%甲酸),洗脱程序为:0~1 min,5%A;1~4 min,80%A;4~10 min,95%A;10~12 min,5%A;流速:0.3 mL/min,进样量:2 μL,柱温:40 ℃。
质谱条件:采用电喷雾离子源(ESI),正离子模式,多反应监测(MRM)模式进行检测。电喷雾电压(IS):4.5 kV;雾化气压力(GS1):0.55 MPa;气帘气压力(CUR):0.30 MPa;辅助气压力(GS2):0.55 MPa;离子源温度(TEM):550 ℃;碰撞室入口电压(EP):10 V;碰撞电压(CE)、去簇离子电压(DP)等参数见表1。
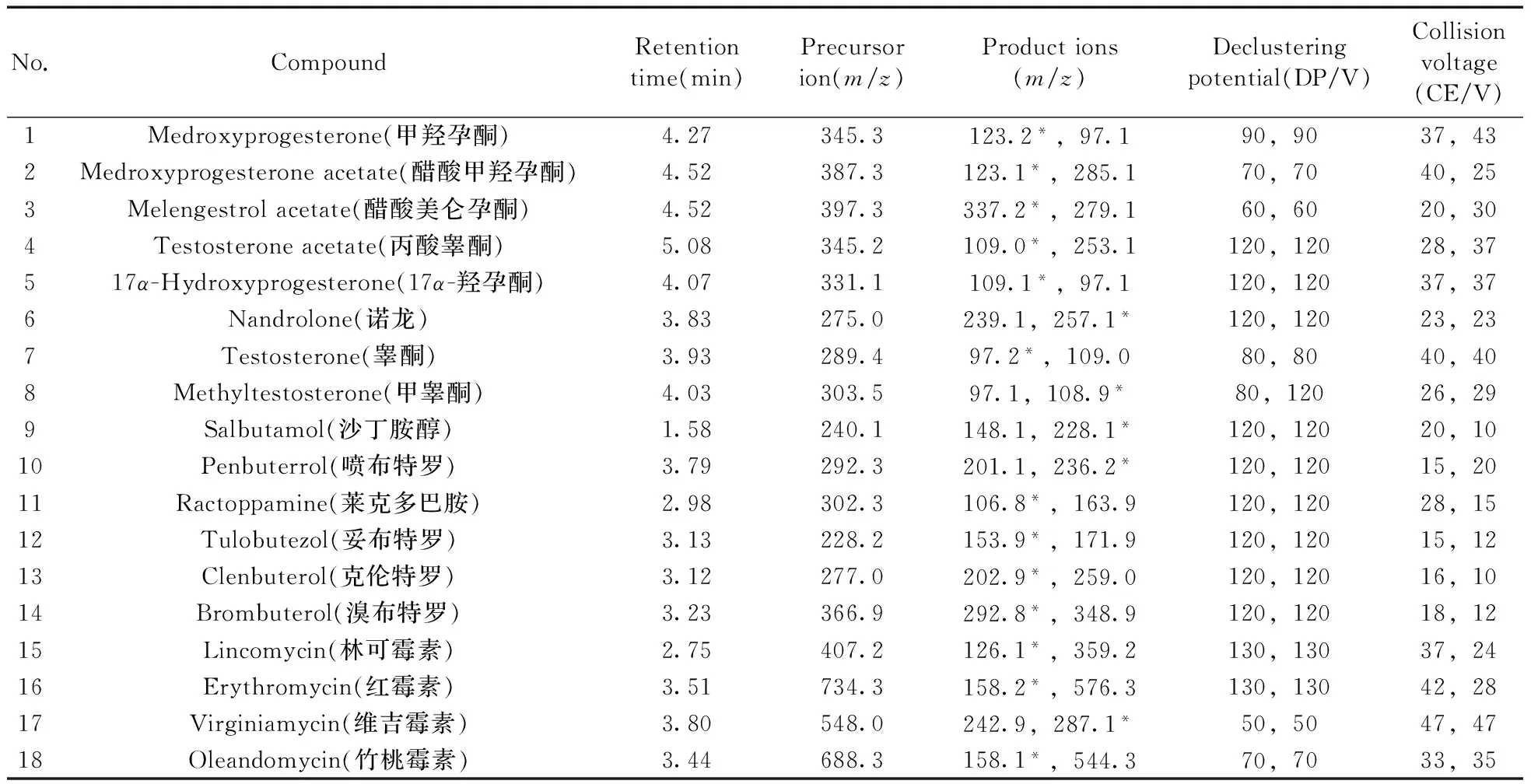
表1 18种化合物的质谱参数及保留时间Table 1 Mass parameters and retention times of 18 compounds
*quantitative ion
2 结果与讨论
2.1 质谱与色谱条件的优化
质谱条件优化:将18种化合物混合标准工作液(100 μg/L)直接进样,进行全扫描,准确找出分子离子[M+H]+,然后对准分子离子进行轰击获得二次碎裂离子,将准分子离子和2个信号强度最高的子离子组成检测离子对,以MRM模式检测。并进一步优化碰撞电压、去簇离子电压,选择其中丰度较大的子离子作为定量离子。具体参数见表1。
色谱条件优化:分别考察了不同体积比的乙腈-水(3∶7、2∶8、1∶9)作为定容溶液时对化合物分离效果的影响。结果表明,上述不同配比的乙腈-水对18种化合物的分离效果均良好,但乙腈-水体积比为3∶7时效果最好。进一步考察了以甲醇-2 mmol/L乙酸铵水溶液、甲醇-2 mmol/L乙酸铵水溶液(含0.2%甲酸)、乙腈-2 mmol/L乙酸铵水溶液和乙腈-2 mmol/L乙酸铵水溶液(含0.2%甲酸)为流动相时对化合物分离效果的影响。结果表明,以乙腈-2 mmol/L乙酸铵水溶液(含0.2%甲酸)为流动相时,18种化合物的分离效果最好,且在含有0.2%甲酸的条件下,灵敏度更高,峰形更好。
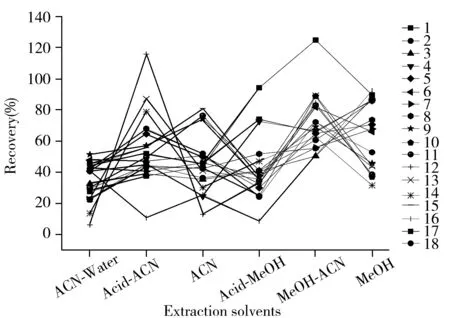
图1 不同提取溶剂对18种化合物提取效果的影响Fig.1 Effect of different solvents on extraction efficiencies of 18 compounds the number denoted was the same as that in Table 1
2.2 提取溶剂的优化
本实验的18种目标物属于不同类别化合物,性质差异大,因此分别考察了甲醇、酸性甲醇、乙腈、酸性乙腈、乙腈-水和乙腈-甲醇作为提取溶剂时对化合物回收率的影响。结果如图1所示,大部分化合物在乙腈-甲醇中的回收率较好,进一步考察不同乙腈-甲醇比例的提取效果发现,乙腈-甲醇体积比为90∶10时的提取回收率最好,但激素类化合物在甲醇中的回收率比在其他溶剂中高,因此选择甲醇和乙腈-甲醇(90∶10)作为提取溶剂,进行分步提取。
2.3 净化方式的选择
实验分别采用HLB柱、MCX柱、C18柱、Oasis PRiME HLB对目标分析物进行了考察。在C18柱上只有个别化合物的回收率达到60%以上,其余均低于40%。在阳离子交换柱MCX柱上,化合物需要调节pH值至酸性,但回收率依然达不到60%以上,尤其在酸性条件下大环内酯类化合物(如红霉素)会分解,导致回收率降低。在HLB柱和Oasis PRiME HLB柱上,所有目标化合物的回收率均能达到65%以上,而Oasis PRiME HLB净化过程相对简单、快速、省时,且能够有效除去样品中脂类和蛋白质等干扰物,因此选择Oasis PRiME HLB柱对目标分析物进行净化。
2.4 方法学验证
2.4.1线性方程、检出限及定量下限采用空白基质提取液配制质量浓度分别为1.0、5.0、10.0、20.0、 50.0、70.0、 100.0 μg/L的18种目标化合物的系列标准溶液,在最优条件下进行测定,以定量离子峰面积(y)对质量浓度(x,μg/L)绘制线性曲线。结果表明,18种化合物在1.0~100.0 μg/L质量浓度范围内线性关系良好,相关系数(r2)大于0.990,检出限(LOD,S/N=3)和定量下限(LOQ,S/N=10)分别为0.07~0.78 μg/kg和0.23~2.58 μg/kg(表2)。
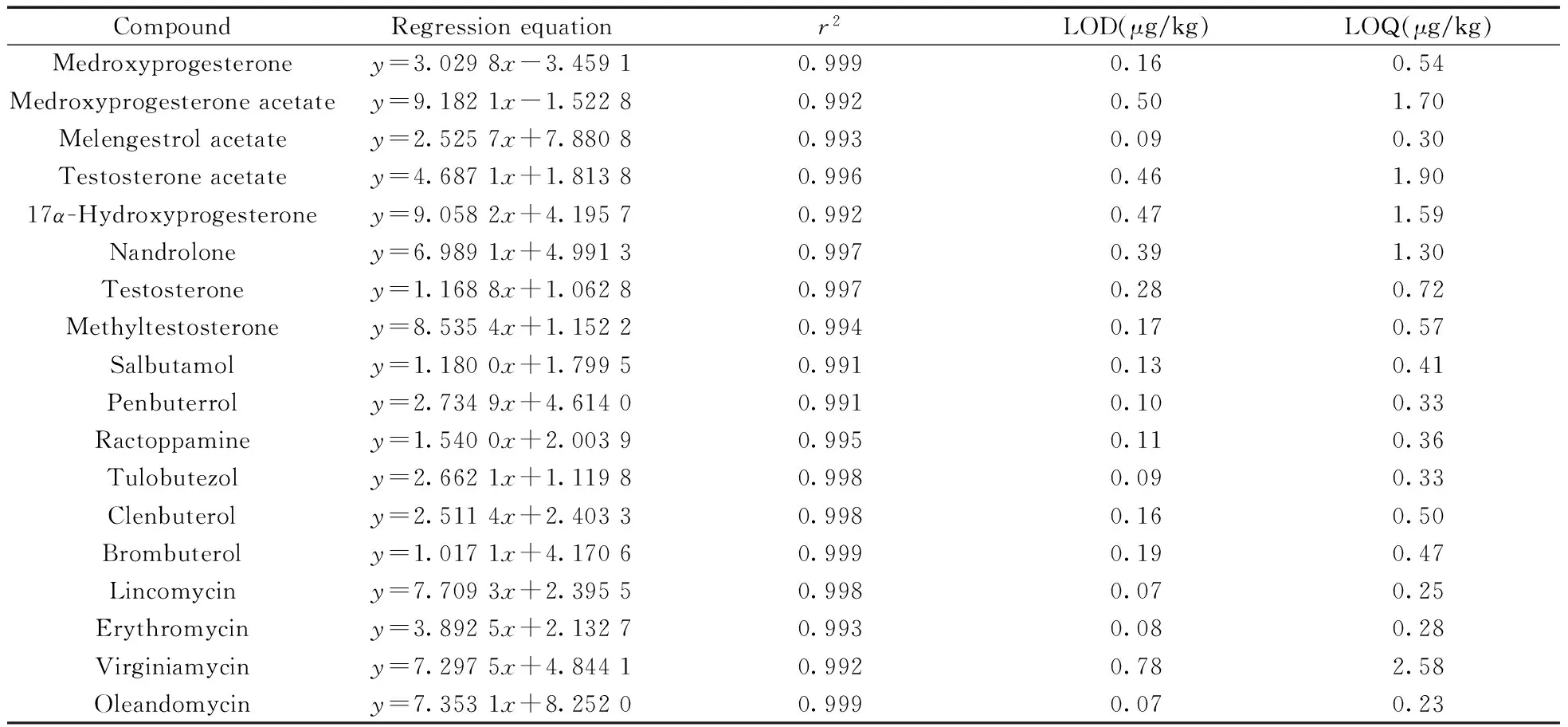
表2 18种化合物的线性方程、相关系数、检出限及定量下限Table 2 Regression equation,correlation coefficients(r2),LOD and LOQ of 18 compounds
2.4.2回收率与精密度在2 g空白样品中添加0.5、1.0、5.0 μg/kg标准溶液,进行加标回收率测定,每个浓度水平重复测定6次。按“1.2”方法处理后供UPLC-MS/MS分析,计算回收率。由表3可知,18种化合物的回收率为67.5%~102.0%,相对标准偏差(RSD)均小于15%。
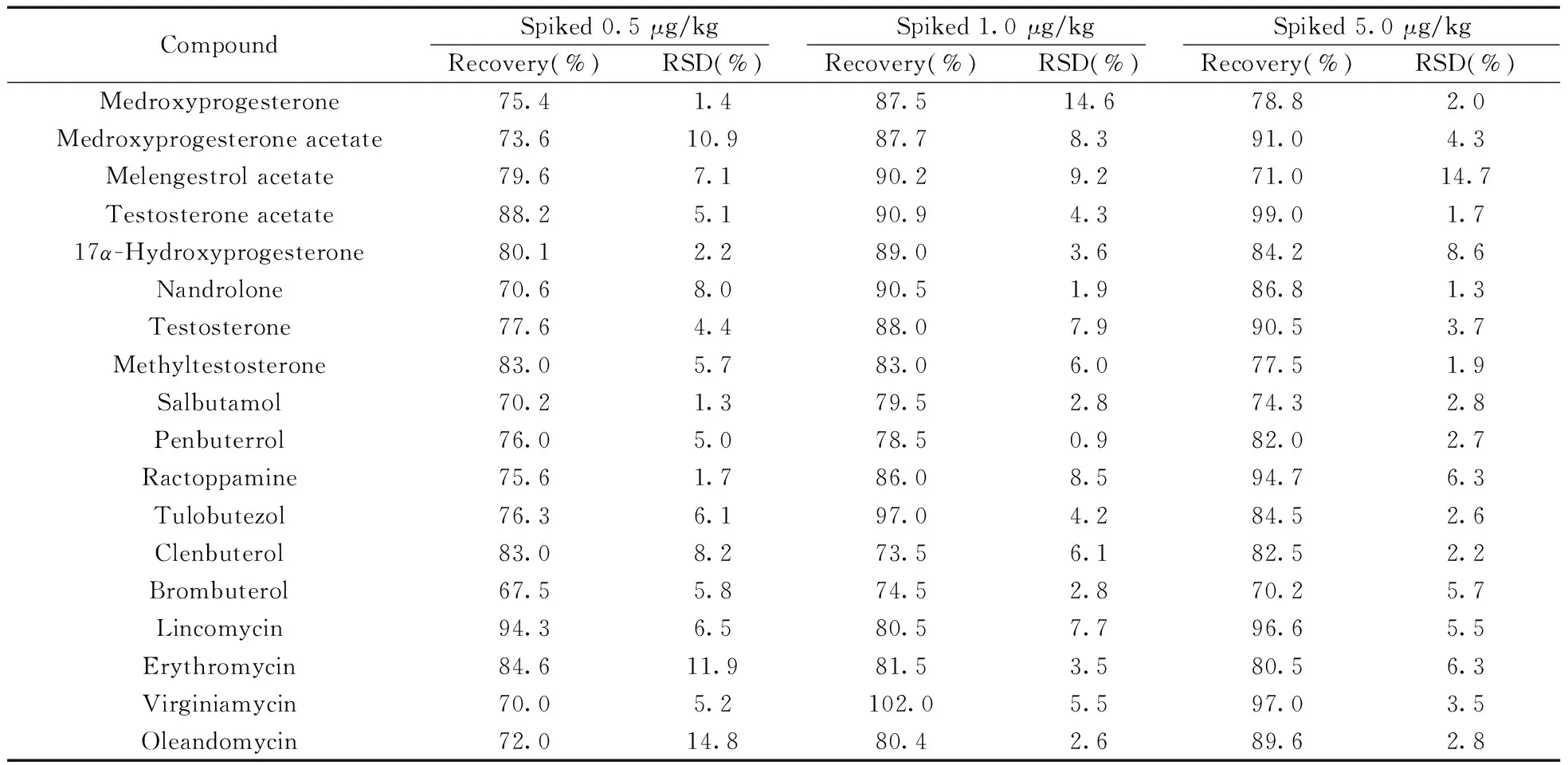
表3 18种化合物的回收率与精密度(n=6)Table 3 Recoveries and precisions for 18 compounds(n=6)
2.5 实际样品检测
利用本文所建立的方法分析了17份牛肝样品,其中1份样品中检出莱克多巴胺,检出量为2.19 μg/kg,3份样品中检出丙酸睾酮,检出量为3.87~31.2 μg/kg,其余药物均未被检出。
3 结 论
本文基于PRiME HLB固相萃取/超高效液相色谱-串联质谱建立了同时检测牛肝中18种促生长剂药物残留的分析方法,分别对色谱、质谱、提取溶剂及净化柱进行优化。在最佳条件下,方法检出限为0.07~0.78 μg/kg,定量下限为0.23~2.58 μg/kg;在0.5、1.0、5.0 μg/kg加标水平下的回收率为67.5%~102.0%,RSD小于15%。本方法简单、快速、准确且灵敏度好,可用于不同动物组织内脏中促生长剂类药物的检测。
[1] Chen J H,Lu Y,Feng N,Jiang J,Xie W D,Jiang Y,Zhao J P,Lu F.Sci.Technol.FoodInd.(陈君慧,路勇,冯楠,姜洁,谢文东,江英,赵俊平,鲁绯.食品工业科技),2013,34(8):74-79.
[2] Kan C A,Jager L P,Grommers F J.Anim.Welf.,1998,7:397-414.
[3] McGuffey R K,Richardson L F,Wilkinson J D.J.DairySci.,2001,84(1):E194-E203.
[4] Zhao S J,Zheng Z R,Qu Z N,Xiao X,Wang Y D,Wang J,Lu P.ChinaAnimalHealthInspection(赵思俊,郑增忍,曲志娜,肖肖,王玉东,王娟,路平.中国动物检疫),2011,28(4):1-4.
[5] Gong Q,Xi C X,Nie F P,Cao S R,Tang B B,Wang G M,Chen D D,Mu Z D.J.Instrum.Anal.(龚倩,郗存显,聂福平,曹淑瑞,唐柏彬,王国民,陈冬东,母昭德.分析测试学报),2017,36(1):117-121.
[6] Wang F M,Zhang H W,Pang S P,Tang Z X,Niu Z Y,Luo X.Chin.J.Anal.Chem.(王凤美,张鸿伟,庞士平,汤志旭,牛增元,罗忻.分析化学),2008,36(12):1629-1635.
[7] He X Q,Xi C X,Tang B B,Wang G M,Chen D D,Peng T,Mu Z D.FoodAddit.Contam.PartA,2014,31(10):1625-1638.
[8] You Y W,Uboh C E,Soma L R,Guan F Y,Li X Q,Liu Y,Rudy J A,Chen J W,Tsang D B.J.Chromatogr.A,2011,1218(26):3982-3993.
[9] Freitas A,Leston S,Rosa J,Castilho Mda C,Barbosa J,Rema,P,Pardal M A,Ramos F.FoodAddit.Contam.PartA,2014,31(5):817-826.
[10] González de la Huebra M J,Vincent U,Bordin G,Rodríguez A R.Anal.Bioanal.Chem.,2004,382(2):433-439.
[11] Han R W,Zheng N,Yu Z N,Wang J,Xu X M,Qu X Y,Li S L,Zhang Y D,Wang J Q.FoodChem.,2015,181:119-126.
[12] Zhu J G,Li P W,Zhang W,Sun X M,Yang Q Q,Zhang Q,Zhang Z W,Ding X X.J.Instrum.Anal.(朱建国,李培武,张文,孙晓曼,杨青青,张奇,张兆威,丁小霞.分析测试学报),2016,35(9):1087-1093.
[13] Ha J,Song G,Ai L F,Li J C.J.Chromatogr.B,2016,1017/1018:187.
[14] Jorge B,Fernando R,Freitasa A.J.Chromatogr.B,2015,976/977:49-54.
[15] Kaufmann A,Butcher P,Maden K.Anal.Chim.Acta,2012,711:46-53.
[16] Tian H,Wang J Q,Zhang Y D,Li S L,Jiang J D,Tao D L,Zheng N.J.Chromatogr.B,2016,1033/1034:172.
[17] Sun Q R,Guo L Q,Zhang J L,Liu Y Q.FoodRes.Dev.(孙清荣,郭礼强,张金玲,刘永强.食品研究与开发),2017,38(4):127-132.
Rapid Determination of 18 Growth Promoting Agents in Bovine Liver by UPLC-MS/MS Coupled with PRiME HLB SPE Clean-up
WANG Zhi1,3,SHI Zong-wei2,XI Cun-xian2,CAO Shu-rui2,WANG Guo-min2,TANG Bo-bin2,ZHENG Jia1,3,MU Zhao-de1,3*
(1.College of Pharmacy,Chongqing Medical University,Chongqing 400016,China;2.Chongqing Engineering Technology Research Center of Import and Export Food Safety,Chongqing Entry-Exit Inspection and Quarantine Bureau,Chongqing 400020,China;3.Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology,Chongqing 400016,China)
A method was developed for the rapid detection of 8 hormones,6β-receptor agonists and 4 antibiotics growth promoting agents in bovine liver by PRiME HLB solid-phase extraction/ultra performance liquid chromatography tandem mass spectrometry(UPLC-MS/MS).The chromatographic separation conditions,MS/MS detection parameters and sample pretreatment were optimized,respectively.The sample was firstly added NH4OAc buffer solution(pH 5.2),and hydrolyzed with a mixed solution ofβ-glucuronidase/sulfatase,then extracted with methanol(MeOH) and acetonitrile(ACN)-MeOH(90∶10,by volume) step by step,finally purified with PRiME HLB.The effluent was collected and concentrated to dryness,and redissolved with ACN-water(3∶7,by volume) for UPLC-MS/MS detection.The results showed that 18 kinds of compounds had good linear relationships in the range of 1.0-100.0 μg/L with their correlation coefficients higher than 0.990.The detection limits(LODs) ranged from 0.07-0.78 μg/kg,and the quantitation limits(LOQs) ranged from 0.23-2.58 μg/kg.The average recoveries of 18 compounds at three spiked levels(0.5,1.0,5.0 μg/kg) were in the range of 67.5%-102.0%with relative standard deviations(RSDs) less than 15%.The method was simple,rapid and accurate,and was suitable for the simultaneous detection of 18 growth promoting agents in animal tissues.
UPLC-MS/MS;PRiME HLB solid-phase extraction;growth promoting agents;bovine liver
10.3969/j.issn.1004-4957.2017.10.009
O657.63;TS201.6
A
1004-4957(2017)10-1219-06
2017-06-19;
2017-07-05
重庆市重大应用技术开发项目(cstc2015yykfC80001)
*
母昭德,博士,教授,研究方向:药物分析,E-mail:wzsophia@yeah.net