HPLC波长切换法同时测定参芪膏中6个主要成分的含量
朱兰平,庄 欢,余 妹
HPLC波长切换法同时测定参芪膏中6个主要成分的含量
朱兰平1,庄 欢2,余 妹3
目的建立HPLC波长切换法同时测定参芪膏中党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素的含量。方法采用Zorbax XDB-C18色谱柱(4.6 mm× 250 mm,5.0 μm),以乙腈-甲醇(9∶1)(A)-0.1%甲酸溶液(B)为流动相,进行梯度洗脱,流速0.9 mL/min,柱温30 ℃,进样量为10 μL,检测波长:266 nm(党参炔苷、丁香苷)、254 nm(毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、芒柄花素)。结果党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素6个成分分别在15.49~309.80、2.15~43.00、5.66~113.20、4.89~97.80、3.28~65.60、12.06~241.20 μg/mL范围内峰面积与浓度呈良好的线性关系,相关系数分别为0.999 7、0.999 2、0.999 5、0.999 3、0.999 6、0.999 9;平均加样回收率及相应的RSD分别为98.07% (0.61%)、99.09% (1.53%)、99.44% (1.33%)、97.86% (1.28%)、99.95% (1.04%)、97.19% (0.58%)。结论所建立的方法快速,灵敏度高,准确度高,专属性好,为参芪膏的质量控制提供依据。
参芪膏;党参炔苷;丁香苷;毛蕊异黄酮苷;芒柄花苷;毛蕊异黄酮;芒柄花素;波长切换法;多组分测定
0 引言
参芪膏为党参、黄芪2味中药材加工而成的煎膏剂,收载于《卫生部颁药品标准》中药成方制剂第17册。该制剂的标准仅规定了性状和黄芪薄层色谱鉴别,未对成分进行定量测定[1],且目前尚无关于该制剂多组分定量测定的文献报道。本文建立了一种较为简便的HPLC波长切换法,对参芪膏中2味中药材中的6种指标性成分(党参中的党参炔苷和丁香苷,黄芪中的毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素)的含量进行了测定。
1 仪器与试药
1.1 仪器 Agilent 1100 系列四元梯度泵高效液相色谱仪(美国安捷伦公司);分析天平(十万分之一,赛多利斯);超声波清洗机(SB-5200DTN型,宁波新芝生物科技股份有限公司)。
1.2 试剂与试药 党参炔苷对照品(批号:111732-201206,含量100.0%)、丁香苷对照品(批号:111574-201504,含量94.9%)、毛蕊异黄酮苷对照品(批号:111920-201505,含量97.1%)、芒柄花素对照品(批号:111703-201504,含量100.0%)来源于中国食品药品检定研究院;芒柄花苷对照品(批号:486-62-4,含量98.0%)来源于上海樊克生物科技有限公司;毛蕊异黄酮对照品(批号:20575-57-9,含量98.0%)来源于上海纯优生物科技有限公司;参芪膏(每瓶装300 g,批号:d15070012、16030002、16040007)来源于太极集团重庆桐君阁药厂有限公司。乙腈和甲醇为色谱纯,水为重蒸馏水,甲酸为分析纯。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 分别精密称取各对照品适量,用甲醇分别溶解并稀释制成含党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素各3.098、0.430、1.132、0.978、0.656、2.412 mg/mL单一成分的对照品储备液;再精密吸取适量,用甲醇稀释成浓度为0.154 9、0.008 6、0.056 6、0.048 9、0.032 8、0.120 6 mg/mL的混合对照品溶液。
2.1.2 供试品溶液 取参芪膏约3.0 g,精密称定,置25 mL量瓶中,加入甲醇适量,超声提取40 min,放冷,用甲醇稀释至刻度,振摇均匀,过滤,取续滤液,即得参芪膏供试品溶液。
2.1.3 阴性样品溶液 按《卫生部颁药品标准》中药成方制剂第17册参芪膏[1]质量标准项下的处方和生产工艺,分别制备不含党参的阴性样品和不含黄芪的阴性样品,再按照上述方法制备各阴性样品溶液。
2.2 色谱条件 采用Zorbax XDB-C18色谱柱(4.6 mm× 250 mm,5.0 μm);流动相A:乙腈-甲醇(9∶1),流动相B:0.1%甲酸溶液,梯度洗脱[2-5](0~9 min,16.0%A;9~15 min,16.0%A→28.0%A;15~30 min,28.0%A→55.0%A;30~35 min,55.0%A→16.0%A);0~15 min时在266 nm[6]波长下检测党参炔苷和丁香苷,15~35 min时在254 nm[7-8]波长下检测毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素;流速:0.9 mL/min;柱温:30 ℃;进样量为10 μL。
2.3 专属性试验 精密吸取“2.1”项下制备的4种溶液各适量,依法检测,结果显示,各阴性样品溶液的色谱图中,在混合对照品溶液和供试品溶液所测党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素6个成分对应的位置无干扰,理论塔板数均>3 500。色谱图见图1。
2.4 线性范围考察 分别精密吸取对照品储备溶液各0.1、0.2、0.5、1.0、1.5、2.0 mL,分别用甲醇稀释至20 mL,振摇均匀,即得到6个系列浓度的混合对照品溶液,按照“2.2”项下色谱条件进行测定,分别以各成分质量浓度C为横坐标、峰面积A为纵坐标,建立标准曲线,得回归方程,如表1所示。
2.5 精密度试验 取上述混合对照品溶液,按“2.2”项下色谱条件测定,连续进样 6 次,测定峰面积,结果党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素峰面积的RSD(n=6)分别为 0.77%、1.35%、1.01%、1.06%、1.13%、0.93%。

图1 样品(A)、对照品(B)、党参阴性(C)、黄芪阴性(D)色谱图
2.6 重复性试验 取参芪膏样品(批号:15070012) 6份,按“2.1.2”的方法制备供试品溶液,依法测定,分别计算党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素的含量及RSD,结果各组分的含量依次为1.513、0.065、0.517、0.381、0.295、1.179 mg/g,RSD依次为1.32%、1.04%、1.63%、1.49%、0.56%、1.24%。
2.7 稳定性试验 取供试品溶液(批号:15070012),在室温下放置0、2、4、6、8、12、18、24 h后进样测定,依法测定党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素的峰面积值,其RSD分别为0.88%、1.23%、1.11%、1.04%、1.03%、0.97%。结果表明,参芪膏供试品溶液在24 h内稳定。
2.8 加样回收率试验 分别精密称取各对照品,用甲醇分别溶解并稀释制成含党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素为0.451、0.197、0.389、0.286、0.221、0.355 mg/mL的对照品溶液,备用。取批号为15070012的参芪膏6份,每份约1.5 g,精密称定后,置于25 mL的量瓶中,精密加入上述备用对照品溶液各5.0、0.5、2.0、2.0、2.0、5.0 mL,再加甲醇适量,超声提取40 min,放冷,用甲醇稀释至刻度,摇匀,过滤,即得参芪膏加样回收样品试液,依法测定,计算6种成分的回收率及RSD,结果见表2。
2.9 参芪膏样品测定 取3批参芪膏,按供试品溶液的制备方法制备供试品溶液,按“2.2” 项下色谱条件测定党参炔苷、丁香苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素含量,见表3。

表1 线性关系实验结果

表2 加样回收率试验结果

续表
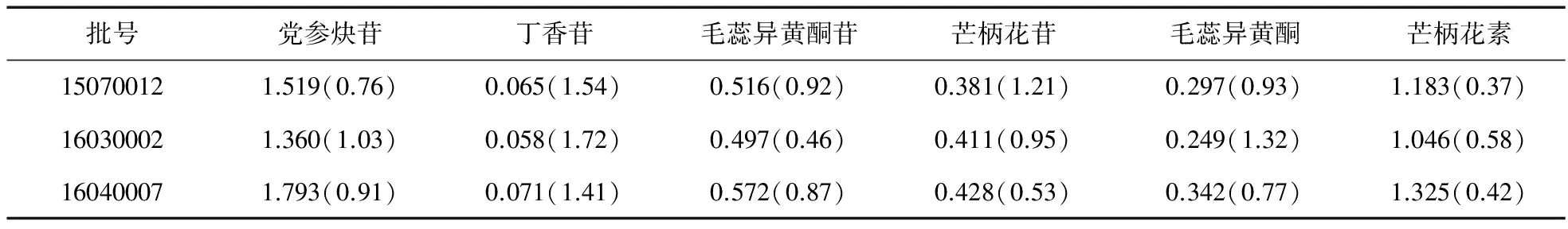
表3 含量测定结果[含量mg/g,RSD(%)]
3 讨论
3.1 样品处理方法的考察 在供试品溶液制备实验过程中,笔者考察了参芪膏供试品制备用不同的提取溶剂(乙醇、50%甲醇、75%甲醇、甲醇)和不同提取时间(20、40、60 min)对参芪膏所测成分的影响,以所测各成分的提取率为指标,优选最佳的样品处理方法。从实验结果来看,采用甲醇提取40 min和甲醇提取60 min,所测各成分提取率相当,考虑到操作的便捷性,最终优选参芪膏供试品溶液制备的溶剂和时间为甲醇提取40 min。
3.2 流动相的考察 在实验中,对梯度洗脱用流动相体系进行了对比考察,选取甲醇-水流动相体系、乙腈-水流动相体系[2]、乙腈-甲醇-水流动相体系[3]分别进行试验,以所测6种成分的分离效果及峰形等为指标,结果表明乙腈-甲醇-水流动相体系优于甲醇-水流动相体系和乙腈-水流动相体系,但毛蕊异黄酮的分离度欠佳,在此基础上,又分别考察了乙腈-甲醇(9∶1)-0.1%甲酸溶液、乙腈-甲醇(9∶1)-0.1%磷酸溶液流动相体系,结果表明,以乙腈-甲醇(9∶1)-0.1%甲酸溶液按照文中规定的梯度洗脱程序作为流动相时,所测各成分均能有效分离,峰形对称,基线较平稳。故优选乙腈-甲醇(9∶1)-0.1%甲酸溶液为流动相体系。
3.3 暂定含量限度的确定 根据本文所测各成分含量平均值约为80%,暂定本品每1 g含党参以党参炔苷计,不得低于1.2 mg,以丁香苷计,不得低于0.05 mg;含黄芪以毛蕊异黄酮苷计,不得低于0.4 mg,以芒柄花苷计,不得低于0.3 mg,以毛蕊异黄酮计,不得低于0.2 mg,以芒柄花素计,不得低于0.9 mg。
4 结论
高效液相波长转换法同时测定参芪膏中6种主要成分,专属性强、操作简便,样品溶液稳定性好,对参芪膏的质量控制及临床安全应用有重要意义。
[1] 中华人民共和国卫生部药典委员会.卫生部颁药品标准(中药成方制剂第十七册)[S].北京:人民卫生出版社,1998:137.
[2] 刘书斌,张樱山,李硕,等.甘肃不同产地党参中表征成分党参炔苷的含量分析[J].甘肃中医学院学报,2014,31(5):15-19.
[3] 王晓辉,刘涛,李清,等.高效液相色谱法同时测定黄芪中的五种异黄酮类成分[J].色谱,2006,24(5):486-488.
[4] 庞维荣,双少敏,刘养清.RP-HPLC法测定党参内酯和党参炔苷的含量及相关性研究[J].世界中西医结合杂志,2008,3(2):89-91.
[5] 纪松岗,李翔,娄子洋,等.高效液相色谱法测定黄芪中毛蕊异黄酮苷和芒柄花素的含量[J].第二军医大学学报,2006,27(1):81-84.
[6] 陈前锋,邓小艳,祝慧凤.HPLC法测定不同产地党参中党参炔苷和丁香苷的含量[J].食品工业科技,2016,37(6):64-67.
[7] 付娟,杨世海,黄林芳.超高效液相色谱法同时测定黄芪中 6 种黄酮类成分的含量[J].中国药学杂志,2013,48(11):916-919.
[8] 梁瑾,刘小花,任远,等.HPLC-DAD-ELSD法同时测定黄芪中5个成分的含量[J].药物分析杂志,2013,33(2):210-213.
Simultaneousdeterminationof6componentsinShenqiGaobyHPLCwavelengthswitchingmethod
ZHU Lan-ping1,ZHUANG Huan2,YU Mei3
(1.Department of Pharmacy,Tinglin Hospital of Shanghai Jinshan District,Shanghai 210505,China;2.Market Supervision and Administration of Shanghai Jinshan District,Shanghai 200540,China;3.Nanqiao Community Health Service Center of Shanghai Fengxian District,Shanghai 201499,China)
ObjectiveTo develop an HPLC wavelength switching method for simultaneous determination of the content of lobetyolin,syringin,calycosin7-O-β-D-glucopyranoside,ononin,calycosin and formononetin in Shenqi Gao.MethodsThe Zorbax XDB-C18(4.6 mm×250 mm,5.0 μm) chromatographic column was adopted;the mobile phase consisted of acetonitrile-methanol (9∶1) (A)-0.1% formic acid solution (B) with gradient elution at a flow rate of 0.9 mL/min;the column temperature was set at 30 ℃;the sample quantity was 10 μL.The wavelength was set at 266 nm (lobetyolin and syringin) and 254 nm (calycosin7-O-β-D-glucopyranoside,ononin,calycosin and formononetin).ResultsLobetyolin,syringin,calycosin7-O-β-D-glucopyranoside,ononin,calycosin and formononetin had good linearity within the range of 15.49~309.80 (r=0.999 7),2.15~43.00 (r=0.999 2),5.66~113.20 (r=0.999 5),4.89~97.80 (r=0.999 3),3.28~65.60 (r=0.999 6) and 12.06~241.20 μg/mL (r=0.999 9),respectively.The average recoveries and the correspondingRSDwere 98.07% (0.61%),99.09% (1.53%),99.44% (1.33%),97.86% (1.28%),99.95% (1.04%) and 97.19% (0.58%),respectively.ConclusionThe established method is rapid with high sensitivity,accuracy and specificity,which can be applied to the quality control of Shenqi Gao.
Shenqi Gao;Lobetyolin;Syringin;Calycosin7-O-β-D-glucopyranoside;Ononin;Calycosin;Formononetin;Wavelength switching method;Multicomponent determination
2017-02-14
1.上海市金山区亭林医院药剂科,上海 201505;2.上海市金山区市场监督管理局,上海 200540;3.上海市奉贤区南桥镇社区卫生服务中心,上海 201499
10.14053/j.cnki.ppcr.201710022

