槲皮黄酮对酒精性肝损伤大鼠高同型半胱氨酸血症及氧化应激的作用
冯莉芳,张玲莉
槲皮黄酮对酒精性肝损伤大鼠高同型半胱氨酸血症及氧化应激的作用
冯莉芳a,张玲莉b
目的探讨槲皮黄酮对酒精性肝损伤大鼠高同型半胱氨酸血症(HHcy)及氧化应激的作用。方法将30只大鼠随机分为正常对照组、模型组、低剂量槲皮黄酮治疗组、中剂量槲皮黄酮治疗组、高剂量槲皮黄酮治疗组,每组6只。用酒精+0.5 mL鱼油灌胃诱导酒精性肝损伤模型,造模3周后,治疗组大鼠分别给予4、2、1 g/kg槲皮黄酮灌胃,7周后麻醉处死大鼠,测定血浆总同型半胱氨酸(tHcy)浓度及血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(Alb)、白/球蛋白比值(A/G)、肝匀浆丙二醛(MDA)、超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)表达水平,并对肝脏病理组织进行检测。结果模型组大鼠tHcy、ALT、AST、MDA的表达水平高于正常对照组,而SOD、GSH含量低于对照组,差异均有统计学意义(P<0.05);治疗后,槲皮黄酮治疗组大鼠tHcy、ALT、AST、MDA均低于模型组(P<0.05),而SOD、GSH含量高于模型组(P<0.05),并呈浓度依赖性。组织病理学检测显示,模型大鼠出现肝细胞脂肪变性、点状坏死,伴随炎性细胞浸润,槲皮黄酮治疗后,点状坏死和炎性细胞浸润消失。结论槲皮黄酮可改善酒精性肝损伤,其作用机制可能与降低高同型半胱氨酸水平及氧化应激有关。
槲皮黄酮;高同型半胱氨酸血症;氧化应激
0 引言
槲皮黄酮是一种黄酮类化合物,广泛存在于植物中。研究发现,槲皮黄酮具有较多的药理作用,包括抗炎症、抗氧化应激、抗病毒、抑制血栓形成、抑制病毒、清除氧自由基及参与免疫调节等[1-5],可用于预防和治疗多种疾病,并且其原材料来源较为广泛,价格低廉,药效明显,给药途径较为方便。近年研究报道,槲皮黄酮可抑制NF-κB信号通路的活化,降低有关炎症因子水平,起到改善肝损伤的作用[6-7],因此在抗炎、抗肝纤维化方面有良好的应用前景。
酒精性肝损伤的发生机制较为复杂,有报道,高同型半胱氨酸血症(HHcy)可能是导致酒精性肝损伤的机制之一[8],槲皮黄酮可以调节同型半胱氨酸的代谢[9]。何映等[10]研究了体内外急性酒精性肝损伤小鼠模型,为之后的工作奠定了基础。本研究建立了酒精性肝损伤大鼠模型,探讨槲皮黄酮对酒精性肝损伤的作用。
1 材料与方法
1.1 材料 SPF级SD雄性大鼠购自湖北省疾控中心,体重(152±13) g;酒精和鱼油购自武汉中百仓储;肝功能试剂盒购自合肥艾力科生物技术有限公司;槲皮黄酮(美国Sigma公司,批号:20141012);Hcy检测试剂盒(华美公司);SOD检测试剂盒(美国Sigma公司);MDA检测试剂盒(美国Sigma公司);GSH检测试剂盒(美国Sigma公司);考马斯亮兰(华美公司)。
1.2 方法 SPF级SD雄性大鼠30只,平均体重(145±8) g,正常饲养待大鼠适应新环境1周后,将30只大鼠随机分为5组,即正常对照组、模型组、低剂量槲皮黄酮治疗组、中剂量槲皮黄酮治疗组、高剂量槲皮黄酮治疗组,每组6只,用酒精和鱼油灌胃诱导酒精性肝损伤模型。每日用酒精、0.5 mL鱼油灌胃,酒精开始剂量为6 g/kg,随后每周递增剂量0.2 g/kg,共7周,同时给予饲料喂养。正常对照组用0.9% NaCl溶液灌胃,同时给予饲料喂养。在造模后第3周开始,治疗组大鼠给予4、2、1 g/kg槲皮黄酮灌胃,共持续4周。造模7周后,收集大鼠血液及肝组织标本,对tHcy、ALT、AST、Alb、MDA、GSH及肝组织病理学形态进行检测。

2 结果
2.1 大鼠一般情况 与对照组相比,模型组大鼠体重明显减轻,差异有统计学意义(P<0.05);而经过高、中、低剂量槲皮黄酮治疗后,大鼠的体重没有发生变化。与对照组相比,模型组大鼠肝脏指数(肝脏湿重/体重×100)显著升高(P<0.05);而经过3种剂量槲皮黄酮治疗后,治疗组大鼠肝脏指数相对模型组显著降低(P<0.05),而治疗组间差异无统计学意义(P>0.05)。见表1。
2.2 大鼠血浆中tHcy含量的变化 酒精性肝损伤大鼠血浆中tHcy含量高于对照组(P<0.05);而经高、中、低剂量槲皮黄酮治疗后,大鼠血浆中tHcy含量较模型组显著降低,差异有统计学意义(P<0.05),而治疗组间tHcy水平差异无统计学意义(P>0.05)。见表2。
2.3 大鼠氧化应激产物检测结果 与正常对照组相比,模型组大鼠中MDA水平升高,而SOD、GSH水平降低(P均<0.05)。与模型组大鼠比较,高、中、低剂量槲皮黄酮治疗组大鼠MDA水平降低,SOD、GSH水平升高,差异有统计学意义(P<0.05),而治疗组间MDA、SOD、GSH水平比较差异无统计学意义(P>0.05)。见表3。

表1 各组大鼠体重及肝脏指数变化
注:与模型组比较,*P<0.05

表2 各组大鼠血浆tHcy水平的变化
注:与模型组比较,*P<0.05
2.4 血清肝功能指标的变化 模型组大鼠血清ALT、AST水平高于空白对照组,差异有统计学意义(P<0.05);而经过高、中、低剂量槲皮黄酮处理后,治疗组大鼠血清ALT、AST水平低于模型组,差异有统计学意义(P<0.05);药物治疗组之间比较差异无统计学意义(P>0.05)。进一步检测,模型组大鼠血清Alb、A/G水平与对照组、治疗组比较差异无统计学意义(P>0.05)。见表4。

表3 各组大鼠氧化应激产物变化
注:与模型组比较,*P<0.05
2.5 肝组织病理切片检测结果 肝组织病理检测结果显示,正常对照组肝组织结构正常,肝细胞形态饱和有光泽,排列规则有序,细胞质正常,肝小叶规则,少见脂肪滴,未发现炎症与坏死细胞。模型组大鼠肝组织结构杂乱无章,胞浆疏松,呈颗粒状变化,肝细胞出现较多脂肪滴,部分呈点状坏死灶,间质中还发现炎症细胞浸润。槲皮黄酮高、中、低剂量处理组大鼠肝组织炎症细胞浸润及肝细胞坏死显著降低。见图1。
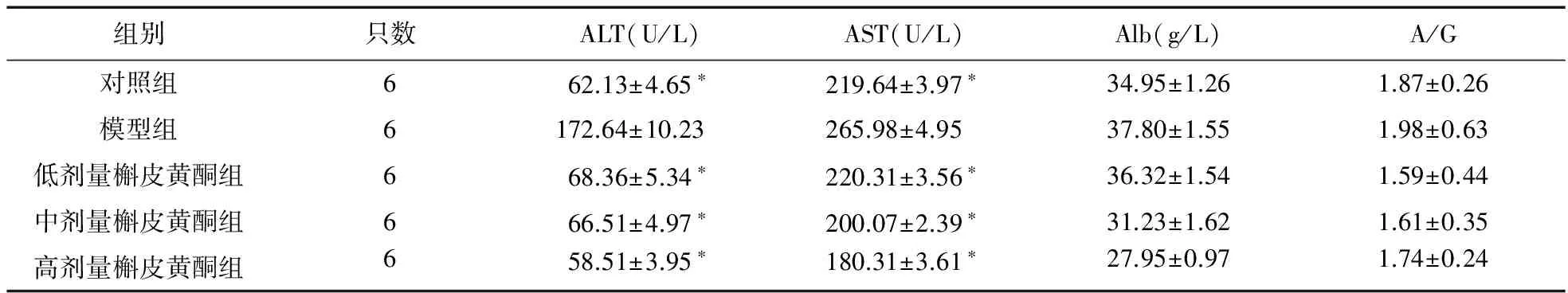
表4 各组大鼠肝功能指标变化
注:与模型组比较,*P<0.05
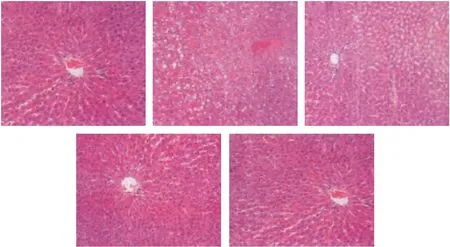
图1 肝组织病理学检测结果(400×)
3 讨论
酒精性肝损伤的发病机制至今尚未阐明,甲硫氨酸代谢异常所致的HHcy可能是导致酒精性肝损伤的致病机制之一[8]。因此,本研究通过槲皮黄酮治疗HHcy来考察其对酒精性肝损伤的药理作用。结果显示,模型组大鼠血浆中tHcy水平高于正常对照组,并且治疗数周后,治疗组tHcy水平降低,这可能是槲皮黄酮干预酒精性肝损伤的机制之一。鱼油里含有大量卵磷脂,由微粒体细胞色素P4502E1系统代谢的乙醇及其代谢产物乙醛、脂肪酸生成大量的活性氧自由基(ROS),ROS不仅可以造成肝细胞的损害,还可以增强肝细胞对脂质过氧化的敏感性。
SOD和GSH作为机体重要的还原剂,在拮抗自由基和氧化性毒物中发挥重要作用。槲皮黄酮在抗炎症反应、抗细胞凋亡[11]、抗氧化应激等方面的研究较多,然而对同型半胱氨酸血症及酒精性肝损伤治疗的研究较为少见。因此,本实验构建了酒精性肝损伤大鼠模型,探讨了槲皮黄酮的治疗效果。结果显示,槲皮黄酮可明显增强SOD活性,促进GSH在肝微粒体中的产生,从而促进肝细胞对自由基及其代谢产物的清除能力,抑制了氧化应激反应,减轻了自由基的损伤,保护肝细胞受损。本实验用高、中、低剂量槲皮黄酮治疗模型大鼠后,药物处理组大鼠血清ALT、AST水平下降,肝细胞坏死消失、炎症减轻。总之,槲皮黄酮能够缓解酒精性肝损伤,其作用机制可能与改善高同型半胱氨酸血症有关。
[1] Lee GH,Lee SJ,Jeong SW,et al.Antioxidative and antiinflammatory activities of quercetin-loaded silica nanoparticles[J].Colloids Surf B Biointerfaces,2016,143(12):511-517.
[2] Lee YH,Kim HJ,Yoo H,et al.Synthesis of (2-amino)ethyl derivatives of quercetin 3-O-methyl ether and their antioxidant and neuroprotective effects[J].Bioorg Med Chem,2015,23(15):4970-4979.
[3] Sharma G,Park J,Sharma AR,et al.Methoxy poly(ethylene glycol)-poly(lactide) nanoparticles encapsulating quercetin act as an effective anticancer agent by inducing apoptosis in breast cancer[J].Pharm Res,2015,32(2):723-735.
[4] Schwingel TE,Klein CP,Nicoletti NF,et al.Effects of the compounds resveratrol,rutin,quercetin,and quercetin nanoemulsion on oxaliplatin-induced hepatotoxicity and neurotoxicity in mice[J].Naunyn Schmiedebergs Arch Pharmacol,2014,387(9):837-848.
[5] Chamorro V,Pandolfi R,Moreno L,et al.Effects of quercetin in a rat model of hemorrhagic traumatic shock and reperfusion[J].Molecules,2016,21(12):E1739.
[6] Chen BL,Wang LT,Huang KH,et al.Quercetin attenuates renal ischemia/reperfusion injury via an activation of AMP-activated protein kinase-regulated autophagy pathway[J].J Nutr Biochem,2014,25(11):1226-1234.
[7] Dok-Go H,Lee KH,Kim HJ,et al.Neuroprotective effects of antioxidative flavonoids,quercetin,(+)-dihydroquercetin and quercetin 3-methyl ether,isolated from Opuntia ficus-indica var.saboten[J].Brain Res,2013,965(12):130-136.
[8] Palmero-Fernández L,Fernández-Treguerres F,Santos-Bueso E,et al.Hyperhomocysteinemia in chronic alcoholism:a case with retinal manifestations[J].Arch Soc Esp Oftalmol,2014,89(8):336-339.
[9] 郭长江,孟斌,高蔚娜,等.槲皮素调节同型半胱氨酸代谢的作用及其机制探讨[A].第二届中韩植物化学物国际学术研讨会论文集[C].2012.
[10]齐慧慧,宋佳,陈岳祥.小鼠急性酒精性肝损伤模型的建立[J].世界华人消化杂志,2012,20(9):759-763.
[11]谭大请,刘孝华.槲皮黄酮对膀胱癌细胞抑制作用的机制研究[J].中国中药杂志,2017,42(9):1742-1746.
Effectsofquercetinonhyperhomocysteinemiaandoxidativestressinratswithalcoholicliverinjury
FENG Li-fanga,ZHANG Ling-lib
(a.Department of Infectious Diseases,b.Department of Pharmacy,Renmin Hospital of Wuhan University,Wuhan 430060,China)
ObjectiveTo investigate the effects of quercetin on hyperhomocysteinemia and oxidative stress in rats with alcoholic liver injury.MethodsThirty rats were randomly divided into 5 groups:control group,model group,and 3 quercetin treatment (4,2 and 1 g/kg) groups.Ethanol plus 0.5 mL fish oil were used to establish models by inducing alcoholic liver injury.At 3 weeks after modeling,4,2 and 1 g/kg of quercetin was given in treatment groups.The plasma total homocysteine (tHcy),serum amino transferase activity (ALT and AST),albumin (Alb),globulin (Glb),liver malodialdehyde (MDA),seperoxidezed dismutase (SOD) and glutathione (GSH) were detected after 7 weeks,and the situation of liver injury was also evaluated by using tissue pathological examination.ResultsThe contents of tHcy,ALT,AST and MDA in model group were higher than those of control group (P<0.05),while SOD and GSH levels were lower (P<0.05).After treatment,the contents of tHcy,ALT,AST and MDA in quercetin treatment groups were lower than those of model group (P<0.05),while the levels of SOD and GSH were higher,and the changes in quercetin treatment groups were in aconcentration-dependent manner.The fatty degeneration,focal necrosis and inflammatory cell infiltration in liver occurred in model group,while the focal necrosis and inflammatory cell infiltration disappeared after treatment with quercetin.ConclusionQuercetin can protect liver against alcoholic liver injury by reducing the tHcy level and oxidative stress.
Quercetin;Hyperhomocysteinemia;Oxidative stress
2017-03-01
武汉大学人民医院a.感染科,b.药学部,武汉 430060
10.14053/j.cnki.ppcr.201710003

