ADAM17与E-cadherin、TIMP3蛋白在胃癌中的表达及临床意义
冯宇娇,王宏坤,郑绘霞,梁建芳
(1山西省肿瘤医院检验科,太原 030013;2山西医科大学第一医院病理科;*通讯作者,E-mail:whk2005002@163.com)
ADAM17与E-cadherin、TIMP3蛋白在胃癌中的表达及临床意义
冯宇娇1,王宏坤2*,郑绘霞2,梁建芳2
(1山西省肿瘤医院检验科,太原 030013;2山西医科大学第一医院病理科;*通讯作者,E-mail:whk2005002@163.com)
目的 探讨解聚素-金属蛋白酶ADAM17、E-cadherin及TIMP3在胃癌中的表达及意义。 方法 应用免疫组织化学EnVision法检测53例胃腺癌组织及阴性切缘正常组织(对照组)中ADAM17、E-cadherin及TIMP3之间的表达情况,分析其与临术病理特征的关系。 结果 ADAM17在癌组织中的表达显著高于正常组织(P<0.05),E-cadherin和TIMP3在癌组织中的表达显著低于正常组织(P<0.05)。ADAM17表达在胃癌淋巴结是否发生转移及不同TNM分期间分别比较,差异均有统计学意义(P<0.05),不同年龄及不同肿瘤分化程度比较,差异均无统计学意义(P>0.05);E-cadherin和TIMP3表达与胃癌分化程度及TNM分期分别比较差异有统计学意义(P<0.05),与年龄及淋巴结转移比较无统计学差异(P>0.05)。ADAM17表达与E-cadherin和TIMP3表达存在负相关性(P<0.05)。 结论 ADAM17与E-cadherin和TIMP3可能在胃癌的发生发展过程中发挥作用,ADAM17高表达与胃癌的恶性进展有关。
胃癌; ADAM17; E-cadherin; TIMP3
胃癌的发生发展是多阶段多因素作用的过程,但到目前为止,胃癌的发病机制尚不明确,还在不断的研究探索中。近期研究发现解聚素-金属蛋白酶17(a disintegrin and metalloproteinase 17,ADAM17),又名肿瘤坏死因子α转化酶,具有解聚素和金属蛋白酶的活性,在多种肿瘤中均有表达,并且在肿瘤的发生发展过程中起着重要作用。在肿瘤组织中,过表达ADAM17可以促进肿瘤细胞的增殖侵袭,血管形成及转移能力[1]。本研究通过检测ADAM17、E-cadherin及TIMP3在胃癌中的表达,希望能为胃癌的发生发展及恶性进展提供一定的实验依据。
1 材料与方法
1.1 材料来源
收集我院2011-2014年间胃癌手术切除标本,对石蜡标本重新包埋切片观察,整理53例胃腺癌及相应切缘阴性的组织做对照,所有标本经过两位经验丰富的高级职称病理专家诊断。
1.2 试剂与方法
ADAM17抗体、E-cadherin、TIMP3及免疫组化试剂盒和DAB显色试剂盒均购自福州迈新生物科技有限公司。ADAM17浓度配比1 ∶200,E-cadherin和TIMP3为工作液,采用EnVision法检测ADAM17、E-cadherin及TIMP3的表达,所有石蜡标本4 μm连续切片,DAB显色。胃癌组织染色设阳性对照和阴性对照,阴性对照采用PBS液代替一抗。
1.3 结果判定
ADAM17蛋白在肿瘤细胞胞膜/胞质呈棕黄色为阳性表达;E-cadherin及TIMP3均为细胞质呈棕黄色颗粒为阳性染色。观察阳性细胞百分比及染色强度,分别计数阳性细胞百分比(阴性为0,1%-25%为1分,26%-50%为2分,51%-75%为3分,>75%为4分),评判阳性细胞染色强度(阴性为0,弱阳性为1分,中度阳性为2分,强阳性为3分),两者相乘≤4分为低表达或不表达,>4分为高表达。
1.4 统计方法
采用SPSS 16.0软件进行统计学处理,计数资料数据比较采用χ2检验,两指标相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 ADAM17在正常组织及胃癌中的表达
53例胃癌组织中,28例(52.8%)ADAM17呈不同程度的表达(见图1),对比正常组织中仅有2例(3.8%)显示 ADAM17表达,其差异有统计学意义(χ2=31.428,P=0.000)。ADAM17表达在胃癌淋巴结转移是否发生及不同TNM分期间表达差异均有统计学意义(P<0.05),在不同发病年龄患者及不同肿瘤分化程度间比较差异均无统计学意义(P>0.05,见表1)。
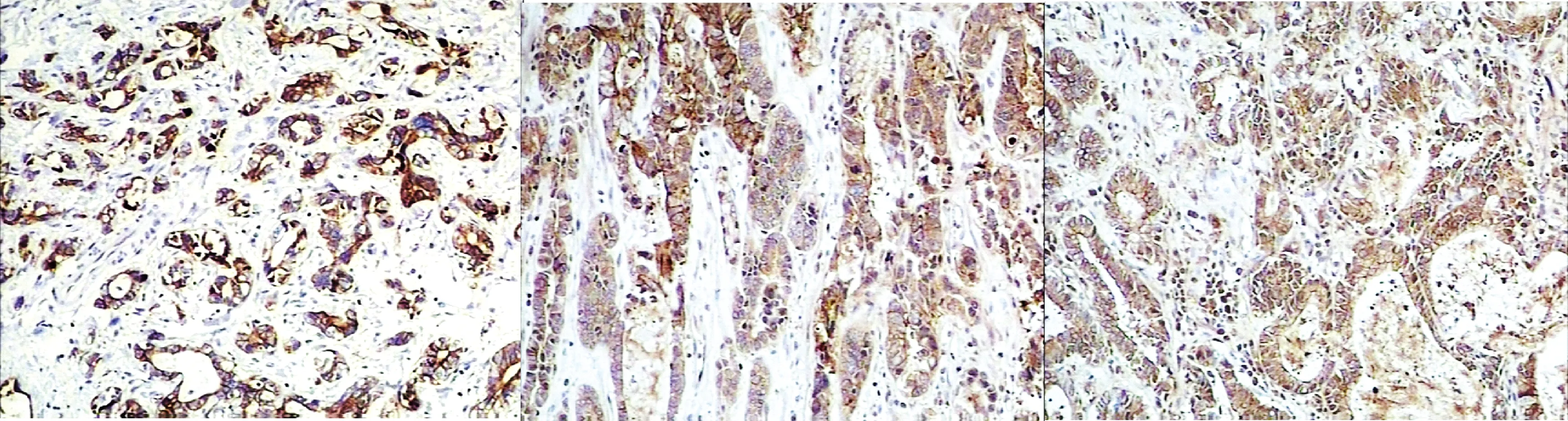
A.胃腺癌ADAM17 B.胃腺癌E-cadherin C.胃腺癌TIMP3

D.胃正常黏膜ADAM17 E.胃正常黏膜E-cadherin F.胃正常黏膜TIMP3图1 ADAM17,E-cadherin,TIMP3在胃腺癌和胃正常黏膜中的表达 (EnVision法,×100)Figure 1 The expression of ADAM17,E-cadherin,TIMP3 in gastric carcinoma and normal control (EnVision,×100)
2.2 E-cadherin和TIMP3在正常组织及胃癌中的表达情况
E-cadherin和TIMP3在正常组织中阳性率均为100%,在胃癌中阳性率为分别为11.3%(6/53)和13.2%(7/53),二者比较差异均有统计学意义(P<0.05,见图1)。 E-cadherin和TIMP3表达在胃癌不同分化程度及不同TNM分期间表达差异均有统计学意义(P<0.05),在不同发病年龄患者及淋巴结是否转移间比较差异均无统计学意义(P>0.05,见表1)。
2.3 ADAM17与E-cadherin及TIMP3在胃癌中的相关性比较
由表2可见,Spearman相关性分析显示,ADAM17与E-cadherin存在负相关性(r=-0.378,P=0.005),与TIMP3之间同样存在负相关性(r=-0.301,P=0.028)。
表1ADAM17、E-cadherin及TIMP3在胃癌组织中的表达及其与临床病理参数的关系
Table1ExpressionofADAM17,E-cadherinandTIMP3andtheirrelationshipwithclinicopathologicalcharacteristicsingastriccancertissues
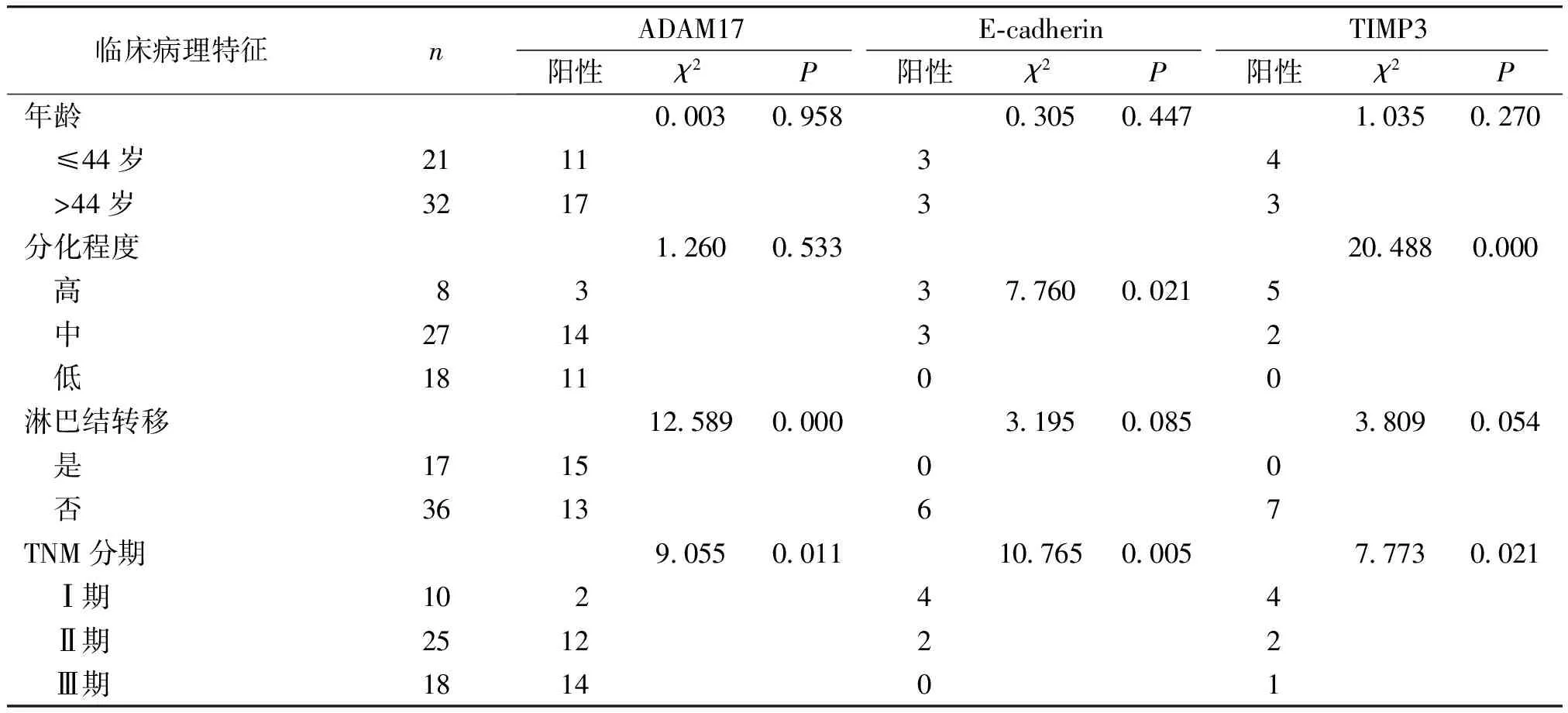
临床病理特征nADAM17E⁃cadherinTIMP3阳性χ2P阳性χ2P阳性χ2P年龄000309580305044710350270 ≤44岁211134 >44岁321733分化程度12600533204880.000 高833776000215 中271432 低181100淋巴结转移1258900003195008538090054 是171500 否361367TNM分期9055001110765000577730021 Ⅰ期10244 Ⅱ期251222 Ⅲ期181401
表2ADAM17与E-cadherin和TIMP3表达在胃癌中的相关性比较
Table2ThecorrelationbetweenADAM17expressionandE-cadherin,TIMP3proteinexpressioningastriccancer

ADAM17E⁃cadherinTIMP3+-+-+028127-619619
3 讨论
解聚素-金属蛋白酶17(a disintegrin and metalloproteinase 17,ADAM17)是ADAM蛋白家族的成员之一,又名肿瘤坏死因子α转化酶,具有解聚素和金属蛋白酶的活性。ADAMs 家族成员同属于I 型跨膜蛋白,它们参与细胞外基质的多种活动,包括胞外基质的降解、细胞与细胞之间的黏连及细胞与基质的黏连、细胞信号转导等,在这些活动中ADAMs 家族成员起了重要的作用。ADAM17具有剪切蛋白酶样的作用,同样可以活化细胞外多个功能区,剪切多种细胞因子如表皮生长因子、受体,细胞因子及黏附分子等胞外结构域的成分,这种功能为细胞融合、迁移、细胞外信号转导等方面提供了重要的支撑,尤其在肿瘤组织中,当ADAM17高表达时能够显著促进细胞的增殖和迁移能力[2,3]。
研究发现,在人类非小细胞肺癌A549细胞系中转染ADAM17后,细胞的增殖、迁移、侵袭及细胞周期的增长都显著增加,而在干扰ADAM17将其抑制后,上述能力都明显减低,这种能力无论是在体外还是体内实验都得到了充分的证明,可见ADAM17在非小细胞肺癌的发展过程中起着重要的作用[4]。最新的研究显示,在胃癌细胞系中敲除ADAM17后,细胞的增殖侵袭能力明显降低,凋亡增加,而转染ADAM17的细胞则增殖侵袭能力明显增强,凋亡减低[5]。我们的实验结果显示ADAM17在胃癌组织中的表达显著高于正常胃黏膜组织,差异有统计学意义,ADAM17的表达还与淋巴结转移及TNM分期有关,而与年龄及肿瘤分化程度等无关。发生淋巴结转移的病例及TNM分期高的病例ADAM17明显高表达,可见ADAM17表达与胃癌的发生发展及恶性进展密切相关。
E-cadherin基因属于钙依赖性跨膜糖蛋白,介导细胞间的黏附反应,维持细胞的极性,并且参与细胞的分化调节,调节细胞与细胞、细胞与基质间的黏附反应,在正常组织中它对维持组织结构的形态和完整性起着重要的作用,在肿瘤组织内它能与多种蛋白(连环素、肌动蛋白丝网及骨架蛋白)结合形成复合物从而抑制肿瘤的侵袭和转移能力[6,7]。在鼻咽癌的研究中,通过在细胞中对E-cadherin的上调,能够显著抑制ADAM17的表达,从而使鼻咽癌细胞的增殖和侵袭能力降低[8]。TIMP3即基质金属蛋白抑制因子,能够抑制组织中基质金属蛋白酶的活性,在正常情况下,具有维持细胞外基质合成与降解平衡的作用,在肿瘤组织中能够抑制肿瘤的生长侵袭和转移[9]。在视网膜病变的研究中发现,TIMP3和某种药物能够显著抑制小鼠视网膜病变中病理性新生血管形成,而原因则是由于灭活了ADAM17和EGFR的表达[10]。已有多项研究证实,E-cadherin和TIMP3在胃癌的发生发展过程中对肿瘤的生长均有一定的抑制作用[11,12],我们的研究结果也显示,E-cadherin在胃癌中的表达明显低于正常组织,在癌组织中的表达与肿瘤分化程度及TNM分期有关,分化越差,表达越低,分期越高,表达越低。由于ADAM17在细胞基质中产生的作用,我们对ADAM17与E-cadherin和TIMP3之间的关系进行了比较分析,结果发现,ADAM17与E-cadherin和TIMP3之间存在显著负相关关系,提示在胃癌中,ADAM17的表达与E-cadherin和TIMP3之间存在相互抑制作用,ADAM17高表达说明E-cadherin和TIMP3对胃癌的抑制作用减弱甚至消失,这也可能是ADAM17的高表达减弱了E-cadherin和TIMP3对它的拮抗作用,从而导致肿瘤的不断增殖,但这种假设还需要从细胞水平进行更深入的研究。
我们的研究证实ADAM17、E-cadherin及TIMP3在胃癌的发生发展过程中起着重要的作用,ADAM17可能是其恶性进展的标志,是判断胃癌生物学行为的重要指标,但具体的作用机制还需要进一步研究。
[1] Lisi S,D’Amore M,Sisto M.ADAM17 at the interface between inflammation and autoimmunity[J].Immunol Lett,2014,162(1 Pt A):159-169.
[2] Wang HP,Wang X,Gong LF,etal.Nox1 promotes colon cancer cell metastasis via activation of the ADAM17 pathway[J].Eur Rev Med Pharmacol Sci,2016,20(21):4474-4481.
[3] Lorenzen I,Lokau J,Korpys Y,etal.Control of ADAM17 activity by regulation of its cellular localisation[J].Sci Rep,2016,6:35067.
[4] Lv X,Li Y,Qian M,etal.ADAM17 silencing suppresses the migration and invasion of non-small cell lung cancer[J].Mol Med Rep,2014,9(5):1935-1940.
[5] Sun J,Jiang J,Lu K,etal.Therapeutic potential of ADAM17 modulation in gastric cancer through regulation of the EGFR and TNF-α signalling pathways[J].Mol Cell Biochem,2017,426(1-2):17-26.
[6] 常磊,袁玉峰,郭涛,等.波形蛋白、E一钙黏蛋白在原发性肝癌上皮问质转化过程中的表达及其意义.中华肝胆外科杂志,2015,21(1):9-13.
[7] Wang T,Shi F,Wang J.Kallistatin suppresses cell proliferation,invasion,and promotes apoptosis in cervical cancer through blocking NF-κB signaling[J].Oncol Res,2016:Epub ahead of print.
[8] Wu J,Yin L,Jiang N,etal.MiR-145,a microRNA targeting ADAM17,inhibits the invasion and migration of nasopharyngeal carcinoma cells[J].Exp Cell Res,2015,338(2):232-238.
[9] 唐海林,苏坚,邓敏,等.胃癌组织中miR-222 与TIMP3 的表达及临床意义[J].中国肿瘤临床,2012,39(4):194-196.
[10] Hewing NJ,Weskamp G,Vermaat J,etal.Intravitreal injection of TIMP3 or the EGFR inhibitor erlotinib offers protection from oxygen-induced retinopathy in mice[J].Invest Ophthalmol Vis Sci,2013,54(1):864-870.
[11] Bernal C,Aguayo F,Villarroel C,etal.Reprimo as a potential biomarker for early detection in gastric cancer[J].Clin Cancer Res,2008,14(19):6264-6269.
[12] Qu Y,Dang S,Hou P.Gene methylation in gastric cancer[J].Clin Chim Acta,2013,424:53-65.
ExpressionandimplicationofADAM17,E-cadherinandTIMP3ingastricadenocarcinoma
FENG Yujiao1,WANG Hongkun2*,ZHENG Huixia2,LIANG Jianfang2
(1DepartmentofClinicalLaboratory,ShanxiCancerHospital,Taiyuan030013,China;2DepartmentofPathology,FirstHospitalofShanxiMedicalUniversity;*Correspondingauthor,E-mail:whk2005002@163.com)
ObjectiveTo explore the expression and significance of ADAM17,E-cadherin and TIMP3 in tissues of gastric adenocarcinoma.MethodsExpression of ADAM17,E-cadherin and TIMP3 was detected with immunohistochemistry EnVision assay in 53 specimens of gastric adenocarcinoma tissues and normal tissues from the negative incisal margin. Relationships between their expression and clinopathologic parameters were analyzed.ResultsThe positive expression of ADAM17 protein in cancer tissues was significantly higher than that of normal tissues(P<0.05),and the expression of E-cadherin and TIMP3 proteins in gastric cancer tissues was significantly lower than that of normal tissues(P<0.05).ADAM17 protein expression in cancer tissues was significantly related to lymph node metastasis and TNM stage(P<0.05),but not related with age and tumor grade.And the expression of E-cadherin and TIMP3 proteins was significantly related to tumor grade and TNM stage(P<0.05),but not related with age and lymph node metastasis.The expression of ADAM17 was negatively correlated with E-cadherin and TIMP3 in gastric cancer tissues,respectively(P<0.05).ConclusionThe ADAM17,E-cadherin and TIMP3 proteins may play a role in the development and progression of gastric cancer,and the high expression of ADAM17 is related with the malignant progression of gastric cancer.
gastric cancer; ADAM17; E-cadherin; TIMP3
R735.2
A
1007-6611(2017)09-0945-04
10.13753/j.issn.1007-6611.2017.09.017
冯宇娇,女,1985-02生,本科,主管技师
2017-01-06

