培美曲塞与铂类化疗药联合使用对晚期肺腺癌患者治疗有效性与安全性研究
范群,伍小平,戴文香,谭业儒,朱红波
(南华大学附一医院 肿瘤内科,湖南 衡阳 421001)
·论著·
培美曲塞与铂类化疗药联合使用对晚期肺腺癌患者治疗有效性与安全性研究
范群,伍小平,戴文香,谭业儒,朱红波
(南华大学附一医院 肿瘤内科,湖南 衡阳 421001)
目的探讨培美曲塞与铂类化疗药联合使用对晚期肺腺癌患者治疗有效性与安全性。方法研究对象为我院收治的200例晚期肺腺癌患者,分为观察组(n=98)与对照组(n=102)。其中观察组患者接受培美曲塞联合顺铂进行治疗,而对照组患者接受多西他赛联合顺铂进行治疗,研究上述治疗方案对患者的治疗效果。结果(1)两组患者治疗前癌胚抗原(CEA)、肿瘤标志物糖类抗原125(CA125)、细胞角蛋白19片段抗原(CYFRA21- 1)、躯体功能、疲乏、恶心呕吐、失眠、食欲丧失、整体生活质量评分差异无统计学意义(P>0.05);观察组治疗后CEA、CA125、CYFRA21- 1指标值及疲乏、恶心呕吐、失眠、食欲丧失评分值明显低于对照组(P<0.05),而观察组躯体功能、整体生活质量评分明显高于对照组(P<0.05)。(2)观察组患者治疗近期有效率、无进展生存期、总生存期高于对照组患者(P<0.05),而不良反应发生率低于对照组(P<0.05)。结论培美曲塞与铂类化疗药联合使用可降低晚期肺腺癌患者CEA、CA125、CYFRA21- 1水平,提高患者生活质量,疗效显著,安全可靠。
培美曲塞; 顺铂; 晚期肺腺癌; 癌胚抗原; 肿瘤标志物糖类抗原125; 细胞角蛋白19片段抗原
按照病理类型进行分类,临床上非小细胞肺癌可分为鳞癌、腺癌和大细胞癌3种,其中以腺癌最为常见,病灶外周较小为该类型典型表现,且腺癌极易发生区域淋巴结转移或远处转移[1]。在肺腺癌早期阶段,其临床症状不明显,发现时大多数患者已处于疾病晚期或发生转移,造成大多数患者5 年生存率较低[2]。临床上针对中晚期肺癌患者的治疗通常以全身治疗为主,其中对于中晚期非小细胞肺癌患者而言则是以含铂的两药联合为标准治疗方法,改善患者生活质量及延长其生存期[3]。因此,积极探索更加有效的治疗方案,提高治疗效果,延长患者生存时间,是目前临床医师研究的热点问题之一。临床研究结果已证实,晚期非小细胞肺癌患者联合使用含铂两药的化疗方案具有一定治疗效果,且该方案的疗效以及患者生存率明显高于单独药物的用药方案。另外,上述治疗方案基础上联用第3种药物并不能显著改善治疗效果。因此,含铂两药的联合化疗方案具有一定的临床应用价值。为了探讨培美曲塞与铂类化疗药联合使用对晚期肺腺癌患者的治疗效果,本研究以我院收治的晚期肺腺癌患者为研究对象,其中观察组患者接受培美曲塞联合顺铂进行治疗,而对照组患者接受多西他赛联合顺铂进行治疗,观察上述治疗方案对患者的影响。现将研究结果报道如下。
1 资料与方法
1.1 一般资料
研究对象为我院2016年1月至2016年12月期间收治的200例晚期肺腺癌患者。患者入选标准[4]:(1)患者病史资料完整,且接受规律的临床治疗;(2)患者病灶具有可测量性;(3)通过病理学诊断确认为肺腺癌Ⅳ或ⅢB期;(4)治疗前ECOG PS评分低于2分,且患者预计生存期超过3个月;(5)治疗前患者肝肾功能、血常规以及心功能检查结果基本正常;(6)治疗前所有患者均签署化疗方案知情同意书;(7)患者全程接受至少2个治疗周期的化疗;(8)在治疗期间,患者未接受其他化疗方案进行治疗;(9)治疗前、后所有患者均进行肿瘤标志物的检查;(10)所有患者病例资料中,均明确记载治疗过程所发生的不良反应。
根据研究人群化疗方式的不同,将其分为观察组 (n=98)与对照组(n=102)。观察组中男52例,女46例,平均年龄(60.6±5.8)岁;按照病理分期进行分类,肺腺癌Ⅳ期患者50例,ⅢB期患者48例;ECOG PS平均评分为(1.6±0.5)分,平均治疗周期(3.8±0.9)个。对照组中男54例,女48例,平均年龄(61.5±6.2)岁;按照病理分期进行分类,肺腺癌Ⅳ期患者52例,ⅢB期患者50例;ECOG PS平均评分为(1.5±0.4)分,平均治疗周期(3.7±0.8)个。两组患者于上述基本资料间差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
观察组患者接受培美曲塞联合顺铂进行治疗,即首次使用培美曲塞前对患者进行预先处理,于给药前1周通过肌肉注射方式给予患者维生素B12,每次1 mg,每3个治疗周期重复注射1次,培美曲塞首次给药前1周需给予患者口服叶酸,每天0.4 mg,直至最后1次培美曲塞给药后的3周,于培美曲塞给药前的1天、当天以及给药后的1天,每天口服8 mg地塞米松,每次4 mg,分2次服用。顺铂给药剂量75 mg·m-2,给药方式静脉滴注,第1天;培美曲塞给药剂量500 mg·m-2,给药方式静脉滴注,第1天。而对照组患者接受多西他赛联合顺铂进行治疗,即首次使用多西他赛前对患者进行预处理,于给药前的1天、当天以及给药后的1天,每天口服16 mg地塞米松,每次8 mg,分2次服用。顺铂给药剂量75 mg·m-2,给药方式静脉滴注,第1天;多西他赛给药剂量75 mg·m-2,给药方式静脉滴注,第1天。两组患者化疗至少2个周期,每个周期为3周。观察并比较两组患者的治疗效果。
1.3 疗效评价指标
1.3.1 疗效评价指标 (1)癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角蛋白 19 片段抗原(CYFRA21- 1)。于治疗前、后采集患者静脉血(空腹),并分离血清。使用化学发光微粒子免疫分析方法对CEA、CA125进行检测,使用电化学发光免疫分析方法对CYFRA21- 1进行测定。相关试剂盒均购自德国罗氏公司,并按照其说明书进行相应操作。(2)躯体功能、疲乏、恶心呕吐、失眠、食欲丧失、整体生活质量评分[5]:采用EORTC QLQ- C30 量表(欧洲癌症研究与治疗组织生命质量核心量表,第3版),对治疗前后患者进行问卷调查。
1.3.2 近期疗效评价标准[6]完全缓解(complete remission, CR):所有目标病灶消失;部分缓解(partial remission , PR):基线病灶长径总和缩小至少30%;疾病稳定(stable disease, SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD;疾病进展(progressive disease, PD):基线病灶长径总和增加至少20%或出现新病灶。有效率(response rate,RR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate, DCR)=(CR+PR+SD)例数/总例数×100%。远期疗效评价标准[7]:无进展生存期(progression- free survival, PFS):指从随机化开始至观察到疾病进展或因任何原因死亡的时间;总生存期(overall survival, OS):指从随机化开始至因任何原因引起死亡的时间。
1.3.3 不良反应 观察两组患者治疗期间不良反应发生情况,主要包括白细胞计数降低、中性粒细胞计数降低、血小板计数降低、脱发、贫血等。
1.4 统计学处理
应用SPSS19.0软件对研究结果进行统计学分析并处理,其中计量资料的比较采用t检验,计数资料的比较采用卡方检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者治疗前后CEA、CA125、CYFRA21- 1的比较
治疗前两组患者CEA、CA125、CYFRA21- 1差异无统计学意义(P>0.05);治疗后观察组CEA、CA125、CYFRA21- 1指标值明显低于对照组,差异均具有统计学意义(P<0.05)。见表1。
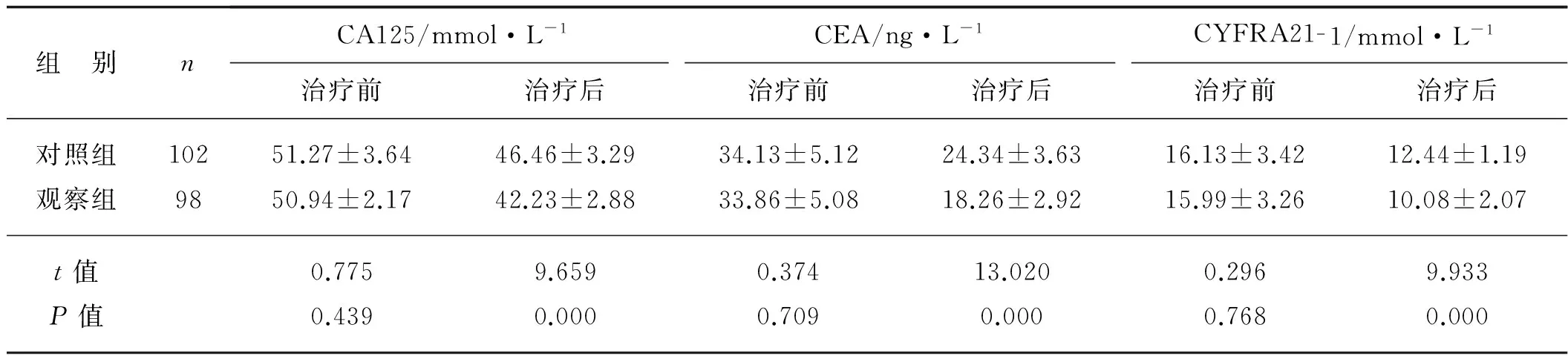
组 别nCA125/mmol·L-1CEA/ng·L-1CYFRA21-1/mmol·L-1治疗前治疗后治疗前治疗后治疗前治疗后对照组10251.27±3.6446.46±3.2934.13±5.1224.34±3.6316.13±3.4212.44±1.19观察组9850.94±2.1742.23±2.8833.86±5.0818.26±2.9215.99±3.2610.08±2.07t值0.7759.6590.37413.0200.2969.933P值0.4390.0000.7090.0000.7680.000
2.2 治疗前后两组患者EORTC生命质量测定量表标准化积分的比较
治疗前两组患者躯体功能、疲乏、恶心呕吐、失眠、食欲丧失、整体生活质量评分差异无统计学意义(P>0.05);治疗后观察组躯体功能、整体生活质量评分明显高于对照组(P<0.05),而疲乏、恶心呕吐、失眠、食欲丧失评分值低于对照组(P<0.05)。见表2、3。
表2 两组患者治疗前EORTC生命质量测定量表标准化积分的比较 分
表3 两组患者治疗后EORTC生命质量测定量表标准化积分的比较 分
2.3 两组患者临床疗效的比较及生存曲线分析
观察组患者治疗近期有效率明显高于对照组(19.61%vs47.96%),差异具有统计学意义(P<0.05);观察组患者无进展生存期、总生存期明显长于对照组患者(P<0.05)。见表4,图1、2。
表4两组患者治疗近期有效率的比较
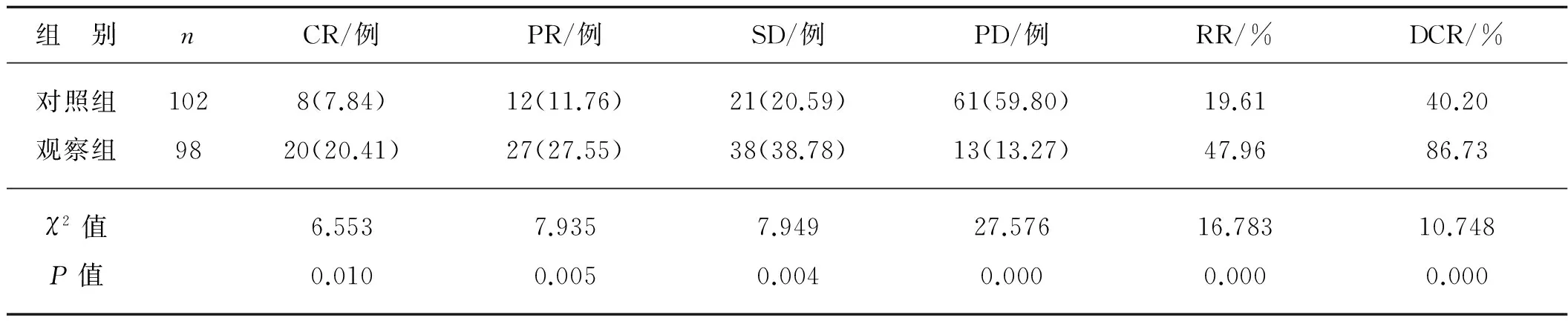
组 别nCR/例PR/例SD/例PD/例RR/%DCR/%对照组1028(7.84)12(11.76)21(20.59)61(59.80)19.6140.20观察组9820(20.41)27(27.55)38(38.78)13(13.27)47.9686.73χ2值6.5537.9357.94927.57616.78310.748P值0.0100.0050.0040.0000.0000.000
注:括号内为百分率
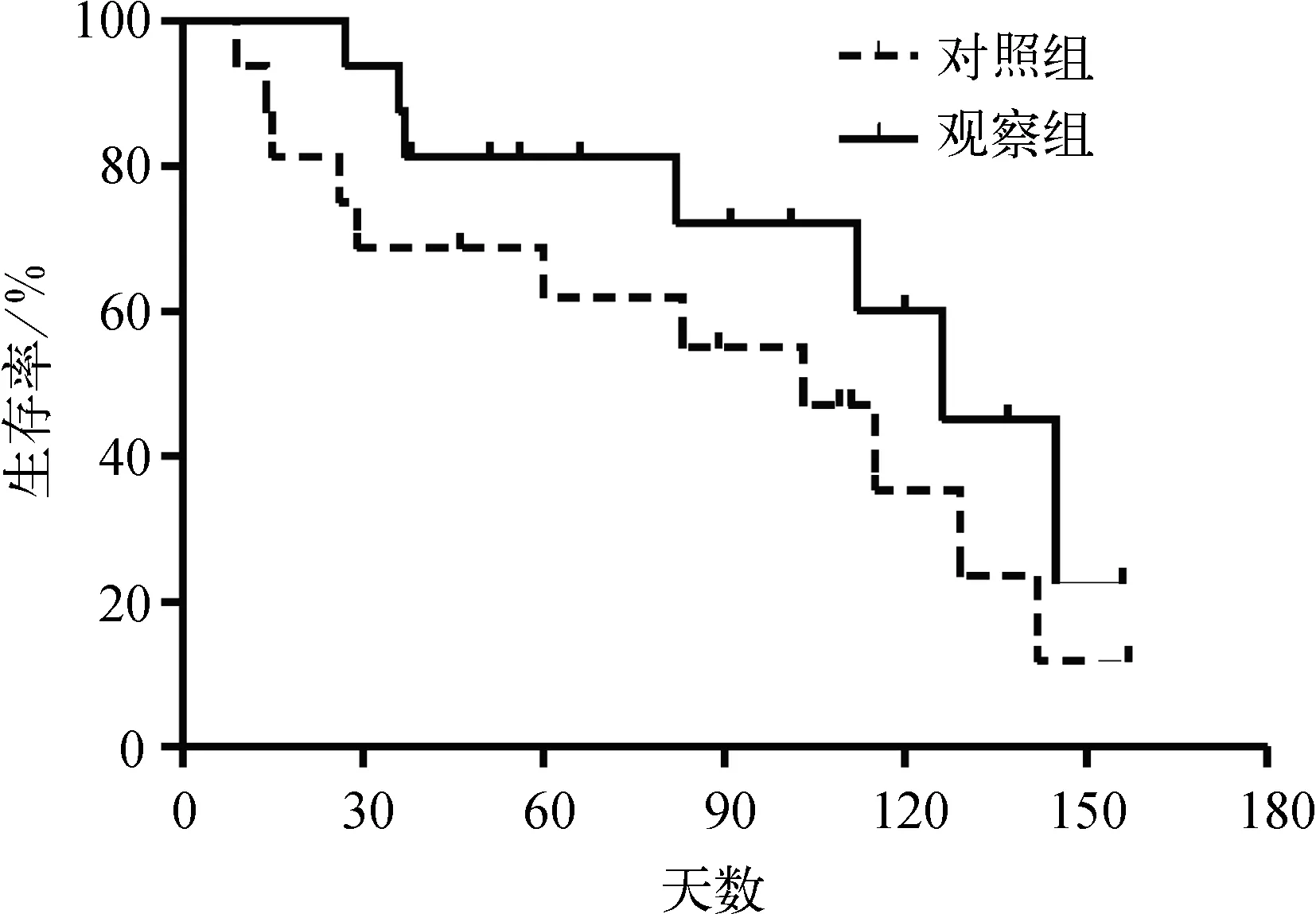
图1两组患者PFS曲线
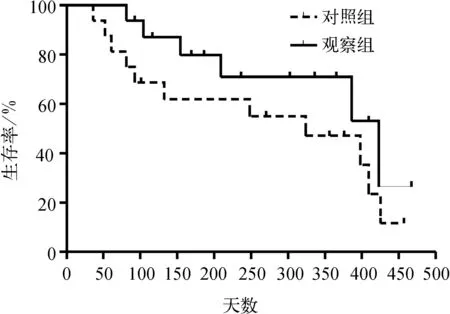
图2两组患者OS曲线
2.4 两组患者不良反应发生情况的比较
观察组患者不良反应(白细胞计数降低、中性粒细胞计数降低、血小板计数降低、脱发、贫血)发生率明显低于对照组,差异均有统计学意义(P<0.05),见表5。
3 讨 论
临床上70%肺癌患者在确诊疾病时已发生转移或处于局部晚期,已失去手术治疗的最佳时机,此时多采用放化疗为主的综合治疗方案[8]。作为一种新型多靶点人工合成的抗代谢药物,培美曲塞具有抑制二氢叶酸还原酶和核苷酸合酶的双重功能,同时也能明显抑制大多数叶酸依赖酶的活性,从多个方面抑制嘌呤、嘧啶的合成,最终发挥其抗肿瘤作用。另外,针对肿瘤的耐药性,该药也能起到明显抑制效果[9]。作为常见金属铂类络合物之一,顺铂是目前常用的细胞周期非特异性抗肿瘤药物,对于厌氧细胞或需氧细胞均能产生活性。药理学研究[10]结果表明,顺铂抗肿瘤活性的发挥主要与该药物结构中的中心铂有关。通过交联DNA或(和)蛋白质,抑制DNA的复制与转录,进而抑制肿瘤细胞的增殖。因此,顺铂也具有放疗增敏的治疗效果。
为了探讨培美曲塞与顺铂联合使用对晚期肺腺癌患者治疗有效性与安全性,本研究以我院收治的200例晚期肺腺癌患者作为研究对象,其中观察组患者接受培美曲塞联合顺铂进行治疗,而对照组患者接受多西他赛联合顺铂进行治疗。结果表明,观察组患者治疗近期有效率明显高于对照组(19.61%vs47.96%,P<0.05),且观察组患者无进展生存期、总生存期明显长于对照组患者(P<0.05)。观察组患者不良反应(白细胞计数降低、中性粒细胞计数降低、血小板计数降低、脱发、贫血)发生率明显低于对照组(P<0.05)。该结果说明培美曲赛联合顺铂治疗晚期肺癌疗效显著,且安全可靠。
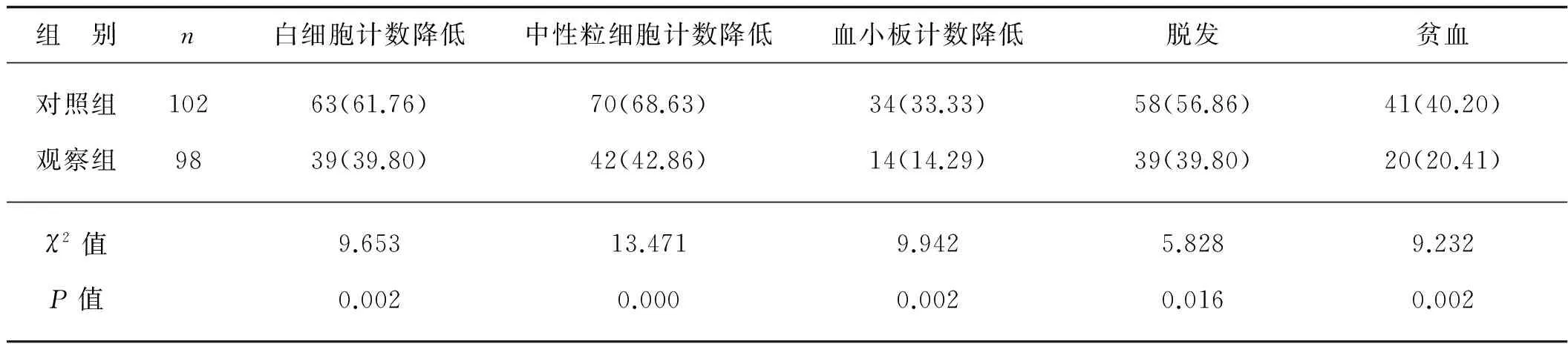
表5 两组患者不良反应发生情况的比较 例
注:括号内为百分率
部分肿瘤患者因对病情的担心而表现出程度不一的焦虑情绪,进而发生一系列躯体症状而降低其生活质量。在本研究中,治疗前两组患者躯体功能、疲乏、恶心呕吐、失眠、食欲丧失、整体生活质量评分差异无统计学意义(P>0.05);治疗后观察组躯体功能、整体生活质量评分明显高于对照组(P<0.05),而疲乏、恶心呕吐、失眠、食欲丧失评分值低于对照组(P<0.05)。该结果说明与多西他赛联合顺铂相比,培美曲塞联合顺铂可提高晚期肺癌患者生活质量,改善其临床症状。
肿瘤具有复杂细胞生物学表现,且呈多态性特点,单一肿瘤标志物难以准确对其进行评估。因此,临床通常联合检测多种肿瘤标志物对疾病进行诊断及预后判断。临床研究[11- 12]结果表明,血清肿瘤标志物与肺癌疾病的严重程度、分期以及临床治疗的预后等密切相关。肿瘤标志物水平越高,则疾病进展越严重。另外,肿瘤标志物水平越高,也说明患者预后较差、生存时间较短。
CEA是一种由肽链和糖链组成的酸性糖蛋白,具有人类胚胎抗原决定簇,是一类肿瘤相关抗原,且具非器官特异性,该蛋白多位于呼吸道、胃肠道、泌尿道等空腔脏器器官。CEA在末梢血及组织中的多核细胞、单核细胞、巨噬细胞等多见,最初作为肠癌的肿瘤标志物。后经研究证实该蛋白在肺癌中也有明显表达,并与肿瘤复发存在显著相关性[13]。
CA125是一类肿瘤糖类抗原,在细胞内合成并储存于其中,正常情况下血清中CA125浓度较低,一旦肿瘤浸润或组织发生恶变,则会造成组织结构破坏,使其释放进入血液中,浓度增加。多项研究已证实血清CA125在肺癌(尤其是肺腺癌)的诊断及预后判断中具有重要价值[14]。
Cyfra21- 1是利用鼠单克隆抗体BM19- 21和KS19检测人血清中细胞角蛋白19的一个可溶性片段,该蛋白是细胞酸性蛋白的主要成分,在人体乳腺、肺上皮分布居多,正常人血液中含量较低,一旦发生癌变,则由上皮释放进入血液中。大量临床研究资料也证实,Cyfra21- 1对于非小细胞肺癌患者而言是最有价值的血清肿瘤标志物之一,有利于非小细胞肺癌的诊断、病情监测及疗效评估[15]。
本研究联合选择CA125、CEA、 Cyfra21- 1肿瘤标志物作为研究组合,能提高晚期肺腺癌患者预后判断的准确性与特异性,这也符合国内外相关研究[16]结果。本研究结果表明,治疗前两组患者CEA、CA125、CYFRA21- 1差异无统计学意义(P>0.05);治疗后观察组CEA、CA125、CYFRA21- 1指标值明显低于对照组(P<0.05)。也进一步说明培美曲赛联合顺铂治疗晚期肺癌疗效显著。
综上所述,培美曲塞与铂类化疗药联合使用能降低晚期肺癌患者CEA、CA125、CYFRA21- 1水平,提高患者生活质量,疗效显著,安全可靠,具有推广价值。
[1] 周亚星,杨锫,刘英姿,等.NF- κB及PXR基因多态对非小细胞肺癌铂类药物治疗的影响[J].中南大学学报:医学版,2016,41(3):233- 237.
[2] 李健,郑琳,戚永超,等.完全与杂交式胸腔镜肺叶切除治疗早期非小细胞肺癌的疗效比较[J].现代医学,2017,6(2):234- 238.
[3] 唐艳,吴芳,胡春宏.RUNX3基因启动子甲基化与早期非小细胞肺癌的预后[J].中南大学学报:医学版,2011,36(7):650- 654.
[4] 凌华晃,李涛,吴祥成,等.培美曲塞二钠联合奈达铂治疗老年晚期肺腺癌的临床疗效及安全性观察[J].中国全科医学,2013,16(7):2506- 2508.
[5] 周彩存,吴一龙,孙燕,等.组织学类型对培美曲塞治疗中国晚期非小细胞肺癌二线及一线后维持治疗患者的综合分析[J].中华肿瘤杂志,2014,36(1):29- 33.
[6] 陈惕.奈达铂联合培美曲塞二钠治疗晚期肺腺癌的临床疗效及安全性[J].实用癌症杂志,2015,6(3):435- 437.
[7] 王凤庭.培美曲塞二钠联合奈达铂治疗晚期非小细胞肺癌[J].肿瘤基础与临床,2014,12(6):485- 486.
[8] 曹运锋,石凡英,郭春辉,等.培美曲塞和吉西他滨分别联合奈达铂治疗晚期肺腺癌的疗效及安全性比较[J].国际呼吸杂志,2016,36(11):810- 813.
[9] 杨艳荣.培美曲塞与吉西他滨联合顺铂治疗晚期肺腺癌疗效及安全性比较[J].新乡医学院学报,2015,32(12):1103- 1105.
[10] 段惠洁,顾国民,王秀丽,等.培美曲塞联合奈达铂一线方案治疗晚期肺腺癌的临床研究[J].肿瘤防治研究,2014,41(1):61- 64.
[11] 康欢,胡蔚,康艳红,等.多种肿瘤标志物联合检测在肺癌诊断中的实用价值[J].现代医学,2012,40(6):706- 708.
[12] 杨新杰,张卉,张权,等.培美曲塞或吉西他滨联合顺铂一线治疗晚期非小细胞肺癌的临床随机对照研究[J].中华肿瘤防治杂志,2012,19(6):38- 41.
[13] 冯晓云,严玲玲,陆志斌.探讨肺癌患者CEA、SCC- Ag和SF经Logistic回归及ROC曲线综合分析的诊断价值[J].现代医学,2016,8(10):1378- 1382.
[14] ZHAO J,ZHAO M,JIN B,et al.Tumor response and survival in patients with advanced non- small- cell lung cancer:the predictive value of chemotherapy- induced changes in fibrinogen [J].BMC Cancer,2012,12 (6):330- 338.
[16] 雷旦生,裴锋,喻晶,等.组织多肽抗原联合ProGRP、CEA、NSE、SCC、CYFRA21- 1在肺癌诊治中的价值[J].肿瘤防治研究,2015,42(5):488- 492.
Studyontheefficiencyandsafetyofpemetrexedcombinedwithplatinumchemotherapyinthetreatmentprocessofadvancedlungadenocarcinoma
FANQun,WUXiao-ping,DAIWen-xiang,TANYe-ru,ZHUHong-bo
(DepartmentofMedicalOncology,theFirstAffiliatedHospitalofUniversityofSouthChina,Hengyang421001,China)
Objective: To study the efficiency and safety of pemetrexed combined with platinum chemotherapy in the treatment process of advanced lung adenocarcinoma.Methods200 patients with advanced lung adenocarcinoma treated in our hospital were considered as study object. They were divided into two groups, 102 patients were treated with docetaxel and cisplatin (control group), while 98 patients were used with pemetrexed and cisplatin for treatment (observation group). The clinical efficacy between the two groups was observed and compared.Results(1) Before treatment, there was no obvious difference between the two groups including carcino- embryonic antigen (CEA), cancer antigen 125 (CA125), cytokeratin fragment antigen 21- 1 (CYFRA21- 1) and the scores about physical function, fatigue, nausea and vomiting, insomnia, loss of appetite, overall quality of life(P>0.05); After treatment, the index including CEA, CA125, CYFRA21- 1 and the scores about fatigue, nausea and vomiting, insomnia, loss of appetite were significantly lower in observation group compared with the control group(P>0.05), while the scores about physical function and overall quality of life were significantly higher in observation group than control group(P>0.05). (2) The effective rate in the observation group was significantly higher than the control group(P<0.05), and the progression free survival and overall survival in the observation group were significantly higher than the control group with increased adverse reaction(P<0.05).ConclusionPemetrexed combined with platinum chemotherapy drugs is used in the treatment process of advanced lung cancer. It can reduce the level of CEA, CA125, CYFRA21- 1 with improved quality of life. The method is safe with better treatment effect.
pemetrexed; cisplatin; advanced lung adenocarcinoma; carcino- embryonic antigen; cancer antigen 125; cytokeratin fragment antigen 21- 1
2017- 03- 09
2017- 06- 30
范群(1980- ),男,湖南邵阳人,主治医师。E- mail:19098847@qq.com
范群,伍小平,戴文香,等.培美曲塞与铂类化疗药联合使用对晚期肺腺癌患者治疗有效性与安全性研究[J].东南大学学报:医学版,2017,36(5):723- 728.
R734.2;R730.53
A
1671- 6264(2017)05- 0723- 06
10.3969/j.issn.1671- 6264.2017.05.008
(本文编辑:何彦梅)

