药理学参数在晚期非小细胞肺癌紫杉醇化疗指导方案中的运用
沈波,武渊,彭伟,石林,史美祺,陆建伟,冯继锋,张琰
(江苏省肿瘤医院,江苏省肿瘤防治研究所,南京医科大学附属肿瘤医院 肿瘤内科,江苏 南京 210000)
·论著·
药理学参数在晚期非小细胞肺癌紫杉醇化疗指导方案中的运用
沈波,武渊,彭伟,石林,史美祺,陆建伟,冯继锋,张琰
(江苏省肿瘤医院,江苏省肿瘤防治研究所,南京医科大学附属肿瘤医院 肿瘤内科,江苏 南京 210000)
目的通过随机对照研究中国非小细胞肺癌患者接受紫杉醇治疗后在药理学参数上的个体差异,评估紫杉醇药理学参数与毒性及疗效的相关性,并根据药理学参数进行剂量调节。方法59例非小细胞肺癌患者采用含紫杉醇的药物治疗方案。紫杉醇的起始剂量为135~175mg·m-2,患者随机分为实验组29例和对照组30例,从第2周期开始对照组仍旧按照体表面积给药,实验组根据紫杉醇TC>0.05值进行相应的剂量调整给药。观察两组患者的骨髓细胞学毒性发生率和缓解率。结果紫杉醇药理参数TC>0.05在第1周期的个体差异很大,平均值为35 h(范围为22~55 h,CV=25.57%)。17%的患者TC>0.05在治疗窗(26~31 h)内,75%的患者TC>0.05大于治疗窗,8%的患者低于治疗窗。采用药理学参数指导用药方式后,总用药量下降了15%。在整个化疗周期内Ⅲ~Ⅳ级毒性,对照组发生率(77%)高于实验组(42%),差异具有统计学意义(P=0.002)。17例患者完成了6个周期的化疗,严重毒性发生率实验组为40%,对照组为65%,两组之间差异具有统计学意义(P=0.031)。紫杉醇剂量的降低对缓解率没有负面影响(实验组为37.93%,对照组为36.67%,P=0.710)。结论紫杉醇TC>0.05是紫杉醇药物暴露的关键药理学参数,并且是严重中性粒细胞减少症的预测因子,按照药理学参数来优化患者的用药剂量能够提高紫杉醇用药的安全性和有效性。
紫杉醇; 非小细胞肺癌; 血药浓度; 不良反应
中国医学科学院肿瘤医院肿瘤研究所研究结果[1]显示, 2015年我国共有429.2万新发肿瘤病例,癌症死亡病例281.4万,其中肺癌以73.33万例发病和61.02万例死亡成为我国发病第一大癌症。化疗是晚期非小细胞肺癌(NSCLC)患者的主要治疗方式,紫杉醇(PTX)与铂类联用的给药方案被广泛应用于NSCLC的一、二线及辅助化疗中。PTX治疗中常见的剂量限制性毒性包括骨髓抑制(中性粒细胞减少症、贫血、血小板减少症)、外周神经病变引起的神经毒性、胃肠道反应和脱发[2- 3]。已有的研究[4]揭示了PTX的药物系统暴露与中性粒细胞减少量之间的统计相关性,表明根据药代动力学参数TC>0.05的结果可直接有效地预测出患者中性粒细胞减少量。本研究通过随机对照研究中国NSCLC患者接受PTX治疗后,在人群药理学参数上的个体差异,评估PTX药理学参数与毒性及疗效的相关性,并根据药理参数进行剂量调节提高PTX用药的安全性和有效性。
1 资料与方法
1.1 一般资料
选择2015年2月至2015年8月江苏省肿瘤医院收治的59例NSCLC患者,其中男43例,女16例,应用以PTX为基础的化疗方案作为一线化疗方案。20例首次化疗,39例患者有既往化疗史。入选标准:(1)ECOG评分≤2分;(2)入组前1个月内未接受放疗;(3)化疗前患者各项常规指标正常;(4)CT及核磁共振扫描未发现远端转移。将59例患者随机分为实验组29例和对照组30例,两组患者间一般资料的比较差异无统计学意义(P>0.05),见表1。

表1 实验组与对照组一般资料对比 例
患者接受PTX 3周化疗方案。第1周期按体表面积(BSA)并根据患者的身体情况给予PTX 135~175 mg·m-2(表2),PTX 3h静脉滴注完毕,3周重复1次。在静脉滴注PTX开始后(24±6) h使用K2EDTA 抗凝管采集外周静脉血2~3 ml,记录采血时间。3 500 r·min-1离心10min,取上层血浆,使用PTX测定试剂盒(胶乳免疫比浊法,江苏长星医疗科技有限公司)测定血药浓度,并使用美国Saladax公司提供的PTX群体药代动力学模型计算软件,计算PTX药代动力学参数TC>0.05值。
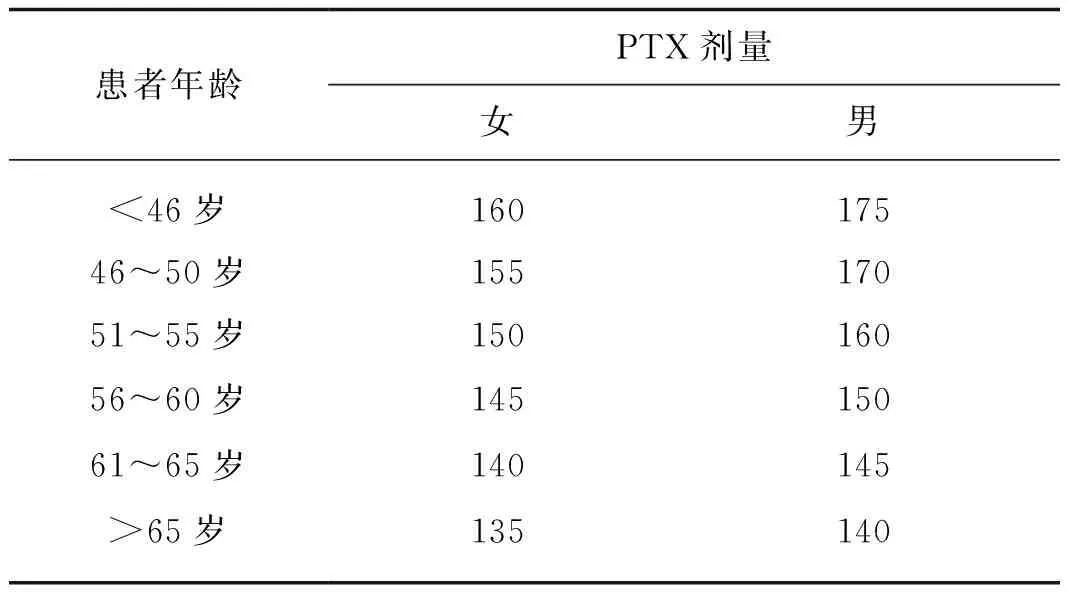
表2 PTX第1周期剂量 mg·m-2
实验组的29例患者,从第2周期开始,基于上一周期的药物浓度检测结果,同时根据文献[5]的报道进行给药剂量的调整,如图1所示。对照组的30例患者维持原有的给药剂量。每化疗2个周期评定1次,若出现不可耐受的不良反应则停药,化疗不超过6个周期。
1.2 骨髓细胞学毒性观察
参照WHO毒性分级标准[6]观察PTX的血液学毒性。
1.3 疗效评价
每化疗2个周期进行CT影像评定1次,若出现不可耐受的不良反应则停药,化疗不超过6个周期。以实体瘤疗效评价为标准[7],分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(progress disease,PD)。缓解率=(CR+PR)例数/总例数×100%,获益率=(CR+PR+SD)例数/总例数×100%。
1.4 统计学处理
采用SPSS软件进行数据分析,计量资料以均数±标准差表示,采用单因素方差分析和t检验,以P<0.05为差异具有统计学意义。

图12~4周期PTX剂量调节
2 结 果
2.1 血药浓度与药代动力学参数分布情况
个体的PTX血药浓度呈正态分布,为24~103(56.83±23.90)g·L-1,3例患者的血药浓度>100g·L-1,血药浓度<35g·L-1的患者有9例,TC>0.05值为22~55 h,平均值35 h,这表明个体间的PTX血药浓度差异很大。17%的患者TC>0.05在治疗窗(26~31 h)内,75%的患者TC>0.05大于治疗窗,8%的患者低于治疗窗,见图2。患者首轮化疗基于BSA给药后,个体间的紫杉醇药代动力学差异显著。
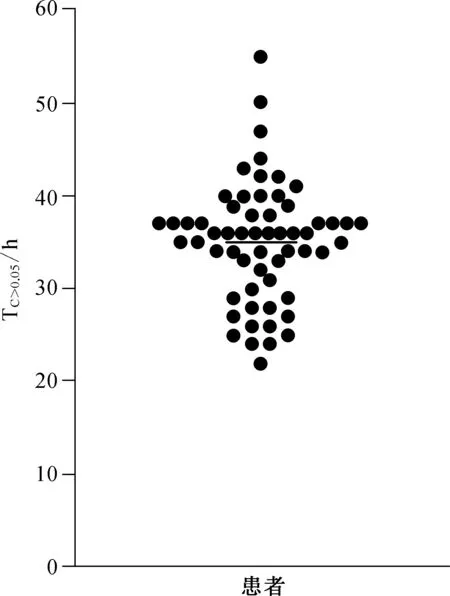
图259例患者紫杉醇血药浓度TC>0.05分布图
2.2 严重骨髓细胞学不良反应发生率
首次化疗的剂量根据BSA给药,从第2轮化疗周期开始,实验组基于药代动力学参数TC>0.05进行剂量调整,整体用药量降低了15%。对照组的Ⅲ~Ⅳ级骨髓抑制发生率为77%,实验组为42%,差异具有统计学意义(P=0.002),见图3。17例患者完成了6个周期的化疗,在整个化疗周期中严重骨髓细胞学毒性发生率在实验组为40%,在对照组为65%,P=0.031,见图4。
2.3 治疗有效率
通过CT影像等评估疗效,实验组PR 11例,SD 13例,PD 5例,缓解率37.93%,获益率82.76%;对照组PR 11例,SD 12例,PD 7例,缓解率36.67%,临床获益率76.67%,两组比较差异无统计学意义(P=0.710)。表明剂量的降低对治疗的评价没有负面影响。

图3实验组与对照组Ⅲ~Ⅳ级骨髓抑制毒性发生率
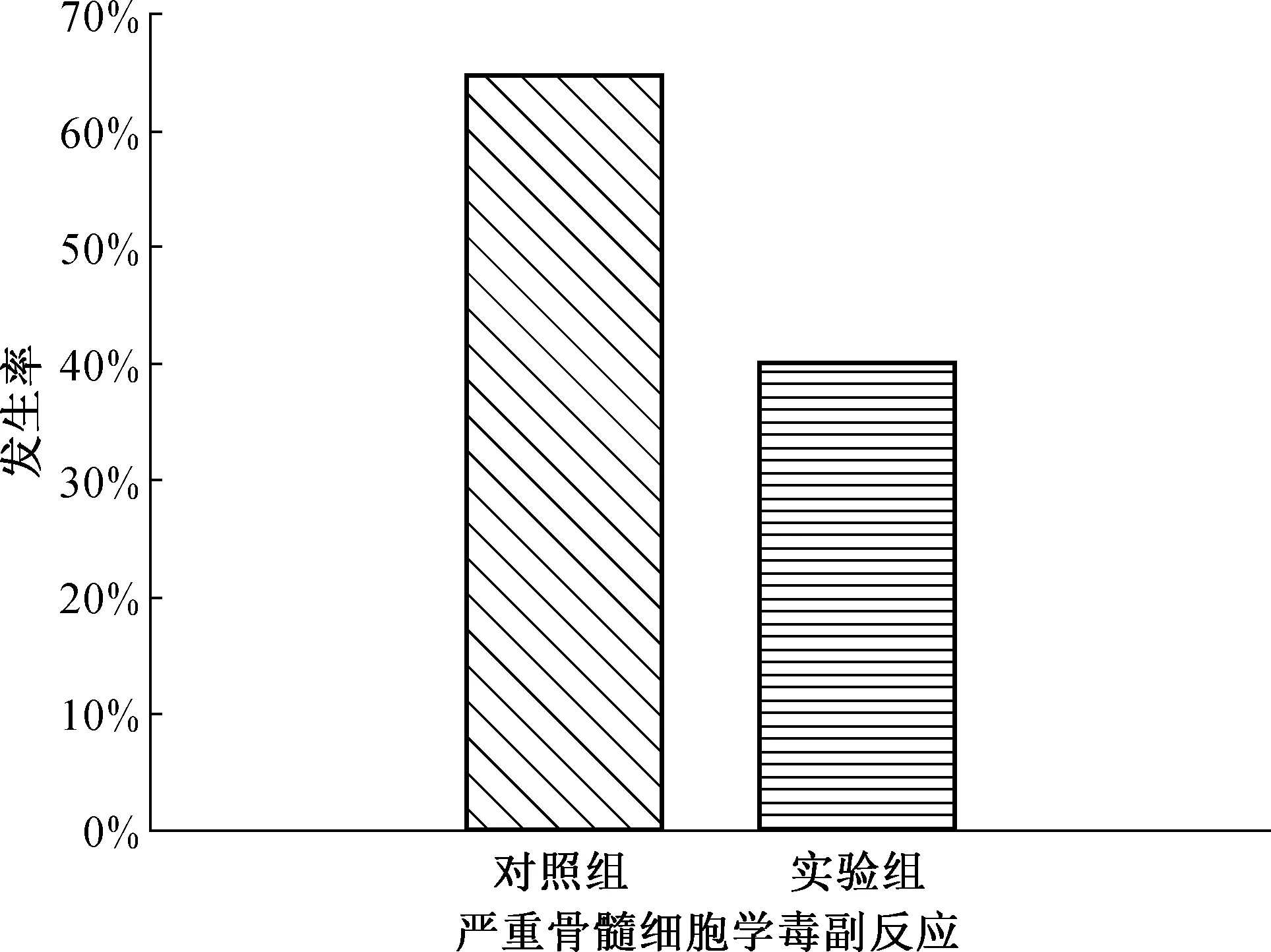
图4完成6个周期化疗患者中实验组与对照组严重骨髓细胞学毒副反应发生率对比
3 讨 论
PTX能够促进微管蛋白聚集以及微管的组装,阻碍细胞有丝分裂,使得纺锤体以及纺锤丝无法形成,最终导致细胞滞留在G2期以及M期,从而起到肿瘤抑制的目的[8]。其毒性主要是过敏反应、血液学毒性、周围神经毒性、心血管毒性和胃肠道毒[9]。目前临床上还是采用基于患者体表面积(mg·m-2)的方法计算PTX的使用剂量。对于NSCLC,PTX通常的给药方案为每3周1次,但是每个人的代谢快慢、生理状态、遗传基因的不同以及其他外界因素都会造成个体对药物的代谢差异[10- 11]。有临床结果[12- 13]证明导致PTX毒性过高和治疗失败的主要原因是患者在药理学上的巨大个体差异。出于对PTX毒性的担心,在使用PTX化疗过程中,为防止引起严重的毒副作用,很少情况实际的给药剂量会根据患者的最大耐受剂量(maximum tolerated dose, MTD)对基于BSA求算的结果进行上调。这就造成了大多数患者在化疗中使用的PTX剂量未达到最适治疗浓度,而部分患者却可能因为PTX用量过高产生严重的毒性反应。
目前有多个针对西方人群进行的关于PTX药代动力学和药代- 药效学的研究证明,药代学参数中PTX血药浓度在0.05 μmol·L-1以上的时间(TC>0.05)和血液毒性以及临床疗效具有显著的统计学相关性。Miller研究组[14]以中性粒细胞绝对计数(ANC)的降低作为药效动力学的主要指标,对32例女性实体瘤患者使用PTX单药3h滴注化疗的临床研究结果表明,PTX的药时曲线下面积(AUC)与ANC及存活率均无相关性,然而PTX的TC>0.05与ANC显著相关(r=-0.41,P=0.04)。
但是对于亚洲尤其是中国人群,相关的数据还比较缺乏,仅有少量研究[15- 16]表明了血药浓度与毒性、疗效之间的相关性。本研究结果显示,PTX血药浓度大于0.05μmol·L-1的时间(TC>0.05)可以作为NSCLC化疗周期中发生Ⅲ~Ⅳ级骨髓抑制的预测因子,同时按照药理学参数来优化患者的用药剂量能够提高PTX用药的安全性和有效性。
[1] CHEN W Q,ZHENG R S,PETER D B,et al.Cancer Statistics in China,2015[J].CA Cancer J Clin,2016,66:115- 132.
[2] JOERGER M,PAWEL J V,KRAFF S,et al.Open- label,randomized study of individualized,pharmacokinetically(PK)- guided dosing of paclitaxel combined with carboplatin or cisplatin in patients with advanced non- small cell lung cancer(NSCLC) [J].Annals of Oncology,2016,27(10):1895- 1902.
[3] de GRAAN A J,ELENS L,SPROWL J A,et al.CYP3A4*22 genotype and systemic exposure affect paclitaxel- induced neurotoxicity[J].Clin Cancer Res,2013,19:3316- 3324.
[4] MIELKE S,SPARREBOOM A,STEINBERG S M,et al.Association of paclitaxel pharmacokinetics with the development of peripheral neuropathy in patients with advanced cancer[J].Clin Cancer Res,2005,11(13):4843- 4850.
[5] JOERGER M,KRAFF S,HUITEMA A D,et al.Evaluation of a pharmacology- driven dosing algorithm of 3- weekly paclitaxel using therapeutic drug monitoring [J].Clinical Pharmacokinetics,2012,51(9):607- 617.
[6] 石远凯,孙燕.临床肿瘤内科手册[M].6版.北京:人民卫生出版社,2015:465- 467.
[7] EISENHAUER E A,THERASSE P,BOGAERTS J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1) [J].Eur J Cancer,2009,45(2):228- 247.
[8] 李红,刘付宝.脂质体紫杉醇联合卡培他滨对晚期乳腺癌患者DBC1 及SIRT1表达的影响[J].东南大学学报:医学版,2016,35(6):961- 964.
[9] 孙荣刚,郑安平,张光斌,等.多西他赛与紫杉醇在食管癌放化疗中的对照研究[J].现代医学,2014,42(9):1067- 1070.
[10] HERSHMAN D L,LACCHETTI C,DWORKIN R H,et al.Prevention and management of chemotherapy- induced peripheral neuropathy in survivors of adult cancers:American Society of Clinical Oncology clinical practice guideline[J].J Clin Oncol,2014,32:1941- 1967.
[11] ENGELS F K,LOOS W J,van der BOL J M,et al.Therapeutic drug monitoring for the individualization of docetaxel dosing:a randomized pharmacokinetic study [J].Clin Cancer Res,2011,17:353- 362.
[12] HENNINGSSON A,KARLSSON M O,VIGANL,et al.Mechanism- based pharmacokinetic model for paclitaxel [J].J Clin Oncol,2001,19(20):4065- 4073.
[13] MOULD D R,FLEMING G F,DARCY K M,et al.Population analysis of a 24- h paclitaxel infusion in advanced endometrial cancer:agynaecologicaloncology group study [J].British J Clin Pharmacol,2006,62(1):56- 70.
[14] MILLER A A,ROSNER G L,EGORIN M J,et al.Prospective evaluation of body surface area as a determinant of paclitaxel pharmacokinetics and pharmacodynamics in women with solidtumors:Cancer and Leukemia Group B Study 9763 [J].Clin Cancer Res,2004,10(24):8325- 8331.
[15] 钱隽,王漪璇,郁韵秋,等.注射用紫杉醇脂质体与紫杉醇注射液在肿瘤患者中的药动学比较[J].肿瘤,2011,31(12):1103- 1107.
[16] 张琰,沈波,冯继锋,等.紫杉醇药代动力学参数(TC>0.05)与化疗药物毒性的相关性研究[J].中华实用诊断与治疗杂志,2016,30(6):614- 616.
Paclitaxelpharmacologyparameterintheapplicationoftheadvancednon-smallcelllungcancer
SHENBo,WUYuan,PENGWei,SHILin,SHIMei-qi,LUJian-wei,FENGji-feng,ZHANGYan
(DepartmentofMedicalOncology,JiangsuCancerHospital,JiangsuInstituteofCancerResearch,NanjingMedicalUniversityAffiliatedCancerHospital,Nanjing210000,China)
Objective: This paper randomized controlled research Chinese patients with non- small cell lung cancer(NSCLC) pharmacokinetic(PK) parameter individual difference who has
paclitaxel(PTX) chemotherapy, and evaluate the correlation between pharmacokinetic parameter paclitaxel and toxicity and efficacy, then adjust the dosage according to the pharmacological parameter.Methods59 NSCLC patients receiving first- line paclitaxel chemotherapy had been enrolled. 59 Patients were randomized to receive paclitaxel at a starting dose of 135~175 mg·m-2. 59 patients with NSCLC were randomly divided into experimental group and control group, 29 cases in experimental group, 30 cases in control group. Starting from the second cycle, PTX dose based on body surface area (BSA) in control group and in experimental group PTX dose based on PK. Severe toxicities of bone marrow and response rates were compared by experimental group and control group.ResultsExposure values from 1st cycle showed great PTX PK variability, with a mean TC > 0.05of 35 h (range=22-55 h, CV=25.57%). 17% of these patients had PTX exposure values within the target range (26 to 31 h), while 75% were above target exposure, and 8% patients showed PTX exposure below target. Exposure optimization of PTX in experimental group led to an overall 15% dose reduction. In 17 patients with 6 cycles of chemotherapy completed, severe neutropenia rate in experimental group at cycle 6 was 40% compared to 65% in control group(P=0.031). Response rate was also evaluated and showed no negative impact (37.93% in experimental groupvs36.67% in control group,P=0.710). A higher neuropathy rate was observed in control group (77%) compared to experimental group (42%)(P=0.002).ConclusionThe time above a PTX plasma concentration of 0.05μmol·L-1(TC>0.05) is the key PK parameter to measure systemic exposure to the drug and is a predictor of severe neutropenia. According to the parameter of PTX pharmacology with exposure optimized PTX dose can improve the effectiveness and safety of PTX chemotherapy.
paclitaxel; non- small cell lung cancer; plasma concentration; adverse reaction
2017- 05- 22
2017- 06- 13
江苏省科学技术厅社会发展面上项目(BE2015719);南京市科技计划项目(201503006)
沈波(1971-),男,江苏盐城人, 主任医师,医学博士。E- mail:shenbo987@126.com
沈波,武渊,彭伟,等. 药理学参数在晚期非小细胞肺癌紫杉醇化疗指导方案中的运用[J].东南大学学报:医学版,2017,36(5):681- 685.
R734.2; R730.53
A
1671- 6264(2017)05- 0681- 05
10.3969/j.issn.1671- 6264.2017.05.001
(本文编辑:何彦梅)

