拉米夫定联合阿德福韦酯治疗拉米夫定耐药慢性乙型肝炎患者的疗效及其与HBV基因型的相关性Δ
常彩芳,范敬静,王 浩(河北北方学院附属第一医院感染科,河北张家口075000)
·精准医疗·
拉米夫定联合阿德福韦酯治疗拉米夫定耐药慢性乙型肝炎患者的疗效及其与HBV基因型的相关性Δ
常彩芳*,范敬静,王 浩(河北北方学院附属第一医院感染科,河北张家口075000)
目的:评价拉米夫定(LAM)联合阿德福韦酯(ADV)治疗LAM耐药慢性乙型肝炎(以下简称“乙肝”)患者的疗效,并研究疗效与乙型肝炎病毒(HBV)基因型的相关性。方法:选择2012年12月-2014年12月LAM耐药慢性乙肝患者101例,均给予LAM+ADV联合治疗至少24个月,并行定期门诊或电话随访。采用聚合酶链反应-反向点杂交法检测各患者的HBV基因型,采用χ2检验、Kaplan-Meier法、Log-rank检验比较随访第6、12、18、24个月时各基因型患者的病毒学应答(HBV-DNA清除率)和生化学应答[丙氨酸转氨酶(ALT)复常率、乙型肝炎e抗原(HBeAg)血清转化率]情况。结果:无失访病例,随访率为100%。共检出HBV基因型2种,其中B型患者34例(33.7%)、C型患者67例(66.3%)。101例患者在上述各时间点的HBV-DNA清除率分别为34.7%、55.4%、79.2%、93.1%;随访第6个月时,B型患者的HBV-DNA清除率和累积HBV-DNA清除率均显著高于C型患者,差异均有统计学意义(P<0.05),而其他时间点各基因型患者HBV-DNA清除率、累积HBV-DNA清除率比较,差异均无统计学意义(P>0.05)。101例患者在上述各时间点的ALT复常率分别为40.6%、69.3%、82.2%、84.2%;各时间点各基因型患者ALT复常率、累积ALT复常率比较,差异均无统计学意义(P>0.05)。101例患者在上述各时间点的HBeAg血清转化率分别为10.9%、19.8%、24.8%、29.7%;各时间点各基因型患者HBeAg血清转化率、累积HBeAg血清转换率比较,差异均无统计学意义(P>0.05)。结论:LAM联合ADV对LAM耐药慢性乙肝患者有效,且HBV基因B型患者的病毒学应答要早于C型患者。
慢性乙型肝炎;拉米夫定;阿德福韦酯;耐药;乙型肝炎病毒基因型;病毒学应答;生化学应答
自1992年乙型肝炎(以下简称“乙肝”)疫苗普及以来,我国已由乙型肝炎病毒(Hepatitis B virus,HBV)感染高流行区过渡到中流行区,但乙肝仍是我国严重的慢性传染病之一[1]。乙肝若不经有效治疗,则有可能进展为肝硬化或肝癌,严重威胁患者的生命[2]。拉米夫定(Lamivudine,LAM)是核苷酸类药物,作用于HBV逆转录酶或DNA聚合酶,抑制HBV的复制。但由于LAM耐药基因屏障较低,易导致HBV耐药突变,且突变的累积发生率约为20%[3-4]。因此,如何制订LAM耐药慢性乙肝患者的抗病毒治疗方案是我国乙肝临床治疗的难点。阿德福韦酯(Adefovir dipivoxil,ADV)联合LAM作为LAM耐药慢性乙肝患者的补救性治疗方案,对HBV的复制具有抑制作用,且效果优于ADV单药治疗[5-6]。同时有研究指出,患者HBV基因型与抗病毒疗效及耐药突变密切相关[7]。鉴于此,本研究将LAM联合ADV方案应用于LAM耐药慢性乙肝患者的治疗,并通过临床随访,分析其抗病毒疗效与HBV基因型的相关性,以期为不同基因型慢性乙肝患者抗病毒治疗方案的制订提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)年龄18~75岁;(2)血清乙型肝炎表面抗原为阳性;(3)参照《病毒性肝炎防治方案》的标准[8]确诊为乙肝;(4)出现LAM耐药后,联合应用ADV抗病毒治疗[LAM耐药判定标准[9]——在至少连续2次实验室检查中发现,血清乙型肝炎病毒脱氧核糖核酸(HBV-DNA)定量较治疗后最低水平升高超过1 logIU/mL]。
排除标准:(1)合并其他肝脏疾病者,如肝癌、肝硬化;(2)其他种类病毒感染者;(3)肾功能不全者,即肌酐清除率<60 mL/min;(4)应用其他抗病毒药物者。
1.2 研究对象
本研究方案经医院医学伦理委员会审核通过后,选取2012年12月-2014年12月在我院感染科门诊或住院部接受治疗的LAM耐药慢性乙肝患者101例。其中,男性75例(74.3%)、女性26例(25.7%),年龄26~70岁、平均年龄(50.8±10.9)岁。所有患者或其家属均知情并签署知情同意书。
1.3 治疗方法
所有患者均接受LAM联合ADV抗病毒治疗至少24个月:拉米夫定片[葛兰素史克制药(苏州)有限公司,批准文号:国药准字H20030581,规格:100 mg]100 mg/d,qd+阿德福韦酯片[葛兰素史克(天津)有限公司,批准文号:国药准字H20050651,规格:10 mg]10 mg/d,qd。
1.4 临床随访
所有患者均行定期门诊及电话随访24个月,以保证其依从性。随访内容为每月检查其肝肾功能、乙型肝炎e抗原(HBeAg)和HBV-DNA等指标。在随访过程中,若患者肾功能指标肌酐清除率<50 mL/min,则ADV需调整为隔日给药1次[10]。
1.5 观察指标
收集两组患者的人口学资料和实验室检查指标,包括肝功能评价指标、HBV标志物、血清HBV-DNA水平、HBV基因型、DNA聚合酶YMDD基因突变情况。
1.5.1 肝功能评价指标 使用7180型全自动生化分析仪(日本Hitachi公司)、采用比色法检测患者丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、白蛋白(ALB)水平;采用凝固法检测患者的凝血酶原时间(PT)。
1.5.2 HBV标志物 使用Architect I2000SR型全自动免疫分析仪(美国雅培公司)、采用化学发光法检测患者HBeAg水平。
1.5.3 HBV-DNA使用荧光定量聚合酶链反应(Polymerase chain reaction,PCR)试剂盒(上海星耀医学科技发展有限公司)、ABI 7500型实时荧光定量PCR仪(美国Life Technology公司),采用荧光定量法测定患者血清HBV-DNA水平(HBV-DNA的检测下限为2 logIU/mL)。
1.5.4HBV基因型 使用HBV基因分型检测试剂盒(中山大学达安基因股份有限公司)、ABI 9700型扩增仪(美国Life Technology公司),采用PCR-反向点杂交法测定。按照试剂盒说明书提取患者DNA。取DNA 2 μL至PCR反应管中,进行扩增。PCR扩增条件:93预变性6 min;93变性30 s,58退火40 s,72延伸45 s,共10个循环;93变性30 s,56退火40 s,72延伸45 s,共10个循环;93变性30 s,55退火40 s,72延伸45 s,共25个循环;最后72再延伸7 min。按照试剂盒说明书进行DNA杂交后,使用达安图像分析软件(中山大学达安基因股份有限公司)进行图像处理,确定患者基因型。
1.5.5 DNA聚合酶YMDD基因突变 使用乙肝病毒YMDD基因突变诊断试剂盒(上海星耀医学科技发展有限公司)、ABI 7500型实时荧光定量PCR仪(美国Life Technology公司),采用荧光定量法确定患者DNA聚合酶YMDD基因的突变情况。
1.5.6 病毒学和生化学应答 考察随访第6、8、12、18、24个月时各患者的病毒学应答和生化学应答情况。病毒学应答:HBV-DNA清除即未检测到HBV-DNA(HBV-DNA水平<2 logIU/mL),HBV-DNA清除率=HBV-DNA转阴的患者数/患者总数×100%。生化学应答:包括ALT复常和HBeAg血清学转换,ALT复常标准为ALT水平<40 U/L,ALT复常率=ALT复常的患者数/患者总数×100%;HBeAg血清学转换即HBeAg转阴且抗HBe转阳,HBeAg血清转换率=HBeAg血清学转换的患者数/患者总数×100%[11]。
1.6 统计学方法
采用SPSS 18.0软件对数据进行统计分析。采用Kolmogorov-Smimov法对计量资料进行正态性检验,满足正态分布的计量资料以±s表示,采用方差分析;不满足正态分布的计量资料以中位数(P25,P75)表示,采用秩和检验。计数资料以率或例数表示,采用χ2检验。不同基因型患者的累积HBV-DNA清除率、ALT复常率和HBeAg血清转换率的计算采用Kaplan-Meier法,组间比较采用Log-rank检验。当双侧P<0.05时,为差异有统计学意义。
2 结果
2.1 随访情况
无失访病例,随访率为100%。随访期间,无患者出现肌酐清除率<50 mL/min,ADV均为每日给药1次。
2.2 基因型分布
共检出HBV基因型2种。其中,B型患者34例(33.7%),C型患者67例(66.3%)。
2.3 不同基因型患者一般资料比较
不同基因型患者的年龄、性别、HBV-DNA水平、YMDD基因突变类型、HBeAg阳性的比例、肝功能评价指标水平等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
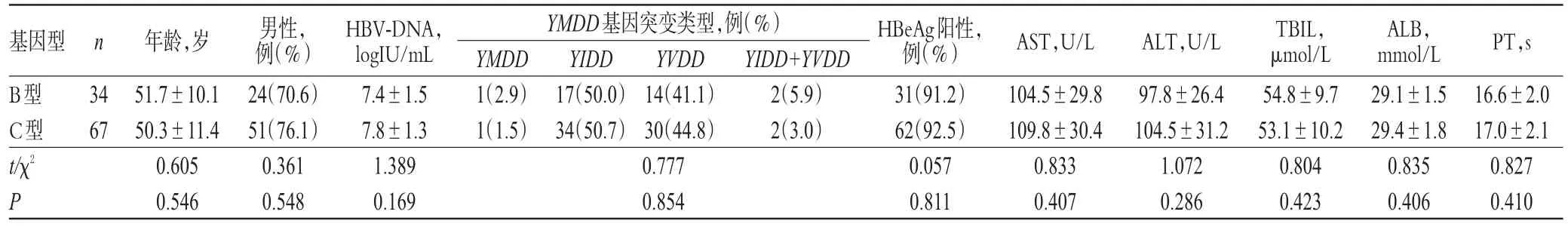
表1 不同基因型患者一般资料比较Tab 1Comparison of general data of patients between different genotypes
2.4 不同基因型患者HBV-DNA清除率比较
在随访的第6、12、18、24个月,101例患者的HBVDNA清除率分别为34.7%(35例)、55.4%(56例)、79.2%(80例)、93.1%(94例)。其中,HBV基因B型患者的HBV-DNA清除率分别为52.9%、67.6%、88.2%、97.1%,HBV基因C型患者的HBV-DNA清除率分别为25.4%、49.3%、74.6%、91.0%。第6个月时,HBV基因B型患者的HBV-DNA清除率显著高于C型患者,差异有统计学意义(P=0.006);而其他时间点各基因型患者HBV-DNA清除率比较,差异均无统计学意义(P>0.05),详见表2。
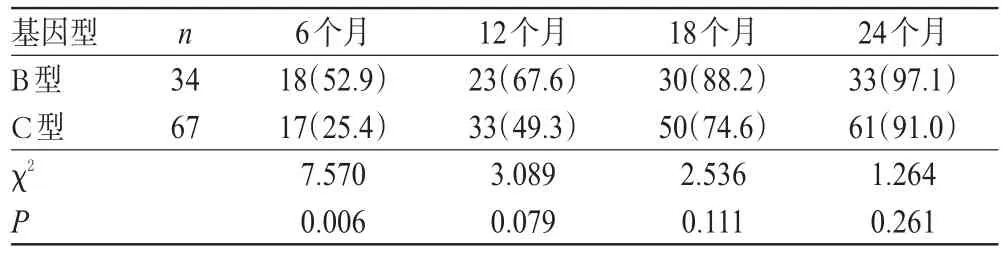
表2 不同基因型患者HBV-DNA清除率比较[例(%%)]Tab 2Comparison of HBV-DNA clearance rates between different genotypes[case(%%)]
Kaplan-Meier法和Log-rank检验分析结果显示,随访第6个月时,B型患者的累积HBV-DNA清除率显著高于C型患者,提示使用LAM联合ADV治疗LAM耐药慢性乙肝时,HBV基因B型患者的病毒学应答要早于C型患者(P=0.007),详见图1。
2.5 不同基因型患者ALT复常率比较
在随访的第6、12、18、24个月,101例患者的ALT复常率分别为40.6%(41例)、69.3%(70例)、82.2%(83例)、84.2%(85例)。其中,HBV基因B型患者的ALT复常率分别为44.1%、76.5%、82.4%、85.3%,HBV基因C型患者的ALT复常率分别为38.8%、65.7%、82.1%、83.6%;B型患者的ALT复常率虽略高于C型患者,但各时间点组间比较差异均无统计学意义(P>0.05),详见表3。
Kaplan-Meier法和Log-rank检验分析结果显示,不同基因型患者的累积ALT复常率比较,差异亦无统计学意义(P=0.203),详见图2。
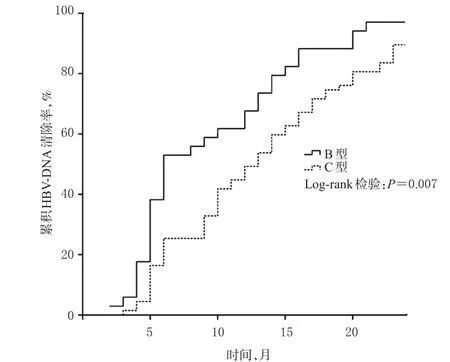
图1 不同基因型患者累积HBV-DNA清除率比较Fig1 Comparison of accumulative HBV-DNA clearance rates between different genotypes
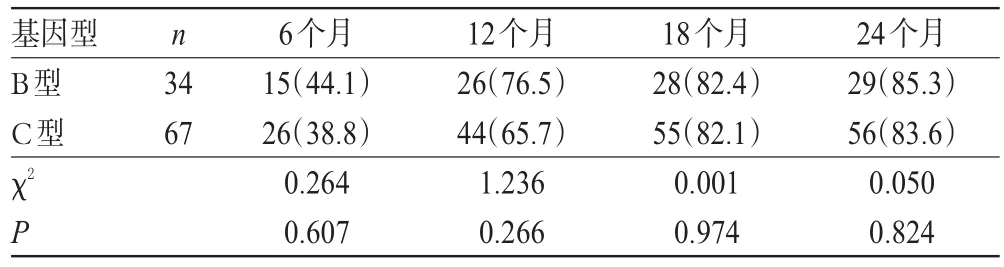
表3 不同基因型患者ALT复常率比较[例(%%)]Tab 3Comparison of ALT normalization rates between different genotypes[case(%%)]
2.6 不同基因型患者HBeAg血清转换率比较
在随访的第6、12、18、24个月,101例患者的HBeAg血清转换率分别为10.9%(11例)、19.8%(20例)、24.8%(25例)、29.7%(30例)。其中,HBV基因B型患者的血清转换率分别为11.8%、23.5%、26.5%、29.4%,C型患者的HBeAg血清转换率分别为10.4%、17.9%、23.9%、29.9%,组间比较差异均无统计学意义(P>0.05),详见表4。
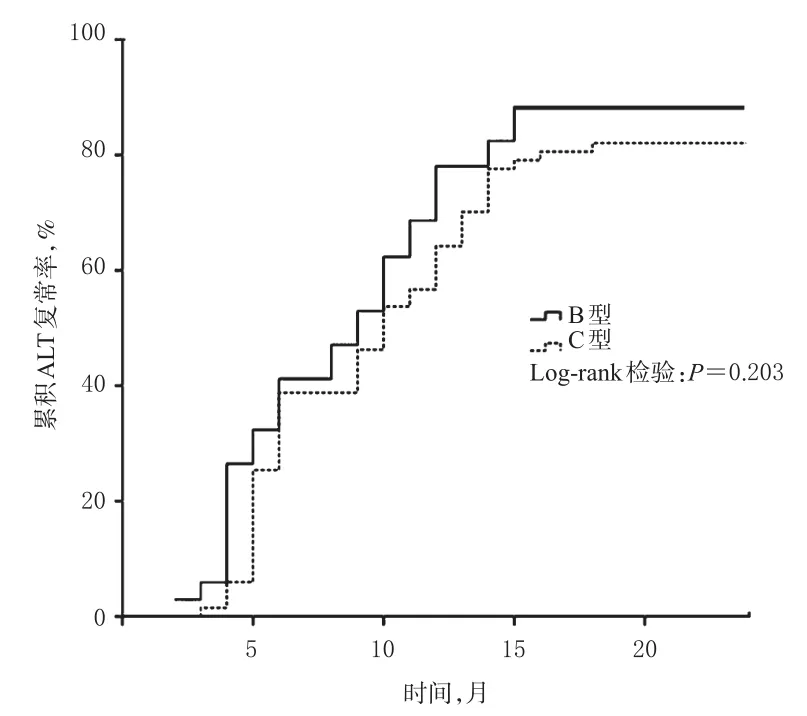
图2 不同基因型患者累积ALT复常率比较Fig2 Comparison of accumulative ALT normalization rates between different genotypes
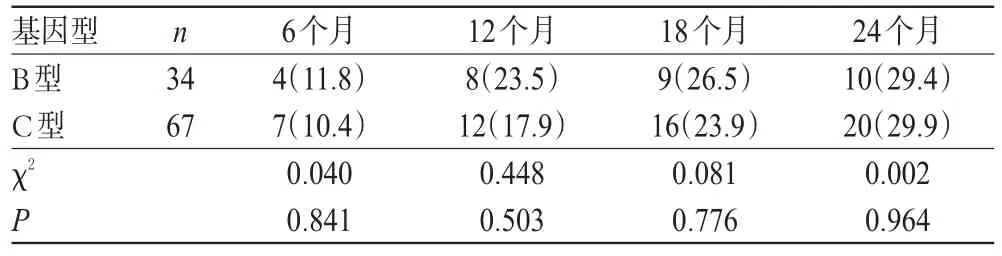
表4 不同基因型患者HBeAg血清转换率比较[例(%%)]Tab 4Comparison of HBeAg seroconversion rates between different genotypes[case(%%)]
Kaplan-Meier法和Log-rank检验分析结果显示,不同基因型患者的累积HBeAg血清转换率比较,差异亦无统计学意义(P=0.375),详见图3。
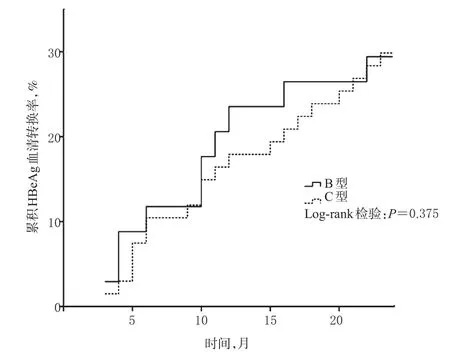
图3 不同基因型患者累积HBeAg血清转换率比较Fig3 Comparison of accumulative HBeAg seroconversion rates between different genotypes
3 讨论
随着组织学诊断技术和抗病毒药物的发展,通过药物抑制HBV复制来治疗慢性乙肝已取得了显著进步,可有效延缓患者疾病进展,并提高其生活质量。然而,慢性乙肝患者的药物耐受仍是乙肝临床治疗的主要难点之一[12]。LAM是我国首个获批上市的抗HBV核苷酸类药物,可显著降低患者的HBV-DNA定量,提高HBeAg血清转换率,减轻肝组织坏死程度,并逆转桥接性纤维化[13-14]。然而,LAM的耐药性成为其在抗HBV治疗中的主要壁垒。相关研究表明,使用LAM治疗慢性乙肝第1、2、3、4、5年,耐药的发生率依次为14%、38%、57%、67%、70%,呈逐年上升趋势[15-16]。LAM的耐药性已证实与DNA聚合酶YMDD基因突变有关[17]。本研究中纳入的101例LAM耐药慢性乙肝患者中,DNA聚合酶YMDD基因突变的比例高达98%[B、C型患者中各有1例未发生突变(即YMDD型),其余分别为YIDD、YVDD、YIDD+YVDD型]。ADV是腺苷一磷酸核苷酸类似物,在慢性乙肝患者的治疗中,可通过抑制HBV-DNA聚合酶来持续降低血清HBV-DNA水平,提高患者的ALT复常率,并改善其肝脏组织学病变[18]。与LAM相比,ADV发生耐药的概率更低,HBeAg阳性和阴性患者的5年累积耐药率分别为20%和29%[19-20]。在LAM耐药慢性乙肝患者中,联合应用ADV抗病毒治疗方案,与ADV单药治疗相比,前者可获得更好的病毒学和生化学应答[5-6]。本研究通过定期门诊及电话随访以保证患者的用药依从性,发现经LAM联合ADV抗病毒治疗24个月后,101例LAM耐药慢性乙肝患者的HBVDNA清除率为93.1%,HbeAg血清转化率为29.7%,且84.2%的患者ALT水平恢复正常,再次证实了LAM联合ADV方案在LAM耐药慢性乙肝患者临床治疗中的效果。
目前,已发现HBV基因至少有10种基因型(A~J),其分布具有明显地域性特征:在亚洲和北美地区,HBV基因型以B型和C型为主;在我国北方地区,基因型以C型为主,南方地区则以B型为主[21]。本研究中基因型分析结果显示,101例患者的HBV基因型以C型为主,占所有研究对象的66.3%。不同HBV基因型患者不仅对抗HBV药物(如干扰素和核苷酸类药物)的反应性不同,对药物的耐受程度也有所差异[3]。然而,关于核苷酸类药物抗HBV治疗在不同基因型慢性乙肝患者中的疗效尚缺乏统一结论,研究也十分有限。Chien RN等[22]和Inoue J等[23]分别在82例台湾患者和28例日本患者中展开研究,结果均显示HBV基因B型患者对LAM联合ADV抗病毒方案的病毒学应答要早于C型患者。本研究结果显示,在随访的第6个月,B型患者的HBV-DNA清除率显著高于C型患者(P<0.05);而在随访的第12~24个月,B型患者的HBV-DNA清除率与C型患者比较,差异均无统计学意义(P>0.05)。此外,在随访的第6~24个月时,B型患者的ALT复常率、HBeAg血清转化率与C型患者比较,差异均无统计学意义(P>0.05)。Kaplan-Meier法和Log-rank检验也证实了上述结果,提示B型患者对联合治疗方案的病毒学应答要显著早于C型患者,但在ALT复常和HBeAg血清学转化等生化学应答方面却未发现此种差异。HBV基因B型患者的病毒学应答早于C型患者的原因可能为:C型患者HBV核心启动子的突变率较B型患者高,而HBV核心启动子的突变能提高HBV病毒的复制水平,且与更为严重的肝纤维化和炎症反应密切相关[22,24];此外与C型患者相比,B型患者更不易发展为对LAM和ADV联合用药耐药的患者[23]。本研究尚未观察到两组患者在生化学应答上的差异,可能与随访时间不够长有关,仍需后续进一步研究。
综上所述,LAM联合ADV对LAM耐药慢性乙肝患者有效,可有效抑制HBV的复制;且HBV基因B型患者的病毒学应答要早于C型患者。但由于本研究并未观察到LAM联合ADV治疗的病毒学突破,所以尚不能确定HBV基因B型患者早于C型患者的病毒学应答是由于C型患者更易出现药物耐受所致,故仍需要更长时间的随访观察才能证实这一结论。此外,由于本研究为单中心研究,且样本量较小,故所得结论仍有待多中心、大样本量研究予以进一步证实。
[1]Luo Z,Li L,Ruan B.Impact of the implementation of a vaccination strategy on hepatitis B virus infections in China over a 20-year period[J].Int J Infect Dis,2012,16(2):e82-e88.
[2]张定凤.乙型肝炎抗病毒治疗的前瞻[J].中华肝脏病杂志,2006,14(7):483-488.
[3]Lin CL,Kao JH.Hepatitis B viral factors and treatment responses in chronic hepatitis B[J].J Formos Med Assoc,2013,112(6):302-311.
[4]Lai CL,Dienstag J,Schiff E,et al.Prevalence and cinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B[J].Clin Infect Dis,2003,36(6):687-696.
[5]周先珊,万谟彬,郑瑞英.阿德福韦酯单药或联合拉米夫定治疗拉米夫定耐药慢性乙型肝炎患者的临床研究[J].解放军医学杂志,2009,34(2):135-138.
[6]Hong JK,Park SK,Yang HJ,et al.Comparison of the clinical outcomes between antiviral-naive patients treated with entecavir and lamivudine-resistant patients receiving adefovir add-on lamivudine combination treatment[J].Clin Mol Hepatol,2016,22(3):350-358.
[7]Li HM,Wang JQ,Rui W,et al.Hepatitis B virus genotypes and genome characteristics in China[J].World J Gastroenterol,2015,21(21):6684-6697.
[8]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[9]Kim SS,Hwang JC,Sun GL,et al.Effect of virological response to entecavir on the development of hepatocellular carcinoma in hepatitis B viral cirrhotic patients:comparison between compensated and decompensated cirrhosis[J].Am J Gastroenterol,2014,109(8):1223-1233.
[10]王云.阿德福韦酯的药理作用与临床评价[J].中国药房,2010,21(34):3245-3246.
[11]王飞,康定理,胡秀琼,等.硫普罗宁联合拉米夫定在肺结核合并慢性乙型肝炎治疗中的作用[J].中国药房,2016,27(29):4112-4115.
[12]Lim YS.Management of antiviral resistance in chronic hepatitis B[J].Gut Liver,2017,11(2):189-195.
[13]姚光弼.拉米夫定抗肝炎病毒治疗[J].中华肝脏病杂志,2001,9(4):242-243.
[14]Dienstag JL,Goldin RD,Heathcote EJ,et al.Histological outcome during long-term lamivudine therapy[J].Gastroenterology,2003,124(1):105-117.
[15]Leung NW,Lai CL,Chang TT,et al.Extended lamivudine treatment in patients with chronic hepatitis B enhances hepatitis B e antigen seroconversion rates:results after 3 years of therapy[J].Hepatology,2001,33(6):1527-1532.
[16]Yao GB,Zhu M,Cui ZY,et al.A7-year study of lamivudine therapy for hepatitis B virus e antigen-positive chronic hepatitis B patients in China[J].J Dig Dis,2009,10(2):131-137.
[17]Calica Utku A,Karabay O.Treatment of chronic hepatitis B patients with tyrosinemethionine-aspartate-aspartate mutations[J].World J Gastroenterol,2016,22(4):1727-1728.
[18]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,et al.Longterm therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years[J].Gastroenterology,2006,131(6):1743-1751.
[19]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,et al.Adefovir dipivoxil for the treatment of hepatitis B e antigen-negative chronic hepatitis B[J].N Engl J Med,2003,348(9):800-807.
[20]Marcellin P,Chang TT,Lim SG,et al.Long-term efficacy and safety of adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B[J].Hepatology,2008,48(3):750-758.
[21]Zeng G,Wang Z,Wen S,et al.Geographic distribution,virologic and clinical characteristics of hepatitis B virus genotypes in China[J].J Viral Hepat,2005,12(6):609-617.
[22]Chien RN,Yeh CT,Tsai SL,et al.Determinants for sustained HBeAg response to lamivudine therapy[J].Hepatology,2003,38(5):1267-1273.
[23]Inoue J,Ueno Y,Wakui Y,et al.Four-year study of lamivudine and adefovir combination therapy in lamivudineresistant hepatitis B patients:influence of hepatitis B virus genotype and resistance mutation pattern[J].J Viral Hepat,2011,18(3):206-215.
[24]Lindh M,Hannoun C,Dhillon AP,et al.Core promoter mutations and genotypes in relation,viral replication and liver damage in East Asian hepatitis B virus carriers[J].J Infect Disto,1999,179(4):775-782.
Therapeutic Efficacy of Lamivudine Combined with Adefovir Dipivoxil in the Treatment of Lamivudine-resistant Chronic Hepatitis B Patients and Its Relationship with HBV Genotype
CHANG Caifang,FAN Jingjing,WANG Hao(Dept.of Infectious Diseases,the First Affiliated Hospital of Hebei North University,Hebei Zhangjiakou 075000,China)
OBJECTIVE:To evaluate therapeutic efficacy of lamivudine(LAM)combined with adefovir dipivoxil(ADV)in the treatment of LAM-resistant chronic hepatitis B patients,and to study the relationship of therapeutic efficacy with hepatitis B virus(HBV)genotype.METHODS:A total of 101 LAM-resistant chronic hepatitis B patients selected during Dec.2012 to Dec.2014 were given LAM+ADV for 24 months at least.Regular outpatient visits or telephone follow-up were also performed.Polymerase chain reaction-reverse dot blot method was used to determine theHBVgenotype.Chi-square test,Kaplan-Meier method and Log-rank test were used to compare the virological response(HBV-DNA clearance rate)and biological response(ALT normalization rate and HBeAg seroconversion rate)among different genotypes at the 6th,12th,18th and 24th month of followup.RESULTS:The follow-up rate was 100%,without missed follow-up.Two genotypes were detected,including 34 patients(33.7%)with genotype B and 67 patients(66.3%)with genotype C.At each time point mentioned above,the HBV-DNA clearance rates of 101 patients were 34.7%,55.4%,79.2%and 93.1%.At 6th month,HBV-DNA clearance rate and accumulative HBV-DNA clearance rate of genotype B were significantly higher than genotype C,with statistical significance(P<0.05).There was no statistical significance in HBV-DNA clearance rates or accumulative HBV-DNA clearance rates between different genotypes at other time points(P>0.05).At each time point mentioned above,ALT normalization rates of 101 patients were 40.6%,69.3%,82.2%,84.2%;there was no statistical significance in ALT normalization rates or accumulative ALT normalization rates between different genotypes(P>0.05).At each time point mentioned above,the HBeAg seroconversion rates of 101 patients were 10.9%,19.8%,24.8%,29.7%;there was no statistical significance in the HBeAg seroconversion rates or accumulative HBeAg seroconversion rates between different genotypes(P>0.05).CONCLUSIONS:LAM combined with ADV is effective for LAM-resistant chronic hepatitis B patients.Moreover,the combination therapy can achieve earlier viological response in patients with genotype B than those with genotype C.
Chronic hepatitis B;Lamivudine;Adefovir dipivoxil;Drug-resistant;Hepatitis B virus genotype;Virological responses;Biological response
R512.6+2
A
1001-0408(2017)29-4037-05
DOI10.6039/j.issn.1001-0408.2017.29.02
河北省医学科学研究重点课题计划项目(No.20150472)
*主治医师。研究方向:慢性乙型肝炎诊断及治疗。电话:0313-8041602。E-mail:ccf_bfyy@163.com
2017-01-15
2017-08-06)
(编辑:张元媛)

