急性高血糖影响小鼠第一时相胰岛素分泌的机制
赵一楠,周迎生,颜迪恩,高秀莹
(首都医科大学附属北京安贞医院内分泌代谢科,北京 100029)
研究报告
急性高血糖影响小鼠第一时相胰岛素分泌的机制
赵一楠,周迎生*,颜迪恩,高秀莹
(首都医科大学附属北京安贞医院内分泌代谢科,北京 100029)
目的观察急性高血糖影响小鼠第一时相胰岛素分泌的功能及形态学变化特点。方法给C57/BL 6J小鼠完成颈静脉插管后输注20%高糖溶液4 h,建立急性糖毒性小鼠模型,行腹腔葡萄糖耐量实验(intraperitoneal glucose tolerance test, IPGTT)及口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)评价葡萄糖耐量及胰岛素分泌功能。HE染色及电镜观察胰岛形态变化及细胞内胰岛素分泌颗粒亚细胞结构变化。结果IPGTT实验中急性糖毒性组15 min血糖值较对照组显著增加[(10.3±0.33) mmol/L vs(19.3±1.66) mmol/L],上升87%(P<0.05),OGTT实验中30 min血糖值较对照组显著增加[(9.8±0.31) mmol/L vs(18.16±1.01) mmol/L],升高85%(P<0.05),且早期胰岛素分泌高峰受损且分泌延迟。GSIS实验中急性糖毒性组在基础状态时(葡萄糖浓度2.8 mmol/L)和高糖(16.7 mmol/L)刺激后,胰岛素分泌较对照组显著降低[(0.481±0.003) ng/mL vs(0.702±0.121) ng/mL,(2.43±0.03) ng/mL vs(4.07±0.34) ng/mL],分别下降46%和67%(P<0.05);胰岛素含量测定结果显示,急性糖毒性组比对照组降低[(97.01±2.05) ng/mL vs(65.12±0.42) ng/mL,(121.40±0.58) ng/mL vs(62.7±0.48) ng/mL],下降49%和94%(P<0.05)。HE染色显示急性糖毒性胰岛边界不规则、内部细胞排列不整;透射电镜可见细胞内胰岛素分泌颗粒空泡,线粒体嵴断裂。结论急性葡萄糖毒性使胰岛β细胞内胰岛素储备减少,导致第一时相分泌胰岛素峰值降低及延迟。
胰岛;急性高血糖试验;糖耐量试验;胰岛素分泌;组织学;超微结构;小鼠
胰岛素分泌功能障碍或胰岛素缺乏是糖尿病发病的重要原因,早期表现在胰岛素第一时相分泌功能的异常[1]。静脉输注葡萄糖液、大量饮用含糖饮料、使用类固醇激素和应激性因素等是引起血糖迅速升高的常见诱因[2]。研究表明,血糖浓度超过生理范围对细胞、组织有损害作用,称糖毒性,当血糖升高不能刺激足够的胰岛素释放就会发生糖尿病[3,4]。我们既往研究发现急性糖毒性可以损伤胰岛素第一时相分泌,形态学研究发现胰岛内部细胞排列不整齐且外部形态不规则,胰岛素染色分布不均匀且颜色程度不一致[5]。本研究拟通过建立急性糖毒性损伤模型,探索急性糖毒性影响胰岛素分泌的功能及形态学机制特点。
1 材料与方法
1.1实验动物
SPF/VAF级C57BL/6J小鼠为12周龄,雄性,30只,体重24~26 g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2016-0011】,首都医科大学附属北京安贞医院心肺血管病研究所实验动物科学部【SYXK(京)2016-0027】完成小鼠饲养及部分相关实验内容。动物正常饮食、进水,饲养环境安静、舒适,12/12 h昼夜规律,饲养温度恒定在22℃~26℃,空气湿度维持在60%~70%。所有饲养小鼠均完成高葡萄糖钳夹实验模型。本实验分为两组,每组15只;(1)正常对照组(control group),颈静脉输注生理盐水;(2)急性糖毒性组(acute hyperglycemia group),颈静脉输注20%葡萄糖。
1.2建立急性葡萄糖毒性模型
将小鼠称重、编号,并根据体重按80 mg/kg注射1%戊巴比妥钠腹腔麻醉小鼠。在颈静脉插管术后恢复3 d。实验时通过鼠尾静脉测定小鼠血糖,在颈静脉插管内注射肝素盐水(200 U/mL)抗凝,将颈静脉插管连接微量注射泵(Perfusor@compact,BRAUN),按照起始速度0.5 mL/h输注20%葡萄糖溶液,血糖在输注10 min后达到16.7 mmol/L,继续输注,每30 min测定血糖1次,据血糖浓度调节输注速度,保持血糖浓度≥16.7 mmol/L,输注4 h后复测血糖,整个过程中小鼠处于麻醉状态。实验结束待观察小鼠恢复后再送回动物房,正常饮食。
1.3葡萄糖耐量试验(GTT)
腹腔葡萄糖耐量试验(IPGTT)时,小鼠禁食过夜10 h以上。通过鼠尾静脉测定空腹血糖,给予腹腔注射20%葡萄糖 (2 g/kg),用固定器固定小鼠,分别测定葡萄糖负荷后15、30、60、120 min血糖,用毛细采血管(Roche)在各时间点鼠尾采血。血标本经4℃ 10 000 r/min离心10 min取上清,放入-80℃冰箱内保存。口服葡萄糖耐量试验(OGTT)时,小鼠禁食过夜10 h以上。通过鼠尾静脉测定空腹血糖,给予口服20%葡萄糖 (2 g/kg)灌喂,用固定器固定小鼠,分别测定葡萄糖负荷后30、60、90、120 min血糖,并留取各时间点血标本,离心、取上清后放入-80℃冰箱保存[6]。上述实验在不同小鼠中分别完成。
1.4胰岛素浓度测定
采用小鼠超敏胰岛素ELISA试剂盒(Alpco公司,USA)测定。从-80℃冰箱中取出样本,放置至室温,涡旋混匀5 s,按照既往研究中方法测定胰岛素浓度[7]。
1.5胰腺组织HE染色
胰腺组织脱水后石蜡包埋,包埋时注意组织切面向下并沉至石蜡底部。石蜡切片制备:将包埋好的石蜡包埋盒保存在-20℃冰箱内,切片前取出放置在冰上,切片厚度6 μm,切片刀尽量从左向右顺序切片,切片前用30%乙醇湿润组织部分以防止组织碎裂,展片时间2~3 s即可。放置在80℃烤片箱内100 min,用以防止组织脱片。此后,石蜡切片还需脱蜡、染色。
胰腺组织在切片制备及染色过程中不同于其他实质脏器(心脏、肝、肾),组织形状不规则,脱水后质地较硬、较脆。切片及展片时组织容易出现碎裂、卷曲,故切片时尽量保证低温、湿润,展片时间不宜过长。HE染色过程中染料作用时间不宜过长,可在每次染色操作完成后于立式显微镜下观察染色情况。
1.6小鼠胰岛的分离、纯化
麻醉后固定小鼠于鼠板上,酒精消毒胸腹部,将腹腔内脏器钝性分离,充分暴露十二指肠及周边胰腺,按照既往研究中分离方法获得胰岛[8]。
1.7葡萄糖刺激的胰岛素分泌实验(GSIS)
挑选过夜培养的胰岛移入含有6 mL KRBH液(0.5% BSA)的培养皿中,于37℃ CO2培养箱中预孵育1 h。体视显微镜下,吸取包膜完整、大小一致的胰岛种于24孔板,每孔10个,加入含不同浓度葡萄糖的刺激液,每孔2 mL,每个浓度设3 个复孔,置于37℃ CO2培养箱孵育1 h。取出24孔板,置于冰上10 min,以终止胰岛素分泌。体视显微镜下,吸取上清1 mL至1.5 mL EP管中(避免吸入胰岛),按照既往研究中的方法完成小鼠胰岛素分泌实验[7,8]。
1.8小鼠胰岛透射电镜
将分离挑选出的200个胰岛用3%戊二醛固定液固定2 h,使其蛋白结构保存良好并失去活性。用0.1 mol/L PB缓冲液对组织清洗3次后,采用琼脂胶进行第1次包埋,使胰岛在琼脂中呈悬浮状态。在首都医科大学电镜室,用1%锇酸对胰岛进行后固定、脱水、包埋、聚合、电子染色。用透射电镜(日本JEOL JEM-1400)观察胰岛β细胞胰岛分泌颗粒及亚细胞结构。
1.9统计学处理
正态分布数据用均值±标准误表示,两组均数比较采用t检验,多组间比较为单因素方差分析或LSD检验。非正态分布数据用中位数及四分位法表示,组间比较采用非参数检验。计数资料用率表示,采用卡方检验分析。应用SPSS软件进行数据统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1成功建立急性糖毒性小鼠模型
本研究通过对小鼠右颈静脉插管后正常食水恢复3 d,使用微量注射泵持续输注高糖,将血糖维持在16.7 mmol/L以上4 h,起始输注速度为0.5 mL/h,输注10 min后测定血糖值,根据血糖上升情况,调节输注速度,2 h后输注速度基本为0.2 mL/h左右,输注结束后监测血糖恢复情况,通常0.5 h内小鼠血糖恢复至术前水平,详见图1。
本实验中小鼠共30只,操作成功24只,死亡6只。死亡原因主要包括:手术操作中出血、插管时产生血栓。每组12只小鼠,其中6只完成IPGTT实验,另外6只完成OGTT实验,并记录数据,每组取3只小鼠胰腺组织完成HE染色,6只分离胰岛并完成体外实验,3只小鼠取胰岛组织完成透射电镜。
2.2通过IPGTT及OGTT显示急性糖毒性对胰岛素第一时相分泌的损伤特点
IPGTT实验结果表明急性糖毒性组15 min血糖值较对照组升高了87%(P<0.05),血糖值曲线下面积较对照组增加了97%(P<0.05);OGTT实验中急性糖毒性组30 min血糖值较对照组升高了85%(P<0.05),血糖值曲线下面积较对照组增加了106%(P<0.05),表明体内葡萄糖代谢能力下降。见图2A-D。而无论是IPGTT还是OGTT,血浆胰岛素高峰都出现了延迟,表明胰岛素早期分泌功能受损。见图2E-F。
2.3通过GSIS及胰岛素含量测定分析急性糖毒性对胰岛素储备影响
分离胰岛后,GSIS实验中急性糖毒性组在基础状态(葡萄糖浓度2.8 mmol/L)、高葡萄糖状态(16.7 mmol/L)、30 mmol/L氯化钾及40 mmol/L氯化钾刺激后,胰岛素分泌水平较对照组分别降低了46%、67%、20%、50%(P<0.05)。胰岛素含量测定结果显示急性糖毒性组比对照组分别降低了49%、95%、61%、74%(P<0.05)。详见图3。
2.4通过HE染色及电镜观察急性糖毒性对胰岛细胞亚细胞结构的损伤
实验各组胰腺组织HE染色显示:对照组中胰岛外形规整,细胞质染色均匀;而急性糖毒性组中胰岛内部细胞排列不整齐且外部形态不规则,细胞质染色分布不均匀且颜色程度不一致,详见图4A、B。胰岛组织电镜结果显示:对照组胰岛中β细胞胰岛素分泌颗粒成熟度高、空泡数量少;而急性糖毒性组中β细胞内成熟胰岛素分泌颗粒明显减少,空泡数量增加,线粒体数量增加,且存在线粒体肿胀及膜断裂等病理改变,详见图4C-F。
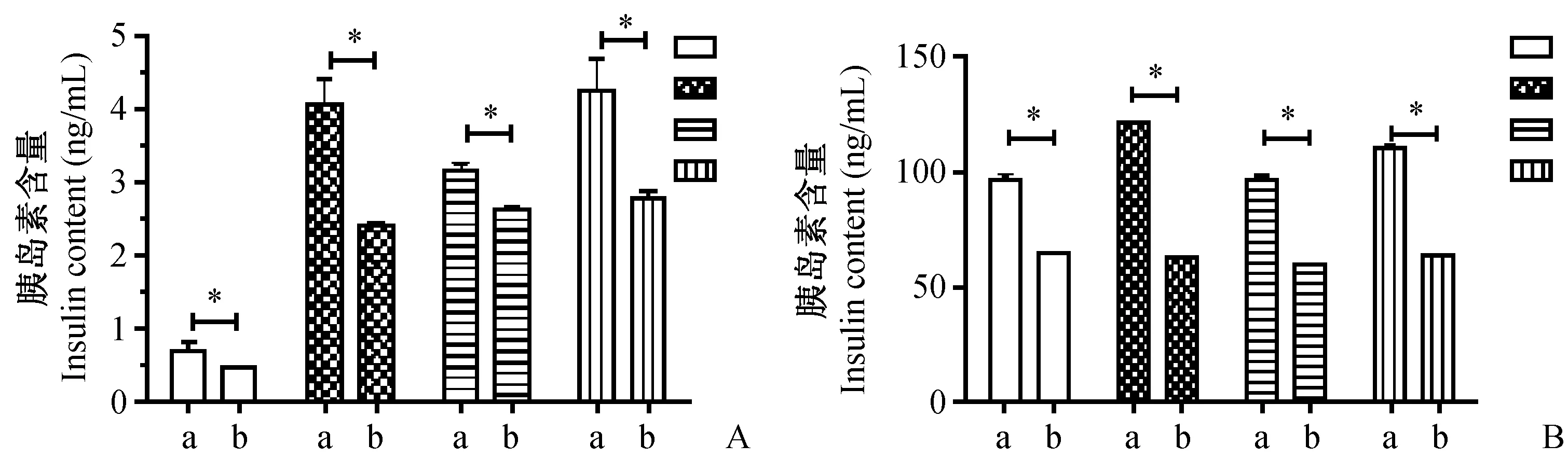
注:A为葡萄糖及氯化钾刺激下对照组与急性糖毒性组的胰岛素分泌水平;B为葡萄糖及氯化钾刺激下对照组与急性糖毒性组的胰岛素含量;其中a为对照组,b为急性糖毒性组。图3 葡萄糖及氯化钾刺激下对照组及急性糖毒性组胰岛素水平Note. A, insulin secretion was stimulated by glucose and potassium chloride in the control and acute hyperglycemia groups. B, insulin content of islets in the control and acute hyperglycemia groups. A, control group; b, acute hyperglycemia group.Fig.3 The insulin levels stimulated by glucose and potassium chloride in the control and acute hyperglycemia groups

注:A、B为对照组及急性糖毒性组胰腺组织HE染色图像(×400);C、E为对照组胰岛组织透射电镜照片(×2000,×4000);D、F为急性糖毒性组胰岛组织透射电镜照片(×2000,×4000);其中可见细胞核(◇)及线粒体(↓),胰岛素颗粒(Δ)。图4 对照组与急性糖毒性组的HE染色及透射电镜结果Note. A, a pancreatic islet in a control mouse; B, a pancreatic islet in an acute hyperglycemic mouse; C, E, electron micrographs of islet cells in a control mouse; D, F, electron micrographs of islet cells in an acute hyperglycemic mouse. Nucleus (◇), mitochondria (↓) and insulin particles (Δ).Fig.4 Histology and ultrastructure of pancreatic islets in the mice of control and acute hyperglycemia groups
3 讨论
本研究中IPGTT结果显示急性糖毒性组15 min血清胰岛素水平明显低于对照组,与之相对应的血糖值却显著高于对照组,因此急性糖毒性能够损害胰岛素第一时相分泌,而胰岛素第一时相分泌与糖尿病的发病密切相关,因此这可能成为糖尿病发病的新的诱因,这与之前Elena Toschi在临床研究报道相一致[4]。为观察胰岛β细胞受损与不同血糖浓度和刺激时间的关系,我们绘制葡萄糖浓度-时间和胰岛素浓度-时间曲线,并计算曲线下的面积。发现急性糖毒性组血糖曲线下的面积高于对照组,而胰岛素水平曲线下面积却低于对照组。Leahy研究[5]表明糖毒性与血液葡萄糖浓度和输液时间相关,通过对大鼠连续葡萄糖输液 (2 mL/h) 48 h,成功地建立葡萄糖钳夹模型,这项研究验证了48 h持续高血糖可以减损胰岛素分泌功能,出现糖耐量减低表现。
既往研究没有确切的时间定义急性和慢性糖毒性。Leahy[5]的研究最早定义48 h为慢性糖毒性。Evans-Molina[9]定义1 h为急性葡萄糖刺激。本课题组前期研究中,定义 4 h作为急性糖毒性,并发现急性糖毒性损伤确实会减损早期胰岛素分泌并减少小鼠胰岛β细胞中胰岛素含量。本研究证实了急性糖毒性损伤对胰岛素第一时相分泌的减损作用,但这种减损作用是由于胰岛素储备减低还是胰岛素敏感性下降造成的仍存在争议。本研究结果表明胰岛素分泌减少和胰岛素含量下降有关。既往体外研究[10]表明,用11 mmol/L和28 mmol/L葡萄培养的胰岛细胞7 d,胰岛素含量分别减少了 45%和60%,胰岛素分泌显著减少。
本研究GSIS实验结果发现,对照组及急性糖毒性组中分离、纯化后的胰岛在葡萄糖刺激下可分泌胰岛素,且本组分离所得胰岛在高葡萄糖刺激下分泌胰岛素量是基础葡萄糖的4倍以上,优于多数文献报道[11-13]。而急性糖毒性组在葡萄糖浓度为2.8或16.7 mmol/L刺激分泌胰岛素水平比对照组分别下降了46%和67%(P<0.05),这与之前报道的体外胰岛在葡萄糖浓度为20 mmol/L的培养基中培养30 min后,胰岛素分泌较对照组减少75%是类似的[14]。既往研究中,Festa[15]发现糖耐量受损和2型糖尿病患者的胰岛素分泌水平分别降低了31%和70%。本研究中,急性糖毒性可以导致胰岛素分泌减损,类似于Festa研究中的糖耐量受损组。慢性糖毒性研究发现,10 mmol/L 的高葡萄糖损伤就会引起胰岛素分泌降低[16,17]。Ling[18]发现后在 20 mmol/L的高葡萄糖损伤就会引起胰岛素分泌降低。临床研究中[19],体外环境下25 mmol/L高葡萄糖损伤48 h可使胰岛细胞的胰岛素 mRNA 含量减少,但在30 min内胰岛素分泌不会减少,故胰岛素分泌的减损是时间依赖性。
本研究发现急性糖毒性组胰岛出现边缘不规则的细胞核及较少的胰岛素分泌泡和大量的空泡,线粒体数量增加,但线粒体嵴有断裂。既往研究[20]也发现慢性糖毒性可以减少胰岛素分泌泡并导致线粒体肿胀。本研究中发现急性糖毒性组胰岛素分泌泡数量减少,这说明确实存在胰岛素含量的减少及胰岛素分泌下降。此外,Morini[21]发现糖毒性可诱导细胞膜骨架断裂和胰岛细胞线粒体肿胀,这也与胰岛素分泌功能障碍相关。
本研究使用戊巴比妥钠对小鼠进行麻醉,对血糖没有影响,既往基础研究表明戊巴比妥钠麻醉大鼠对其血糖及胰岛素分泌没有影响,而芬太尼麻醉大鼠,会使其血糖升高[22]。本研究已经发现急性糖毒性对胰岛素分泌的损伤作用,但其损伤机制的分子生物学研究,尚需进一步实验探讨。此外,急性糖毒性对胰岛造成的这种损伤是短暂一过性还是永久性目前尚不清楚,期待在未来的研究中进一步完善。
[1] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults [J]. JAMA, 2013, 310(9): 948-959.
[2] Ashcroft FM, Rorsman P. Diabetes mellitus and the β cell: the last ten years [J]. Cell, 2012, 148(6): 1160-1171.
[3] Yan D, Zhao Y, Gao X, et al. Acute intravenous glucose load impairs early insulin secretion and insulin content in islet β cells in mice [J]. Life Sci, 2016, 144: 148-155.
[4] Toschi E, Camastra S, Sironi AM, et al. Effect of acute hyperglycemia on insulin secretion in humans [J]. Diabetes, 2002, 51(Suppl 1): S130-S133.
[5] Leahy JL,Cooper HE, Deal DA, et al. Chronic hyperglycemia is associated with impaired glucose influence on insulin secretion. A study in normal rats using chronic in vivo glucose infusions [J]. J Clin Invest, 1986, 77(3): 908-915.
[6] 周迎生, 高妍, 李斌, 等. 高脂喂养联合链脲佐菌素注射的糖尿病大鼠模型特征 [J]. 中国实验动物学报, 2005, 13(3): 154-158.
[7] Zhou YS, Gao Y, Guo XH, et al. Effects of timely insulin treatment on protection of beta cells in a rat model of type 2 diabetes mellitus [J]. Chin Med J (Engl), 2004, 117(10): 1523-1529.
[8] Gao X, Yan D, Zhao Y, et al. Moderate calorie restriction to achieve normal weight reverses β-cell dysfunction in diet-induced obese mice: involvement of autophagy [J]. Nutr Metab (Lond), 2015, 12: 34.
[9] Evans-Molina C, Garmey JC, Ketchum R, et al. Glucose regulation of insulin gene transcription and pre-mRNA processing in human islets [J]. Diabetes, 2007, 56(3): 827-835.
[10] Meyer J, Sturis J, Katschinski M, et al. Acute hyperglycemia alters the ability of the normal β-cell to sense and respond to glucose [J]. Am J Physiol Endocrinol Metab, 2002, 282(4): E917-E922.
[11] Liu Z, Jeppesen PB, Gregersen S, et al. Chronic exposure to leucine in vitro induces β-cell dysfunction in INS-1E cells and mouse islets [J]. J Endocrinol, 2012, 215(1): 79-88.
[12] da Silva Xavier G, Loder MK, McDonald A, et al. TCF7L2 regulates late events in insulin secretion from pancreatic islet β-cells [J]. Diabetes, 2009, 58(4): 894-905.
[13] Boden G, Ruiz J, Kim CJ, et al. Effects of prolonged glucose infusion on insulin secretion, clearance, and action in normal subjects [J]. Am J Physiol, 1996, 270(2 Pt 1): E251-258.
[14] Moran A, Zhang HJ, Olson LK, et al. Differentiation of glucose toxicity from β cell exhaustion during the evolution of defective insulin gene expression in the pancreatic islet cell line, HIT-T15 [J]. J Clin Invest, 1997, 99(3): 534-539.
[15] Festa A, Haffner SM, Wagenknecht LE, et al. Longitudinal decline of β-cell function: comparison of a direct method vs a fasting surrogate measure: the Insulin Resistance Atherosclerosis Study[J]. J Clin Endocrinol MeTab, 98(10): 4152-4159.
[16] Laskewitz AJ, van Dijk TH, Grefhorst A, et al. Chronic prednisolone treatment aggravates hyperglycemia in mice fed a high-fat diet but does not worsen dietary fat-induced insulin resistance [J]. Endocrinology, 2012, 153(8): 3713-3723.
[17] Purrello F, Rabuazzo AM, Anello M, et al. Effects of prolonged glucose stimulation on pancreatic β cells: from increased sensitivity to desensitization [J]. Acta Diabetol, 1996, 33(4): 253-256.
[18] Ling Z, Pipeleers DG. Prolonged exposure of human β cells to elevated glucose levels results in sustained cellular activation leading to a loss of glucose regulation [J]. J Clin Invest, 1996, 98(12): 2805-2812.
[19] Thibault C, Guettet C, Laury MC, et al. In vivo and in vitro increased pancreatic β-cell sensitivity to glucose in normal rats submitted to a 48-h hyperglycemic period [J]. Diabetologia, 1993, 36(7): 589-595.
[20] Jung HS, Chung KW, Won KJ, et al., Loss of autophagy diminishes pancreatic beta cell mass and function with resultant hyperglycemia [J]. Cell MeTab, 2008, 8 (4): 318-324.
[21] Morini S, Braun M, Onori P, et al. Morphological changes of isolated rat pancreatic islets: a structural, ultrastructural and morphometric study [J]. J anatomy, 2006, 209(3): 381-392.
[22] Johansen O, Vaaler S, Jorde R, et al. Increased plasma glucose levels after Hypnorm anaesthesia, but not after Pentobarbital anaesthesia in rats [J]. Lab Anim, 1994, 28(3): 244-248.
Impairmentmechanismsofacutehyperglycemiainthefirst-phaseinsulinsecretioninmouse
ZHAO Yi-nan, ZHOU Ying-sheng*, YAN Di-en, GAO Xiu-ying
(Department of Metabolism and Endocrinology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029,China)
ObjectiveTo clarify the impairment mechanisms of acute hyperglycemia in the first-phase insulin secretion in mice.MethodsThe mouse model of acute glucose toxicity was established by glucose infusion through jugular vein catheterization. The glucose and insulin levels were assessed by IPGTT and OGTT in the mice of acute hyperglycemia and control groups. The histology of pancreatic islets was observed using HE staining and the insulin granules and other cytoplasmic organelles were observed by electron microscopy.ResultsThe mouse model of acute hyperglycemia was successfully established. The IPGTT showed that the blood glucose level was decreased by 87% (10.3±0.33 mmol/L vs. 19.3±1.66 mmol/L) at 15 min in the acute hyperglycemia group compared with the control group. The OGTT showed that the blood glucose level was decreased by 85% (9.8±0.31 mmol/L vs. 18.16±1.01 mmol/L) at 30 min in the acute hyperglycemia group compared with the control group. However, the peak values of insulin secretion were delayed in both IPGTT and OGTT. Insulin levels at 2.8 and 16.7 mmol/L glucose stimulation in the acute hyperglycemia group was declined by 46% and 67% than the control group, respectively (P<0.05). Residual insulin content in islet β cells was declined by 49% at 2.8 mmol/L and 94% at 16.7 mmol/L glucose infusion than the control group (P<0.05). The histology showed irregular structure of pancreatic islets in the acute hyperglycemia group. The electron microscopy revealed that the amount of insulin granules was decreased, and more cytoplasmic vacuoles and swollen mitochondria were observed.ConclusionsAcute intravenous glucose load decreases insulin content of islet β cells, leading to decrease and delay of the first-phase insulin secretion.
Acute hyperglycemia; Pancreatic islets; Glucose tolerance test; Insulin secretion; Histology; Ultrastructure; Mouse
ZHOU Ying-sheng,yszhou@cemu.edu.cn
Q95-33
A
1005-4847(2017) 05-0479-07
10.3969/j.issn.1005-4847.2017.05.003
2017-02-27
国家自然科学基金资助项目(81641027);教育部留学回国基金资助项目(2012-940);北京市科委科研基金资助项目(Z131100004013044);北京市学科带头人基金资助项目(2013-2-006)。
赵一楠(1988-),男,在读博士生,专业:内分泌与代谢疾病。E-mail: zhaoyinan1988@163.com
周迎生(1965-),男,教授,主任医师,博士生导师,研究方向:2型糖尿病发病机制及心血管并发症防治。E-mail: yszhou@ccmu.edu.cn

