PCOS易感基因Hmga2在小鼠子宫蜕膜化中的表达与调节
曹永芝,赵跃然,林德贵
(1. 中国农业大学动物医学院, 北京 100193; 2. 山东大学生殖医学研究中心,济南 250021)
研究报告
PCOS易感基因Hmga2在小鼠子宫蜕膜化中的表达与调节
曹永芝1,2,赵跃然2,林德贵1*
(1. 中国农业大学动物医学院, 北京 100193; 2. 山东大学生殖医学研究中心,济南 250021)
目的研究PCOS易感基因Hmga2在子宫内膜容受性和蜕膜化中的表达与调节。方法通过早期妊娠、延期着床与激活、人工蜕膜化、卵巢类固醇激素处理等实验,利用qPCR、Western blot技术,阐述Hmga2在子宫内膜容受性中的作用。结果Hmga2随着妊娠表达量逐渐增加,着床点与非着床点相比表达量显著升高,胚胎激活组比延迟着床表达量显著增高,人工诱导蜕膜化与非蜕膜化比较表达显著升高,Hmga2的表达与雌激素和孕激素呈正相关,体内受雌孕激素调节。结论表明Hmga2的表达与小鼠早期妊娠胚胎着床过程密切相关,参与子宫内膜蜕膜化过程,受活化胚泡和类固醇激素的影响。
多囊卵巢综合征;高迁移率族蛋白A2;蜕膜化;胚胎;小鼠
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一个表型复杂多样以及表现高度异质性的常见女性内分泌疾病。其主要的临床表现为月经不规律(月经稀发或闭经),高雄激素表现(临床高雄激素表现和/或高雄激素血症)以及卵巢多囊性改变[1]。研究报道,6%~8%的生育期女性被诊断为PCOS[2]。PCOS发病机制较复杂,至今仍未完全阐明,一般认为由遗传和环境两方面共同影响,与下丘脑-垂体-卵巢轴功能失常、肾上腺功能紊乱、遗传、代谢、环境等因素有关。妊娠过程的成功有赖于两个方面:一是优质的胚胎,二是良好的子宫内膜容受性,此二者在各种因素的严格调控下相互作用,完成胚胎着床过程。排卵后的6~10 d,月经周期的20~24 d子宫有个极短的允许胚胎植入容受性最大的敏感期,妊娠期间的这个特定的时间间隔被定义为胚胎植入的窗口期(window of implantation, WOI)[3],部分PCOS患者接受促排卵治疗后观察到存在高排卵率、低妊娠率的现象,受精卵植入过程发生的障碍是这种治疗后妊娠失败现象的主要原因,其发生的关键在于子宫内膜容受性降低[4,5],子宫内膜容受性对提高PCOS患者妊娠率有重要作用。
囊胚粘附到子宫上皮后,围绕囊胚子宫基质细胞开始发生广泛地增殖和分化,同时伴随着蜕膜区大量的血管发生,这个过程称为子宫蜕膜化。植入位点处的子宫体积和重量迅速地増大,最终使胚泡完全包埋入子宫系膜对侧的基质床中[6]。目前认为蜕膜的主要作用是在有功能的胎盘形成之前为胚泡的发育提供营养物质,并且早期蜕膜对发育初期的胚胎起到免疫保护作用[6,7]。
在胚胎发育过程中细胞分化主要依赖特定基因通过特定的方式进行调控。核染色体的结构变化对于基因的启动和表达起着决定性作用。全基因组关联分析(genome wide association study,GWAS)中高迁移率族蛋白A2(HMGA2)基因为PCOS 易感基因,该基因是近年发现的染色质非组蛋白,它能通过与染色质结合而改变染色质的结构,从而调节其他基因的转录。人类的HMGA2编码基因长度约为160 kb,其编码序列中共包含5个外显子[8-10]。Hmga2-/-的小鼠表现为侏儒表形,且因缺乏精子生成能力而不育,而突变型Hmga2过表达,则导致小鼠出现体型巨大、肥胖及发生淋巴瘤[11]。研究表明HMGA2在多种恶性抑瘤组织中存在过表达现象,且与其不良预后有关[12,13],在卵巢浆液性癌中,HMGA2可作为其早期诊断的分子标志物,与P53联合应用提高诊断效率[14,15]。
HMGA2在GWAS验证研究中已经确定为PCOS易感基因,该基因在PCOS病人胚胎着床过程中的作用未见报道。因此,本研究拟通过体内动物模型研究Hmga2在子宫内膜容受性和蜕膜化中的作用,评价胚胎植入窗口期子宫内膜容受性的高低,对于提高IVF妊娠率和寻求有效的避孕措施有一定的临床意义。
1 材料与方法
1.1材料
1.1.1 实验动物
SPF级KM小鼠,6~8周龄,体重约为 22~24 g,由山东大学实验动物中心提供【SCXK(鲁)2013-0009】,饲养于22℃恒温条件下,光照周期为 14 h 光照(06:00-20:00),10 h 黑暗,自由采食和饮水。实验小鼠饲养及组织取材均于山东大学实验动物中心进行【SYXK(鲁)2010-0011】。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.1.2 试剂
检测 RNA 提取试剂盒和 cDNA 逆转录酶试剂盒购自TaKaRa生物技术有限公司,mRNA定量试剂采用LightCycler® 480 SYBR green I master,仪器采用Light Cycler®96 荧光定量 PCR 仪(Roche)。Western blot所用一抗为anti-HMGA2 antibody(GT763),二抗(抗鼠,Proteintech, goat anti-mouse IgG(H+L),SA00001-1),内参选用anti-β-actin(Proteintech, 60008-1-Ig),RIPA蛋白裂解液等其他试剂购自碧云天生物技术研究所。
1.2方法
1.2.1 实时荧光定量PCR分析
采用Trizol Reagent 抽提子宫组织RNA,异丙醇沉淀浓缩 RNA,灭菌 DEPC 水溶解总 RNA,紫外分光光度计测总 RNA 的吸光度(absorbance,A)值,琼脂糖凝胶电泳检测其完整性。以cDNA 为模板检测Hmga2和GAPDH的表达,以GAPDH为内参照计算Hmga2的相对表达量。Hmga2的引物序列为:上游5′-AAGGCAGCAAAAACAAGAGC-3′,下游5′-GCAGGCTTCTTCTGAACGAC- 3′;GAPDH的引物序列为: 上游5′-TCTGACTTCAACAGCGACAC-3′,下游5′-GCCAAATTCGTTGTCATACC -3′,引物由上海英骏科技有限公司合成。PCR循环条件为 94℃预变性 3 min、94℃变性20 s、63℃退火 20 s、72℃延伸30 s,共30个循环。PCR 反应的特异性通过产物热解离曲线进行确认逆转录为 cDNA 后,运用qRT-PCR 检测。
1.2.2 Western Blot分析
用细胞裂解液提取组织总蛋白,用 BCA 蛋白定量法测定总蛋白浓度。配制分离胶(14%)和浓缩胶(5%);60 V 恒压预电泳 1 h 后上样,80 V 恒压电泳;待充分分离后将蛋白转移至 PVDF 膜上;5%脱脂奶粉封闭 1 h 后,一抗(anti-HMGA2 antibody: Abcam,GT763, 1∶1000稀释;anti-β-actin,Proteintech, 60008 -1-Ig,1∶2000稀释)4℃过夜;PBST 清洗 3 次,每次5 min;辣根过氧化物酶标记的二抗孵育(Proteintech,goat anti-mouse IgG(H+L),SA00001-1,1∶5000稀释)1 h 后,PBST 清洗 3 次,每次5 min;ECL 法显色。
1.2.3 动物模型及取材
(1)早期妊娠

注:A: Hmga2 mRNA 在早期妊娠第1~8天表达的荧光定量PCR 结果;B: Hmga2 mRNA 在妊娠第5天着床位点(5N)和非着床位点(5I)表达的荧光定量PCR 结果。数据表示表示差异有显著性(P<0.05)。图1 Hmga2 mRNA在小鼠早期妊娠子宫中的表达Note. A: qPCR analysis of Hmga2 mRNA expression on days 1-8 of pregnancy. B: qPCR analysis of Hmga2 mRNA expression at the implantation sites (5-I) and inter-implantation sites (5-N) on day 5 of pregnancy. Data are shown as (± s). Asterisks denote significance (P<0.05)Fig.1 Expression of Hmga2 mRNA in the early pregnant uteri of mice
将雌鼠与成年雄鼠按照1∶2 比例合笼,次日上午见栓标记为妊娠第1天,收集妊娠第1~8天的小鼠子宫,用生理盐水自输卵管或子宫中冲取胚胎为确认妊娠。取小鼠妊娠第5~6天的子宫时,注射1%芝加哥蓝 0.1 mL,5 min 后取子宫,着床位点血管通透性增加变为蓝色,分别收集着床位点及非着床位点组织。每组至少取材3只。
(2)延迟着床及激活
手术切除妊娠第4天雌鼠的双侧卵巢,然后妊娠第5天和第6天上午皮下注射孕酮(每只1 mg/0.1 mL)。第7天将小鼠分为两组:一组皮下注射 P4(每只1 mg/0.1 mL)为延迟着床组;另一组皮下同时注射17β雌二醇(E2,每只25 ng/0.1 mL)和P4(每只1 mg/0.1 mL)为着床激活组,分别于第8天收集子宫。1%芝加哥蓝确定着床激活组小鼠子宫着床位点。延迟着床组小鼠,冲洗一侧子宫观察是否有胚胎存在,另一侧子宫放入液氮里冷冻。每组至少3只。
(3)人工蜕膜化
健康成年未交配雌鼠与成年结扎雄鼠合笼,取假孕第4天小鼠,一侧子宫内注射50 μL芝麻油进行人工诱导蜕膜化,另一侧子宫作为对照。在假孕第8天上午处死,分别收集人工诱导蜕膜化和对照侧子宫组织,每组至少3只。
(4)卵巢类固醇激素处理
卵巢类固醇激素处理选取性成熟雌鼠,麻醉后手术切除双侧卵巢,术后恢复两周,皮下注射类固醇激素(激素均溶于芝麻油中),剂量为:①对照组:每只0.1 mL 芝麻油;②P4组:每只1 mg/0.1 mL;③E2组:每只100 ng/0.1 mL;④ P4+E2组:每只1 mg P4+100 ng E2/0.1 mL。每组至少 3 只,激素注射后24 h后分别牺牲小鼠,收集子宫取材。
1.3统计方法
2 结果
2.1Hmga2在小鼠早期妊娠子宫中的表达实验采用荧光定量PCR检测
Hmga2 mRNA 在小鼠子宫内表达量的变化。结果显示,Hmga2 mRNA 在妊娠第4~8 天逐渐增高,妊娠第4天与第7天比较差异有显著性(图1A);与非着床位点比较,Hmga2 mRNA 在妊娠第5天着床位点表达量显著增强(图1B)。Western blot与其结果一致(图2)。
2.2Hmga2在小鼠延迟着床及激活子宫中的表达检测Hmga2mRNA
在延迟着床及激活小鼠子宫中的表达,表明雌激素可激活胚泡着床,使Hmga2表达量显著高于延迟着床小鼠(图3)。
2.3Hmga2在小鼠子宫蜕膜化过程中的表达
通过人工诱导蜕膜化表明Hmga2在人工诱导蜕膜化子宫组织中高表达,人工诱导组与对照组表达差异有显著性(图4)。妊娠第4天小鼠子宫分离的子宫基质细胞经雌激素和孕酮联合处理可诱导基质细胞蜕膜化。
2.4类固醇激素对Hmga2表达的调控
在卵巢摘除小鼠子宫中当卵巢摘除小鼠皮下注射雌激素24 h后,皮下注射孕酮可刺激Hmga2的表达显著增加。联合注射雌激素和孕酮,Hmga2在子宫中的表达量增加。皮下注射雌激素后Hmga2表达增加,但差异无显著性(图5)。

注:Hmga2在小鼠早期妊娠第1~6天子宫中的表达;I:着床点,N:非着床点。图2 HMGA2在小鼠早期妊娠子宫中的表达Note. Expression of HMGA2 on days 1-6 of pregnancy; I: Implantation sites, N: Inter-implantation sites.Fig.2 Expression of HMGA2 in the early pregnant uteri of mice

图3 Hmga2在小鼠延迟着床及激活子宫中的表达Fig.3 Expression of Hmga2 in delayed implantation and activation of uteri in the mice

图4 Hmga2在人工诱导蜕膜化子宫中的表达Fig.4 Expression of Hmga2 under artificial decidualization
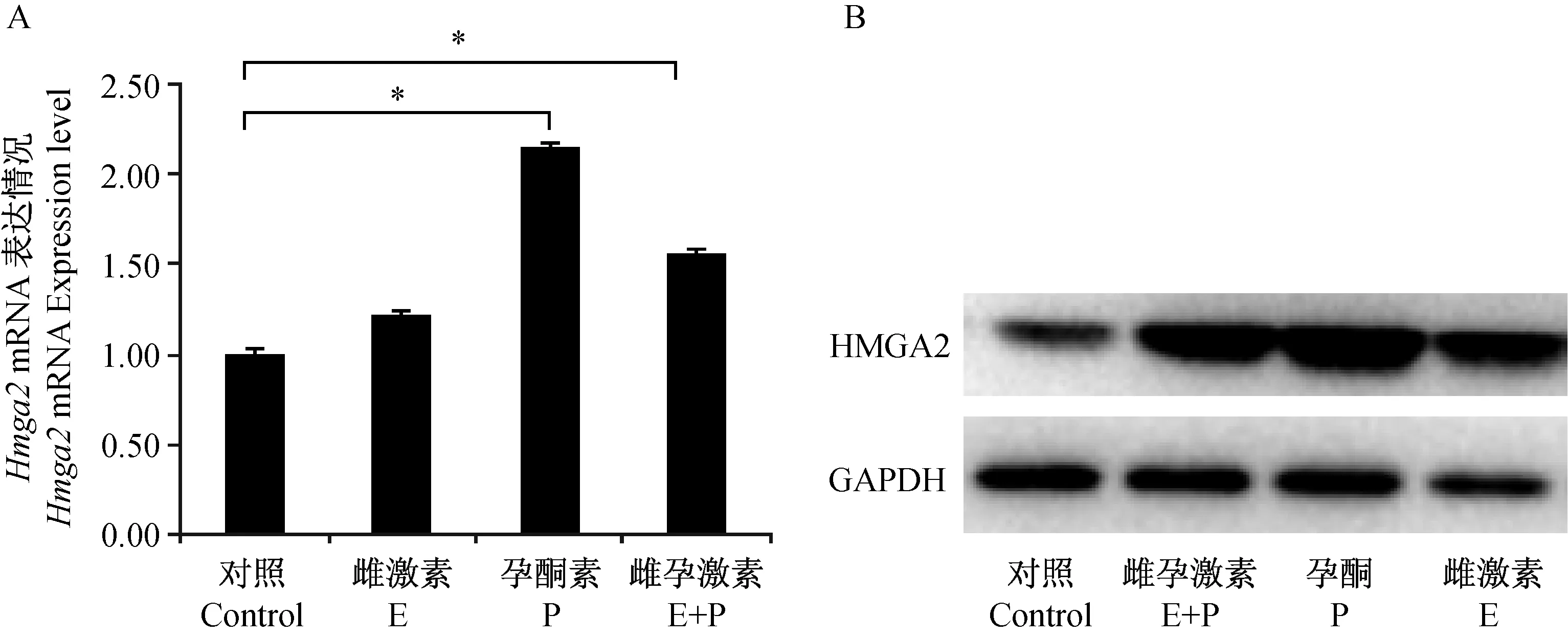
图5 卵巢摘除小鼠类固醇激素处理24 h后,Hmga2在子宫中的表达Fig.5 Hmga2 expression in the uteri of mice after ovariectomy and treated with steroid hormones for 24 h
3 讨论
在人和小鼠妊娠过程中,蜕膜组织主要为胚胎提供营养物质,并且可形成屏障防止滋养层细胞的过度入侵[16,17],蜕膜组织正常发育对成功妊娠起主导作用。相关的研究表明,一些信号通路和关键的调控分子参与胚胎植入后期蜕膜组织的发育[18]。全基因组关联分析(GWAS)中HMGA2基因为PCOS 易感基因,而PCOS患者又出现低妊娠率和高流产率的问题,并且HMGA2在PCOS子宫内膜组织中表达升高,增殖分化是子宫内膜基质细胞蜕膜化的前提条件,而HMGA2基因与生长增殖密切相关,所以研究HMGA2在子宫内膜容受性中的作用至关重要。HMGA2在胚胎发育阶段各组织中均高表达,起到了促进正常心脏发育、神经干细胞自我更新、调节细胞分化等多种作用,而在正常成人组织中则基本不表达,仅少量见于CD34+造血干细胞,子宫肌母细胞及睾丸细胞中[19]。本研究表明Hmga2在妊娠第3~8 天逐渐增高,与非着床位点比较,Hmga2妊娠第5天着床位点表达量显著增强,提示子宫中Hmga2的表达可能与小鼠早期妊娠胚胎着床过程密切相关。Hmga2在伴随着妊娠开始表达量逐渐增加。粘附反应开始于妊娠第5天午夜,此时伴随着子宫内膜血管局部增强的渗透力,完成粘附反应之后,穿过腔上皮到达基质细胞层,该基因在胚胎着床过程子宫中的定位如何,子宫组织不同位置是否存在表达差异有待进一步研究。
胚胎着床到子宫内膜是成功妊娠的关键,胚胎着床后子宫内膜开始发生蜕膜化,异常的蜕膜化可导致一些妊娠并发症及流产的发生[20],人工诱导蜕膜化组与对照组表达差异极显著表明,假孕第8天小鼠Hmga2在人工诱导蜕膜化子宫组织中高表达;胚胎激活和延迟着床组表达差异显著,表明该基因受活化胚泡的影响。在妊娠第 6~8 天子宫基质细胞发生大量的增殖,并分化为多倍体的蜕膜细胞[21]。子宫基质细胞正常发生蜕膜化对成功的胚胎着床是必要的,因为蜕膜组织可为胚胎发育提供充足的营养物质,同时还具有抑制母体免疫反应发生以及调控滋养层入侵子宫内膜等功能[18,22]。
子宫内膜容受性建立机制极其复杂,不仅受母体全身和局部的激素、免疫系统和各种因子表达水平的调控,而且与局部胚胎、子宫间复杂的信息交流、细胞分化发育状态有关[23],特别是类固醇激素对蜕膜化的启动和维持起重要的调节作用。在正常小鼠妊娠期间,雌二醇(E2)在妊娠第1天(D1)的峰值会刺激子宫内膜上皮细胞的增生,而在D2随着水平的降低,上皮细胞则开始调亡,在D3刚刚开始形成的黄体则会分泌孕酮(P4),使子宫内膜基质细胞开始增生。D4则E2峰值会与高水平的相联合,刺激子宫基质细胞增生并且使子宫进入容受性,以便于胚胎着床[24]。孕酮主要通过与其受体PR 结合发挥作用[25]。在本研究中孕酮和雌激素均可诱导卵巢摘除小鼠子宫Hmga2的表达,说明该基因在子宫蜕膜化反应中受雌孕激素调节并呈现正相关。当胚泡粘附在子宫腔上皮后,围绕在着床胚胎周围的子宫基质细胞经历大量增殖,随后分化为蜕膜细胞,子宫基质细胞发生蜕膜化是以高水平表达蜕膜化分化分子和典型的形态学变化为主要特征[26]。Hmga2基因在体外过表达或降调对子宫内膜容受性相关基因的表达有何影响,该基因在高雄激素状态下表达有何改变,是否伴随着体内外相关因子的变化有待进一步研究。
在子宫内膜容受窗口期中,子宫内膜上皮分泌活动最为活跃,为胚胎着床提供一个合适的宫腔内环境,子宫内膜上皮是与胚胎最先接触的子宫内膜成分,参与胚胎在子宫内膜上的定位、粘附与侵入。本研究着重研究了Hmga2对小鼠蜕膜化过程中的作用,Hmga2的表达与小鼠早期妊娠胚胎着床过程密切相关,参与子宫内膜蜕膜化过程,受活化胚泡的影响和类固醇激素的调控。
[1] Ehrmann DA. Polycystic ovary syndrome [J]. N Engl J Med, 2005, 352(12): 1223-1236.
[2] Goodarzi MO, Azziz R. Diagnosis, epidemiology, and genetics of the polycystic ovary syndrome [J]. Best Pract Res Clin Endocrinol MeTab, 2006, 20(2):193-205.
[3] Chaen T, Konno T, Egashira M, et al. Estrogen-dependent uterine secretion of osteopontin activates blastocyst adhesion competence [J]. PLoS One, 2012, 7(11): 48933.
[4] Chian RC. In-vitro maturation of immature oocytes for infertile women with PCOS [J]. Reprod Biomed Online, 2004, 8(5): 547-552.
[5] 龚斐, 郭慧, 彭炬等. 改良超长方案改善多囊卵巢综合征(PCOS)不孕患者子宫内膜容受性的研究 [J]. 生殖与避孕, 2015, 35(5): 300-309.
[6] Dey SK, Lim H, Das SK, et al. Molecular cues to implantation [J]. Endocr Rev, 2004, 25(3): 341-373.
[7] Collins MK, Tay CS, Erlebacher A. Dendritic cell entrapment within the pregnant uterus inhibits immune surveillance of the maternal/fetal interface in mice [J]. J Clin Invest, 2009, 119(7): 2062-2073
[8] Reeves R, Nissen MS. The A.T-DNA-binding domain of mammalian high mobility group I chromosomal proteins. A novel peptide motif for recognizing DNA structure [J]. J Biol Chem, 1990, 265(15): 8573-8582.
[9] Fusco A, Fedele M. Roles of HMGA proteins in cancer [J]. Nat Rev Cancer, 2007, 7(12): 899-910.
[10] Young AR, Narita M. Oncogenic HMGA2: short or small? [J]. Genes Dev, 2007, 21(9): 1005-1009
[11] Hock R, Furusawa T, Ueda T, et al. HMG chromosomal proteins in development and disease [J]. Trends Cell Biol, 2007, 17(2): 72-79.
[12] White A, Flores A, Ong J, et al.Hmga2 is dispensable for cutaneous squamous cell carcinoma [J]. Exp Dermatol, 2016, 25(5): 409-419.
[13] Eide HA, Halvorsen AR, Bjaans MM, et al. TheMYCN-HMGA2-CDKN2A pathway in non-small cell lung carcinoma-differences in histological subtypes [J]. BMC Cancer, 2016, 16(1): 71.
[14] Wu J, Wei JJ.HMGA2 and high-grade serous ovarian carcinoma [J]. J Mol Med (Berl), 2013, 91(10): 1155-1165.
[15] Galdiero F, Romano A, Pasquinelli R, et al. Detection of high mobility group A2 specific mRNA in the plasma of patients affected by epithelial ovarian cancer [J]. Oncotarget, 2015, 6(22): 19328-19335.
[16] Zhang S, Lin H, Kong S, et al. Physiological and molecular determinants of embryo implantation [J]. Mol Aspects Med, 2013, 34(5): 939-980.
[17] Wang Q, Lu J, Zhang S, et al. Wnt6 is essential for stromal cell proliferation during decidualization in mice [J]. Biol Reprod, 2013, 8(1): 5.
[18] Cha JM, Dey SK. Reflections on rodent implantation [J]. Adv Anat Embryol Cell Biol, 2015, 216: 69-85.
[19] Cleynen I, Van de Ven WJ. The HMGA proteins: a myriad of functions (Review) [J]. Int J Oncol, 2008, 32(2): 289-305.
[20] Jiang Y, Liao Y, He H, et al. Fox M1 directs STAT3 expression essential for human endometrial stromal decidualization [J].Sci Rep, 2015, 5: 13735.
[21] Zhang S, Lin H, Kong S, et al. Physiological and molecular determinants of embryo implantation [J]. Mol Aspects Med, 2013, 34(5): 939-980.
[22] Peng J, Monsivais D, You R, et al. Uterine activin receptor-like kinase 5 is crucial for blastocyst implantation and placental development [J]. Proc Natl Acad Sci U S A, 2015, 112(36): 5098-5107.
[23] Singh M, Chaudhry P, Asselin E. Bridging endometrial receptivity and implantation: network of hormones, cytokines, and growth factors [J]. Endocrinol, 2011, 210(1): 5-14.
[24] Carson DD, Bagchi I, Dey SK, et al Embryo implantation [J]. Dev Biol, 2000, 23(2): 217-37.
[25] Large MJ, De Mayo FJ. The regulation of embryo implantation and endometrial decidualization by progesterone receptor signaling [J]. Mol Cell Endocrinol, 2012, 358(2): 155-165.
[26] Tawadros N, Salamonsen LA, Dimitriadis E, et al. Facilitation of decidualization by locally produced ghrelin in the human endometrium [J]. Mol Hum Reprod, 2007, 13(7): 483-489.
ExpressionandregulationofPCOSsusceptiblegeneHmga2inmouseuterinedecidualization
CAO Yong-zhi1,2, ZHAO Yue-ran2, LIN De-gui1*
(1. College of Veterinary Medicine, China Agriculture University, Beijing 100193, China; 2. Center for Reproductive Medicine, Shandong University, Jinan 250021)
ObjectiveTo study the expression and regulation of polycystic ovary syndrome (PCOS) susceptibility geneHmga2 in endometrial receptivity and decidualization.MethodsExperiments including early pregnancy, delayed implantation and activation, artificial decidualization and ovarian steroid hormone treatment were performed, and Q-PCR and Western blot analyses were applied to explain the role ofHmga2 in endometrial receptivity.ResultsTheHmga2 expression increased gradually with pregnancy. Its expression at the implantation site was significantly higher than that at the inter-implantation site,in the embryo activation group than in delayed implantation group, and in the artificial decidualization than the non-decidualization. The expression ofHmga2 was positively correlated with the expression of estrogen and progesterone, and was positively regulated by estrogen and progesterone in vivo.ConclusionsOur findings indicate that the expression ofHmga2 is closely related to the embryo implantation process in early pregnancy in mice, is involved in the process of endometrial decidualization, and is influenced by the activated blastocyst and steroid hormones.
Polycystic ovary syndrome; PCOS;Hmga2; Decidualization; Embryos; Mouse
LIN De-gui. E-mail: csama@sina.com
Q95-33
A
1005-4847(2017) 05-0473-06
10.3969/j.issn.1005-4847.2017.05.002
2017-02-28
国家自然科学基金项目(编号:31572578)。
曹永芝(1983-),男,博士研究生,实验师,专业:临床兽医。Email: yz_cao@163.com
林德贵(1961-),男,教授,研究方向:小动物疾病。Email: csama@sina.com

