介孔硅纳米粒超声影像及治疗研究进展
莫新海 综述,张 波 审校
(同济大学附属东方医院医学超声科,上海 200120)
介孔硅纳米粒超声影像及治疗研究进展
莫新海 综述,张 波*审校
(同济大学附属东方医院医学超声科,上海 200120)
介孔硅纳米粒热/化学稳定性强,比表面积大,表面易于修饰,可改善其性能并赋予新的功能。且介孔硅纳米粒的粒径、形貌、结构等可控,在医学领域引起广泛关注。本文对介孔硅纳米粒在超声影像和超声治疗方面的研究进展进行综述。
介孔硅;超声检查;超声治疗
超声检查具有便捷、低价、无电离辐射、非侵入性实时及快速成像等优势。超声造影剂可提高超声图像信噪比和对比度,增强高强度聚焦超声(high intensity focused ultrasound, HIFU)的热效应、空化效应及疗效。目前临床常用脂质和蛋白质作为制备超声造影剂的材料,但上述有机材料热/化学稳定性差、抗压强度低且易破裂,导致血循环半衰期短。与有机材料相比,无机材料介孔硅因耐腐蚀、热/化学稳定性强、比表面积大且适合载药的特点而备受关注[1];介孔硅纳米粒可降解为单体硅酸和聚合硅酸等无毒产物[2],并已通过美国食品和药品管理局(Food and Drug Administration, FDA)的安全认证[1]。介孔硅纳米粒表面有丰富的羟基,易于进行修饰,修饰后可改善纳米粒血液相容性、延长血池循环时间[3],也可赋予纳米粒多模态成像[4]、靶向分子造影[5]、控制性释药[6-7]等新功能。且介孔硅纳米粒的粒径大小、形状外貌及孔道结构具有良好的可调控性。本文对介孔硅纳米粒在超声影像及超声治疗领域的研究进展进行综述。
1 介孔硅纳米粒的基本特征及制备
根据国际纯粹与应用化学协会的定义[8],孔径<2 nm的孔称为微孔,孔径>50 nm的孔称为大孔,孔径在2~50 nm之间则称为介孔。介孔材料指含有介孔的材料,相比于其他孔径的材料,介孔材料具有较大的比表面积和孔体积。现将介孔硅纳米粒制备方法介绍如下。

图1 化学刻蚀法制备具有中空介孔结构的纳米硅粒[10-11] A.中空介孔硅纳米粒透射电镜图; B.中空介孔硅纳米粒扫描电镜图; C.刻蚀过程中调整中空介孔硅纳米粒孔径的示意图
1.1 软模板法 软模板法是以表面活性剂为模板合成介孔材料的方法。表面活性剂是两亲性分子,在水溶液中,亲水基朝外,倾向于接触水;疏水基朝里,倾向于离开水;自行组装成稳定的超分子结构——胶束。不同性质的表面活性剂可形成不同形状的胶束;以胶束为模板,通过静电、氢键及配位键等与无机硅相互作用,引导前驱体间进行缩合反应[8]。而后选择合适的方法脱去模板,即可获得相应形貌的介孔结构。
1.2 硬模板法 硬模板法采用硬模板材料(如聚苯乙烯球)作为空间填充物,前驱体在模板表面沉积和缩聚,不同形状的模板可形成不同形貌的模板/前驱体核壳结构,去除模板后即可获得相应形貌的介孔结构[9]。
1.3 化学刻蚀法 通过酸、碱溶液溶解或破坏Si—O—Si键,对纳米硅粒进行刻蚀,制备具有中空介孔结构的纳米硅粒(图1),即为化学刻蚀法[10-11]。采用Stöber法制备实心纳米硅粒,即“核”,并以其为模板,以十八烷基三氯硅烷为结构导向剂,与正硅酸乙酯在模板表面沉积和缩聚,形成具有介孔结构的硅壳层,即“壳”。去除“核”,留下“壳”后,即可构建具有中空结构的介孔硅纳米粒[12]。
2 介孔硅纳米粒的功能化修饰
三烷氧基有机硅烷是介孔硅材料修饰的常用原料,其通式为(R'O)3SiR,其中,R代表有机官能团,R'O代表烷氧基团[8]。修饰介孔硅纳米粒常用的方法为嫁接法和共缩聚法(图2)。嫁接法是将(R'O)3SiR与活化后的介孔硅纳米粒羟基反应,将官能团连接在介孔硅纳米粒。共缩聚法是在模板剂存在的条件下,直接向反应体系中加入四烷氧基硅烷[Si(R'O)4]和(R'O)3SiR,两者发生水解、缩聚反应,将有机官能团引入介孔硅纳米粒[8,11]。
将有机硅烷的官能团引入介孔硅纳米粒是为了进行后续的功能化修饰。如将3-氨丙基三乙氧基硅烷的氨基引入纳米粒子中,以碳二亚胺法将纳米粒子的氨基与抗体的羧基进行缩合反应,使纳米粒子获得靶向性[5]。又如将(3-巯基丙基)三甲氧基硅烷的巯基引入纳米粒子中,再与纳米金(Au)结合,可使纳米粒子获得CT和热成像功能[4];此时如再加入巯基化的PEG(mPEG-SH),mPEG-SH与Au结合,即可对纳米粒子进行PEG修饰,修饰后的纳米粒子可抑制血浆蛋白的吸附和网状内皮组织的识别,可有效延长血循环时间[13]。
3 介孔硅纳米粒在超声显像中的应用
目前,临床常用的微泡造影剂多不稳定、易破裂且粒径大,难以从循环血池中通过血管内皮屏障渗出而聚集在肿瘤部位[5]。为构建稳定性强、单分散性的纳米级造影剂,Yildirim等[14]制备疏水性介孔硅纳米粒(mesoporous silica nanoparticles with hydrophobic surface functionalization, hMSN)后,采用两亲性聚合物F127包裹hMSN,构建平均粒径约100 nm的造影剂P-hMSN;并发现在HIFU作用下,P-hMSN内气体产生空化效应,可增强超声散射,从而实现超声造影;此外,该实验还证实在无HIFU辐照时,P-hMSN不会产生背景信号。尽管P-hMSN会产生溶血效应,但可忽略不计;同时,P-hMSN性质稳定,易于储藏。虽然P-hMSN具有诸多优势,但需高机械指数(mechanical index, MI)的HIFU激发,该MI值(MI=9.4)远超过FDA规定的诊断应用推荐值(MI≤1.9)[15]。Jin等[15]采用软模板法合成介孔硅纳米粒,再以全氟十七烷三甲基氧硅烷对纳米粒进行修饰,构建疏水性纳米粒子(perfluorodecyltriethoxysilane-modified mesoporous silica nanoparticles, F-MSN),并发现F-MSN可在MI=0.6、频率7.5 MHz超声波激发下产生气泡,增强超声散射,实现超声造影;且当MI=1.0时,超声造影时间可长达至少30 min。
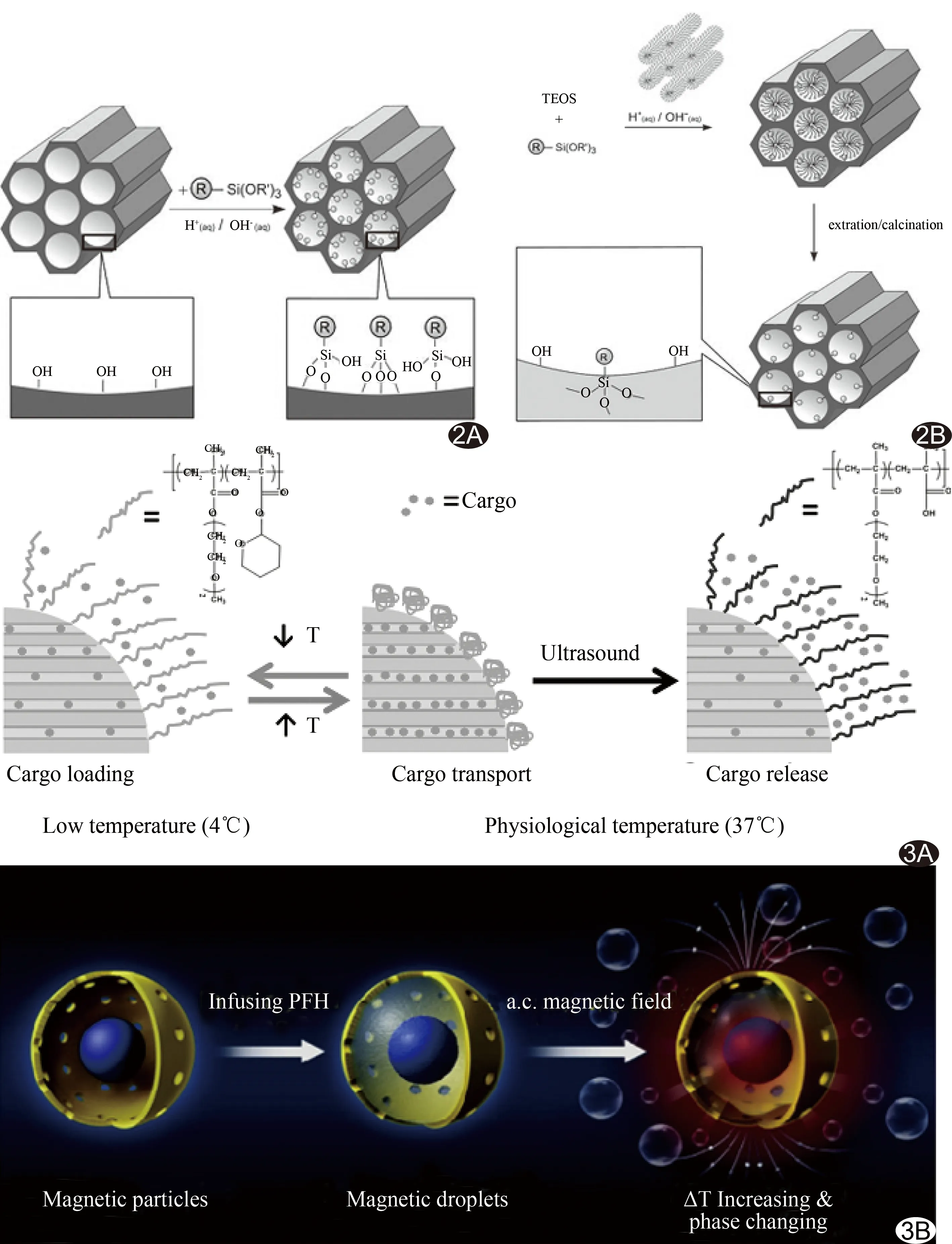
图2 采用嫁接法和共缩聚法修饰介孔硅纳米粒[8] A.介孔硅合成后功能化修饰,采用嫁接法将有机硅烷连接于介孔硅上; B.介孔硅合成时直接功能化修饰,采用共缩聚法对介孔硅进行有机化修饰 图3 介孔硅纳米粒释药系统与磁响应系统工作机制[6,22] A.介孔硅纳米粒双重响应释药系统反应过程示意图; B.载PFH磁性介孔硅纳米粒合成过程及在交变磁场中响应过程示意图
靶向超声造影剂是将配体分子连接在造影剂上,利用配体特异性结合表达相应受体的细胞或组织,增强超声造影的特异性。Milgroom等[5]采用10%盐酸活化介孔硅纳米粒羟基,通过嫁接法将3-氨丙基三乙氧基硅烷与纳米粒相连接,从而引入氨基官能团,获得氨基纳米粒,再以碳二亚胺法连接赫赛汀,获得靶向纳米粒MSN-Herceptin。MSN-Herceptin可选择性地黏附于高表达HER2+的乳腺癌细胞,且平均像素密度高,可获得高质量的超声图像。
干细胞移植作为再生医学的一种治疗手段,具有广阔的应用前景。但能否将干细胞准确移植到病变部位,是影响干细胞治疗效果的主要因素之一。实时超声影像可作为引导干细胞治疗的备选方式。Chen等[16]通过软模板法合成了凹形结构的介孔硅纳米粒,可提供更有效的背散射界面,增强超声信号,实现干细胞超声示踪。干细胞移植区发生缺血及炎性反应[17],可导致干细胞死亡,影响治疗效果。为提高干细胞的生存率,Kempen等[18]制备载Gd和IGF的介孔硅纳米粒,发现摄取这种纳米粒的干细胞可用于超声、MRI引导下干细胞定向移植,且载IGF介孔硅纳米粒可显著提高干细胞存活率。
4 介孔硅纳米粒在超声治疗中的应用
目前癌症仍是人类死亡的首要原因。临床对肿瘤扩散和转移患者多选择化疗作为治疗手段,但化疗药物可通过循环系统在体内广泛分布,且多数化疗药物无特异性,在杀伤肿瘤细胞的同时也影响正常细胞的分裂和生长,引起多种不良反应。超声波产生的机械效应和热效应可激发纳米药物载体释药[19],从而实现药物定向释放,使有效避免化疗药物误伤正常组织成为可能,同时可协同热疗和化疗作用。何敏瑜等[20]将空心介孔硅纳米粒与DNA1链接后,装载阿霉素,再加入DNA2;DNA1与DNA2碱基互补配对,因DNA2富含鸟嘌呤,可形成G-四链体结构,将药物封装在介孔通道;HIFU辐照后,温度达到双螺旋DNA解链温度,G-四链体结构松解,实现孔道内的药物释放。Paris等[6]在介孔硅纳米粒表面嫁接聚合物poly(MEO2MA-co-THPMA),见图3A;在4℃时,聚合物呈卷曲构象,介孔通道打开,装载药物;在37℃时,聚合物呈折叠构象,介孔通道关闭,可运输药物;在超声辐照下,聚合物的构象再次改变,重新打开介孔通道,实现药物释放;此外,即使这种载药纳米粒被细胞吞噬进入细胞内,仍可对超声辐照做出响应而释放药物。Dabbagh等[7]将聚丙烯酰胺(polyacrylamide, PAA)包覆介孔硅纳米粒外,构建热敏药物载体(polyacrylamide-mesoporous silica core-shell nanostructure, PMSN)。PAA的起始凝胶温度高于人体生理温度,因而在人体生理温度下,药物释放效率低,从而保护正常组织免受药物不良反应影响。在聚焦超声热消融温度下,药物释放效率及速率显著增加,提示PMSN有望成为协同热疗和化疗的备选方案。
5 介孔硅纳米粒超声影像与治疗一体化应用
尽管介孔硅纳米粒可作为超声造影剂、细胞示踪剂、热敏释药载体等,但能否实现介孔硅纳米粒集合超声造影与治疗于一体成为研究热点。Wang等[21]将Au覆盖在介孔硅纳米粒表面,再依次装载模型药物和全氟己烷(perfluorohexane, PFH)后,用PEG修饰介孔硅纳米粒,构建纳米胶囊。利用Au的热学性能、PFH相变特性,纳米胶囊实现了整合超声造影、释药、HIFU消融治疗于一体。由于超声波无法穿透骨骼,且易受气体干扰,为了弥补超声影像的不足,Li等[4]通过构建巯基介孔硅纳米粒,再将Au通过巯基与纳米粒连接后装载PFH,最后mPEG-SH通过Au与纳米粒连接,合成纳米粒子HAPP,实验结果表明,HAPP具有良好的超声成像性能。因Au是高原子序数元素,可吸收X射线,并且Au能吸收近红外光谱,实验结果亦表明,HAPP具有良好的CT和热成像性能及良好的光热治疗效果。Teng等[22]为弥补骨骼及气体阻碍超声治疗的局限性,构建了载PFH及超顺磁性Fe3O4介孔硅纳米粒(PFH-encapsulated magnetic mesoporous particles with a hollow space, MDs),MDs在交变磁场的作用下,可将电磁能转变为热能,触发PFH相变;同时,MDs产生的热能可用于肿瘤热消融治疗(图3B);结果表明,在交变磁场作用2 min后,MDs温度高达77℃,PFH发生相变,显著增强超声成像信号;动物实验显示,MDs产生的热效应,可致肿瘤细胞死亡、肿瘤体积显著缩小。
6 介孔硅纳米粒超声影像及治疗存在的问题及展望
超声影像相对于其他影像技术,具有价格低、实时成像、移动便捷等优势。造影剂可提高超声图像的对比度和HIFU治疗的效果。介孔硅纳米粒以其独特的形貌结构和稳定性,在超声成像及治疗领域均具有优势。但超声成像原理决定了超声不能用于全身成像,因此介孔硅纳米粒协同超声、CT、MRI等多模态成像有望成为未来的研究热点。在治疗领域,介孔硅纳米粒可作为载药系统,得益于其中空介孔结构,但仍有一些急需解决的问题。进一步提高介孔硅纳米粒药物包封率,载药系统稳定性、靶向性及释药响应性等均可影响介孔硅纳米粒的治疗效果。相信随着对介孔硅纳米粒研究的深入,介孔硅纳米粒的应用领域将进一步扩展。
[1] Chen Y, Chen H, Shi J. In vivo bio-safety evaluations and diagnostic/therapeutic applications of chemically designedmesoporous silica nanoparticles. Adv Mater, 2013,25(23):3144-3176.
[2] He Q, Zhang Z, Gao Y, et al. Intracellular localization and cytotoxicity of sphericalmesoporous silica nano- and microparticles. Small, 2009,5(23):2722-2729.
[3] He Q, Zhang J, Shi J, et al. The effect of PEGylation of mesoporous silica nanoparticles on nonspecific binding of serum proteins and cellular responses. Biomaterials, 2010,31(6):1085-1092.
[4] Li X, Xing L, Zheng K, et al. Formation of goldnanostar-coated hollow mesoporous silica for tumor multimodality imaging and photothermal therapy. ACS Appl Mater Interfaces, 2017,9(7):5817-5827.
[5] Milgroom A, Intrator M, Madhavan K, et al. Mesoporous silica nanoparticles as a breast-cancer targeting ultrasound contrast agent. Colloids Surf B Biointerfaces, 2014,116:652-657.
[6] Paris JL, Cabaas MV,Manzano M, et al. Polymer-grafted mesoporous silica nanoparticles as ultrasound-responsive drug carriers. ACS Nano, 2015,9(11):11023-11033.
[7] Dabbagh A, Abdullah BJ, Abu Kasim NH, et al. A new mechanism of thermal sensitivity for rapid drug release and low systemic toxicity in hyperthermia and thermal ablation temperature ranges. Int J Hyperthermia, 2015,31(4):375-385.
[8] Hoffmann F, Cornelius M, Morell J, et al. Silica-basedmesoporous organic-inorganic hybrid materials. Angew Chem Int Ed Engl, 2006,45(20):3216-3251.
[9] Huang CC, Huang W, Yeh CS. Shell-by-shell synthesis of multi-shelledmesoporous silica nanospheres for optical imaging and drug delivery. Biomaterials, 2011,32(2):556-564.
[10] Wang X, Chen H, Chen Y, et al. Perfluorohexane-encapsulatedmesoporous silica nanocapsules as enhancement agents for highly efficient high intensity focused ultrasound (HIFU). Adv Mater, 2012,24(6):785-791.
[11] Chen Y, Chen H, Shi JL. Construction of homogenous/heterogeneous hollowmesoporous silica nanostructures by silica-etching chemistry: Principles, synthesis, and applications. Acc Chem Res, 2014,47(1):125-137.
[12] Chen Y, Chen H, Guo L, et al. Hollow/rattle-typemesoporous nanostructures by a structural difference-based selective etching strategy. ACS Nano, 2010,4(1):529-539.
[13] Liu J, Luo Z, Zhang J, et al. Hollowmesoporous silica nanoparticles facilitated drug delivery via cascade pH stimuli in tumor microenvironment for tumor therapy. Biomaterials, 2016,83:51-65.
[14] Yildirim A, Chattaraj R, Blum NT, et al. Stable encapsulation of air in mesoporous silica nanoparticles: Fluorocarbon-free nanoscale ultrasound contrast agents. Adv Healthc Mater, 2016,5(11):1290-1298.
[15] Jin Q, Lin CY, Kang ST, et al.Superhydrophobic silica nanoparticles as ultrasound contrast agents. Ultrason Sonochem, 2017,36:262-269.
[16] Chen F, Ma M, Wang J, et al. Exosome-like silica nanoparticles: A novel ultrasound contrast agent for stem cell imaging. Nanoscale, 2017,9(1):402-411.
[17] Nguyen PK, Lan F, Wang Y, et al. Imaging: Guiding the clinical translation of cardiac stem cell therapy. Circ Res, 2011,109(8):962-979.
[18] Kempen PJ, Greasley S, Parker KA, et al. Theranostic mesoporous silica nanoparticles biodegrade after pro-survival drug delivery and ultrasound/magnetic resonance imaging of stem cells. Theranostics, 2015,5(6):631-642.
[19] Sirsi SR, Borden MA. State-of-the-art materials for ultrasound-triggered drug delivery. Adv Drug Deliv Rev, 2014,72:3-14.
[20] 何敏瑜,冉海涛,马明,等.超声介导DNA门控空心介孔二氧化硅纳米粒的药物释放.中国医学影像技术,2015,21(2):191-195.
[21] Wang X, Chen H, Zheng Y, et al. Au-nanoparticle coatedmesoporous silica nanocapsule-based multifunctional platform for ultrasound mediated imaging, cytoclasis and tumor ablation. Biomaterials, 2013,34(8):2057-2068.
[22] Teng Z, Wang R, Zhou Y, et al. A magnetic droplet vaporization approach using perfluorohexane-encapsulated magneticmesoporous particles for ultrasound imaging and tumor ablation. Biomaterials, 2017,134:43-50.
书讯
由南昌大学第一附属医院龚洪翰教授主编,徐克、冯晓源、郭启勇三位教授任主审、戴建平教授作序的《县级医院影像科医生手册》已由人民卫生出版社出版并在全国发行。这本手册是人民卫生出版社组织编写的《全国县级医院系列实用手册》大型系列丛书之一,本书的编者除港澳台地区外,覆盖全国32个省市,读者对象主要为县级医院影像科医生,以常见病和多发病为主,突出基本理论、基本知识和基本技能;全书采用导图、流程图、示意图及表格式、条目式编写,且以病变的影像征象入手去分析病灶,鉴别病变,着重传授看片的技巧和征象分析的思路,因此适用于各个层次的影像科医生。本手册为口袋书,但其内容全面,涵盖了本专业的各个系统,构思新颖、内容丰富,指导性和实用性强。同时,手册收集了一些与影像诊断相关常用的解剖数值及临床检验的生化指标、常见的影像学“病征”和诊断用计算“公式”。因此,既可作为日常工作的手头书,又可作为平时学习的参考书。
《县级医院影像科医师手册》为32开简装本,全书约60余万字。定价58元,全国新华书店均有销售,也欢迎来函来电向购买。联系人:徐珍珍;地址:南昌市永外正街17号,南昌大学第一附属医院;邮编:330006;联系电话:0791-88693825或88692582,传真:0791-88623153。邮箱:1059245012@qq.com。
Researchprogressesofmesoporoussilicananoparticlesforultrasonicimagingandtherapy
MOXinhai,ZHANGBo*
(DepartmentofMedicalUltrasound,ShanghaiEastHospital,TongjiUniversitySchoolofMedicine,Shanghai200120,China)
Mesoporous silica nanoparticles have high thermal/chemical stability and high surface-to-volume ratio. The mesoporous silica nanoparticles can improve performance and add new function by surface modification. Therefore, mesoporous silica nanoparticles have attracted an extensive attention in medicine because their diameter, shape and construction are easily controlled. The research progresses of mesoporous silica nanoparticles for ultrasound imaging and ultrasound guided therapy were reviewed in this article.
Mesoporous silica; Ultrasonography; Ultrasonic therapy
10.13929/j.1003-3289.201704073
R445.1
A
1003-3289(2017)10-1470-05
国家自然科学基金面上项目(81571693)。
莫新海(1989—),男,广东英德人,在读硕士,医师。研究方向:超声诊断及治疗。E-mail: alpha0919@126.com
张波,同济大学附属东方医院医学超声科,200120。E-mail: zhangbodongfang@qq.com
2017-04-14
2017-07-11

