2013—2016年胆道感染病原菌分布及耐药性分析
薛海玲,孙兰菊,房杰,陈明慧
论著
2013—2016年胆道感染病原菌分布及耐药性分析
薛海玲,孙兰菊,房杰,陈明慧
目的:分析2013年—2016年天津市南开医院胆道感染患者胆汁病原菌分布及对抗生素的耐药性。方法:采用VITEK-2 compact微生物全自动分析仪进行细菌鉴定及药敏试验,并采用WHONET5.6软件进行分析。结果:胆汁培养阳性检出率为55.53%(2631/4738)。非重复临床分离的4539株病原菌中,革兰阴性菌占62.02%,革兰阳性菌占36.90%,真菌占1.08%。前6位致病菌是大肠埃希菌(26.06%)、肺炎克雷伯菌(11.87%)、屎肠球菌(10.58%)、粪肠球菌(10.22%)、铜绿假单胞菌(4.30%)和阴沟肠杆菌(3.90%)。大肠埃希菌和肺炎克雷伯菌的ESBLs检出率分别为54.27%和31.54%。碳青霉烯类耐药的大肠埃希菌和肺炎克雷伯菌的检出率为0.76%和0.93%。碳青霉烯类耐药的铜绿假单胞菌和鲍曼不动杆菌检出率分别为38.46%和28.97%。万古霉素耐药的屎肠球菌检出率0.63%。甲氧西林耐药的金黄色葡萄球菌(MRSA)及甲氧西林耐药的凝固酶阴性的葡萄球菌(MRCNS)检出率分别为56.04%和76.79%。结论:胆道感染患者病原菌以肠源性细菌为主,广泛耐药细菌种类逐渐增多,出现了广泛耐药的铜绿假单胞菌和鲍曼不动杆菌,碳青霉烯类耐药的大肠埃希菌和肺炎克雷伯菌,并且出现了万古霉素耐药的肠球菌。
胆道感染;胆汁;病原菌;耐药性
胆道感染是临床外科的常见疾病和多发病,抗菌药物的使用是仅次于手术的重要治疗措施。近年来,随着抗生素的广泛使用,细菌耐药性逐渐增强,给临床治疗增加了难度。为了指导临床合理选择和使用抗生素以及改善胆道感染的预后,现对我院2013年5月—2016年4月3年间胆道感染病原菌分布及耐药性的检测结果分析报道如下。
1 材料与方法
1.1 标本及菌株来源4539株病原菌分离自2013年5月—2016年4月天津市南开医院住院患者胆道感染标本,同一患者剔除重复分离菌株。
1.2 菌株鉴定及药敏采用VITEK-2compact微生物全自动分析仪进行细菌鉴定及药敏试验。采用K-B法做头孢哌酮/舒巴坦和米诺环素的药敏试验。
1.3 质控菌株阴沟肠杆菌ATCC 700323,大肠埃希菌ATCC 25922,肺炎链球菌ATCC 49619,金黄色葡萄球菌ATCC 29213,并按照CLSI2012年规定的折点进行结果判断。
1.4 统计学处理数据采用WHONET5.6软件进行分析。采用SPSS19.0软件进行统计分析。
2 结果
2.1 病原菌分布胆汁培养阳性检出率为55.53%(2631/4738)。对2013—2016年胆汁标本阳性率进行逐年统计,并采用卡方检验中的chi-square检验方法,可知P>0.01。从总的趋势看,随着年份的增加,阳性率没有显著差异,均维持在54.00%~56.00%的高水平。见表1。在4539株非重复临床分离病原菌中,革兰阴性菌2815株,占62.02%;革兰阳性菌1675株,占36.90%;真菌49株,占1.08%。位于前5位的革兰阴性菌分别为大肠埃希菌、肺炎克雷伯菌肺炎亚种、铜绿假单胞菌、阴沟肠杆菌和鲍曼不动杆菌,分别占总病原菌的26.02%、11.87%、4.30%、3.90%和2.40%;位于前5位革兰阳性菌分别为屎肠球菌,粪肠球菌、表皮葡萄球菌、铅黄肠球菌和溶血葡萄球菌,分别占总病原菌的10.58%、10.22%、2.45%、1.52%和1.50%;真菌均为假丝酵母菌,占1.08%,以白色假丝酵母菌和热带假丝酵母菌为主,分别占0.51%和0.35%。见表2。厌氧菌4株,占0.09%。
2.2 病原菌的耐药监测肠杆菌科:大肠埃希菌和肺炎克雷伯菌的超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)检出率分别为54.27%和31.54%。这两种菌对碳青霉烯类抗生素耐药率较低,均小于1%,其中检出碳青霉烯类耐药的大肠埃希菌9株,检出率为0.76%,碳青霉烯类耐药的肺炎克雷伯菌5株,检出率为0.93%。阴沟肠杆菌对常见抗菌药物耐药率较高,AmpC检出率41.18%,对碳青霉烯类抗生素较敏感,仅检出1株碳青霉烯类耐药的菌株。阴沟肠杆菌对头孢吡肟、哌拉西林/他唑巴坦、阿米卡星、庆大霉素、妥布霉素、左氧氟沙星、环丙沙星和复方新诺明较敏感,耐药率均低于10%。此次检测共检出碳青霉烯类耐药的肠杆菌(carbapenem resistant enterobacteriaceae,CRE)共15株。
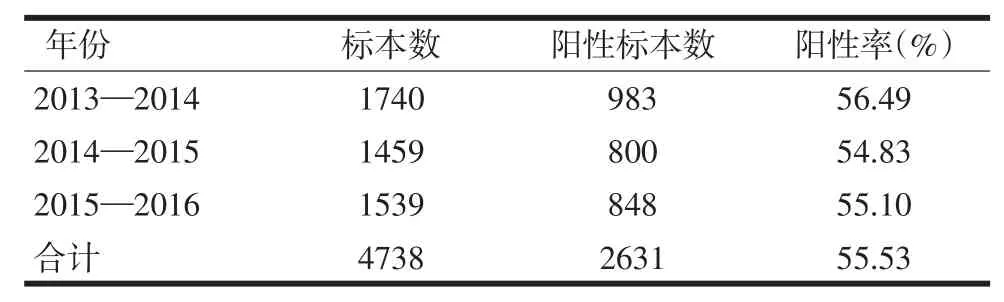
表1 2013—2016年4738例胆汁标本微生物培养阳性率
非发酵菌:铜绿假单胞菌对阿米卡星、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星及头孢吡肟的耐药率均低于20%。碳青霉烯类耐药的铜绿假单胞菌(carbapenem resistant pseudomonas aeruginosa,CRPA)检出率为38.46%,检出8株广泛耐药的铜绿假单胞菌(extensively drug resistant pseudomonas aerugino Sa,XDR-PA)。碳青霉烯类耐药的鲍曼不动杆菌(carbapenem resistant acinetobacter baumannii,CRAB)检出率为28.97%,检出1株广泛耐药的鲍曼不动杆菌(extensively drug resistant acinetobacter baumannii,XDR-AB)。CRAB对米诺环素及替加环素仍保持低耐药率,分别是3.70%和0%。见表3。
肠球菌属:屎肠球菌对多种抗生素耐药率高于粪肠球菌,粪肠球菌对青霉素和氨苄西林的耐药率分别为20.69%和20.47%,屎肠球菌分别为55.00%和51.25%。屎肠球菌对万古霉素耐药率为0.63%,未发现对利奈唑胺耐药的菌株;粪肠球菌对利奈唑胺的耐药率分别为0.43%,未发现对万古霉素耐药的菌株。见表4。
葡萄球菌属:甲氧西林耐药的金黄色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)及甲氧西林耐药的凝固酶阴性的葡萄球菌(methicillin resistant staphylococcus coagulase negative,MRCNS)的检出率分别为52.27%和72.26%。未检出万古霉素、利奈唑胺和替加环素耐药的葡萄球菌,未检出喹努普汀/达福普汀耐药的金黄色葡萄球菌,检出4株喹努普汀/达福普汀耐药的凝固酶阴性葡萄球菌。见表4。
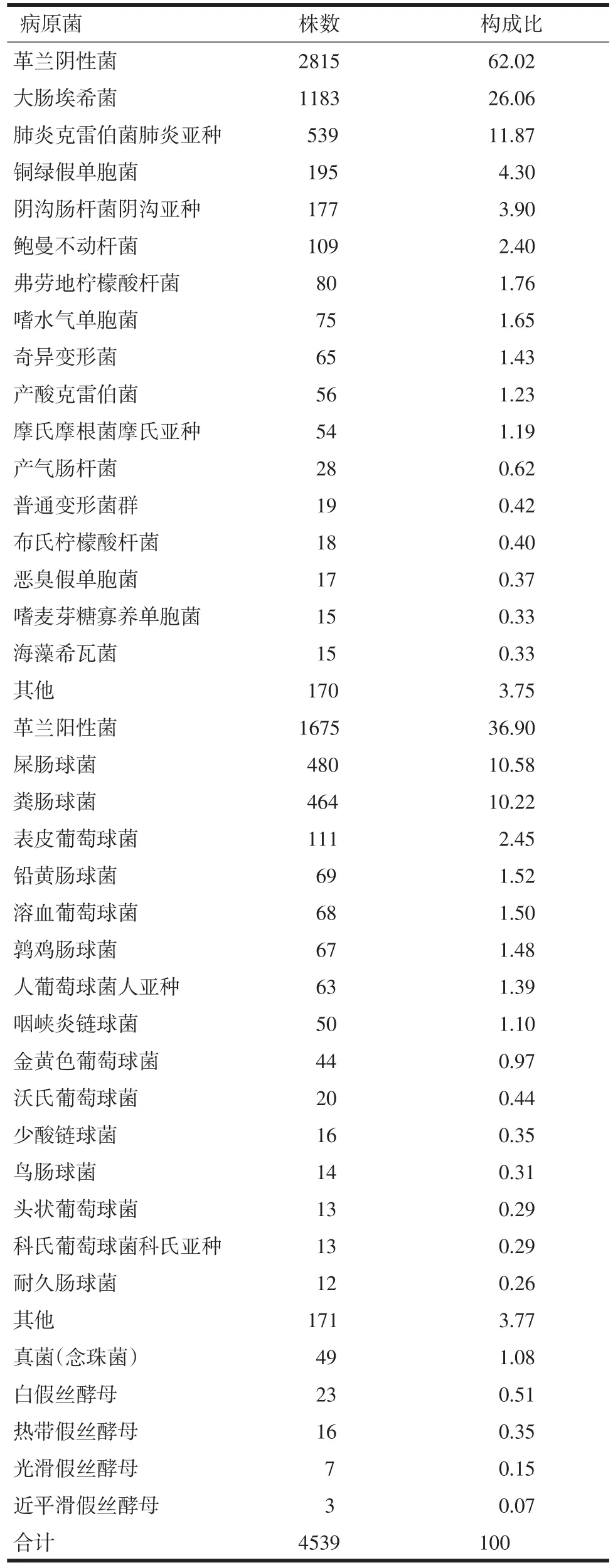
表2 2013—2016年胆道感染病原菌分布(n,%)
真菌:胆道感染检出真菌均为假丝酵母菌,其对真菌药物的耐药率仍保持较低水平。见表5。
3 讨论
为合理使用抗菌药物,我院采取一系列有效措施提高微生物标本送检率。腹腔感染标本中,胆汁标本相对于其他体液标本来说,数量最多,病原菌检出率较高[1]。监测表明,我院近3年胆汁培养阳性检出率55.53%,介于文献报道的42.2%和69.80%之间[2-3]。这可能与我院以创伤性手术数量多,且擅长急腹症治疗等相关。
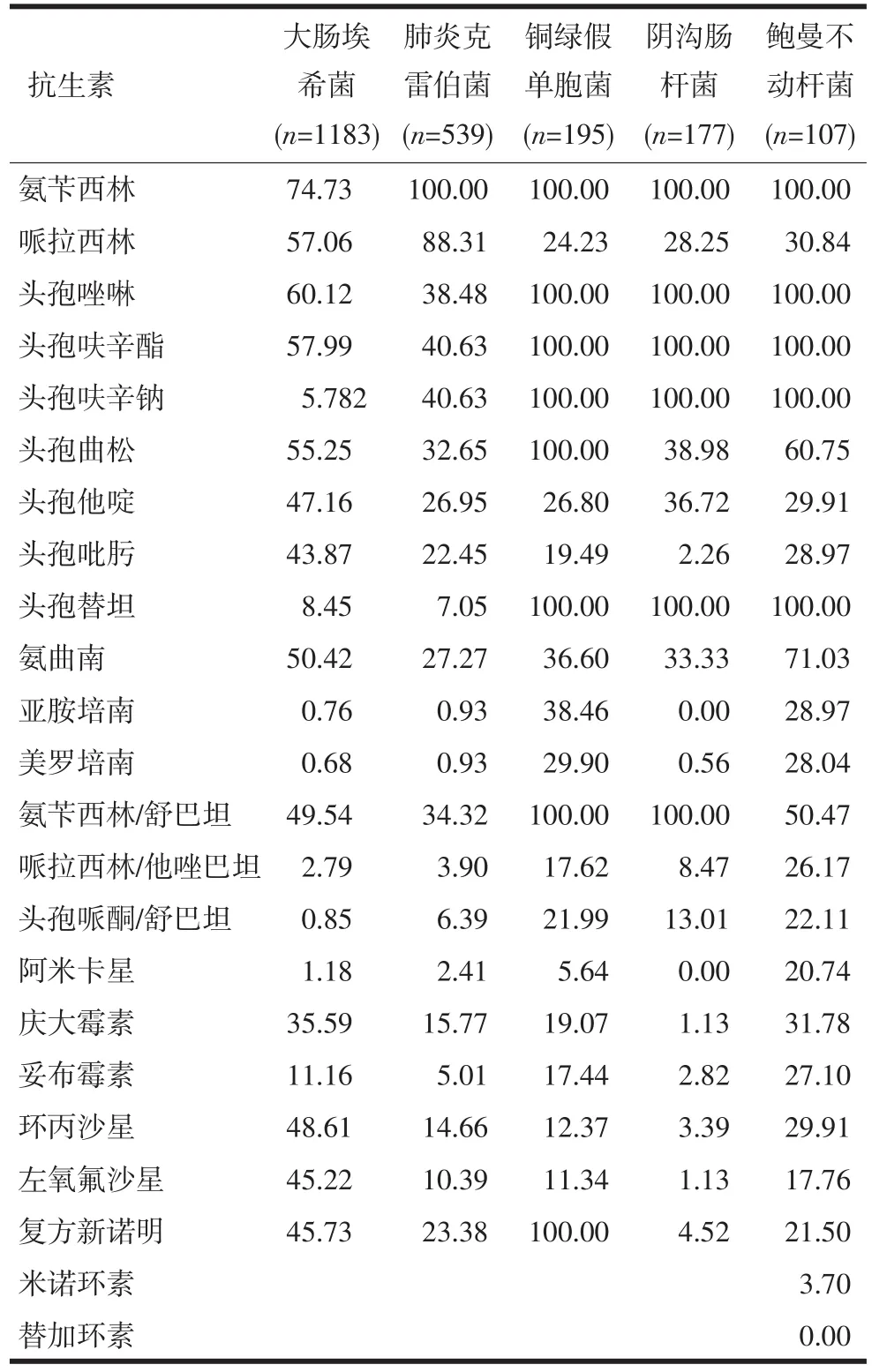
表3 主要革兰阴性杆菌对常用抗菌药物的耐药率(%)
胆汁在正常情况下是无菌的。当胆道结石、寄生虫、增生性狭窄、肿瘤或其他外源性原因等引起胆道阻塞时,肠道病原菌容易逆行经血液或淋巴系统进入胆道,进而引起胆道系统继发感染。因此,胆道感染的病原菌多与肠道菌群分布具有相关性[4-5]。
本研究表明,胆道感染中革兰阴性杆菌占优势,革兰阳性球菌、真菌比例相对较低。革兰阴性杆菌中占比第一位和第二位的分别是大肠埃希菌和肺炎克雷伯菌;革兰阳性球菌中位于首位的是肠球菌属。该监测结果与2011年卫生部全国细菌耐药监测网报道一致[6],这也与肠道细菌种类及分布相关。铜绿假单胞菌和鲍曼不动杆菌的检出率均低于2011年全国检测水平,但是在我院病原菌中检出率相对较高,应引起重视。一些胆汁中少见的细菌如嗜麦芽窄食单胞菌和嗜水气单胞菌等病原菌也有较多的检出。胆道真菌感染中白色假丝酵母菌占优势,可能与白色念珠菌菌丝和芽管不易被吞噬,粘附性强,易引起感染有关[7]。厌氧菌检出率较低,可能与我院送检胆汁标本多为需氧培养有关。监测还显示,两种以上病原菌标本数占总阳性标本的61.92%。提示胆道感染多为混合感染,增加了病情的复杂性和难治性。
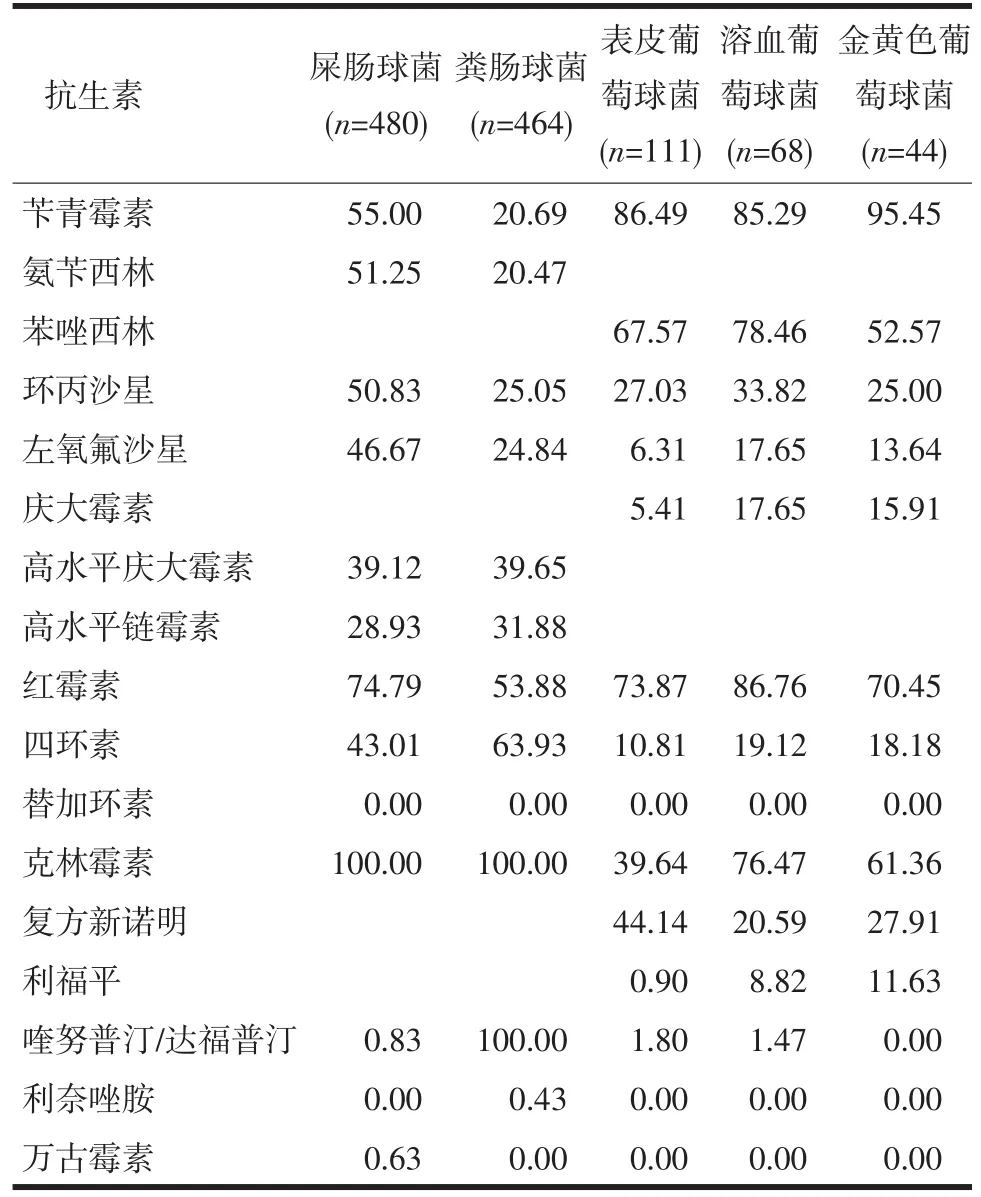
表4 葡萄球菌及肠球菌对常用抗菌药物的耐药率(%)
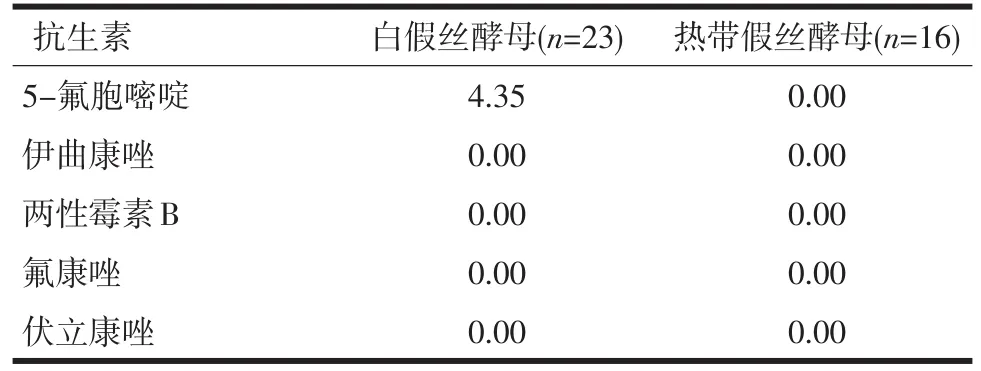
表5 真菌对常用药物的耐药率(%)
在革兰阴性杆菌中,大肠埃希菌和肺炎克雷伯菌的ESBLs检出率分别为54.27%和31.54%。其ESBLs基因型中,CTX-M仍占重要位置,与bla CTX-M是世界及中国主要流行的ESBLs型这一结论相符。质粒传播在CTX-M型ESBLs的广泛流行中起关键作用。大肠埃希菌的整体耐药率高于肺炎克雷伯菌,两种菌对碳青酶烯类药物仍比较敏感,CRE检出率分别为0.76%和0.93%。碳青霉烯类耐药的同时对其他多种药物表现出多重耐药性。广泛耐药的肺炎克雷伯菌检出率高于大肠埃希菌,这增加了临床治疗难度。目前研究发现肠杆菌科细菌对碳青霉烯类耐药的主要机制有两种,一是产生碳青霉烯酶,包括KPC酶、IMI酶和金属酶,二是与药物转运相关的外膜通道蛋白的缺失或数量减少有关。此外,伴或不伴高水平的β内酰胺酶(AmpC酶、ESBLs等)的产生也起了一定作用,产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类药物耐药的主要机制[8-9]。阴沟肠杆菌AmpC的检出率为41.18%,并发现1株碳青霉烯类耐药菌株。高产AmpC酶的产生是阴沟肠杆菌对除第四代头孢菌素和碳青霉烯类以外的几乎所有β-内酰胺类抗生素耐药的主要原因,较长时间使用β-内酰胺类抗生素是导致高产AmpC酶阴沟肠杆菌感染的临床主要危险因素[10]。临床应予以重视,合理使用抗生素。
在非发酵革兰阴性杆菌中,占首位的铜绿假单胞菌的检出率和CRPA检出率均低于2011年全国水平[6]。铜绿假单胞菌对哌拉西林、头孢他啶、头孢吡肟、美罗培南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、氨基糖苷类及喹诺酮类等抗菌药物耐药率均在30%以内。对阿米卡星耐药率最低,可能与其对多数氨基糖苷类钝化酶比较稳定,不易产生耐药性有关[11]。铜绿假单胞菌对碳青霉烯类耐药的机制通常不是由单一因素造成的,不同耐药机制之间也可以相互影响。文献报道铜绿假单胞菌对碳青霉烯类耐药,但对头孢他啶(或头孢吡肟)敏感,这主要是由该菌细胞膜上通道蛋白OprD的下调和mexXY-OprM和mexAB-OprM的过表达引起的[12]。占第二位的鲍曼不动杆菌的检出率和CRAB检出率也低于2011年全国水平[6]。鲍曼不动杆菌对第三、四代头孢菌素类、氨基糖苷类和喹诺酮类抗菌药物呈现高耐药性,但对米诺环素、阿米卡星和左氧氟沙星保持较低耐药率,耐药率低于25%,未发现对替加环素耐药的菌株。鲍曼不动杆菌对碳青霉烯类耐药的因素有多种,如产生β-内酰胺酶AmpC、OXA-51、OXA-23与主动外排系统AdeABC、AdeFGH过表达等。此外,OMP34外膜蛋白低表达是其耐药的辅助因素[8]。本次监测检出8株XDR-PA和1株XDR-AB菌株,这些广泛耐药菌株的出现,常常导致临床上无药可用,增加患者的死亡率。临床和感控部门应高度重视,制定合理的控制措施,防止耐药性强的铜绿假单胞菌和鲍曼不动杆菌的出现及院内感染的流行。
在葡萄球菌属中,以凝固酶阴性的葡萄球菌为主,金黄色葡萄球菌的检出率仅为0.96%,远低于2011年的全国水平4.1%。MRSA和MRCNS的检出率分别为52.27%和72.26%,检出率均低于2011年全国水平[6]。耐甲氧西林的葡萄球菌的耐药机制有两种,一种是染色体介导的固有耐药,通过mecA基因调节产生特殊的青霉素结合蛋白(penicillin binding proteins,PBP),这种特殊的PBP对β-内酰胺类抗生素亲和力极低,导致细菌仍能生长,产生耐药性;另一种机制是质粒介导的获得性耐药,通过耐药因子产生β-内酰胺酶,水解β-内酰胺类抗生素,产生耐药性[8]。均未发现万古霉素、利奈唑胺和替加环素耐药的葡萄球菌。未检出喹努普汀/达福普汀耐药的金黄色葡萄球菌,检出4株喹努普汀/达福普汀耐药的凝固酶阴性的葡萄球菌。金葡菌对利福平、喹诺酮类、庆大霉素和复方新诺明保持较低的耐药率,均小于30%。利福平容易产生肝毒性,副作用较大,不建议使用[13]。复方新诺明口服用药,作用慢,对于重度病人,仍首选利奈唑胺和糖肽类抗生素如万古霉素[14]。
在胆道感染中,肠球菌属的检出率较高。屎肠球菌检出率和耐药性均高于粪肠球菌。粪肠球菌对青霉素和氨苄西林的耐药率分别为20.69%和20.47%,而屎肠球菌分别为55.00%和51.25%。粪肠球菌对高水平庆大霉素和高水平链霉素的耐药率分别是39.65%和31.88%,屎肠球菌分别为39.12%和28.93%,耐药率均低于40%,高水平庆大霉素和链霉素常与青霉素类或糖肽类抗生素抗生素联合使用,协同抗菌。两种菌对利奈唑胺和糖肽类抗生素万古霉素很敏感,常作为重症患者治疗的首选。已检出万古霉素耐药的屎肠球菌(vancomycin rresistant enterococci,VRE)3株,未发现对利奈唑胺耐药的屎肠球菌;检出利奈唑胺耐药的粪肠球菌2株,未发现万古霉素耐药的粪肠球菌。VRE的出现给临床治疗带来挑战。
监测显示,念珠菌中以白假丝酵母菌和热带假丝酵母菌为主,其耐药率仍处于较低水平。白假丝酵母菌对5-氟胞嘧啶耐药性为4.35%,对两性霉素B等抗真菌药耐药性极低。文献报道两性霉素B具有广谱的抗真菌作用,但是由于其存在较大的毒副作用,在临床上的使用受到了限制。氟康唑通过抑制真菌细胞膜麦角固醇生物合成所需酶类发挥作用[17-18],副作用低,且口服和注射效果都很显著,成为最常用的抗真菌药物之一。而光滑假丝酵母菌对氟康唑天然不敏感,出现该菌感染时,应选择其他抗真菌药物进行治疗。
胆道感染的病原菌中,仍以大肠埃希菌、肠球菌属和肺炎克雷伯菌等肠源性细菌为主,铜绿假单胞菌和鲍曼不动杆菌等易引起医院感染的病原菌也占一定比例。出现了耐药性强的XDR-PA、XDR-AB、CRE和VRE,增加了临床治疗的难度和复杂性,医院应高度重视,合理选择与使用抗生素。
[1]孙兰菊,薛海玲,陈明慧,等.2012—2014年腹腔感染病原菌菌谱及耐药性监测[J].中国中西医结合外科杂志,2016,22(1):24-27.
[2]齐弋枢,王淼.472份胆汁标本需氧菌培养及药敏分析[J].中国实验诊断学,2016,20(6):993-994.
[3]黄会,吴多荣,张罡.487例胆汁培养病原菌构成及耐药性分析[J].实用预防医学,2015,22(5):615-617.
[4]沈旭,李阳.胆道感染的病原菌分布及耐药分析[J].哈尔滨医药,2015,35(1):6-7,17.
[5]Bae WK,Moon YS,Kim JH,et al.Microbiologic study of the bile⁃culture and antimicrobial susceptibility in patients with biliary tractinfection[J].Korean J Gastroenterol,2008,51(4):248-254.
[6]周春妹,胡必杰,吕媛.卫生部全国细菌耐药监测网2011年胆汁培养病原菌耐药监测[J].中国临床药理学杂志,2012,28(12): 933-936.
[7]曾跃斌,侯冰,周云英,等.176株念珠菌属的分离鉴定及其耐药性分析[J].山西医药杂志,2014,43(15):1755-1758.
[8]张静,喻玮,赵丽娜,等.我国细菌耐药现状与特征[J].中华临床感染病杂志,2016,9(2):118-128.
[9]Azita Leavitt,Inna Chmelnitsky,Raul Colodner,et al.Ertapenem Re⁃sistance among Extended-Spectrum-Lactamase-Producing Klebsi⁃ella pneumonia isolates[J].J Clin Mircrobiol,2009,47(4):969-974.
[10]王丽倩,王银环,史亚,等.临床分离耐药阴沟肠杆菌超广谱β-内酰胺酶基因的检测与分型[J].浙江临床医学,2014,(8):1303-1304. [11]郑晓林,廖致红.铜绿假单胞菌耐药率与抗菌药使用量相关性分析[J].中国药师,2009,12(4):457-459.
[12]Zeng ZR,Wang WP,Huang M,et al.Mechanisms of carbapenem resistance incephalosporin-susceptible Pseudomonas aeruginosa in China[J].Diagn Microbiol Infect Dis,2014,78(3):268-270.
[13]赵克健.化学药品药名手册[M].天津:天津科学技术出版社, 2000:378.
[14]耐甲氧西林金黄色葡萄球菌感染防治专家委员会.耐甲氧西林金黄色葡萄球菌感染防治专家共识[J].中华实验和临床感染病杂志,2011,5(3):60-72.
[15]Paramythiotou E,Frantzeskaki F,Flevari A,etal.Invasive fungal infections in the ICU:how to approach,how to treat[J].Molecules, 2014,19(1):1085-1119.
[16]Shoham S,Marwaha S.Invasive fungal infections in the ICU[J]. Intensive Care Med,2010,25(2):78-92.
Distribution and Drug Resistance of Pathogenic Bacteria in Patients of Biliary Tract Infection from 2013 to 2016
XUE Hai-ling,SUN Lan-ju,FANG Jie,et al.Department of Clinical Laboratory,Tianjin Nan⁃kai Hospital,Tianjin(300100),China
ObjectiveTo investigate the distribution and antibiotic resistance of pathogenic bacteria from the patients of biliary tract infection in Tianjin Nankai Hospital from 2013 to 2016 and provide the reference for clinical treatment.MethodsThe identification and the susceptibility test of the isolated bacteria were per⁃formed by the automatic VITEK-2 compact system,and the data was collected and analyzed using WHONET 5.6 software.ResultsThe positive rate of bile culture was 55.53%(2631/4738).A total of 4539 bacterial strains were isolated,including 2815 strains(62.02%)of Gram-negative bacilli,1675(36.90%)strains of Gram-positive cocci and 49(1.08%)strains of fungus.The top six bacteria were Escherichia coli(26.06%),Klebsiella pneumonia(11.87%),Enterococcus faecium(10.58%),Enterococcus faecalis(10.22%),Pseudomonas aeruginosa(4.30%)and Enterobacter cloacae(3.90%).Those of Escherichia coli and Klebsiella pneumonia pro⁃ducing ESBLs were 54.27%and 31.54%respectively.About the two kinds,the rates of resistance to carbapen⁃ems were 0.76%and 0.93%.About Pseudomonas aeruginosa and Acinetobacter baumannii,the rates of resis⁃tance to carbapenem were 38.46%and 28.97%respectively,about Enterococcus faecium,the rate of resistance to vancomycin was 0.63%.The detection rates of MRSA and MRCNS were 56.04%and 76.79%.ConclusionThe most common pathogens in biliary tract infection were intestinal,the species of resistant pathogenic bacte⁃ria has increased gradually.The Pseudomonas aeruginosa and Acinetobacter baumannii,carbapenem resistant Escherichia coli and Klebsiella pneumonia,and vancomycin resistant enterococcus(VRE)has appeared.
Biliary tract infection;bile;patho⁃gens;antibiotic resistance
R378.2
A
1007-6948(2017)05-0463-05
10.3969/j.issn.1007-6948.2017.05.001
天津南开医院检验科(天津300100)
孙兰菊,E-mail:tjnkslj@163.com
(收稿:2017-04-26 修回:2017-09-20)
(责任编辑 田在善 屈振亮)

