Ⅱ型肺泡上皮细胞凋亡在肺气肿大鼠肺功能下降中的作用研究
顾超 刘元顺 吕云 曹林峰 李亚清 李娜
·论著·
Ⅱ型肺泡上皮细胞凋亡在肺气肿大鼠肺功能下降中的作用研究
顾超 刘元顺 吕云 曹林峰 李亚清 李娜
目的 探讨Ⅱ型肺泡上皮细胞(AECⅡ)凋亡在被动吸烟肺气肿大鼠肺功能下降中的相关作用。方法 选取90只清洁级雄性SD大鼠,完全随机平均分成6组,A组正常对照组,B、C、D、E、F组大鼠被动吸入不同浓度香烟烟雾。采用小动物肺功能仪测定各组大鼠肺功能、肺组织病理学检测、Real-time PCR测定肺泡表面活性蛋白A(SPA)和SPC mRNA水平、免疫组织化学法检测SPA和SPC蛋白表达水平,TUNEL与SPC双重免疫荧光染色分析AECⅡ凋亡情况。结果 当香烟烟雾中一氧化碳(CO)浓度达到(300±10)ppm以上时,大鼠肺功能中气道阻力(AR)明显增加、肺动态顺应性(Cdyn)及呼气峰值流速(PEF)降低(P<0.05);大鼠肺组织出现明显肺气肿样表现,肺泡平均内衬间隔(MLI)和平均肺泡面积(MAA)显著增加(P<0.05);肺组织中SPA和SPC mRNA及蛋白表达水平明显下降(P<0.05),AECⅡ凋亡百分比显著增高(P<0.05)。结论 AECⅡ凋亡在被动吸烟建立的大鼠肺气肿发生发展过程中起重要作用。
被动吸烟 肺泡 上皮细胞 凋亡 大鼠
据预计到2020年,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)将是全球死亡原因的第三位因素[1]。肺弹性组织的降解、肺泡结构破坏与丢失、气腔的扩大是引起肺气肿或COPD患者气流受限的重要原因[2]。吸烟是引起肺气肿和COPD的最主要危险因素。Ⅱ型肺泡上皮细胞(type II alveolar epithelial cells,AECⅡ)作为AECI的祖细胞,具有合成和分泌肺泡表面活性物质(surfactant protein,SPs)、维持肺泡内外液体平衡、免疫调节等作用[3],在维持正常肺泡内稳态和肺组织损伤修复中具有十分重要的意义[4]。2016年8月至12月作者采用不同被动吸烟浓度建立肺气肿大鼠模型,分析其肺功能变化及相关机制。
1 材料与方法
1.1 实验动物及材料 (1)动物:清洁级雄性SD大鼠90只,体重180~200 g,购于上海西普尔-必凯实验动物有限公司(许可证号:SCXK沪2008-0016),饲养于浙江中医药大学动物实验研究中心,饲养及实验温度21℃~25℃,相对湿度40%~60%,12h明暗交替。本研究经浙江中医药大学实验动物伦理委员会批准。(2)主要试剂: TRIzol(美国Invitrogen公司),PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒、SYBR® Premix Ex TaqTMII试剂盒(日本TaKaRa公司),兔抗大鼠肺表面活性蛋白(SP)A及SPC抗体、羊抗兔IgG二抗(美国Santa Cruz公司),TUNEL凋亡细胞检测试剂盒(江苏碧云天公司),雄狮牌香烟(浙江中烟工业有限公司),DAPI(美国Sigma公司)。引物序列由上海Invitrogen公司合成(见表1)。
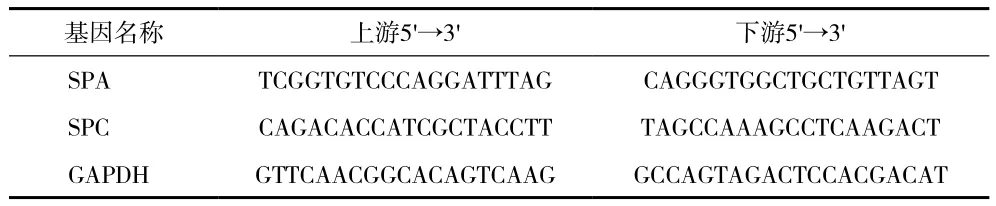
表1 引物序列
1.2 方法 (1)建立肺气肿大鼠模型:将90只大鼠完全随机平均分为6组,参照文献[5-6]方法,采用被动吸烟建立肺气肿大鼠模型。每天将B组、C组、D组、E组、F组大鼠分别置于不同的自制吸烟箱(60cm×50cm×40cm)中,每只吸烟箱点燃香烟数不同,保证B组CO浓度维持在(200±11)ppm、C组CO浓度维持在(300±10)ppm、D组CO浓度维持在(400±13)ppm、E组CO浓度维持在(500±15)ppm和F组CO浓度维持在(600±18)ppm,每次被动吸烟时间90 min,7d/周,共12周。同时间段内,将A组大鼠置于相同吸烟箱中吸入空气。(2)大鼠肺功能测定:各组大鼠被动吸烟12周完成后,采用小动物肺功能仪(上海Alcott Biotech公司)测定各组大鼠肺功能,麻醉消毒后固定,切开颈部皮肤,将气管倒T型切开,食道插管经口插入食道中部,并连接压力传感器记录食道压(即胸腔负压),Y型套管气管插管后,分别连接至微型压力传感器和呼吸流量传感器记录气道压和呼吸流量。观察食道压、气道压和呼吸流量,采集信号良好的波形10min,通过MPA肺功能分析系统计算出气道阻力(AR)、肺动态顺应性(Cdyn)和呼气峰值流速(PEF)并取平均值。(3)肺组织病理学检测:各组大鼠完成肺功能检测后立即用10%水合氯醛腹腔内麻醉处死各组大鼠,对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。取各组大鼠左肺组织,于4%多聚甲醛固定,常规脱水,石蜡包埋并切片,常规脱蜡至水,行苏木素-伊红(HE)染色,肺组织病理半定量分析肺泡平均内衬间隔(MLI,将每个视野正中为中心划“十”字交叉线,计数经十字交叉线的肺泡间隔数为Ns;测量十字线总长度为L,MLI=L/Ns)及平均肺泡面积(MAA,计数每个视野的肺泡数,测量每个视野面积为TA,HE染色阳性区域(肺实质)面积为 PA,MAA =(TA-PA)/Na)。(4)Real-time PCR检测SPA及SPC mRNA水平:收集各组大鼠右肺组织,以TRIzol提取总RNA,按照试剂盒说明书合成cDNA,行Real-time PCR,以GAPDH为内参;根据目的基因分别加入:2×SYBR® Premix Ex TaqⅡ 10μl,ROX Reference Dye Ⅱ 0.4μl,上游引物(10μmol/L)0.8μl,下游引物(10μmol/L)0.8μl,cDNA 2μl,补充无菌去离子水至总体积为20μl,离心混匀,95℃预变性4 min(95℃ 10s,56℃ 30s,72℃ 30s,共 45 个循环)。以2-ΔΔCt分析目的基因相对表达差异。(5)免疫组化法检测SPA和SPC蛋白表达:取各组大鼠左肺组织切片,常规脱蜡至水,灭活内源性氧化酶后高压抗原修复,山羊血清封闭,加入1∶500稀释的SPA或SPC抗体孵育,加入1∶100稀释的生物素标记的抗兔IgG孵育,DAB显色后苏木素复染,采用中性树胶封片,光镜下观察拍照,并计算阳性细胞所占百分比。SPA或SPC阳性细胞百分比=SPA或SPC阳性细胞数/400个总细胞×100%。(6)TUNEL和SPC双重免疫荧光染色:取各组大鼠左肺组织切片,TUNEL法原位标记凋亡细胞,严格按试剂盒说明书操作。组织切片常规脱蜡至水,不含DNase的蛋白酶K消化,滴加1∶500稀释的SPC抗体孵育,后加入1∶200稀释的FITC- IgG抗体,室温孵育,漂洗后加入TUNEL检测液避光孵育,DAPI复染,IX71荧光显微镜(日本Olympus公司)下观察拍照。计算TUNEL和SPC双阳性细胞所占百分比,即AECⅡ凋亡百分比=TUNEL和SPC双阳性细胞数/DAPI阳性细胞总数×100%。
1.3 统计学方法 采用SPSS 19.0统计软件。计量资料以(x±s)表示,用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺功能改变 见表2。

表2 各组大鼠肺功能AR、Cdyn和PEF比较[n=15,(x±s)]
2.2 肺组织病理学变化 各组大鼠肺组织常规HE染色结果显示,B组未出现明显的肺气肿样表现;C组、D组、E组和F组大鼠肺组织均出现肺气肿征象:部分肺泡呈囊状扩张,肺泡腔不规则且大小不一,相同视野内肺泡数目减少,部分肺泡间隔断裂,肺泡融合。肺组织病理半定量分析,见表3。
2.3 SPA和SPC表达水平 见图1、2。
2.4 AECⅡ凋亡变化 见图3。
3 讨论
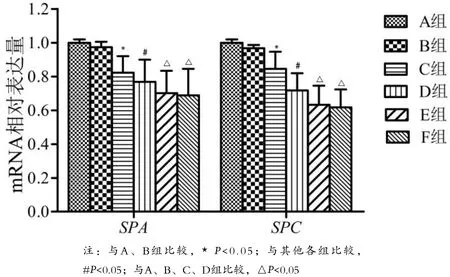
图1 各组大鼠肺组织SPA和SPC mRNA表达水平
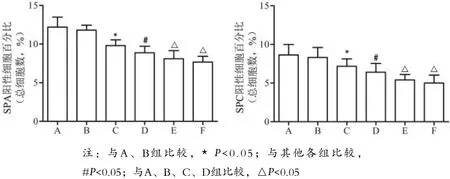
图2 各组大鼠肺组织SPA和SPC阳性细胞百分比

图3 各组大鼠肺组织AECⅡ凋亡百分比
COPD发病机制复杂,病理改变累及气道、肺实质和肺血管等结构,且呈进行性发展,目前尚无有效药物阻止COPD患者肺功能长期下降[1]。肺弹性组织的降解、肺泡结构破坏与丢失、气腔的扩大是引起肺气肿或COPD患者气流受限的重要原因。吸烟是肺气肿和COPD的主要危险因素,与肺部对香烟烟雾等有害气体或有害颗粒的异常炎症反应有关,被认为是COPD的常见致病因素[7]。本研究中,当香烟烟雾中CO浓度维持在300±10 ppm时,开始出现大鼠肺功能中AR增加、Cdyn及PEF降低;并且,大鼠肺组织出现明显的肺气肿样表现,MLI和MAA明显增加,其严重程度与肺功能下降程度相一致。
哺乳动物的肺泡上皮细胞由I型肺泡上皮细胞(AECI)和AECⅡ组成。AECⅡ不仅可分化为AECI,还可通过有丝分裂补充自身数量;同时AECⅡ还具有合成和分泌肺泡表面活性物质(SPs)、维持肺泡内外液体平衡、免疫调节等作用[3,8]。肺泡表面活性物质包括SPA、SPB、SPC和SPD,可由肺泡上皮中的AECⅡ合成和分泌。SPA和SPC是特异性地由AECⅡ分泌[9-10],在减小肺泡表面张力中起重要作用。AECⅡ作为AECI的祖细胞,其严重受损或丢失将导致肺泡受损及肺泡修复障碍。本资料中,被动吸烟建立大鼠肺气肿模型,大鼠肺组织中SPA和SPC mRNA和蛋白水平显著下降,其下降程度与大鼠肺功能下降及肺组织肺气肿样改变程度相一致,提示AECⅡ存在一定程度的受损;进一步采用TUNEL和SPC双重免疫荧光染色法,结果表明肺气肿大鼠肺组织存在明显的AECⅡ凋亡,进而导致大鼠肺功能下降并出现明显的肺气肿样表现,最终出现不可逆肺损伤。但随着烟雾中CO浓度的持续升高,大鼠肺功能、病理学改变及SPA和SPC 的表达不再恶化。作者认为可能的原因主要是:在被动吸烟过程中,随着烟雾中CO浓度的升高,大鼠逐渐出现活动减少、精神状态萎靡及呼吸频率减慢,可能出现呼吸抑制,进而可能导致在高CO浓度时大鼠吸入的总颗粒物等有害物质并未明显增多,最终出现肺功能不再继续下降,病理学改变、SPA和SPC表达及AECⅡ凋亡不再恶化。
[1] Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Seattle: GOLD,2016.
[2] Burgel PR. Pathogenesis of chronic obstructive pulmonary disease.Presse Med, 2009, 38(3):406-412.
[3] Funk CJ, Manzer R, Miura TA, et al. Rat respiratory coronavirus infection: replication in airway and alveolar epithelial cells and the innate immune response. J Gen Virol, 2009, 90(Pt 12):2956-2964.
[4] Hoffman AM, Ingenito EP. Alveolar epithelial stem and progenitor cells: emerging evidence for their role in lung regeneration. Curr Med Chem, 2012, 19(35):6003-6008.
[5] Zheng H, Liu Y, Huang T, et al. Development and characterization of a rat model of chronic obstructive pulmonary disease (COPD)induced by sidestream cigarette smoke. Toxicol Lett, 2009,189(3):225-234.
[6] Jiang H, Zhu Y, Xu H, et al. Activation of hypoxia-inducible factor-1alpha via nuclear factor-kappa B in rats with chronic obstructive pulmonary disease. Acta Biochim Biophys Sin(Shanghai), 2010, 42(7):483-488.
[7] Macnee W. Pathogenesis of chronic obstructive pulmonary disease.Clin Chest Med, 2007, 28(3):479-513.
[8] 顾超, 严建平, 许武林, 等. 大鼠羊水间充质干细胞向Ⅱ型肺泡上皮细胞定向分化的体外实验. 中华医学杂志, 2014, 94(26):2050-2054.
[9] Goldmann T, Kähler D, Schultz H, et al. On the significance of Surfactant Protein-A within the human lungs. Diagn Pathol, 2009,12:4-8.
[10] Fujino N, Kubo H, Suzuki T, et al. Isolation of alveolar epithelial type II progenitor cells from adult human lungs. Lab Invest, 2011,91(3):363-378.
Objective To study the effects of type II alveolar epithelial cells apoptosis on pulmonary function decline in rats with emphysema.Methods Ninety SPF-grade male Sprague-Dawley rats were randomly sorted into six groups. A group was control group;rats form B,C,D,E and F groups were exposed to different passive smoking concentrations. Small animal lung function instrument was used to analyze the pulmonary function of each rat. Histological changes of rats were analyzed by H&E staining,and surfactant protein A(SPA)and SPC mRNA expressions were detected by Real-time PCR;SPA and SPC protein expressions were measured by immunohistochemical analysis. TUNEL/SPC immunofluorescence staining was used to analyze the apoptosis of type II alveolar epithelial cells(AECⅡ). Results When the concentration of carbon monoxide(CO)in cigarette smoke was above 300±10 ppm,the airway resistance(AR)from rats was increased significantly,and the pulmonary dynamic compliance and peak expiratory flow were obviously decreased in lung function(P<0.05). Enlargement of airspace was observed and the amount of alveoli was decreased in the lung tissues,and the mean linear intercept and mean alveolar airspace from rats were significantly increased(P<0.05);SPA and SPC mRNA and protein expressions were markedly decreased(P<0.05);and the percentage of AECⅡ apoptosis was significantly increased(P<0.05).Conclusions AECⅡ apoptosis plays an important role in the development of emphysema in rats induced by passive smoking.
Passive smoking Pulmonary alveoli Epithelial cells Apoptosis Rats
国家自然科学基金资助项目(81000016);浙江省嘉兴市第一医院院级课题资助项目(2016-YA-01);浙江省嘉兴市科技计划项目(2017AY33010)
314000 浙江省嘉兴市第一医院(顾超 曹林峰 李娜)310053 浙江中医药大学第二临床医学院(刘元顺)311261 杭州市萧山区中医骨伤科医院(吕云)310014 浙江省人民医院(李亚清)

