一氧化氮对百合鳞茎的休眠解除效应*
王 齐 师春娟 王 琳 张小平 孙 亮 王有国
(1. 云南林业职业技术学院,云南 昆明 650224;2. 云南省林业科学院 , 云南 昆明 650201; 3. 云南农业大学 园林园艺学院 ,云南 昆明 650201)
一氧化氮对百合鳞茎的休眠解除效应*
王 齐1师春娟2王 琳1张小平3孙 亮3王有国3
(1. 云南林业职业技术学院,云南 昆明 650224;2. 云南省林业科学院 , 云南 昆明 650201; 3. 云南农业大学 园林园艺学院 ,云南 昆明 650201)
为研究一氧化氮(NO)在打破百合鳞茎休眠中的作用,用硝普钠(SNP)处理休眠的“哥德琳娜”百合(Lilium brownii var. viridulum ‘Gondelina’)鳞茎后,在25 ℃下进行培养,观测其萌发生长和测定不同解除休眠生长时期GA(赤霉素)、IAA(吲哚乙酸)、ZR(玉米素核苷)、ABA(脱落酸)4种内源激素的质量摩尔浓度变化。结果表明,NO能够促进“哥德琳娜”百合鳞茎休眠的解除,随处理体积摩尔浓度的增加,鳞茎发芽率呈先增大后减小趋势,其中10 mmol/L SNP体积摩尔浓度浸泡处理对休眠“哥德琳娜”百合鳞茎的解除效果最好,发芽率达58.2%,比对照增大37.9个百分点,且与对照差异显著(P<0.05);鳞茎质量和根生长量呈先增大后减小趋势,10 mmol/L SNP体积摩尔浓度浸泡处理下增加最大,分别比对照增大41.74%和102.03%,且与对照差异显著(P<0.05);用10 mmol/L SNP体积摩尔浓度浸泡处理下,鳞茎内源激素GA、IAA和ZR质量摩尔浓度随处理天数增加呈增大趋势,且均与对照差异显著(P<0.05),而ABA质量摩尔浓度随处理天数增加呈减小趋势,与对照之间差异不显著。NO能够促进生长素的快速生成,加速“哥德琳娜”百合鳞茎休眠解除的进程。
一氧化氮(NO);百合鳞茎;休眠;内源激素
百合(Lilium brownii var. viridulum)由于其花色艳丽、花姿雅致,并蕴含“百年好合、幸福祥和”之意,被誉为“球根花卉之王”[1],普遍应用于各种节庆活动和日常生活之中,是国内外鲜切花市场的主要花卉品种之一,且市场需求和生产面积不断扩大,在世界花卉市场中的地位越来越高。限制我国自繁种球商业化生产的一个主要因素是百合鳞茎的休眠解除技术欠缺[2]。百合鳞茎具有自发休眠的特性,生产上解除休眠的主要手段是冷处理,但由于不同品种、不同产地的百合鳞茎对冷处理的条件要求各异,导致冷处理没有统一的标准,生产上往往由于冷处理不当导致休眠解除不彻底或物质消耗过多,出现百合种球发芽率低、发芽不整齐、切花质量差等现象[3-5]。另外一个限制百合生产的问题是百合冷处理解除休眠的时间集中,导致花期集中、供花期短,难以实现优质种球的周年供应[6-7]。
NO及乙烯作为生物活性小分子或植物生长调节物质,参与了植物生长发育的各个阶段,在植物休眠及解除过程中也发挥着重要作用。据研究表明,NO能够诱导休眠种子内源激素含量的变化,可以诱导乙烯响应相关因子在拟南芥(Arabidopsis thaliana)中的转录[8];NO诱导牧草种子萌发过程中会引起H2O2和ABA的含量变化[9];另外,NO也可通过刺激乙烯的产生,降低对ABA敏感的苹果(Malus pumila)种子的休眠[10];NO减轻了拟南芥种子对ABA的敏感性,促进拟南芥种子的萌发[11]。但有关工作主要集中在种子休眠及解除方面,在球根花卉休眠解除应用上的研究不多[12-14]。因此,参照NO在种子休眠解除上的应用,利用其能打破休眠的特性,研究NO对休眠百合鳞茎的休眠解除效果,进而探索其作用机理,为生产应用提供理论依据。
1 材料与方法
1.1 试验地概况
试验在云南农业大学进行,该校位于云南省昆明北市区,属云南省中部,102°10′~103°40′E,24°23′~26°33′N。该区域属低纬度高原山地季风气候,冬无严寒,夏无酷暑,四季如春;年平均气温 15 ℃,年均日照 2 200 h;无霜期 240 d 以上,年均降水约1 000 mm。植物资源丰富,分布着亚热带常绿阔叶林、针阔混交林、温带针叶林、高山灌丛和草甸等不同类型植被。该区域土壤类型属高原红壤,主要有红壤土、紫色土和水稻土。
1.2 试验材料
供试百合鳞茎取自云南英茂花卉有限公司试验基地,品种为“哥德琳娜”。
NO供体硝普钠(Sodium nitroppmsside,SNP)购自德国Merck公司,先配成100 mmol/L 的母液,4 ℃保存,用时按处理所需进行稀释。
1.3 试验设计
2015年10月,待地上茎叶枯萎后采收种球,刷去鳞茎上的泥土,剪除枯萎的茎轴;选用鳞片抱合紧密、无病虫害、鳞茎盘无损伤的独头鳞茎,周径12~14 mm;用50%多菌灵可湿性粉剂500倍液浸泡30 min消毒处理后,置在阴凉处阴干;分别在1、5、10、20 mmol/L SNP 溶液中浸泡处理30 min,以不浸泡SNP溶液的鳞茎为对照(CK),滤干后用蒸馏水冲洗4~5次。
1.4 种球培养
经浸泡处理后洗过滤干的“哥德琳娜”百合鳞茎每30个为一个处理,每处理设3次重复;栽植于已消毒、含水量为70%的泥炭基质中,栽植深度为刚露出鳞茎顶端。置于25 ℃的ZPQ-350型智能气候箱中培养,温度变幅为±0.5 ℃。
1.5 取样与测定
形态指标的测定以处理30 d为一个试验期,按照完全取样的方法,在试验结束时一次性取出,取出后观测鳞茎形态生长,测定指标包括:鳞茎质量、根长生长量、生根数量;统计处理30 d的鳞茎发芽数量,并计算发芽率和发芽势。
内源激素含量的测定以处理42 d为一个试验期,采用酶联免疫(ELISA)法测定内源激素含量[15],ELISA试剂盒由南京农业大学生产。内源激素样品提取和测定均按宋要强等[2]、李宗霆等[15]的操作方法进行,每7 d为间隔进行取样,即取母鳞茎(鳞茎的第1~2层鳞片),迅速在液氮中冷冻并于(-20 ℃)保存备测。样品测定指标包括ABA、GA、IAA和ZR质量摩尔浓度,由云南农业科学院测定;同时,测算GA/ABA、IAA/ABA、ZR/ABA值变化。
1.6 数据分析
数据采用 Microsoft excel 2007软件进行汇总,用 DPS(Data Processing System)7.05 数据处理软件,对测定形态指标数据及内源激素质量摩尔浓度进行差异显著性分析、多重比较,差异显著水平均为0.05;相关分析的差异显著 水平为0.05。
2 结果与分析
2.1 不同SNP体积摩尔浓度处理对百合鳞茎形态生长的影响
2.1.1 不同SNP体积摩尔浓度处理对百合鳞茎质量的影响 不同SNP体积摩尔浓度处理对百合鳞茎质量的影响呈先增大后减小的趋势(图1),与CK处理相比,在1、5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎质量分别增大5.31%、14.15%、41.74% 和 5.69%,且在 10 mmol/L SNP体积摩尔浓度处理下达到最大值1.04 g;经差异显著性分析,5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎质量与CK差异显著(P<0.05)。
2.1.2 不同SNP体积摩尔浓度处理对百合鳞茎根长生长的影响 不同SNP体积摩尔浓度处理对百合鳞茎根长生长量的影响呈先增大后减小的趋势(图1),与CK处理相比,在1、5、10和20 mmol/L体积摩尔浓度下百合鳞茎根的生长量分别增大32.77%、76.86%、102.03% 和 61.33%,且在 10 mmol/L SNP体积摩尔浓度处理下达到最大值4.52cm;经差异显著性分析,1、5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎根的生长量与CK均差异显著(P<0.05)。
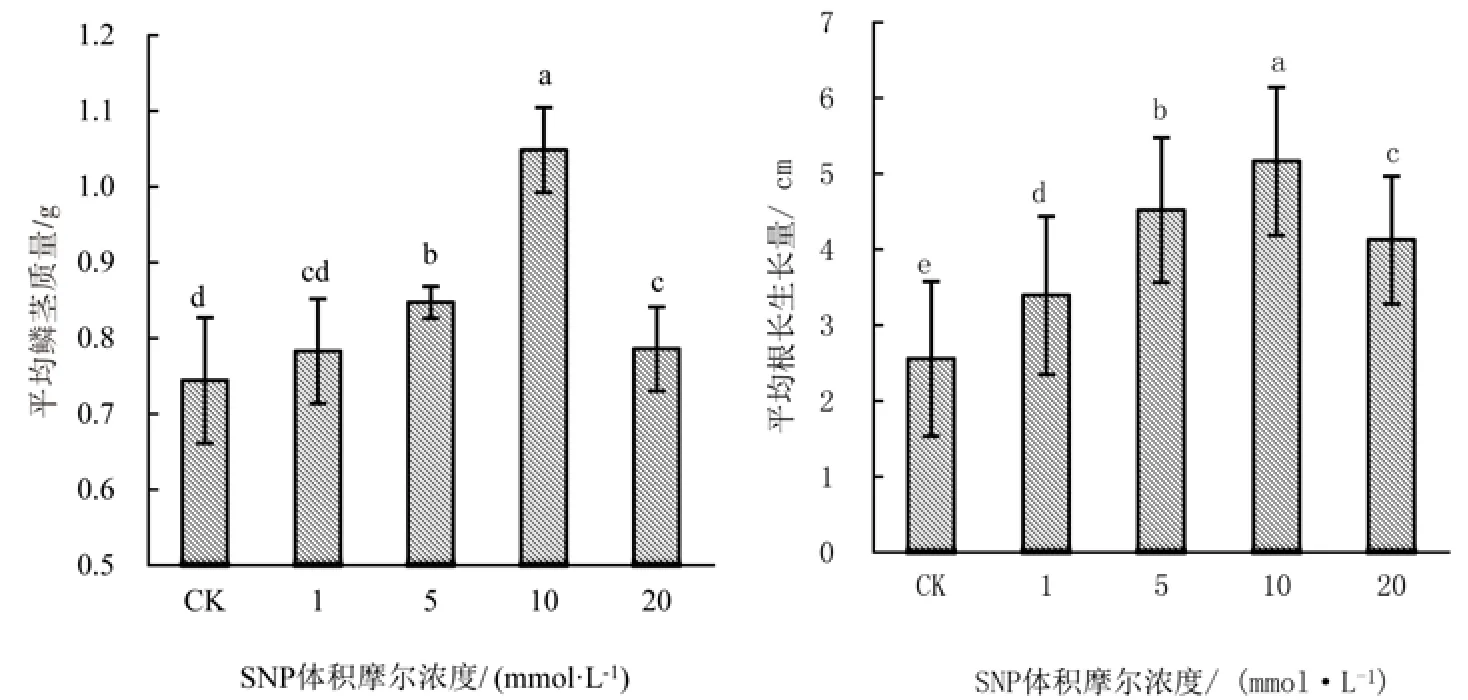
图1 不同SNP体积摩尔浓度处理对百合鳞茎质量、根长生长量的影响
2.1.3 不同SNP体积摩尔浓度处理对百合鳞茎生根数的影响 不同SNP体积摩尔浓度处理对百合鳞茎生根数的影响呈先增大后减小的趋势(图2),与CK处理相比,在1、5、10和20 mmol/L体积摩尔浓度处理下百合鳞茎根数量分别增大30.36%、33.07%、71.10%和 35.19%,且在10 mmol/L SNP体积摩尔浓度处理下达到最大值4.5根;经差异显著性分析,1、5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎根数量与CK均差异显著(P<0.05);1、5 和 20 mmol/L SNP 体积摩尔浓度处理之间百合鳞茎根数量差异不显著。
2.2 不同SNP体积摩尔浓度处理对百合鳞茎发芽的影响
不同SNP体积摩尔浓度处理下百合鳞茎发芽势的变化基本呈先增大后减小的趋势,SNP体积摩尔浓度在10 mmol/L处理下达到最大,其发芽势达44.7%,然后在20 mmol/L处理下降至18.3%(图2)。与CK处理相比,在1 mmol/L体积摩尔浓度下百合鳞茎发芽势下降0.7个百分点,在5、10和20 mmol/L体积摩尔浓度下百合鳞茎发芽势分别增大8.4、30.8、4.4个百分点。经差异显著性分析,1、5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎发芽势与CK均差异显著(P<0.05)。
不同SNP体积摩尔浓度处理下百合鳞茎发芽率的变化有先增大后减小的趋势,SNP体积摩尔浓度在10 mmol/L处理下达到最大,其发芽率达到58.2%,然后在20 mmol/L处理下降至31.9%(图2)。与CK处理相比,在1、5、10和20 mmol/L浓度下百合鳞茎发芽率分别增大4.0、17.5、37.9和11.6个百分点。经差异显著性分析,5、10和20 mmol/L SNP体积摩尔浓度处理下百合鳞茎发芽率与CK均差异显著(P<0.05);1 mmol/L体积摩尔浓度处理下百合鳞茎发芽率与CK差异不显著。

图2 不同SNP体积摩尔浓度处理对百合鳞茎根数量、发芽率和发芽势的影响
2.3 SNP处理后百合鳞茎内源激素含量的变化
由于在前期形态指标测定的基础上,确认10 mmol/L SNP浸泡处理为最佳处理体积摩尔浓度,因此研究SNP处理后百合鳞茎内源激素变化时只选取对照和10 mmol/L SNP浸泡处理测定分析。
2.3.1 SNP处理后百合鳞茎内源激素ABA质量摩尔浓度的变化 SNP处理后百合鳞茎内源激素ABA质量摩尔浓度的变化随处理天数增加呈减小的趋势(图3),与CK处理相比,SNP处理后减少的程度更快。在处理后第7 天和14 天,内源激素ABA质量摩尔浓度比CK大23.85%和19.99%;在处理后第21天、28天、35天和42天,内源激素ABA质量摩尔浓度比CK小10.35%、33.75%、46.04%和51.83%。经t检验表明,在10 mmol/L SNP溶液处理下,百合鳞茎内源激素ABA质量摩尔浓度与对照CK之间差异不显著。
2.3.2 SNP处理后百合鳞茎内源激素GA质量摩尔浓度的变化 SNP处理后百合鳞茎内源激素GA质量摩尔浓度的变化随处理天数增加呈增大的趋势(图3),与CK处理相比,在处理后第7天、14天、21天、28天、35天和42天,内源激素GA质量摩尔浓度比CK大61.17%、60.92%、49.58%和84.07%、49.03%和48.86%;至第42天达15.86 nmol/g。经t检验表明,在10 mmol/L SNP溶液处理下,百合鳞茎内源激素GA质量摩尔浓度与CK之间差异显著(P<0.05)。

图3 SNP处理后百合鳞茎内源激素ABA、GA质量摩尔浓度的变化
2.3.3 SNP处理后百合鳞茎内源激素IAA质量摩尔浓度的变化 SNP处理后百合鳞茎内源激素IAA质量摩尔浓度的变化随处理天数增加呈增大的趋势(图4),与CK处理相比,在处理后第7天、14天、21天、28天、35天和42天,内源激素IAA质量摩尔浓度比CK大6.36%、21.04%、11.72%和18.29%、27.09%和28.33%;至第42天达107.50 pmol/g。经 t检验表明,在 10 mmol/L SNP 溶液处理下,百合鳞茎内源激素IAA质量摩尔浓度与CK之间差异显著(P<0.05)。
2.3.4 SNP处理后百合鳞茎内源激素ZR质量摩尔浓度的变化 SNP 处理后百合鳞茎内源激素 ZR质量摩尔浓度的变化随处理天数增加呈增大的趋势(图4),与CK处理相比,在处理后第7天、14天、21天、28天、35天和42天,内源激素ZR质量摩尔浓度比对照CK大0.25%、5.92%、4.44%和7.97%、18.67%和30.50%;至第42天达12.86 nmol/g。经 t检验表明,在 10 mmol/L SNP 溶液处理下,百合鳞茎内源激素ZR质量摩尔浓度与CK之间差异显著(P<0.05)。
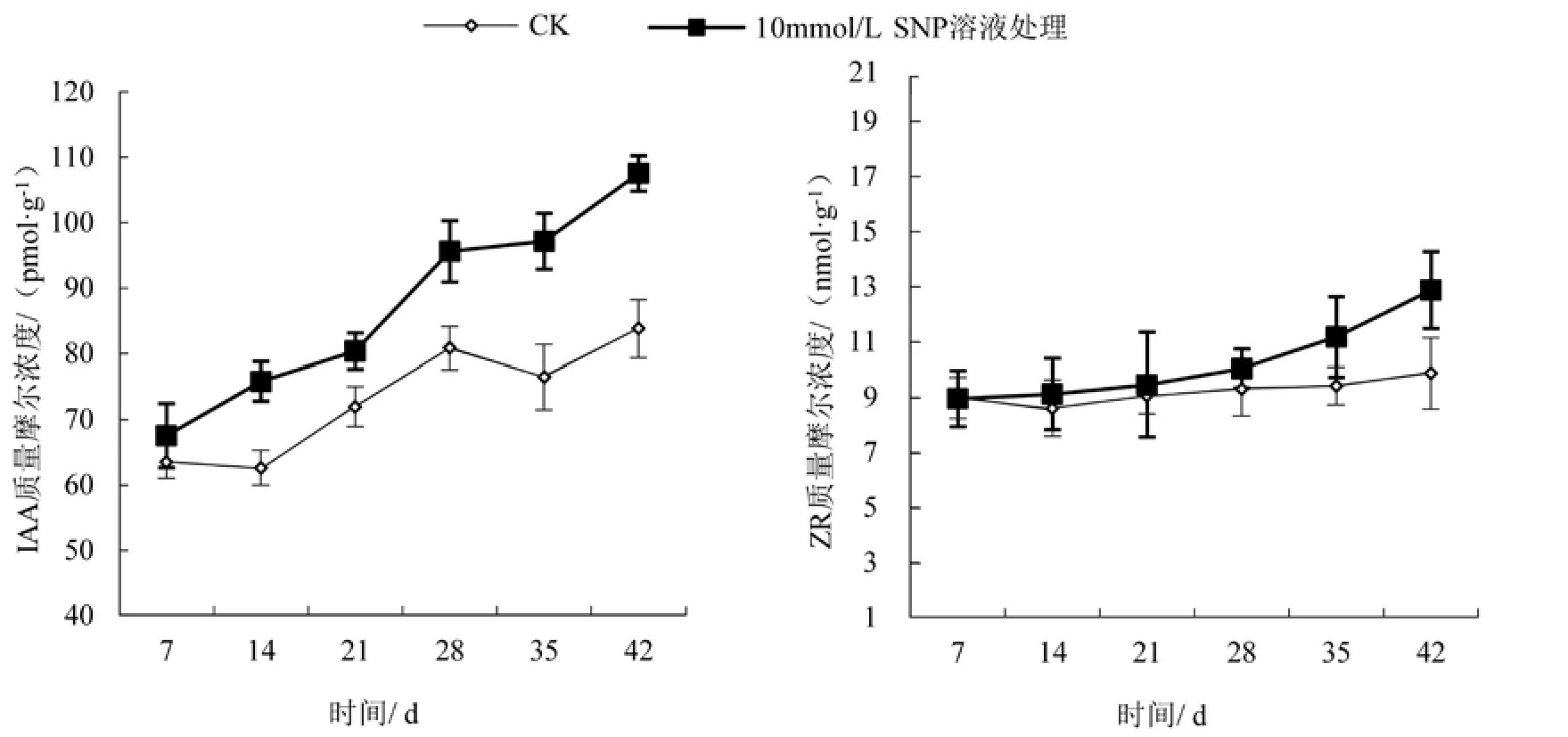
图4 SNP处理后百合鳞茎内源激素IAA、ZR质量摩尔浓度的变化
3 结论与讨论
试验研究表明,NO作为信号分子,参与了植物生长发育和胁迫反应中对植物生长发育、种子萌发和激素反应等生理过程的调节。对于百合鳞茎休眠的解除,除低温作为一个外界刺激诱导信号外[16],NO则是另一种外界刺激信号因子,百合鳞茎受到NO作用后,发生了一系列复杂的生理生化反应,致使影响百合鳞茎休眠的内源激素种类和含量发生增减变化,从而打破休眠,促进发芽生长;在同类研究中也发现了NO可参与植物体内或者种子体内各种内源激素含量的变化,从而引起植物休眠的解除。其诱发的机理可能是其作为一种活性小分子物质,参与了植物生长发育过程中的信号传导,引起了植物生理的一系列反应变化,结果导致了内源激素的提前(推迟)出现,植物或种子的提前(推迟)生长。如小麦种子萌发的早期阶段NO可以迅速增加β-淀粉酶的活性[17],从而促进小麦种子的萌发。但本研究也发现,过高浓度的NO会抑制芽的生长,甚至引起芽的死亡。使用外源NO能够促进百合鳞茎休眠的解除,在10 mmol/L体积摩尔浓度SNP处理下萌发效果较好,能够促进芽的生长,与没有NO处理过的百合鳞茎之间存在显著的差异。NO也可诱发内源激素GA、IAA、ZR的变化,随处理时间的延长呈增大的趋势,说明这些内源激素也参与了百合鳞茎休眠的解除。
[1] 包满珠. 花卉学[M]. 2版. 北京: 中国农业出版社, 2005:265- 271.
[2] 宋要强, 张琳, 惠伟. 一氧化氮和乙烯在打破杜梨种子休眠中的相互作用[J]. 西北林学院学报, 2013, 28(6): 51-55.
[3] 管毕财, 龚熹, 郭琼. 低温打破龙牙百合休眠过程中可溶性蛋白的变化[J]. 南昌大学学报(理科版), 2006, 30(5):492-495.
[4] 孙红梅, 李天来, 李云飞. 低温贮藏期间百合鳞茎中的游离氨基酸组分和含量变化[J]. 植物生理学通讯, 2004,40(4): 414-418.
[5] SUN H M, LI T L, LI Y F. Physiology mechanism of metabolisms in the middle scales of Lilium davidii var.unicolor bulbs stored at low temperature for dormancy-release[J]. Agricultural sciences in China, 2005, 4(7): 521-527.
[6] 郭志刚, 张伟. 切花生产技术丛书——球根类[M]. 北京:清华大学出版社, 1999.
[7] 孙红梅, 李天来, 李云飞. 兰州百合鳞茎发育及低温解除休眠过程中内源激素的变化[J]. 植物研究, 2006, 26(5):570-576.
[8] PARANI M, RUDRABHATLA S, MYERS R, et al.Microarray analysis of nitric oxide responsive transcripts in Arabidopsis[J]. Plant Biotechnology Journal, 2004,2(4): 359-366.
[9] SARATH G, HOU G, BAIRD L M, et al. Reactive oxygen species, ABA and nitric oxide interactions on the germination of warm-season C4-grasses[J]. Planta, 2007,226(3): 697-708.
[10] Gniazdowska A, Dobrzyńska U, Babańczyk T, et al.Breaking the apple embryo dormancy by nitric oxide involves the stimulation of ethylene production[J].Planta, 2007, 225(4): 1051-1057.
[11] BETHKE P C, LIBOUREL I G L, JONES R L. Nitric oxide reduces seed dormancy in Arabidopsis[J]. Journal of experimental botany, 2005, 57(3): 517-526.
[12] 张少颖, 任小林, 程顺昌, 等. 外源一氧化氮供体浸种对玉米种子萌发和幼苗生长的影响[J]. 植物生理学通讯, 2004, 40(3): 309-310.
[13] BELIGNI M V, LAMATTINA L. Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyl elongation, three light-inducible responses in plants[J]. Planta, 2000, 210(2): 215-221.
[14] GNIAZDOWSKA A, KRASUSK U, BOGATEK R.Dormancy removal in apple embryos by nitric oxide or cyanide involves modifications in ethylene biosynthetic pathway[J]. Planta, 2010, 232(6): 1397-1407.
[15] 李宗霆, 周燮. 植物激素及其免疫检测技术[M]. 南京:江苏科学技术出版社, 1996: 179.
[16] 李栩华, 安丽萍, 李彬, 等. 低温对百合鳞茎内源激素含量变化的影响[J]. 中国沙漠, 2011, 31(5): 1208-1213.
[17] HILL L M, REIMHOLZ R, SCHRODER R, et al. The onset of sucrose accumulation in cold-stored potato tubers is caused by an increased rate of sucrose synthesis and coincides with low levels of hexose-phosphates,an activation of sucrose phosphate synthase and the appearance of a new form of amylase[J]. Plant, Cell and Environment, 1996, 19(11): 1223-1237.
The Effect of Nitric Oxide on Dormancy Release in Bulbs of Lilium brownii var. viridulum
WANG Qi1SHI Chunjuan2WANG Lin1ZHANG Xiaoping3SUN Liang3WANG Youguo3
(1. Yunnan Forestry Technological College, Kunming,Yunnan 650224, China ; 2. Yunnan Academy of Forestry, Kunming,Yunnan 650201, China ;3. College of Horticulture and Landscape,Yunnan Agricultural University,Kunming,Yunnan 650201, China)
In order to study the effect of nitric oxide on bulb dormancy release of Lilium brownii var.viridulum‘Gondelina’, bulbs of L. brownii var. viridulum ‘Gondelina’were treated by sodium nitroprusside(SNP)and cultivated under 25 ℃ conditions. We observed the germination growth condition of the bulbs and the content changes of 4 kinds of endogenous hormones in different release dormancy and growth periods, including gibberellin(GA), indoleacetic acid(IAA), zeatin nucleoside (ZR) and abscisic acid (ABA). The results showed that nitric oxide could accelerate the dormancy release of L. brownii var. viridulum ‘Gondelina’ bulbs. With theSNP concentration increasing, the germination rate increased first then decreased. In this research, the optimum SNP concentration was 10 mmol/L and the germination was 58.2%, which was comparatively increased 37.9%with CK and has significant difference with CK (P<0.05). The weight and root increment showed first increased and then reduced trend, which were increased 41.74% and 102.03% respectively than CK. The content endogenous hormones, including GA, IAA and ZR, were increased gradually with the treated days, and they have significant difference with CK (P<0.05),while the content endogenous ABA were decreased gradually with the treated days. There was no significant difference between two groups, which showed that nitric oxide could promote the syntheses of auxin, and the dormancy completion of bulbs of L. brownii var. viridulum ‘Gondelina’ accelerated.
nitric oxide;bulbs of Lilium brownii var. viridulum;dormancy;endogenous hormones
S681.9
A
2096-2053(2017)05-0062-06
云南林职院博士基金项目“NO和乙烯对百合试管生小鳞茎休眠解除效果研究”(KY(BS)201401)。
王齐(1975—),男, 讲师, 主要从事草坪科学与管理、中水灌溉相关研究工作,E-mail:346649584@qq.com。
师春娟(1978—),女,工程师,主要从事园艺植物组培快繁工作,E-mail:275256813@qq.com。

