绿僵菌产毒素能力及产毒素动态分析*
徐金柱 秦长生 杨 华 赵丹阳 揭育泽 邱华龙
(广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
绿僵菌产毒素能力及产毒素动态分析*
徐金柱 秦长生 杨 华 赵丹阳 揭育泽 邱华龙
(广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
以绿僵菌素A(DxtA)和绿僵菌素B(DxtB)的产量为指标,分析了僵菌属5个种15个菌株液体培养的产毒素能力差异,确定了高产毒素优良菌株,并拟合了高产毒菌株在摇瓶条件下的产毒素动态。结果表明,不同种绿僵菌间的产毒素能力差异极显著(P<0.01),黄绿绿僵菌(Metarhizium flavoviride)、戴氏绿僵菌(M. taii)和蚱蜢绿僵菌(M. acridum)均不产生毒素,鳞腮绿僵菌(M. lepidiotae)可产少量毒素,金龟子绿僵菌(M. anisopliae)产毒素能力最强,其中M19的DxtA产量最高(144.12 μg·mL-1),M25菌株的DxtB产量最高(65.31 μg·mL-1);M25菌株的综合表现最佳;M25菌株在液体摇瓶培养条件下DxtA产量经SPSS拟合,符合Logist模型:Y=84.99/(1+11.82×e-0.3X),即前4 d是营养生长,毒素分泌量较少,4 d后生物量维持平衡,第5天起毒素产量进入指数增长期,9 d后毒素产量进入平台期。
绿僵菌;毒素;动态曲线
昆虫病原真菌具有广泛的生活方式和代谢方式,能在不同环境下生长,如贫瘠的营养条件[1]和存在对其他真菌致死的化合物条件等[2-3]。绿僵菌(Metarhizium spp.)能通过在皮层根细胞内或皮层根细胞间生长而在根际定殖[4],并能将昆虫内的氮转移给植物。虫生真菌可起到持续控制害生发生的作用,作为其中的代表性物种,绿僵菌已成为生物药剂开发的重要研究对象,并已在分子和生化水平上进行了全面深入的研究,筛选出多种对不同害虫具强毒力的菌株,研制出多种农林业害虫的生防制剂。
产毒素能力是影响绿僵菌杀虫毒力的重要因子,具有抑制血淋巴免疫、触杀、胃毒、拒食、杀卵及产卵忌避作用和内吸输导作用[5]。本文分析了绿僵菌属5个种15个菌株在液体培养条件下的产毒素能力,及其种间差异性,筛选出高产毒素菌株,确定其在液体培养条件下的产毒素动态,为绿僵菌素制剂及应用提供重要参数。
1 材料与方法
1.1 材料
供试绿僵菌为广东省林业科学研究院分离保存的15株绿僵菌(表1)。斜面种子培养基(PPDA):马铃薯 200 g,葡萄糖 40 g,蛋白胨 5 g,琼脂 20 g,水 1 000 mL。种子培养基:NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,蛋白胨5 g,水 1 000 mL。发酵培养基[6]:麦芽糖质量浓度2.55%,蛋白胨质量浓度0.75%,β-丙氨酸质量浓度0.02%,葡萄糖质量浓度0.5%。
1.2 绿僵菌培养
1.2.1 种子培养 供试菌株(表1)的斜面分生孢子用0.05%吐温-80溶液洗脱,经高速分散,血球计数板计数后,稀释成1×107孢子/mL孢子悬浮液。取1 mL孢子悬浮液接种于装有49 mL种子培养基的150 mL三角瓶,200 rpm,(26±1)℃培养 3 d,备用。
1.2.2 发酵培养 分别取 10 mL 液体种子接种于装有 190 mL 发酵培养基的 500 mL 三角瓶,200 rpm,(26±1)℃培养,每个处理3重复。培养至第 10天,每瓶取 1 mL 发酵液,10 000 g离心10 min,取上清液,0.45 μm 滤膜过滤后,进行HPLC检测,根据DxtA和DxtB的标准曲线,测定供试菌株液体条件下产毒素量。
1.3 绿僵菌素检测
1.3.1 标准曲线 DxtA标准品购于Sigma公司,DxtB标准品由华南农业大学胡琼波教授提供。标准品DxtA和DxtB分别用丙酮溶解后,用乙腈梯度稀释至6个质量浓度(20、40、60、80、100、120 μg·mL-1),每个浓度进行3次HPLC检测,平均峰面积(Y)和标样浓度(X)间经线性回归分析,获得回归方程Y=aX+b。
1.3.2 HPLC检测 Agilent 1100高效液相色谱仪,配以G1311A泵,G1315B DAD紫外检测器。色谱柱为反相柱为 Agilent TC-C18 柱 250×4.6 mm,5 μm,流动相为 1:1 的 CH3CN:H2O,流速 1 mL·min-1,检测波长 215 nm,检测时间 15 min,上样量 20 μL,室温(25 ℃)下检测。
1.4 绿僵菌产毒素动态分析
通过HPLC检测,确定以高产毒菌株M25为研究对象,在100 mL三角瓶内装入47.5 mL发酵培养基,灭菌后接入2.5 mL种子液,40个重复,200 rpm,(26±1)℃培养,每隔24 h随机取3瓶,每瓶内各取1 mL发酵液,10 000 rpm离心,取上清经0.45 μm滤膜过滤后,进行HPLC检测,其余发酵液经滤纸抽滤,无菌水洗涤2次,75 ℃烘24 h,称取菌丝重量,连续取样12 d,分析液体培养条件下绿僵菌的生长和产毒素的动态变化。
1.5 18SrDNA序列测定确定供试菌株种归属
在 PPDA 平板(D=9 cm)表面 铺 上 玻璃纸,接入0.2 mL供试绿僵菌孢子悬浮液,涂布均匀,置26℃恒温培养箱暗培养34 d,取菌丝冷冻备用。氯化苄法[7]提取绿僵菌DNA,18SrDNA基因特异性扩增采用真菌通用引物ITS1(5’-TCCGTAGGTGAACCTGC GG- 3’)和 ITS4(5’-TCCTCCGCTTATTGATATGC- 3’),25 μL体系:dNTP 10 μL,10×PCR buffer 2.5 μL,LA Taqase 0.2 μL,1 U,引 物(10 μm/μL) 各 1 μL,DNA 模 板 1 μL,ddH2O 15.3 μL。扩增条件:95 ℃,3 min;(94 ℃ 1 min;54 ℃ 1 min;72 ℃ 2 min)35 循环;72 ℃ 2 min。扩增产物由生工生物工程(上海)股份有限公司完成序列测定。
1.6 数据分析
应用 Microsoft excel 2006 对 DxtA 和 DxtB 标准曲线进行回归,应用SPSS 13.0拟合供试菌株M25产毒素的生长曲线[8]。不同菌株产毒素量经DPS进行差异性分析。测定的18SrDNA经NCBI数据库(http://www.ncbi.nlm.nih.gov/)比对,确定供试菌株的种归属,结合供试菌株产毒素能力,分析不同种菌株的产毒差异。
2 结果与分析
2.1 绿僵菌毒素A、毒素B标准曲线
在确定的条件下,DxtA和DxtB的出峰时间分别为8.889 和14.825 min。不同浓度的DxtA和DxtB标样经HPLC获取峰面积,经Microsoft excel 2006以质量浓度对峰面积拟合,DxtA和DxtB线性回归方程分别为:Y=11 301X(R2=0.999 5)和 Y=449 771X(R2=0.999 6)(图 1)。
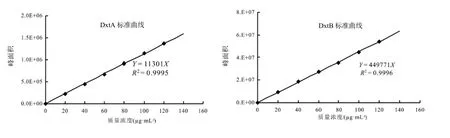
图1 DxtA和DxtB标准曲线
2.2 绿僵菌产毒素动态
M25液体培养前4 d是营养生长,生物量不断增加,而毒素量增加较少,第4天后生物量维持平衡,第5天起毒素分泌量明显加大,7~9 d毒素分泌最快,9 d后产毒素量趋于稳定(图2)。SPSS拟合结果表明,M25菌株的毒素产生符合Logist模型:Y=84.99/(1+11.82×e-0.3X)(图2)。因此,在评价菌株产毒能力时宜选取培养9~10 d的发酵液进行毒素产量检测,进行高产菌株筛选。

图2 绿僵菌M25菌株液体培养营养生长及DxtA产量动态
2.3 绿僵菌产毒素能力分析
HPLC检测结果表明,供试的15个绿僵菌菌株的产生毒素能力表现出3种类型:高产毒株(M19、M25、M28、M32、M42、M50、M52)、低产毒株(M09、M30、M40)和不产毒株(M20、M43、M985、M1245、M1258)(图 3),DxtA 和DxtB产量间具有一定的相关性,DxtA产量高的菌株,其DxtB的产量也比较高,而不产DxtA的菌株的发酵液里也未检测到DxtB。
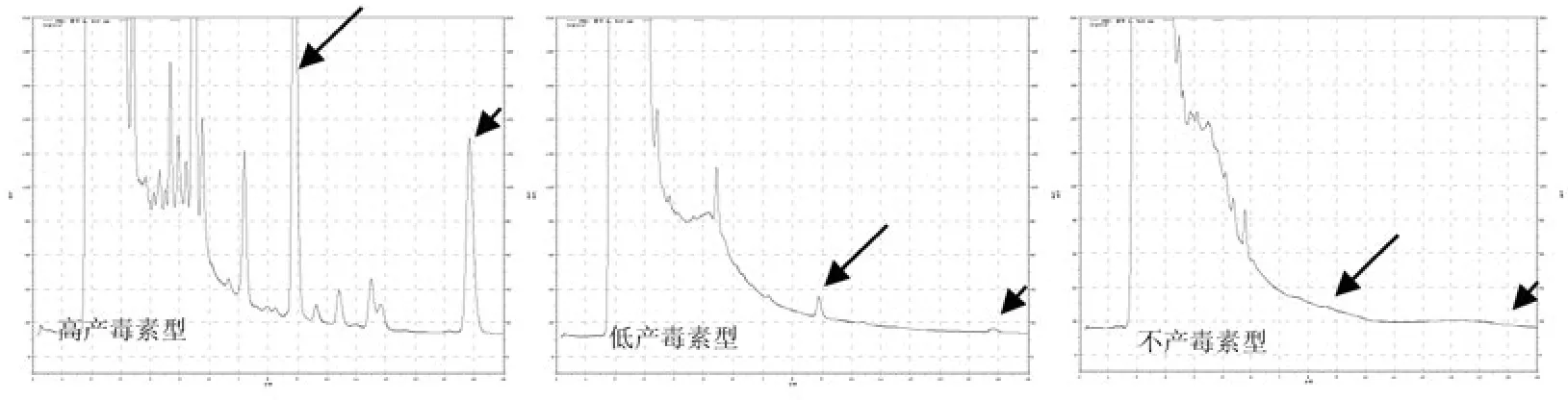
图3 绿僵菌产毒素类型
根据绿僵菌ITS序列比对结果,鉴定了供测试的15个菌株的种归属,包括8株金龟子绿僵菌(M. anisopliae)、1 株 戴 氏绿 僵 菌(M. taii)、1株鳞腮绿僵菌(M.lepidiotae)、4株黄绿绿僵菌(M.flavoviride)和1株蚱蜢绿僵菌(M.acridum)(表1)。菌株间产毒能力差异极显著(P<0.01),其中金龟子绿僵菌的产毒素能力较其它菌株强,除M09菌株的产毒量较低外,其它菌株DxtA的产量均在100 μg·mL-1以上,而戴氏绿僵菌和黄绿绿僵菌均不产生毒素。DxtA产量最高的菌株为M19(144.12 μg·mL-1),DxtB 产量最高是 M25菌株(65.31 μg·mL-1)。
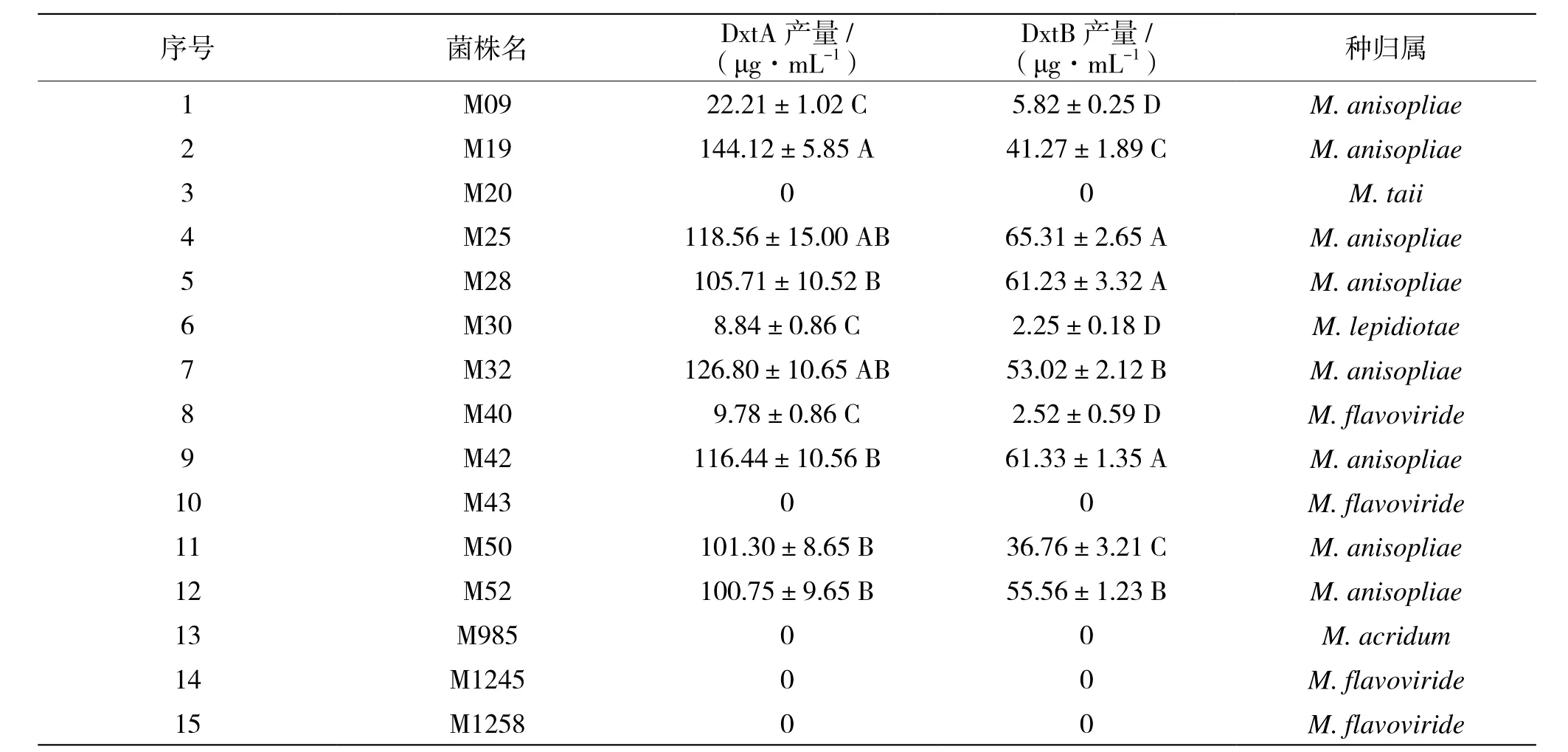
表1 供试绿僵菌毒素产量及种归属
3 结论与讨论
绿僵菌主要是通过在昆虫体内快速繁殖菌丝或产生毒素使寄主致病[9-10],绿僵菌分生孢子在寄主体表萌发后,进入寄主血腔大量繁殖致死寄主。研究表明[11-12],绿僵菌对寄主具有较强的专一性,一些绿僵菌种,如罗伯特绿僵菌(M. robertsii)和金龟子绿僵菌,寄主范围较广,而另一些种只对某一类昆虫表现出特异性,如蚱蜢绿僵菌对直翅目昆虫,大孢绿僵菌(M. majus)对甲虫类特异。本文探讨的5种绿僵菌毒素分泌能力,证明了金龟子绿僵菌是高产毒毒菌株,其它4种为低产毒或不产毒菌株,与寄主专化性保持一致,说明绿僵菌毒素在这一过程中起到重要作用,毒素的产生对增加寄主范围具有重要作用。王宾等[13]证明了绿僵菌破坏素的生物合成是由非核糖体蛋白合成酶完成,绿僵菌产毒素能力的差异主要取决于是否有dtxS1基因。产毒素种能杀死多个目标昆虫,而不产毒素绿僵菌只有很少的寄主,在绿僵菌进化过程中,毒素的生物合成基因簇的获得和保持,与真菌寄主专化性相一致。
绿僵菌为水溶性胞外蛋白,绿僵菌毒素的分泌与菌丝的生长同步,但主要是在菌丝生长达到平台期后,即培养的第5~8天是毒素产生的关键时期,毒素产生量呈现指数增加,第9天后达平台期,是提取毒素的最佳时期。本研究筛选出最佳菌株并确定该菌株在液体培养条件下毒素产量的变化动态,为毒素的提取和深入研究提供了参考。
[1] RANGEL D E, ANDERSON A J, ROBERTS D W.Evaluating physical and nutritional stress during mycelial growth as inducers of tolerance to heat and UV-B radiation in Metarhizium anisopliae conidia[J]. Mycological Research, 2008, 112(t 11): 1362-1372.
[2] ROBERTS D W, LEGER R S J. Metarhizium spp,cosmopolitan insect-pathogenic fungi:Mycological Aspects[J]. Advances in Applied Microbiology, 2004,54(54): 1-70.
[3] RANGEL D E N, Everton K K Fernandes,DETTENMAIER S J, et al. Thermotolerance of germlings and mycelium of the insect-pathogenic fungus Metarhizium spp. and mycelial recovery after heat stress[J]. Journal of Basic Microbiology, 2010, 50(4): 344-350.
[4] HU G, LEGER R S J. Field studies using a recombinant mycoinsecticide (Metarhizium anisopliae) reveal that it is rhizosphere competent[J]. Applied & Environmental Microbiology, 2002, 68(12): 6383-6387.
[5] MENG X, XU X, HU J, et al. Toxicity and differential protein analysis following destruxin a treatment of Spodoptera litura (Lepidoptera: Noctuidae) SL-1 cells[J].Toxicon Official Journal of the International Society on Toxinology, 2011, 58(4): 327-335.
[6] LIU B L, CHEN J W, TZENG Y M. Production of Cyclodepsipeptides Destruxin A and B from Metarhizium anisopliae[J]. Biotechnology Progress, 2000, 16(6): 993-999.
[7] 朱衡, 瞿峰, 朱立煌.利用氯化苄提取适于分子生物学分析的真菌 DNA[J].菌物学报, 1994 (1): 34-40.
[8] 戴国俊, 王金玉, 杨建生, 等.应用统计软件SPSS拟合生长曲线方程[J].畜牧与兽医, 2006, 38(9): 28-30.
[9] 童应华, 李万里, 马淑娟.金龟子绿僵菌及其粗提物对樟巢螟幼虫的致病性 [J].昆虫学报, 2014, 57(4): 418-427.
[10] 何广位, 胡维娜, 胡琼波. 绿僵菌素对四种昆虫细胞的毒性[J]. 应用昆虫学报, 2015, 52(6): 1466-1473.
[11] WANG S, FANG W, WANG C S, et al. Insertion of an esterase gene into a specific locust pathogen(Metarhizium acridum) enables it to infect caterpillars[J].PLOS Pathogens, 2011,7(6): e1002097.
[12] AMIRIBESHELI, KHAMBAY, CAMERON, et al. Inter-and intra-specific variation in destruxin production by,insect pathogenic Metarhizium spp. and its significance to pathogenesis[J]. Mycological Research, 2000, 104(4):447-452.
[13] WANG B, KANG Q, LU Y, et al. Unveiling the biosynthetic puzzle of destruxins in Metarhizium species[J].Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(4): 1287-1292.
Production and Dynamic of Destruxins from Metarhizium spp.
XU Jinzhu QIN Changsheng YANG Hua ZHAO Danyang JIE Yuze QIU Hualong
(Guangdong Provincial Key Laboratory of Silviculture, Protection and Utilization/Guangdong Academy of Forestry, Guangzhou,Guangdong 510520, China)
Taking the yield of DxtA and DxtB as indexes, the difference of the destruxin producing ability of 15 Metarhizium strains (belonged to 5 species) was analyzed. The DxtA dynamic curve of the best strain was fitted under shaking flask culture by sampling every day. The results showed that there was a significant difference in the destruxin producing ability among 5 species. Metarhizium anisopliae strains showed highest production, while M. flavoviride, M. taii and M. acridum did not produce DxtA or DxtB, M. lepidiotae produce a little destruxin.Among them, the M19 strain was the best to produce DxtA (144.12 μg·mL-1), and the M25 strain was the best to produce DxtB (65.31 μg·mL-1). The M25 was selected to be the best in DxtA and DxtB production. Under shaking flask culture, the DxtA production of M25 was fitted by SPSS, and showed to accord with Logist model Y=84.99/(1+11.82×e-0.3X): produce a little destruxin in the first 4 days vegetative growth and from the fifth day,it change into exponential growth and reached platform period from the ninth day.
Metarhizium; destruxin; dynamics curve
S763
A
2096-2053(2017)05-0001-05
林业公益性行业科研专项“新型高效绿僵菌生物杀虫剂研究”(201304408)。
徐金柱(1978— ),男,教授级高级工程师,主要从事生物杀虫剂研究与利用工作,E-mail: 282272693@qq.com。
秦长生(1967— ),男,研究员,主要从事森林病虫害综合防治研究工作,E-mail: 919824595@qq.com。

