NDA208542-Rociletinib的FDA审评案例分析
安 娜,唐健元
(国家食品药品监督管理总局药品审评中心 北京 100038)
NDA208542-Rociletinib的FDA审评案例分析
安 娜,唐健元*
(国家食品药品监督管理总局药品审评中心 北京 100038)
肺癌是全球死亡率最高的恶性肿瘤,其中非小细胞肺癌(Non-small Cell Lung Cancer,NSCLC)占85%。表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)基因是NSCLC中最常见的驱动基因之一。人表皮生长因子受体酪氨酸激酶抑制剂(Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors,EGFRTKIs)给EGFR基因敏感突变患者的治疗带了突破性进展。但是,EGFR-TKIs的耐药性问题日益突出,临床急需用于EGFR-TKI治疗中或治疗后出现进展并伴有EGFR T790M阳性突变的NSCLC患者的治疗药物。洛奇替尼(Rociletinib)拟定位于解决这一尚未被满足的临床需求,但是由于本品的有效性并不优于已上市的同类药物,存在较高的安全性风险(高血糖、QT间期延长和猝死),且给药剂量未被美国食品药品监督管理局(Food and Drug Administration,FDA)认可,最终未能上市。本文从审评角度分析和总结本案例的经验教训,供业界争鸣。
非小细胞肺癌 美国食品药品监督管理局 审评审批 案例分析 新药上市申请 精准医学
肺癌是全球死亡率最高的恶性肿瘤,每年大约有150万人死于肺癌[1]。在美国,高达85%的肺癌是非小细胞肺癌(NSCLC),在被确诊的患者中大部分发现时已是ⅢB和Ⅳ期(进展期或转移的)NSCLC[2]。以往对NSCLC的治疗均采用铂类等化疗药物,疗效不尽如人意。随着精准医学概念的提出,“个性化治疗”这个观念逐渐被人们认可。研究表明,接近15%的NSCLC转移患者出现表皮生长因子受体(EGFR)激活突变,因此把伴有EGFR突变的NSCLC患者作为一个独立的治疗亚群。针对EGFR突变的靶向治疗药物迅猛发展,以吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)、埃克替尼(Icotinib)为代表的第一代和以阿法替尼(Afatinib)为代表的第二代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)已成为EGFR突变型晚期NSCLC的重要治疗手段。多项前瞻性研究表明,EGFR突变的晚期NSCLC患者经EGFR-TKIs治疗后客观缓解率(Objective Response Rate,ORR)和无疾病进展时间(Progression Free Survival,PFS)的获益远超化学治疗[3-8]。EGFR基因突变的NSCLC对已批准上市的EGFR抑制剂敏感,但药物的耐药性问题日益突出。研究发现应用EGFR-TKI治疗的NSCLC患者出现获得性耐药的患者中50%可检测到T790M突变[9]。对EGFR-TKI治疗中或治疗后出现进展并伴有EGFR T790M阳性突变的NSCLC患者的治疗存在未被满足的临床需求。
洛奇替尼(Rociletinib)是克洛维斯肿瘤(Clovis Oncology)有限公司研发的新药,用于治疗EGFR-TKI治疗中或治疗后出现进展并伴有EGFR T790M阳性突变的NSCLC患者,为第三代EGFR-TKI药物,本适应症获得美国食品药品监督管理局(FDA)的加速批准认定。但是基于本品在确证性临床试验中的有效性、安全性数据和剂量问题,2016年4月12日,美国FDA抗癌药专家委员会以12∶1的投票结果反对Rociletinib批准上市。本文从审评角度结合Rociletinib的FDA专家委员会材料[10],分析和总结本案例的经验教训,以供各位同仁思考和借鉴。
1 Rociletinib的作用机制
研究发现,EGFR突变患者中发生频率最高的突变是EGFR受体酪氨酸激酶区域外显子19氨基酸缺失和外显子21点突变(EFGRL858R:EGFR受体酪氨酸激酶区域亮氨酸858突变为精氨酸)[11],这两种突变占EGFR突变的85%。Rociletinib通过与EGFR的突变进行不可逆结合并抑制信号发送,如外显子21L858R替换,外显子19缺失以及T790M耐药性突变。

表1 2nd-Line转移性NSCLC(非小细胞癌)的可用治疗策略
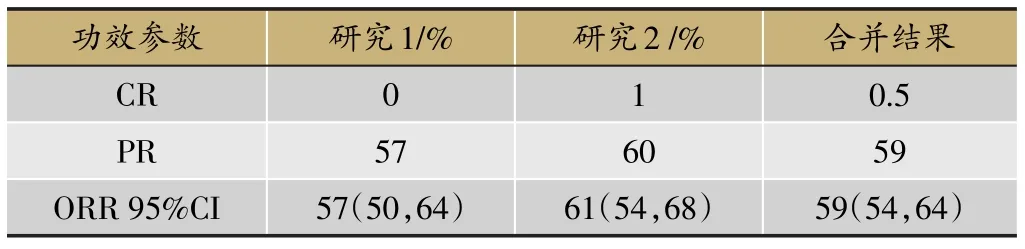
表2 奥希替尼功效研究结果(n=210)
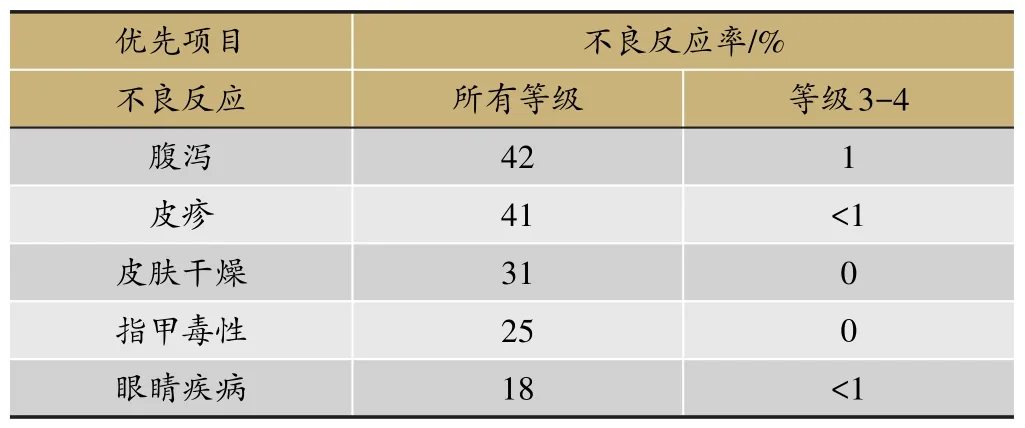
表3 奥希替尼常见不良反应(n=411)

表4 Rociletinib监管里程碑
2 Rociletinib的拟定适应症
Rociletinib的适应症人群为EGFR T790M突变阳性的NSCLC患者,此类人群在之前进行过EGFR靶点治疗并且经已获FDA批准的检测方法检测到EGFR T790M突变。基于本品的ORR和反应持续时间(Duration of Response,DoR)的数据,本适应症获得FDA的加速批准认定。但对于本适应症的后续上市注册审批,仍然需要依据确证性临床试验中临床获益的描述和验证性结果。
2.1 非小细胞肺癌(NSCLC)
在美国,因肺癌导致癌症死亡的原因较多,其中非小细胞肺癌患者约占肺癌患者的85%,
表皮生长因子受体突变的非小细胞肺癌患者在美国人群中约占10%-15%,而亚洲人群则高达30%-50%。
2.1.1 EGFR突变-NACLC治疗药物EGFR-TKIs
FDA批准的表皮生长因子受体突变的非小细胞肺癌治疗药物表皮生长因子受体-酪氨酸激酶抑制剂EGFR TKIs包括吉非替尼、厄洛替尼和阿法替尼,这类药物治疗与化学治疗药物相比,治疗效果有所改善。但部分患者获得了EGFR-TKIs耐药性,服药患者中的50%-60%患者发生T790M突变。已经批准的EGFR-TKIs对此部分患者无效,因此患者需要进行NSCLC2nd-Line治疗(表1)。
2.1.2 EGFR突变-NSCLC的其他治疗药物
奥希替尼(Osimertinib)是新一代不可逆性EGFRTKI,对EGFR敏感突变和T790M耐药突变均有更好的作用,也是目前唯一获得美国FDA批准上市,用于治疗EGFR-TKI治疗中或治疗后出现进展并伴有EGFR T790M阳性突变的NSCLC患者。多项临床试验结果充分证实了奥希替尼治疗一线EGFR-TKI治疗失败且T790M突变阳性的晚期NSCLC患者的疗效优于化疗,最常见的≥3级以上的药物不良反应为腹泻、皮疹和皮肤干燥。其有效性结果和药物不良反应如下(表2、表3)。
3 Rociletinib临床试验
Rociletinib药物研究审批与监管过程如表4所示。
3.1 药物使用剂量出现分歧
FDA与申请人存在的主要分歧是药物的使用剂量,申请人反复提出的确认剂量为500 mg和625 mg。2015年4月,新英格兰杂志(The New England Journal of Medicine)发表了Rociletinib进行的CO-1686-008(TIGER-X)临床试验,初步研究结果提示:未经确认的T790M阳性500 mg组Rociletinib治疗的客观缓解率(Objective Relapse Rate,ORR)为60%,625 mg组ORR为54%[12]。故申请人提出的建议剂量为500 mg,每日两次。之后的CO-1686-019(TIGER-2)试验显示500mg组ORR为28%,625 mg组ORR为34%。申请人通过评估TIGER-X,TIGER-2两个试验中主要疗效指标——ORR的结果,将剂量改为625 mg,每日两次。但是,2016年2月FDA指出药物代谢动力学试验数据不支持625 mg的使用剂量。于是,2016年3月,申请人修改了采用开放、随机、多中心临床试验设计的确证性试验CO-1686-020(TIGER-3)的分组情况,在原500 mg剂量组和对照组的基础上加入625 mg剂量组,以验证625 mg剂量选择的科学性。遗憾的是2016年5月,申请人终止了该项临床试验,也终止了Rociletinib的研发进程。
3.1.1 Rociletinib溶解度特性
在整个临床试验的分析过程中,确定主要获益人群和主要疗效终点非常重要。除此之外,药物代谢关系的分析亦不容忽视,此为后期药效关系以及整个疗效评价的基石。药代的个体差异性很大,稳态下的血液暴露量最高可达79%CV,半衰期很短,为3.7 h。但化合物溶解度很低,在pH>2时几乎不溶。饮食对此也有影响,高脂肪饮食能够增加54%AUC,药物需要与食物一起服用。药物代谢过程主要是酰胺水解和N-乙酰化作用(图1)。
3.1.2 基于可利用的数据确定Rociletinib的合适剂量
FDA与公司所得试验结果差异较大,FDA的结果进行了过二次确认,同时试验的总人群存在有区别,并且数据读取的方式不一样。两者标准的不同导致最后结果数据出现了差异。此次分析中,FDA将不同剂量安全性和有效性的数据汇总在一起进行比较,这种比较方法可以对Rociletinib肿瘤治疗效果的有效性进行合理评估。结果显示,药物500-1000 mg BID剂量与血液暴露量关系变化趋势平缓(非线性药代动力学)。暴露量与有效性的关系变化趋势平缓(图2),暴露于高剂量Rociletinib的患者并不一定有更好的获益。而有毒代谢物暴露量与安全性的关系变化趋势较大(图3),具有较高代谢物暴露量的患者QTc延长(与M460相关)和高血糖风险(与M502相关)增加。

图1 Rociletinib生物转化途径

图2 Rociletinib血液暴露量与有效性间关系
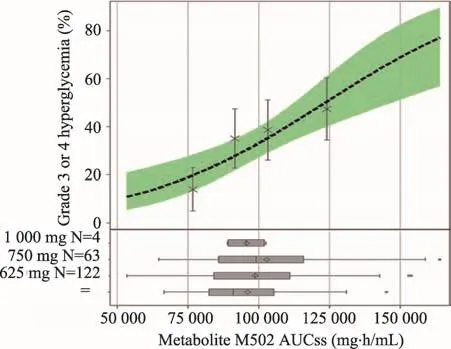
图3 Rociletinib血液暴露量与安全性间关系
4 Rociletinib安全性
4.1 QTc延长与代谢物M460血液浓度具有相关性
将QTc信息综合分析,从延长比例来看,可以看到QTcF≥450 ms的安全人群占63%,QTcF≥501 ms的安全人群占13%绝对值变化>30 ms的安全人群占76%,绝对值变化>60 ms的安全人群占34%。总的临床结果调查显示,有5例受试者出现了严重的心律失常甚至猝死。同时按照N-乙酰基转移酶2基因多态性分成的快代谢、中等、慢代谢人群进行分析可以看出快代谢人群的有毒代谢物M460血液浓度最低,并且也存在QTc延长现象,慢代谢人群的有毒代谢物M460的血液浓度最高。最严重的QTc延长超过了60 ms,快代谢人群发生率为22.9%,但是慢代谢人群发生率则达到了51%,所以有毒代谢物M460血液浓度与QTc延长具有相关性。体外实验也支持这一结论。

图4 QTc延长与代谢物M460血液浓度的关系
4.2 Rociletinib安全性堪忧
2016年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)报道的研究结果显示Rociletinib所有剂量组的平均ORR为33.9%,接受Rociletinib治疗后,经血液、组织、尿液的任一标本类型检测出的T790M突变阳性患者的ORR分别为32.1%、33.9%和36.7%其ORR缓解率相似。但在安全性方面,入组的548例患者中有35.2%的患者出现3级以上高血糖,10.2%的患者出现3级以上QT间期延长[13]。
在本品临床试验中,51%的受试者进行了剂量降低,最常见原因为高血糖(22%)和QTc延长(11%);47%的受试者出现了严重不良反应事件(Serious Adversary Event,SAE),需要特别关注QT间期延长和高血糖。对市场上流通的其他肿瘤治疗药物进行比较分析,在某些情况下,QTc延长并不是一件影响很大的事情,目前可导致QTc延长的许多相关药物也都已获得批准。Rociletinib针对的适应症是NSCLC,本身是非常有临床价值和优势的,但QT>500 ms的发生率为13%,远远高于其他所有已获批的肿瘤治疗药物,并且出现了1例尖端扭转型室性心动过速,2例和猝死。与此相比,治疗同一适应症的奥希替尼,其QT>500 ms的发生率仅有0.2%,因此,Rociletinib的安全性堪忧,特别是在QTc延长方面,与同类药物相比处于明显劣势。对于高血糖来讲,由快代谢、中等和慢代谢可以清晰地看到,不管是从一般高血糖还是严重高血糖进行分析均可以分析,其发生率与N-乙酰基转移酶2以及毒性代谢物M502的血液浓度都是密切相关的。
5 FDA审评意见
综上所述,FDA认为Rociletinib在有效性方面,经正确的数据分析后的ORR只有30.2%,进一步将所有数据铺在一起分析结果显示,其ORR大约只有25%,DoR为8.9个月;在安全性方面,本品存在严重以及危及生命的不良反应。由于本品进行的是单组研究,所以其真正的发病率未知,同时其有毒代谢物暴露量因为受N-乙酰基转移酶2(N-acetyltransferase 2,NAT2)基因多态性的影响而具有个体间差异大的特性。对于药物的使用剂量,申请人提出的625 mg使用剂量也并未得到认同,其剂量改动比率较高,并且<500 mg剂量的数据非常有限。
FDA对Rociletinib(NDA208542)的审评意见为,从有效性角度分析,它是有活性的,但可能并不优于已上市的同类药品。在安全性方面,提倡从机理角度去解释和分析出现QT间期延长现象的人群差异。此外,在剂量选择上,FDA并不同意申请人现在所提出的625 mg的使用剂量。对于此药物,FDA的最后审评意见是在最终试验结果出来以后,再确定审批结果。2016年4月12日,美国FDA抗癌药专家委员会以12:1的投票结果反对Rociletinib批准上市。
5.1 关于药物暴露量和有效性的报告
部分数据分析结果显示,625 mg与500 mg剂量相比,625 mg的血液浓度有时反而较低,这种高剂量代谢物比低剂量的血液浓度反倒更低的现象的出现,是因为慢代谢、快代谢人群分布的差异。若试验过程中,将这两种人群进行平衡,使慢代谢和快代谢均匀分布,其血液浓度差异应该消除。在研究的血浆暴露量范围内,血浆暴露量和它的疗效基本是平行线,是因为疗效已经达到最大限度,或者说是量效关系的平台区。
5.2 试验人群细分之结果利弊观
不同的代谢方式酶的基因多态性会影响药物血浆暴露量从而影响安全性和疗效,不同种族间这种基因多态性是有差异的,FDA曾发布过一个不同地区的种族敏感性分析数据,要求2017年5月份之后提交的数据都要对种族或者民族进行分层,这方面可能对中国国内的国际多中心类的研究有一个很好的借鉴。
之前对国际多中心临床试验进行人群标记时较为模糊,现在就可以对不同种族和地区的人群进行标记。但这种更为详细的划分方法,从亚群的统计分析上来说可能会较为困难。样本量太小,可能不具有普遍性,与整体人群差别较大,若出现此类异常结果,可尝试从药代、临床药理等角度进行分析反驳。从总体来讲,注意大数据与小数据结果的有效整合更有利于试验结果的透彻分析。
6 总结与展望
在本案例中,Rociletinib失败的原因除了有效性、安全性和剂量选择方面的缺陷,笔者认为另一不容忽视的问题是EGFR-TKI耐药机制的复杂性,并不是所有EGFR-TKI耐药都是由T790M突变产生。因此,多途径挖掘并找到精准的适应症人群才能做到真正的个体化精准治疗。虽然,Rociletinib的上市注册申请以失败而告终,但该项研究对T790M突变的检测经验仍值得借鉴。T790M血液、组织和尿液检测可相互补充,每种标本检测均可发现其他标本未检测出的病例,而且无论哪种标本检测出的T790M阳性患者,接受Rociletinib治疗,缓解率均相似,说明血液和尿液EGFR突变检测应被视为可行的方法,在肿瘤组织无法获得的情况下这种方法尤其值得推广。
致谢:本文根据王亚宁博士在“思与行——精准医疗下的中药研发及评价”系列讲坛中的报告整理,并得到王博士的指导,非常感谢王博士的支持!
1 Jemal A,Bray F,Center M M,et al.Global cancer statistics.CA-Cancer J Clin,2011,61(2):69-90.
2 Houston K A,Henley S J,Li J,et al.Patterns in lung cancer incidence rates and trends byhistologic type in the United States,2004-2009.Lung Cancer,2014,86(1):22-28.
3 Mok T S,Wu Y L,Thongrasert S,et al.Gefitinib or carboplatinpaclitaxelin pulmonary adenocarcionoma.N Engl J Med,2009,361(10):947-957.
4 Maemondo M,Inoue A,Kobayashi K,et al.North-East Japan Study Group.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR.N Engl J Med,2010,362(25):2380-2388.
5 Zhou C,Wu Y L,Chen G,et al.Erlotinib versus chemotherapy as firstline treatment for patients with advanced EGFR mutation-positive nonsmall cell lung cancer(OPTIMAL,CTONG-0802):a multicentre,openlabel,randomised,phase 3 study.Lancet Oncol,2011,12(8):735-742.
6 Rosell R,Carcereny E,Gervais R,et al.Spanish Lung Cancer Group in collaboration with GroupeFrancais de Pneumo-Cancerologie and AssociazioneItaliana Oncologis Toracica.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):amulticentre,open-label,randomised phase 3 trial.Lancet Oncol,2012,13(3):239-246.
7 Seauist L V,Yang J C,Yamamoto N,et al.Phase III study of afatinibor cisplat in plus pemetrexed in pat ient s with met a st at ic lungadenocarcinoma with EGFR mutations.J Clin Oncol,2013,31(27):3327-3334.
8 Yang J C,Wu Y L,Schuler M,et al.Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma(LUXLung3 and LUX-Lung 6):analysis of overall survival data from two randomised,phase 3 trails.Lancet Oncol,2015,16(2):141-151.
9 Wang S,Song Y,Yan F,et al.Mechanisms of resistance to third generation EGFR tyrosine kinase inhibitors.Front Med,2016,10(4):383-388.
10 Lola Fashoyin-Aje,Chao Liu.NDA 208542-Rociletinib FDA Presentation,Food and Drug Administration,2016.https://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/drugs/oncologicdrugsadvisorycommittee/ucm496630.pdf
11 Lynch T J,Bell D W,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib.N Engl J Med,2004,350(21):2129-2139.
12 Sequist L V,Soria J C,Goldman J W,et al.Rociletinib in EGFR-mutatednon-small-cell lung cancer.N Engl J Med,2015,372(18):1700-1709.
13 Wakelee H A,Gadgeel S M,Goldman J W,et al.Epidermal growth factor receptor(EGFR)enotyping of matched urine,plasma and tumor tissue from non-small cell lung cancer(NSCLC)patients(pts)treated with rociletinib.J Clin Oncol,2016,34(suppl):abstr 9001.
Analysis of FDA’s Review for NDA208542-Rociletinib
An Na,Tang Jianyuan
(Center for Drug Evaluation,China Food and Drug Administration,Beijing 100038,China)
Lung cancer is the highest mortality rate of malignancies in the world.Among them,non-small cell lung cancer(NSCLC)accounts for 85%.Epidermal growth factor receptor(EGFR)gene is one of the most common driving genes in NSCLC.The EGFR tyrosine kinase inhibitors(EGFR-TKIs)bring a breakthrough in the treatment for patients with EGFR gene-sensitive mutations.However,the drug resistance problem of EGFR-TKIs has been increasingly highlighted.So a drug for the patients accompanied by EGFR T790M positive mutation and along with progression in or after treatment with EGFR-TKI NSCLC is clinically urgent needed.Rociletinib is designed to address this unmet clinical need.While considering the non-superior effectiveness to the similar drugs in the market and the high risk of safety(hyperglycemia,QT prolongation and sudden death)of Rociletinib,the dosage was not accepted by the Food and Drug Administration(FDA).And Rociletinib did not make it to the market eventually.This paper discussed lessons learned from this case under review perspective for reference and inspiration.
Non-small cell lung cancer,U.S.Food and Drug Administration,review and approval,case analysis,new drug application,precision medicine
10.11842/wst.2017.07.001
R951
A
2017-07-10
修回日期:2017-07-20
* 通讯作者:唐健元,研究员,主要研究方向:药品监管科学、政策法规和临床评价。
(责任编辑:马雅静,责任译审:王 晶)

