慢性阻塞性肺疾病患者身体成分改变及合并肌肉减少症的影响因素研究
廉 洁,潘殿柱,安晓琴,李 洋
1.121000 辽宁省锦州市,锦州医科大学研究生学院 2.121000 辽宁省锦州市,锦州医科大学附属第一医院呼吸科 3.121000 辽宁省锦州市,锦州医科大学第一临床学院
·论著·
慢性阻塞性肺疾病患者身体成分改变及合并肌肉减少症的影响因素研究
廉 洁1,潘殿柱2*,安晓琴2,李 洋3
1.121000 辽宁省锦州市,锦州医科大学研究生学院 2.121000 辽宁省锦州市,锦州医科大学附属第一医院呼吸科 3.121000 辽宁省锦州市,锦州医科大学第一临床学院
目的了解慢性阻塞性肺疾病(COPD)患者的身体成分改变,并探讨其合并肌肉减少症的影响因素。方法选取2016年9—12月在锦州医科大学附属第一医院就诊的COPD患者96例为病例组;另于同期在本院体检者中,选取性别、年龄与病例组相匹配的健康成年人52例为对照组。检测并比较两组身高、体质量、BMI及身体成分情况;根据欧洲老年人肌肉减少症工作组(EWGSOP)制定的标准,以骨骼肌指数、步速为判断是否合并肌肉减少症的指标,采用单因素Logistic回归分析和多元逐步Logistic回归分析探讨COPD合并肌肉减少症的影响因素。结果病例组男性体质量、BMI、全身肌肉量、躯干肌肉量、双上肢肌肉量、双下肢肌肉量、四肢肌肉量、去脂体质量、骨骼肌指数、去脂体质指数低于对照组男性,差异有统计学意义(P<0.05);病例组女性体质量、BMI、全身肌肉量、躯干肌肉量、双上肢肌肉量、双下肢肌肉量、四肢肌肉量、去脂体质量、骨骼肌指数低于对照组女性,差异有统计学意义(P<0.05)。病例组肌肉减少症发生率高于对照组,差异有统计学意义(P<0.05)。单因素Logistic回归分析结果显示,年龄、病程、BMI是COPD合并肌肉减少症的影响因素(P<0.05);多元逐步Logistic回归分析结果显示,年龄、长期吸烟史、病程、BMI是COPD合并肌肉减少症的影响因素(P<0.05)。结论COPD患者肌肉量和去脂体质量明显低于健康者;COPD患者易合并肌肉减少症,高龄、长期吸烟、病程长、低BMI是其危险因素。
肺疾病,慢性阻塞性;肌减少症;身体成分;影响因素分析
廉洁,潘殿柱,安晓琴,等.慢性阻塞性肺疾病患者身体成分改变及合并肌肉减少症的影响因素研究[J].中国全科医学,2017,20(28):3504-3508,3514.[www.chinagp.net]
LIAN J,PAN D Z,AN X Q,et al.Changes in body composition and associated factors for sarcopenia in patients with chronic obstructive pulmonary disease[J].Chinese General Practice,2017,20(28):3504-3508,3514.
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的可以预防和治疗的疾病,其气流受限多呈进行性发展,与气道和肺组织对烟草烟雾等有害气体或有害颗粒的慢性炎性反应增强有关[1]。COPD主要累及肺脏,也可引起全身(或肺外)的不良效应[1]。COPD患者身体成分的改变主要表现为脂肪和肌肉的改变[2],且存在COPD患者脂代谢失调的证据[3]。骨骼肌的改变最终会导致肌肉减少症(sarcopenia)的发生,欧洲老年人肌肉减少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)将其定义为老年人骨骼肌质量、力量及功能下降的一种病症,主要强调骨骼肌质量下降,或伴有骨骼肌力量下降,或同时伴有骨骼肌功能下降[4]。近年研究结果显示,去脂体质量降低是COPD的主要并发症之一,最终可导致功能障碍[5]。本研究旨在了解COPD患者的身体成分改变,并探讨其合并肌肉减少症的影响因素,以为COPD患者的营养状态评估、骨骼肌功能障碍发生机制探索提供依据,最终寻求更有效的防治方法、提高患者生存质量、改善患者长期预后。
1 对象与方法
1.1 研究对象 选取2016年9—12月在锦州医科大学附属第一医院就诊的COPD患者96例为病例组。纳入标准:(1)年龄47~76岁;(2)就诊期间完成了肺功能检查、身体成分检测、握力检测、骨密度检测及相关问卷调查,临床资料完整。排除标准:(1)合并严重脏器功能障碍或不全,或伴有其他系统肿瘤;(2)不能自由行走和站立;(3)伴有精神疾患,或有酒精/药物滥用史;(4)伴有慢性肾炎,或接受透析治疗。另于同期在本院体检者中,选取性别、年龄与病例组相匹配的健康成年人52例为对照组。本研究经锦州医科大学附属第一医院伦理委员会审核批准,纳入者均签署知情同意书。
1.2 诊断标准 COPD:参照《慢性阻塞性肺疾病诊治指南(2013年修订版)》[1]中的相关诊断标准,病例组患者均经肺通气功能测定和舒张试验检查确诊。肌肉减少症:根据EWGSOP制定的标准,采用骨骼肌指数、握力、步速进行判定[4]。(1)骨骼肌指数,男≤7.01 kg/m2、女≤5.43 kg/m2;(2)握力,男≤35.04 kg、女≤21.82 kg;(3)步速≤0.8 m/s。当满足(1)+(2)或(1)+(3)时,可确诊为肌肉减少症[4]。本研究以满足(1)+(2)为肌肉减少症。
1.3 研究方法
1.3.1 资料收集 通过查阅体检报告,收集对照组的性别、年龄、吸烟时间等;通过查阅病历,收集病例组的性别、年龄、吸烟时间、病程、1年内病情加重次数、合并哮喘情况等。以吸烟≥10支/d,持续吸烟≥10年为有长期吸烟史。
1.3.2 身高、体质量测量 采用电子体质量秤(江苏思缔医疗科技有限公司,型号RGZ-120)测量两组身高、体质量,并计算BMI。测量身高时,嘱受试者赤脚站立,双脚合拢,高度齐于头顶,测量结果精确至0.1 cm;同时记录电子屏幕上的体质量,精确至0.1 kg。
1.3.3 肺功能检查 采用组合型肺功能仪(德国JAEGER公司)检查病例组沙丁胺醇(葛兰素史克公司制药有限公司,规格400 μg)舒张气道后的肺功能,主要记录指标包括第1秒用力呼气末容积占预计值百分比(FEV1%)、第1秒用力呼气末容积与用力肺活量比值(FEV1/FVC)、用力肺活量占预计值百分比(FVC%)。
1.3.4 身体成分检测 采用生物电阻抗分析仪(日本百利达公司,型号MC-180)检测两组肌肉、脂肪含量。操作方法为:在生物电阻抗分析仪上输入受试者性别、年龄、身高等信息,嘱受试者赤脚站立,双脚的前脚掌和后脚跟分别与仪器的脚部电极板接触,两手握住电极把手,放松身体,两臂自然下垂,点击“开始测量”,获得各项指标。主要记录指标包括全身肌肉量、躯干肌肉量、双上肢肌肉量、双下肢肌肉量、四肢肌肉量、全身脂肪量、去脂体质量,并计算骨骼肌指数、去脂体质指数、脂肪体质指数。骨骼肌指数=四肢肌肉量/身高2[6],去脂体质指数=去脂体质量/身高2[7],脂肪体质指数=脂肪量/身高2[7]。
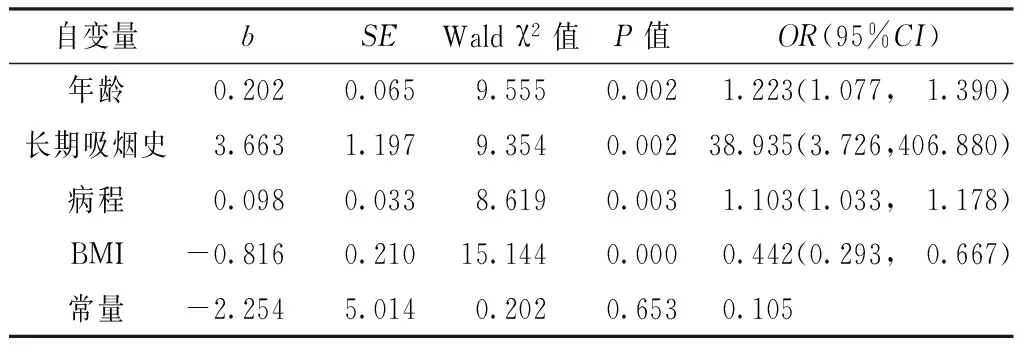
1.3.5 骨密度检测 采用骨密度测定仪(美国GE Healthcare公司,型号Achilles Express ver 7.50)检测病例组右脚跟骨骨密度。操作方法为:在骨密度仪的检测膜与受试者右足喷适量耦合剂,启动骨密度测定仪,记录T值及骨质情况。根据WHO推荐的T值评分法,将受试者的实际测量值与同性别健康青年组峰值进行比较,以-1 1.3.6 握力检测 采用握力计(广东香山衡器集团,型号EH101)检测两组握力,受试者手持握力测试仪,身体直立,两脚自然分开,两臂自然下垂,用优势手以最大力紧握把柄。测试2次,取最大值,精确至0.1 kg。 1.3.7 问卷评估 (1)采用改良的英国医学研究委员会呼吸困难量表(Modified Medical Research Council Scal,mMRC)对病例组呼吸困难程度进行分级。共包括5个等级,等级越高表明呼吸困难程度越重[9]。(2)采用慢性阻塞性肺疾病评估测试(COPD Assessment Test,CAT)对病例组的目前健康状态进行评估。测试共8个条目,各条目采用5级评分法,根据症状或症状的干扰程度分别计为1~5分。总分0~40分,以0~10分为轻微影响,以11~20分为中等影响,以21~30分为严重影响,以31~40分为非常严重影响[10]。 2.1 两组基本情况 对照组中,男27例(51.9%),女25例(48.1%),年龄45~76岁,平均年龄(61.0±5.8)岁,有长期吸烟史13例(25.0%)。病例组的基本情况见表1。 2.2 两组身高、体质量、BMI及身体成分比较 (1)两组男性体质量、BMI、全身肌肉量、躯干肌肉量、双上肢肌肉量、双下肢肌肉量、四肢肌肉量、去脂体质量、骨骼肌指数、去脂体质指数比较,差异有统计学意义(P<0.05);身高、全身脂肪量、脂肪体质指数比较,差异无统计学意义(P>0.05,见表2)。(2)两组女性体质量、BMI、全身肌肉量、躯干肌肉量、双上肢肌肉量、双下肢肌肉量、四肢肌肉量、去脂体质量、骨骼肌指数比较,差异有统计学意义(P<0.05);身高、全身脂肪量、去脂体质指数、脂肪体质指数比较,差异无统计学意义(P>0.05,见表3)。 表1 病例组基本情况 注:FEV1%=第1秒用力呼气末容积占预计值百分比,FEV1/FVC=第1秒用力呼气末容积与用力肺活量比值;FVC%=用力肺活量占预计值百分比,mMRC=改良的英国医学研究委员会呼吸困难量表,CAT=慢性阻塞性肺疾病评估测试 表2 两组男性身高、体质量、BMI及身体成分比较 表3 两组女性身高、体质量、BMI及身体成分比较 2.3 两组肌肉减少症发生率比较 对照组合并肌肉减少症3例(5.8%),病例组合并肌肉减少症27例(28.1%)。两组肌肉减少症发生率比较,差异有统计学意义(χ2=10.616,P<0.05)。 2.4 COPD合并肌肉减少症的影响因素分析 在病例组中,以是否合并肌肉减少症为因变量(赋值:否=0,是=1),以可能的发病因素[4,11-12]为自变量(赋值见表4),进行单因素Logistic回归分析和多元逐步Logistic回归分析。 表4 COPD合并肌肉减少症影响因素分析的自变量赋值情况 Table4 Assignment for independent variables possibly associated with COPD with sarcopenia 自变量赋值性别男=1,女=2长期吸烟史无=1,有=2哮喘未合并=1,合并=2CAT评分0~10分=1,11~20分=2,21~30分=3,31~40分=4骨质骨质正常=1,骨质少孔=2,骨质疏松=3 注:COPD=慢性阻塞性肺疾病;年龄、病程、1年内病情加重次数、mMRC分级、BMI以实际值纳入 2.4.1 单因素Logistic回归分析 单因素Logistic回归分析结果显示,年龄、病程、BMI是COPD合并肌肉减少症的影响因素(P<0.05,见表5)。 2.4.2 多元逐步Logistic回归分析 多元逐步Logistic回归分析结果显示,年龄、长期吸烟史、病程、BMI是COPD合并肌肉减少症的影响因素(P<0.05,见表6)。 COPD已经逐渐成为世界范围内慢性病发生率和死亡率较高的疾病之一,气道的慢性阻塞进行性发展为不完全可逆,导致通气血流比例失调,最终引起低氧伴或不伴高碳酸血症[13]。低氧除可损伤肺功能外,还与许多肺外全身性不良后果密切相关,包括骨骼肌损伤、肥胖、心血管疾病、糖尿病等[1]。骨骼肌损伤最终会并发肌肉减少症,有研究表明COPD患者的肌肉减少症发病率约为30%[14],与本研究结果相近。 表5 COPD合并肌肉减少症影响因素的单因素Logistic回归分析 Table5 Univariate Logistic regression analysis of the possible associated factors for COPD with sarcopenia 自变量bSEWaldχ2值P值OR(95%CI)性别3.1072.1282.1320.14422.344(0.345,1446.210)年龄0.3200.1217.0260.0081.377(1.087, 1.744)长期吸烟史2.9861.8382.6380.10419.800(0.540, 726.620)病程0.1090.0524.3990.0361.115(1.007, 1.234)1年内病情加重次数1.1281.3320.7170.3973.088(0.227, 42.012)哮喘1.8981.6821.2730.2596.675(0.247, 180.519)mMRC分级0.8620.6911.5990.2121.065(0.769, 1.474)CAT评分-1.9761.7311.3020.2540.139(0.005, 4.128)骨质0.6011.7720.1150.7341.825(0.057, 58.775)BMI-1.5270.7524.4320.0350.217(0.052, 0.900) 表6 COPD合并肌肉减少症影响因素的多元逐步Logistic回归分析 Table6 Multiple stepwise Logistic regression analysis of the possible associated factors for COPD with sarcopenia 自变量bSEWaldχ2值P值OR(95%CI)年龄0.2020.0659.5550.002 1.223(1.077, 1.390) 长期吸烟史3.6631.1979.3540.00238.935(3.726,406.880)病程0.0980.0338.6190.003 1.103(1.033, 1.178) BMI-0.8160.21015.1440.000 0.442(0.293, 0.667) 常量-2.2545.0140.2020.6530.105 目前,COPD患者的BMI下降已经得到证实[15],本研究也证实了该点。另外,一项国内研究针对BMI在COPD患者营养状态、骨密度及骨骼肌功能评估中的价值进行讨论,结果表明BMI可同时作为评估COPD患者营养状态和骨骼肌功能的评估指标[16]。对于COPD患者而言,去脂体质量是独立于脂肪体质量的1个死亡预测因子[5,17]。本研究结果也显示,COPD患者的去脂体质量明显低于对照组。排除个体因素后,去脂体质指数是1个与呼吸困难严重程度、肺功能、营养状态及生活质量关系更为密切的指标[18]。本研究结果显示,男性COPD患者的去脂体质指数明显低于对照组男性,而女性COPD患者的去脂体质指数与对照组女性间无差异,这可能与女性脂肪含量相对较多有关。由此推测,在同等严重程度的COPD患者中,相对于女性患者,男性患者的去脂体质指数改变对于评价营养状态更具有临床意义。 吸烟是COPD患者合并肌肉减少症的危险因素[19-20]。本研究将病例组的吸烟史划分为是否有长期吸烟史,结果进一步证明,有长期吸烟史是COPD合并肌肉减少症的危险因素之一。在明确香烟烟雾对COPD合并肌肉减少症有促进作用的同时,也强调了尽早戒烟对于延缓COPD患者健康状态恶化的积极作用。年龄本身与肌肉流失、纤维化、线粒体效率降低及神经肌肉接头功能下降有关[21],>50岁的COPD患者,每年存在1%~2%的肌肉流失[5]。COPD患者由于病情导致的运动量减少,会加剧年龄对合并肌肉减少症的影响。病程较长的患者日常活动减少,久坐习惯的养成以及心情抑郁会导致肌肉废用性萎缩(肌纤维变小、Ⅱ型纤维增多)[22]。韩国的一项研究结果表明,低BMI是>60岁患者发生肌肉减少症的危险因素之一[11]。本研究结果也显示,BMI是COPD合并肌肉减少症的影响因素。因此,减少吸烟或及早戒烟、适量运动、保持心情愉悦、增加一定量的营养物质摄入、保持适当水平的BMI,对减少COPD患者合并肌肉减少症的发生有积极作用。 对于肌肉减少症的诊断,目前尚无统一标准。本文采用的是EWGSOP提出的诊断标准,该标准综合了肌量、肌力及肌肉功能3个方面,通过骨骼肌指数、握力、步速进行判定[6]。结果证实,COPD患者的肌肉减少症发生率明显高于健康成年人,与西方部分研究结果略有差异[12,23]。这可能是因为:本研究样本量较少,亚洲人群在人种、体型、生活方式及文化背景等方面与西方存在明显差异。目前,针对亚洲人群COPD合并肌肉减少症的研究尚处于初步阶段,本研究结果可作为以我国人群为代表的亚洲人群肌肉减少症诊断统计数据的补充,对亚种人群COPD合并肌肉减少症诊断标准的制定存在重要意义。但本文也存在一定的局限性:(1)未利用步速这一指标对肌肉减少症进行诊断,基于COPD患者的实际情况(气促严重患者难以完成),仅采用骨骼肌指数+握力进行诊断,可能会对研究结果造成一定影响;(2)本研究样本量较少,可能会导致结论存在片面性。 作者贡献:廉洁参与文章的构思与设计、研究的实施与可行性分析、数据收集,负责数据整理与统计学处理、结果的分析与解释、撰写论文;潘殿柱参与文章的构思与设计、研究的实施与可行性分析,负责论文的中英文修订、文章的质量控制及审校,对文章整体负责,监督管理;安晓琴参与研究的实施与可行性分析、数据收集;李洋参与数据收集。 本文无利益冲突。 [1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中国医学前沿杂志:电子版,2014,6(2):67-80. [2]李春芝,刘洪英,刘军肖.慢性阻塞性肺疾病患者脂代谢和血清促血管生成素2水平与病情严重程度的关系[J].中国全科医学,2015,18(34):4210-4215.DOI:10.3969/j.issn.1007-9572.2015.34.014. LI C Z,LIU H Y,LIU J X.Relationship between lipid metabolism and serum angiogenin 2 levels in patients with COPD and illness severity[J].Chinese General Practice,2015,18(34):4210-4215.DOI:10.3969/j.issn.1007-9572.2015.34.014. [3]MIRZAIE M,KHERADMAND F.Bioactive lipids in emphysema.Decoding fat to reveal COPD phenotypes[J].Am J Respir Crit Care Med,2015,191(3):241-243.DOI:10.1164/rccm.201412-2264ED. [4]CEDERHOLM T,CRUZ-JENTOFT A J,MAGGI S.Sarcopenia and fragility fractures[J].Eur J Phys Rehabil Med,2013,49(1):111-117. [5]SCHOLS A M,BROEKHUIZEN R,WELING-SCHEEPERS C A,et al.Body composition and mortality in chronic obstructive pulmonary disease[J].American Journal of Clinical Nutrition,2005,82(1):53-59. [6]CRUZJENTOFT A J,BAEYENS J P,BAUER J M,et al.Sarcopenia:European consensus on definition and diagnosis Report of the European Working Group on Sarcopenia in Older People[J].Age & Ageing,2010,39(4):412-423.DOI:10.1093/ageing/afq034. [7]VANITALLIE T B,YANG M U,HEYMSFIELD S B,et al.Height-normalized indices of the body′s fat-free mass and fat mass:potentially useful indicators of nutritional status[J].American Journal of Clinical Nutrition,1990,52(6):953-959. [8]HOSOI T.Diagnosis and treatment of osteoporosis in men[J].Nihon Rinsho,2007,65(Suppl 9):S495-498. [9]MAHLER D A,WELLS C K.Evaluation of clinical methods for rating dyspnea[J].Chest,1988,93(3):580-586. [10]JONES P W,HARDING G,BERRY P,et al.Development and first validation of the COPD Assessment Test[J].European Respiratory Journal,2009,34(3):648.DOI:10.1183/0903193 6.00102509. [11]LEE S K,LEE J A,KIM J Y,et al.The risk factors of sarcopenia among Korean elderly men:based on 2009 Korean National Health and Nutrition Examination Survey Data[J].Korean Journal of Obesity,2014,23(1):139-140. [12]COSTA T M,COSTA F M,MOREIRA C A,et al.Sarcopenia in COPD:relationship with COPD severity and prognosis[J].J Bras Pneumol,2015,41(5):415-421.DOI:10.1590/S1806-37132015000000040. [13]张宏,孙辉,欧阳文,等.影响COPD患者机械通气时间的相关因素分析[J].安徽医学,2017,38(1):57-59.DOI:10.3969/j.issn.1000-0399.2017.01.016. ZHANG H,SUN H,OUYANG W,et al.Related factors affecting the time of mechanical ventilation in patients with COPD[J].Anhui Medical Journal,2017,38(1):57-59.DOI:10.3969/j.issn.1000-0399.2017.01.016. [14]CESARI M,PEDONE C,CHIURCO D,et al.Physical performance,sarcopenia and respiratory function in older patients with chronic obstructive pulmonary disease[J].Age & Ageing,2012,41(2):237.DOI:10.1093/ageing/afr167. [15]SCHOLS A M,SLANGEN J,VOLOVICS L,et al.Weight loss is a reversible factor in the prognosis of chronic obstructive pulmonary disease[J].Journal of Cardiopulmonary Rehabilitation,1999,19(4):265.DOI:10.1164/ajrccm.157.6.9705017. [16]丁怿虹,施劲东,刘勤,等.慢性阻塞性肺疾病患者体重指数和骨密度骨骼肌功能相关性研究[J].中国实用内科杂志,2016,36(8):675-679. DING Y H,SHI J D,LIU Q,et al.Correlation between BMI and bone mineral density,skeletal muscle function in patients with chronic obstructive pulmonary disease[J].Chinese Journal of Practical Internal Medicine,2016,36(8):675-679. [17]ABBATECOLA A M,FUMAGALLI A,SPAZZAFUMO L,et al.Body composition markers in older persons with COPD[J].Age & Ageing,2014,43(4):548-553.DOI:10.1093/ageing/aft196. [18]POTHIRAT C,CHAIWONG W,PHETSUK N,et al.The relationship between body composition and clinical parameters in chronic obstructive pulmonary disease[J].J Med Assoc Thai,2016,99(4):386. [19]BARREIRO E,PEINADO V I,GALDIZ J B,et al.Cigarette smoke-induced oxidative stress[J].American Journal of Respiratory & Critical Care Medicine,2010,182(4):477. [20]POMPE E,JONG P A D,RIKXOORT E M V,et al.Smokers with emphysema and small airway disease on computed tomography have lower bone density[J].International Journal of Chronic Obstructive Pulmonary Disease,2016,11(1):1207.DOI:10.2147/COPD.S103680. [21]李丽雅,赵岳.孤独症患儿父母创伤后成长与社会支持和应对方式的相关性研究[J].中国全科医学,2015,18(28):3485-3487.DOI:10.3969/j.issn.1007-9572.2015.28.024. LI L Y,ZHAO Y.Correlation of posttraumatic growth with social support and coping style in parents of children with autism [J].Chinese General Practice,2015,18(28):3485-3487.DOI:10.3969/j.issn.1007-9572.2015.28.024. [22]BLOOMFIELD S A.Changes in musculoskeletal structure and function with prolonged bed rest[J].Med Sci Sports Exerc,1997,29(2):197-206.DOI:10.1097/00005768-199702000-00006. [23]LEE D W,CHOI E Y.Sarcopenia as an independent risk factor for decreased BMD in COPD patients:Korean National Health and Nutrition Examination Surveys Ⅳ and Ⅴ(2008—2011)[J].PLoS One,2016,11(10):e0164303.DOI:10.1371/journal.pone.0164303. ChangesinBodyCompositionandAssociatedFactorsforSarcopeniainPatientswithChronicObstructivePulmonaryDisease LIAN-Jie1,PANDian-zhu2*,ANXiao-qin2,LIYang3 1.GraduateSchool,JinzhouMedicalUniversity,Jinzhou121000,China2.DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospitalofJinzhouMedicalUniversity,Jinzhou121000,China 3.TheFirstClinicalCollege,JinzhouMedicalUniversity,Jinzhou121000,China ObjectiveTo investigate the changes in body composition and associated factors for sarcopenia in patients with chronic obstructive pulmonary disease(COPD).MethodsNinety-six patients with COPD who were treated in The First Affiliated Hospital of Jinzhou Medical University from September to December 2016 were selected as the case group,and other 52 sex-and age-matched healthy adults underwent physical examination in the hospital during the same period were selected as the control group.All of them measured height,weight,BMI and body composition.In accordance with the definition and consensus diagnostic criteria developed by the European Working Group on Sarcopenia in Older People(EWGSOP),sarcopenia was identified by skeletal muscle mass index and gait speed.Univariate Logistic regression analysis and multiple stepwise Logistic regression analysis were performed to investigate the associated factors for COPD with sarcopenia.ResultsThe measured values of weight,BMI,total-body skeletal muscle mass,trunk muscle mass,upper extremity skeletal muscle mass,lower extremity skeletal muscle mass,limb skeletal muscle mass,lean body mass,skeletal muscle index and lean body mass index were lower in male COPD patients than in male controls(P<0.05).Female COPD patients were found with higher values of weight,BMI,total-body skeletal muscle mass,trunk muscle mass,upper extremity skeletal muscle mass,lower extremity skeletal muscle mass,limb skeletal muscle mass,lean body mass and skeletal muscle index compared with the female controls(P<0.05).The incidence of sarcopenia in case group was higher than that in the control group(P<0.05).The results of the univariate Logistic regression analysis showed that age,course of COPD and BMI are the associated factors of COPD with sarcopenia(P<0.05).Multivariate Logistic regression analysis showed that age,long-term smoking history,course of COPD,BMI are the associated factors of COPD with sarcopenia(P<0.05).ConclusionCOPD patients are identified with significantly decreased muscle mass(total-body skeletal muscle mass,trunk muscle mass,upper extremity skeletal muscle mass,lower extremity skeletal muscle mass,limb skeletal muscle mass) and declined lean body mass.Moreover,they are prone to suffer from sarcopenia.Advanced age,long-term smoking,long course of COPD and decreased BMI are the risk factors. Pulmonary disease,chronic obstructive;Sarcopenia;Body composition;Root cause analysis *通信作者:潘殿柱,教授,硕士生导师;E-mail:pandianzhu@163.com R 563.9 R 746.4 A 10.3969/j.issn.1007-9572.2017.28.011 *Correspondingauthor:PANDian-zhu,Professor,Mastersupervisor;E-mail:pandianzhu@163.com 2017-05-19; 2017-09-05) (本文编辑:王凤微)
2 结果




3 讨论