小檗碱对猪卵母细胞体外成熟过程miRNA及脂质代谢相关基因的影响
黄小萌,张 超,武 丽,刘 兵,王俊丽,曹素英,高建明
(北京农学院动物科学技术学院,北京102206)
小檗碱对猪卵母细胞体外成熟过程miRNA及脂质代谢相关基因的影响
黄小萌,张 超,武 丽,刘 兵,王俊丽,曹素英,高建明*
(北京农学院动物科学技术学院,北京102206)
本试验旨在探明小檗碱(Berberine,Ber)对猪卵母细胞体外成熟的作用及其对miRNA表达差异和脂滴代谢相关基因的影响。吸取法获取卵丘-卵母细胞复合体,0.1% 透明质酸酶脱除颗粒细胞的未成熟卵母细胞为GV组,以TCM-199培养液为体外成熟液作为对照组,添加中药单体成分Ber为Ber组,观察卵母细胞成熟效果,基因芯片技术分析Ber对猪卵母细胞体外成熟过程中miRNA的差异变化,尼罗红染色测定脂滴含量变化,RT-PCR检测候选基因及脂质代谢相关基因表达含量。结果表明: Ber组卵母细胞颗粒细胞扩散率(P<0.05)和第一极体排出率较对照组均差异显著(P<0.01);相比于对照组和GV组间的差异miRNA,Ber组上调4个在卵母细胞成熟中差异表达的miRNA,下调1个miRNA;Ber组卵母细胞脂滴含量明显少于对照组;Ber组卵母细胞中与脂质代谢相关的基因的表达均极显著低于对照组(P<0.01),且对照组卵母细胞极显著低于GV组(P<0.01)。Ber可能通过影响miRNA及脂质代谢相关的基因,降低猪卵母细胞中脂滴的含量,进而促进猪卵母细胞体外成熟。
Ber;miRNA;卵母细胞;体外成熟;脂质代谢;猪
卵母细胞质量是胚胎发育的基础,猪在解剖、生理、病理等方面与人体极为相似,是适合医学研究的常见动物模型[1],因此,探明影响猪卵母细胞体外成熟(In Vitro Maturation,IVM)质量的影响因素具有重要意义。研究表明,在哺乳动物原始卵泡生长发育到成熟排卵过程中,需要miRNA的参与。Tesfaye等[2]对牛体外成熟卵泡研究发现,在卵母细胞成熟过程中,miR-125a、miR-127、miR-145和miR-208的上调表达对卵泡发育具有重要作用。Qiyuan等[3]发现,在小鼠卵母细胞成熟过程中miRNA表达含量呈动态变化。与小鼠等其他哺乳动物相比较,猪卵母细胞miRNA的表达和功能研究分析相对较少,其作用机制尚不十分清楚。
Ber(Berberine,Ber)是从黄连种植物中提取的一种异喹啉生物碱化合物,有很广的生物学效应,具有调节糖脂代谢[4]等作用。本实验室前期研究发现,将中药单体成分Ber添加于胚胎培养液中,能调控小鼠附殖前胚胎抗调亡基因miR-21[5],显著促进小鼠体外培养的囊胚移植妊娠率和窝成活率[6]。因此,本试验在前期研究基础上,添加Ber于TCM-199体外成熟液中,探索Ber对体外成熟猪卵母细胞作用以及猪卵母细胞成熟过程中miRNA的差异表达影响,从而提高卵母细胞体外成熟质量,为卵母细胞体外成熟的研究和应用提供数据参考。
1 材料与方法
1.1 卵巢来源 从北京市沙河第五肉联厂的屠宰车间采集新鲜的猪卵巢,置入35℃含双抗的生理盐水中,1 h内运回实验室。
1.2 猪卵母细胞体外成熟 采用吸取法获取卵巢上3~6 mm卵泡中卵丘-卵母细胞复合体(Cumulus-Oocyte complexes,COCs), 经 TL-HEPES-PVA液洗涤 3遍,体视显微镜下挑选卵丘细胞2层以上、致密、胞质均匀的COCs,分别移入mTCM199成熟液中作为对照组,以及添加Ber(0.1 μg/mL,纯度 ≥ 99.97%,中国药品生物制品检定所)的mTCM199成熟液作为Ber组,于39℃、5% CO2、95%空气、100%相对湿度的CO2培养箱中体外培养44 h,其0~22 h添加0.5 μg/mL 促黄体素(LH)、0.5 μg/mL促卵泡素(FSH),而22~44 h不添加LH和FSH。IVM 44 h后,挑选颗粒细胞扩散3倍以上的COCs,用0.1% 透明质酸酶脱除颗粒细胞,挑选排出第一极体的卵母细胞备用,并统计第一极体排出率。
1.3 猪卵母细胞miRNA差异表达分析 收集0.1% 透明质酸酶脱除颗粒细胞后的胚泡(Germinal Vesicle,GV)期的未成熟卵母细胞为GV组,以及IVM 44 h的添加和未添加Ber的成熟卵母细胞(每组各500枚),保存于-80℃中,并存于干冰中送至上海康成生物科技有限公司,应用Exiqon miRNA Array分析卵母细胞成熟中miRNA的差异表达,完成GO和pathway分析。
1.4 猪卵母细胞脂滴染色 按照试剂盒说明,将卵母细胞用PBS清洗后,置于稀释后的GENMED染色液后,避光孵育10 min,将单个卵母细胞置于载玻片上,压片后,激光共聚焦扫描显微镜(FV-1000,OLYMPUS,日本)下观察荧光,Image J图像分析软件统计荧光面积。
1.5 RT-PCR验证候选基因 分别收集GV期卵母细胞、IVM 44 h的添加和未添加Ber的成熟卵母细胞各100枚于1.5 mL离心管中,按照RNA提取试剂盒说明提取总RNA,按照PCR试剂盒操作说明进行反转录和Real-time PCR。取12 μL RNA样本,依次加入 5×Buffer 4 μL,10×Nucleics Mix 2μL,Reverse Transcriptase Mix 2 μL ,制备 20 μL 反转录反应体系,混合均匀,37℃孵育60 min,95℃ 5 min,反转录产物于-20℃保存。反应在STRATAGENE荧光实时定量分析系统中按照miScript PCR Starter Kit试剂盒操作说明进行,GAPDH为内参基因。PCR反应条件为:95℃预变性15 min;94℃变性15 s,55℃退火30 s,70℃延伸30 s,共40个循环。采用2-ΔΔCt法进行基因的相对定量。试验重复3次。
1.6 统计分析 应用SPSS 17.0统计软件的单向方差分析和SNK多重比较法对数据进行分析和差异显著性比较。结果以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示无显著差异。
2 结 果
2.1 Ber对猪卵母细胞体外成熟的影响 由表1可见,经IVM 44 h,Ber组猪卵母细胞的颗粒细胞扩散率显著高于对照组(P< 0.05),且Ber组卵母细胞第一极体排出率极显著高于对照组(P < 0.01)。说明Ber能够提高猪卵母细胞体外成熟率。
2.2 Ber对猪卵母细胞体外成熟过程中miRNA的差异表达 分别检测GV期的未成熟卵母细胞、添加和未添加Ber的IVM 44 h的成熟卵母细胞中miRNA的差异表达。芯片结果显示(图1),相比于GV组,对照组93个miRNA上调(倍数≥2.0,下同),Ber组110个miRNA上调,其中共同上调miRNA 88个;对照组47个miRNA下调(倍数≤0.5,下同),Ber组50个miRNA下调,其中共同下调miRNA 39个。相比于对照组,Ber组上调miRNA 21个;下调miRNA 7个。相比于对照组和GV组间的差异miRNA,Ber组上调4个在卵母细胞成熟中差异表 达 的 miRNA(miR-542-3p、miR-192、miR-148b-5p和miR-331-5p), 下 调1个miRNA(miR-18b)(表2)。
2.3 候选基因验证结果 通过对miR-192、miR-542-3p、miR-18b及miR-9的 表 达 进 行RTPCR检测,从而验证芯片检测结果的可靠性。RTPCR结果表示,Ber组卵母细胞中miR-192和miR-542-3p的表达均极显著高于对照组和GV组(P<0.01),且对照组极显著高于GV组(P<0.01);Ber组卵母细胞中miR-18b的表达极显著低于对照组(P<0.01),且对照组极显著低于GV组(P<0.01);Ber组卵母细胞中miR-9的表达极显著高于GV组(P<0.01),但与对照间无显著差异(P>0.05)(图2-A)。与芯片检测结果相比(图2-B),RTPCR结果中miRNA的表达倍数略有不同,但其变化趋势及显著性一致,因此,基因芯片筛选的差异基因可靠有效。

表1 小檗碱对猪卵母细胞体外成熟的影响
芯片和RT-PCR结果均表明,Ber组卵母细胞中miR-192和miR-542-3p的表达均高于对照组和GV组,且对照组极显著高于GV组,在上调的基因中,miRNA-192表达倍数和含量均最多。因此,推测miRNA-192对猪体外成熟卵母细胞体外成熟作用显著。
2.4 差异表达miRNA的靶基因及通路分析 通过Pictar、miRscan、miRBase等预测软件,对miR-542-3p、miR-192、miR-148b-5p、miR-331-5p及miR-18b靶基因进行预测并通过GO分析,从生物学进程(BP)、细胞组成(CC)以及分子功能(MF)这3部分进行统计分析。结果发现,在BP方面,靶基因功能主要集中在物质代谢方面(包括基础代谢、大分子代谢和细胞大分子代谢)(图3-A);在CC方面,靶基因主要富集在细胞及其内外(图3-B);在MF方面,靶基因主要富集在物质结合方面(包括蛋白结合、酶结合等方面)(图3-C)。通过对靶基因进行pathway预测,差异基因主要集中在PPAR、NF-kB等通路(图4),且这些通路与细胞代谢和物质代谢有着极密切的联系。
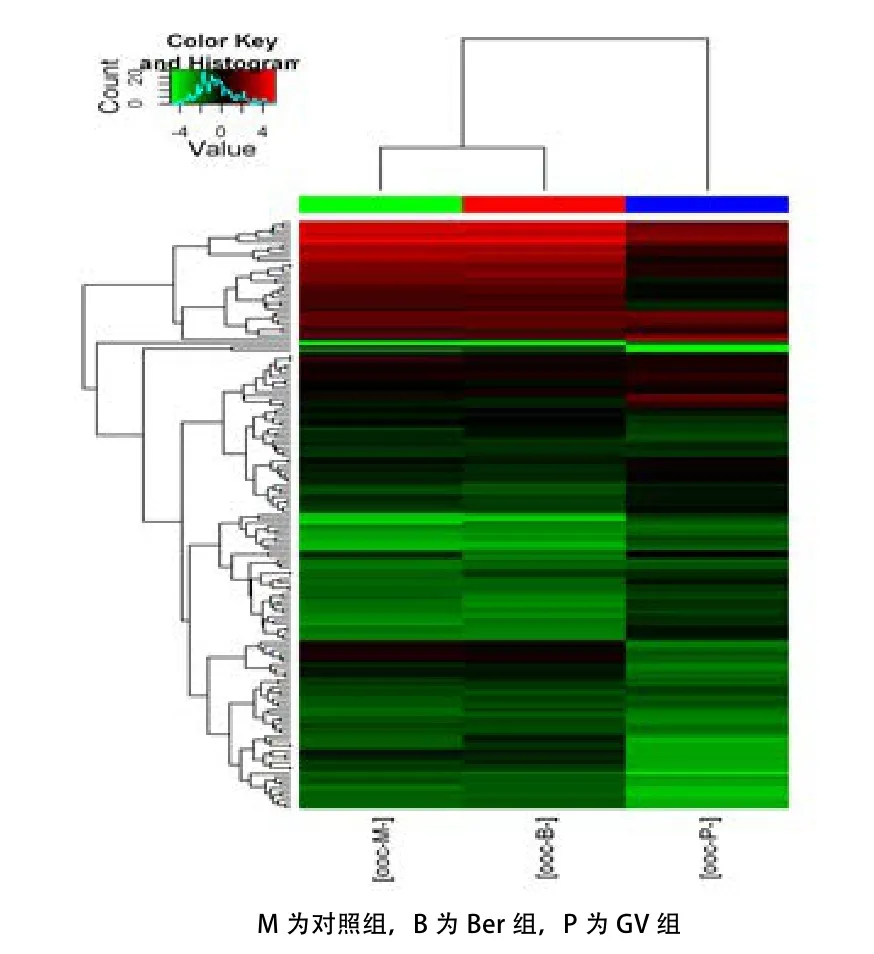
图1 miRNA的热图分析
2.5 Ber对猪卵母细胞脂滴代谢的调控作用 通过生物信息学预测发现,Ber可能参与了调控猪卵母细胞体外成熟过程中糖脂代谢过程,因此,应用尼罗红染色法对猪卵母细胞中脂滴进行荧光染色。由图5可知,相比于GV组,对照组成熟卵母细胞中脂滴量显著降低(P<0.05),Ber组极显著降低(P<0.01),且Ber组脂滴量显著低于对照组(P<0.05)。由此说明,在猪卵母细胞IVM过程中,脂滴逐渐减少,且添加Ber后,卵母细胞中脂滴的含量明显减少。可见Ber参与了猪卵母细胞中脂滴代谢过程。
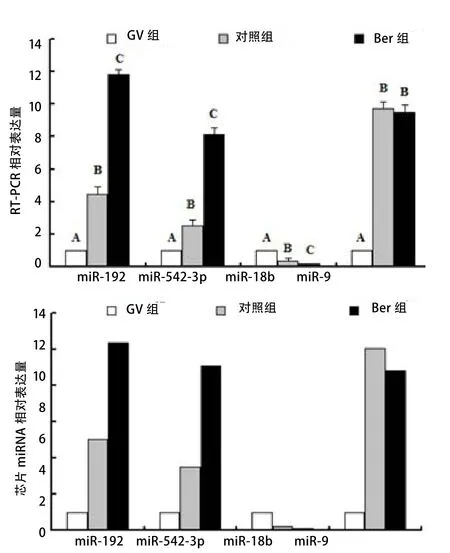
图2 不同组别卵母细胞中miR-192、miR-542-3p、miR-18b及miR-9的表达
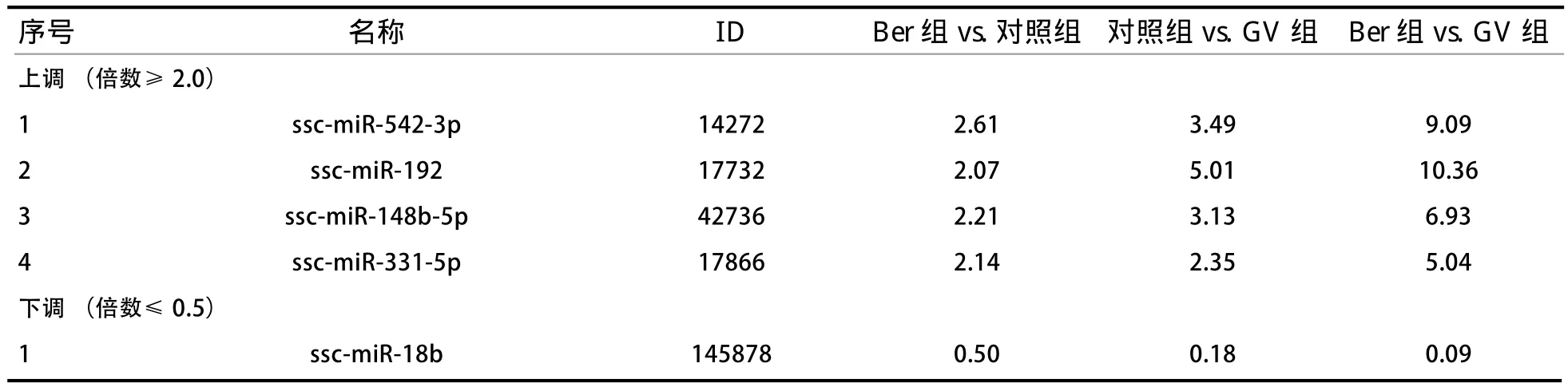
表2 Ber处理后差异表达的miRNA
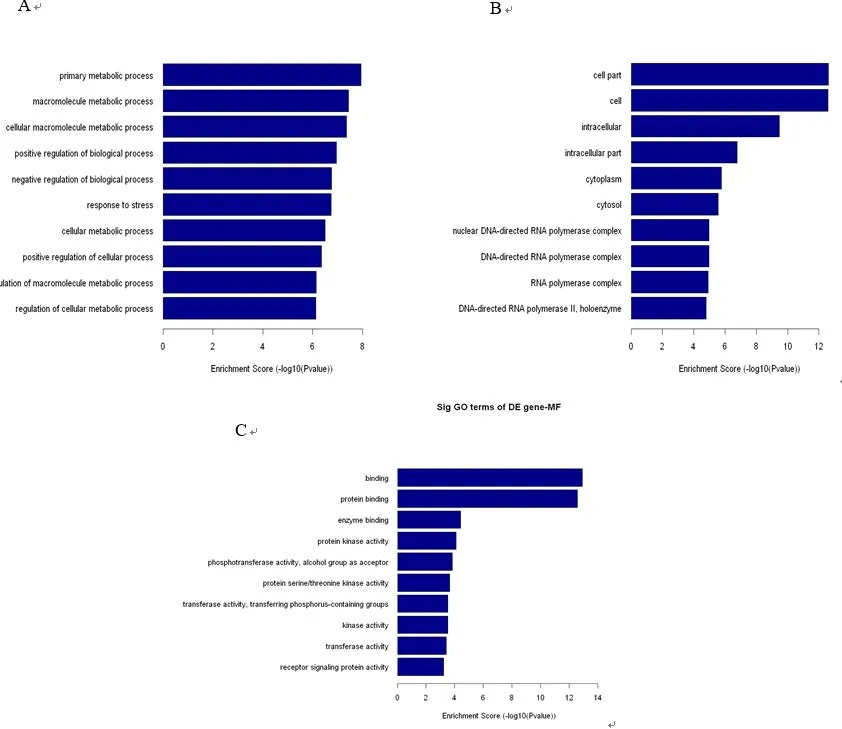
图3 差异表达基因的GO分析
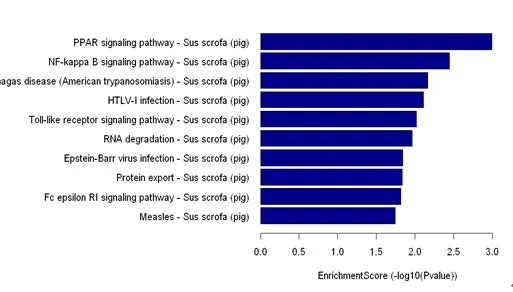
图4 差异miRNA靶基因的pathway分析
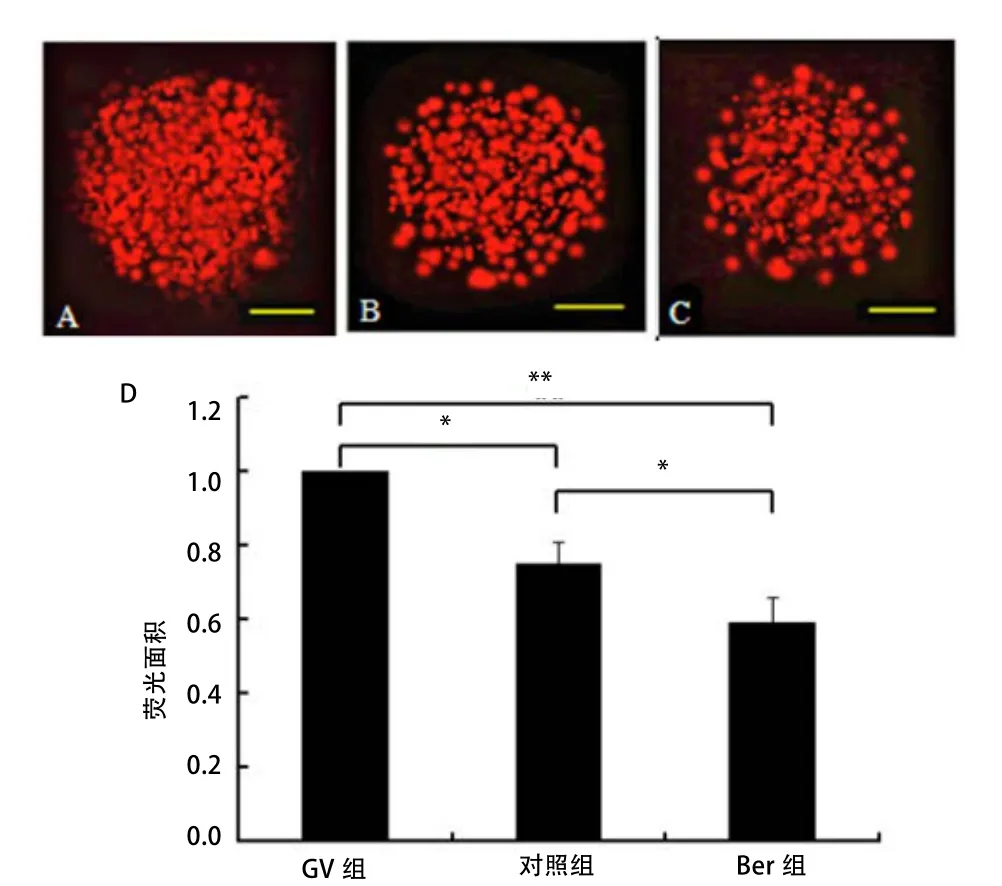
图 5 小檗碱对猪卵母细胞脂滴的影响
为确定Ber对猪卵母细胞脂滴的作用,检测了与脂质代谢相关的基因(脂肪酸结合蛋白,FABP3、胆固醇调节元件结合蛋白,SREBP1)和预测的信号通路基因(过氧化物酶体增殖物激活受体,PPARγ),FABP3、SREBP1和PPARγ的表达水平与脂质合成呈正相关。RT-PCR结果显示,Ber组卵母细胞中FABP3、SREBP1和PPARγ的转录水平均极显著低于对照组(P<0.01),且对照组卵母细胞极显著低于GV组(P < 0.01)(图6)。因此,推测Ber可能通过影响miR-192表达,以及FABP3、SREBP1、PPARγ等基因的表达水平影响猪卵母细胞脂滴代谢,提高了卵母细胞成熟率。
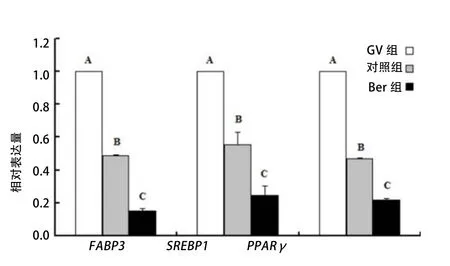
图6 小檗碱对脂质代谢相关基因转录水平的影响
3 讨 论
脂滴是卵母细胞的主要储能物质,可以为胚胎发育提供能量。脂滴是一个复杂的多功能细胞器,参与物质代谢、能量循环、信号传导等过程。猪卵母细胞中存在大量的脂滴,且脂滴较难代谢,致使猪卵母细胞的耐冻性极差,其冷冻卵母细胞解冻后的存活率和生存能力均受到极大的损害。在猪卵母细胞体外成熟过程中,细胞质内脂滴的含量与未成熟卵母细胞相比明显下降[7-8],这与本试验结果相一致。研究发现,脂滴含量较多的猪卵母细胞IVF囊胚发育率仅为3.3%,与之相反,脂滴较少的卵母细胞体外受精囊胚发育率为16.4%[9]。Watanabe等[10]发现,在猪IVM液中添加促脂质外流剂(甲基-β-环糊精)后,卵母细胞中脂滴含量下降,体外受精胚胎的卵裂率从69.6%提高至76.9%,囊胚发育率从9.5%提高至26.3%。本试验通过向猪卵母细胞IVM液中添加Ber,发现卵母细胞中脂滴的含量明显减少,成熟率显著提高。推测Ber可能是通过调控脂滴代谢而促进猪卵母细胞体外成熟。
miRNA对生物体具有多种重要的调节作用,但miRNA对卵母细胞成熟的作用却存在较大的分歧。有研究发现,由于Dgcr8在卵母细胞和早期胚胎中低表达,致使miRNA发挥作用的通道被阻断,从而miRNA在小鼠卵母细胞中不发挥作用[11]。还有学者认为在小鼠的卵子发生以及牛、猪卵母细胞成熟过程中,miRNA均发挥着重要的调控作用[12-14]。因此,miRNA与猪卵母细胞成熟关系值得探究。
本研究通过miRNA芯片技术比较了GV期未成熟卵母细胞、添加和未添加Ber的IVM卵母细胞中miRNA的差异表达,发现Ber能够上调4个与卵母细胞成熟相关的miRNA(miR-542-3p、miR-192、miR-148b-5p和 miR-331-5p), 下调1个miRNA(miR-18b)。其中,miR-542-3p和miR-192是变化倍数最大的2个miRNA,研究发现,miR-542-3p能够抑制肿瘤癌症细胞增殖过程[15],由于卵母细胞成熟过程中,细胞增殖和分化过程停滞,因此推断,miR-542-3p有可能通过抑制卵母细胞增殖和分化,而为卵母细胞的成熟提供更多的物质基础;miR-192的功能研究较多的集中于脂质代谢方面。Dionysios等[16]通过对小鼠长期饲喂高脂饲料,致使小鼠肥胖,检测其脂肪组织中miRNA的表达谱,发现肥胖小鼠的脂肪组织内,miR-192的含量明显降低,因此,miR-192可能对脂肪形成和堆积产生抑制作用。而且,与饲喂普通饲料母鼠的后代相比,长期饲喂高脂饲料母鼠的后代成年时肝脏中的miR-192等多个与脂肪代谢相关的miRNA表达出现显著下降[17],由此说明,母体的脂肪代谢能力可能通过miRNA介导,而对后代的脂肪代谢功能产生影响。因此推测,miR-192可能是调节卵母细胞中脂质代谢的重要基因。
为了确定Ber对猪卵母细胞脂滴的作用,本试验检测了与脂质代谢相关的基因FABP3、SREBP1和PPARγ,发现3个基因表达水平与脂质合成呈正相关。RT-PCR结果显示,Ber组卵母细胞中3个基因的转录水平均极显著低于对照组。后期将针对miRNA相关基因对猪卵母细胞脂滴代谢及其质量的影响机制进行深入研究。
4 结 论
Ber可能通过上调4个与猪卵母细胞成熟相关的miRNA(miR-542-3p、miR-192、miR-148b-5p和miR-331-5p)下调1个miRNA(miR-18b),降低猪卵母细胞中脂质代谢相关基因FABP3、SREBP1和PPARγ的转录水平,从而提高猪卵母细胞的体外成熟率。
致谢:
对于兽医学(中医药)北京市重点实验室;农业部都市农业(北方)重点实验室给予的支持,谨致谢忱!
[1] Prates E G, Marques C C, Baptista M C, et al. Fat area and lipid droplet morphology of porcine oocytes during in vitro maturation with trans-10, cis-12 conjugated linoleic acid and forskolin[J]. Animal, 2012, 7 (4) : 602-609.
[2] Tesfaye D, Worku D, Rings F, et al. Identification and expression profiling of microRNAs during bovine oocyte maturation using heterologous approach[J]. Mol Reprod Dev, 2009, 76: 665-677.
[3] Yang Q Y, Lin J M, Liu M, et al. Highly sensitive sequencing reveals dynamic modifications and activities of small RNAs in mouse oocytes and early embryos[J]. Sci Adv,2016, 2(6):e1501482.
[4] Choi Y J, Lee K Y, Jung S H, et al. Activation of AMPK by berberine induces hepatic lipid accumulation by upregulation of fatty acid translocase CD36 in mice[J].Toxicol Appl Pharm, 2017, 316:74-82.
[5] Zhang C, Shi Y R, Liu X R, et al. The anti-apoptotic role of berberine in preimplantation embryo in vitro development through Regulation of miRNA-21[J]. PLoS One, 2015,10(6): e0129527.
[6] 高建明,傅文栋, 陈武, 等. 中药成分小檗碱对小鼠2-细胞胚胎体外培养及移植效果的研究[J]. 中国畜牧杂志,2006, 42(15): 16-19.
[7] McEvoy T G, Coull G D, Broadbent P J, et al. Fatty acid composition of lipids in immature cattle, pig and sheep oocytes with intact zona pellucid[J]. J Reprod Fertil, 2000,118(1): 163-170.
[8] Prates E G, Alves S P, Marques C C, et al. Fatty acid composition of porcine cumulus oocyte complexes (COC)duringmaturation: effect of the lipidmodulators trans-10,cis-12 conjugated linoleic acid (t10, c12 CLA) and forskolin[J]. In Vitro Cell Dev An, 2013, 49: 335-345.
[9] Hiraga K, Hoshino Y, Tanemura K, et al. Selection of in vitro-matured porcine oocytes based on localization patterns of lipid droplets to evaluate developmental competence[J]. J Reprod Dev, 2013, 59: 405-408.
[10] Wantanabe H, Hirai S, Tateno H, et al. Variation of cholesterol contents in porcine cumulus-oocyte complexes is a key factor in regulation of fertilizing capacity[J].Theriogenology, 2013, 79: 680-686.
[11] Ma J, Flemr M, Stein P, et al. MicroRNA activity is suppressed in mouse oocytes[J]. Current Biol, 2010, 20:265-270.
[12] Tang F, Kaneda M, O’Carroll D, et al. Maternal microRNAs are essential for mouse zygotic development[J]. Gene Dev,2007, 21: 644-648.
[13] Chen L, Hu X, Dai Y, et al. MicroRNA-27a activity is not suppressed in porcine oocytes[J]. Front Biosci (Elite Ed),2012, 4: 2679-2685.
[14] Stowe H M, Curry E, Calcatera S M, et al. Cloning and expression of porcine Dicer and the impact of developmental stage and culture conditions on MicroRNA expression in porcine embryos[J]. Gene Combis, 2012,501(2):198-205.
[15] Yuan L, Yuan P, Yuan H, et al. miR-542-3p inhibits colorectal cancer cell proliferation, migration and invasion by targeting OTUB1[J]. Am J Cancer Res, 2017, 7(1):159-172.
[16] Chartoumpekis D V, Zaravinos A, Ziros P G, et al.Differential expression of MicroRNAs in adipose tissue after long-term high-fat diet-induced obesity in mice[J].PLoS One, 2012, 7: e34872.
[17] Zhang J, Zhang F, Didelot X, et al. Maternal high fat diet during pregnancy and lactation alters hepatic expression of insulin like growth factor-2 and key microRNAs in the adult offspring[J]. BMC Genomics, 2009, 10: 478.
Effects of Berberine on miRNA and Related Genes of Lipid Metabolism in Porcine Oocytes Matured in vitro
HUANG Xiao-meng, ZHANG Chao, WU Li, LIU Bing, WANG Jun-li, CAO Su-ying, GAO Jian-ming*
(Animal Science and Technology College, Beijing University of Agriculture, Beijing 102206, China)
To study the effects of berberine (Ber) on miRNA and related genes of lipid metabolism in porcine oocytes matured in vitro. Obtaining the cumulus oocyte complexes by the draw method , 0.1% hyaluronidase to remove granulosa cell of the immature oocytes as the GV group, GV porcine oocytes undergo in vitro maturation 44h, TCM-199 as control group and adding berberine as Ber group respectively, these groups oocytes were observed effects of matured in vitro and collected oocytes of GV, control and Ber group to proceed gene chip analysis. The content of lipid droplets were measured by Nile red staining, and RT-PCR was used to measure the related gene expression of lipid metabolism. Comparing with the control group, we found that granular cell proliferation rate ( P<0.05) and the polar body I (PbI )formation rate(P<0.01) were significantly increased. Comparing with the different expression miRNA of control group vs GV, Ber group up-regulated 4 miRNA and down-regulated 1 miRNA , and the GO and pathway analysis found that these miRNA mainly involved in metabolic process; The oocytes lipid content of Ber group significantly lower than that of the control;The lipid metabolism related genes expression all significantly lower than the control group (P<0.01) and the control group significantly lower than GV oocytes (P<0.01). Berberine through regulating miRNA and the related genes of lipid metabolism deceased porcine oocytes lipid content and improved the porcine oocytes matured in vitro.
Berberine; miRNA ; Oocytes; In vitro maturation; Lipid metabolism; Pig
S828.3
A
10.19556/j.0258-7033.2017-10-047
2017-08-01;
2017-08-24
国家自然基金项目(31572402);科技创新服务能力建设-科研计划(市级)重点项目(KZ201610020017)
黄小萌(1991-),女,内蒙古人,硕士研究生,研究方向为动物胚胎生物技术,E-mail:1747484059@qq.com;并列第一作者:张超(1990-),男,北京人,硕士研究生,研究方向为动物胚胎生物技术,E-mail:Zhangchao46@163.com
* 通讯作者:高建明,E-mail:gjmbac@sohu.com

