表阿霉素及其相关物质在反相离子对色谱中的色谱行为
刘文霞, 朱益雷, 魏惠珍, , 吕 尚, 吴柳瑾,罗小妹, 饶 毅*, 方海红*,3
(1.江西中医药大学药学院,江西南昌 330006;2.中药固体制剂制造技术国家工程中心,江西南昌 330006;3.江西科技师范大学药学院,江西南昌330013)
表阿霉素(Epirubicin)是临床上重要的蒽环类抗肿瘤药物[1],已广泛用于多种肿瘤的治疗[2 - 6]。其相关的杂质主要有阿霉素酮(Doxorubicinone)、柔红霉酮(Daunorubicinone)、阿霉素(Doxorubicin)、双氢柔红霉素(Dihydrodaunorubicin)、柔红霉素(Daunorubicin)和表柔红霉素(Epi-daunorubicin)等。表阿霉素与其相关物质在结构和性质上具有很高的相似度[7]。目前表阿霉素的测定方法主要有电致化学发光法[8]和液相色谱法。液相色谱法是分析表阿霉素较为理想的方法,但已报道方法[9 - 11 ]都是测定表阿霉素及其常见3种杂质,而另外3种相关物质研究较少。
反相液相色谱(RPLC)已经成为现代色谱学一种广泛使用的分离方法,然而在分析一些极性较大的化合物时,单一的反相色谱体系并不能得到满意的分离效果,往往会出现保留不足或色谱峰拖尾的现象[12 - 13]。十二烷基硫酸钠(SDS)是一种阴离子表面活性剂,液相色谱法常常将其加入到流动相中作为离子对试剂。样品在流动相中与离子对试剂生成不带电荷的疏水性离子对[14],然后吸附或溶解在固定相上。离子对试剂的烷基链越长,生成的离子对和反相键和相的亲和力越强,组分的保留值越大。本实验将SDS作为高效液相色谱流动相添加剂,考察不同条件对表阿霉素及其6种相关物质色谱行为的影响,根据所得的色谱参数,进一步了解其分离机理,为表阿霉素及其相关物质的分离测定提供新的思路。
1 实验部分
1.1 仪器与试剂
LC20ADXR高效液相色谱仪(日本,岛津公司),配有二元梯度系统泵、在线脱气系统、SPD检测器;AUW2200 型十万分之一电子分析天平(日本,岛津公司);AB104-N 型万分之一天平(梅特勒-托利多公司);PB-10 型 pH 计(sartorius 公司);Milli-Q 超纯水仪(Milipore 公司);KQ3200 型超声波清洗仪(昆山市超声仪器有限公司)。
表阿霉素、阿霉素酮、柔红霉酮、阿霉素、双氢柔红霉素、柔红霉素、表柔红霉素对照品及表阿霉素原料药均购自于意大利Sicor Società Italiana Corticosteroidi S.r.l公司。甲醇、乙腈(色谱纯,TEDIA公司);H3PO4、KH2PO4(分析纯,国药集团化学试剂有限公司);十二烷基硫酸钠(SDS)(优级纯,Sigma公司);电阻率18.2 MΩ·cm的超纯水。
1.2 对照品溶液的配制
取适量表阿霉素及其6种相关物质对照品,用甲醇超声溶解,配制成一定浓度的储备液,临用时用甲醇稀释并按一定比例混合。
1.3 色谱条件
色谱柱:依利特 Hypersil ODS2柱(250×4.6 mm,5 μm),流动相流速为1 mL/min,紫外检测波长为253 nm,柱温为30 ℃,进样体积为10 μL。
离子对试剂浓度和pH指的是流动相中水相部分,流动相比例通过动态混合二元泵调节,容量因子(k):k=(t-t0)/t0,其中t0为死时间,t为溶质保留时间。t0测定方法:用100%乙腈进样1 μL甲醇所得保留时间。实验测得该色谱柱死时间为2.130 min。
2 结果与讨论
2.1 有机相性质的考察
本文首先考察甲醇和乙腈对表阿霉素及其相关物质保留行为的影响。甲醇为典型的质子化溶剂,容易形成氢键,可与水分子竞争固定相表面的活性位点,破坏富水层的形成,增加固定相表面的疏水性,从而导致组分难以洗脱下来[12]。将甲醇比例增大同样会使组分间选择性降低,难以分离开。而作为非质子溶剂的乙腈洗脱能力更强,分离效果明显优于甲醇。
2.2 有机相比例的考察
分别调节流动相中乙腈体积百分比为30%、42%、45%、47%、50%、55%,考察有机相百分数与组分保留的影响。结果显示,随着乙腈比例增大,组分保留时间减小,当乙腈比例为 30% 时,只有阿霉素酮及柔红霉酮在60 min内被洗脱下来,乙腈比例大于47% 时,阿霉素酮保留时间过短,会受溶剂峰干扰。因此离子对试剂浓度和pH均采用 42% 乙腈比例进行考察。
2.3 离子对试剂浓度考察
按上述色谱条件,分别配制不同浓度(3.0、6.0、9.0、12.0、15.0 mmol/L)的SDS溶液,用H3PO4调节pH=3.0的缓冲液作为流动相的水相部分,考察SDS浓度对表阿霉素及其相关物质色谱行为的影响,SDS浓度与表阿霉素及其相关物质的色谱参数(分离度、容量因子、理论塔板数)变化见图1(A~C)。
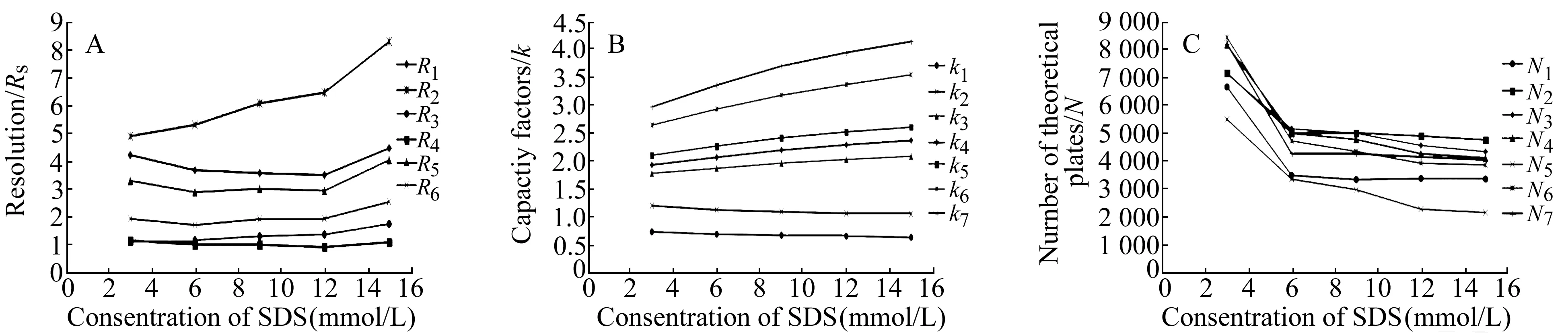
图1 SDS浓度对分离度(A)、容量因子(B)、理论塔板数(C)的影响Fig.1 Effect of SDS concentration on the resolution(A),capacity factor(B)and theoretical plate(C)Subscripts 1,2,3,4,5,6,7 of resolution(R),capacity factor(k),theoretical plate(N) refer to doxorubicinone,daunorubicinone,doxorubicin,epirubicin,dihydrodaunorubicin,daunorubicin,epi-daunorubicin .
由图1可以看出,随着离子对试剂(SDS)浓度增加,表阿霉素与相关物质的容量因子增大(由于阿霉素酮及柔红霉酮不含与离子对作用的极性基团,保留值几乎不受离子对试剂的影响),理论塔板数有所下降,这主要是因为流动相中离子对试剂浓度增加,形成中性离子对复合物的能力加强,减弱了固定相上离子化组分与极性基团之间的排斥作用,增强分析物在色谱柱上的保留。然而浓度较高的离子对试剂会影响反向C18色谱柱的活性位点,使柱效降低,因此为防止离子对试剂与固定相产生不可逆吸附,不宜使用过高浓度该试剂,并且实验后用大量水将其冲洗干净,否则会大大缩短色谱柱的寿命。此外,各组分之间的选择性随着离子对试剂浓度增加而增大。
2.4 pH的考察
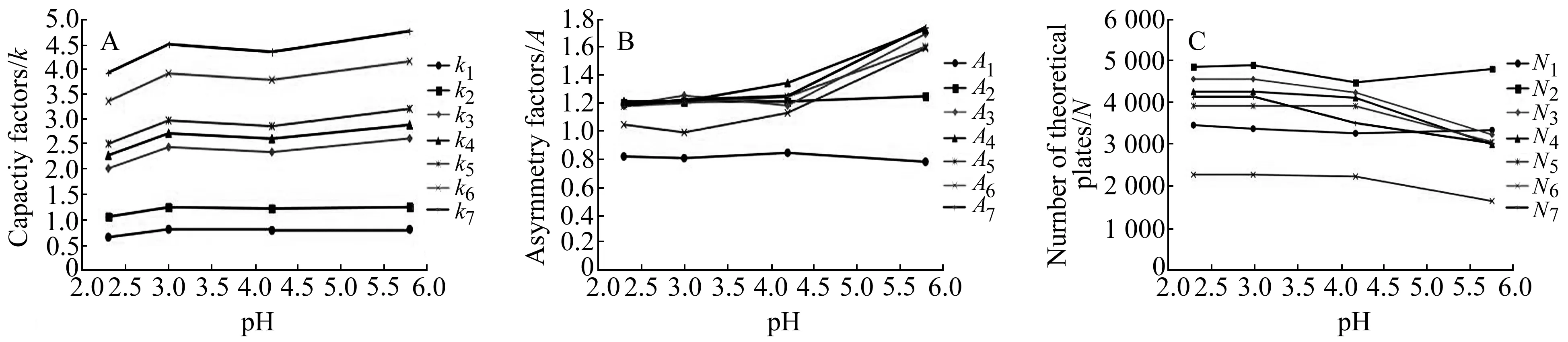
图2 pH对容量因子(A)、对称因子(B)、理论塔板数(C)的影响Fig.2 Effect of pH on the capacity factor(A),asymmetry factor(B)and theoretical plate(C)Subscripts 1,2,3,4,5,6,7 of capacity factor(k),asymmetry factor(A),theoretical plate(N) refer to doxorubicinone,daunorubicinone,doxorubicin,epirubicin,dihydrodaunorubicin,daunorubicin,epi-daunorubicin.
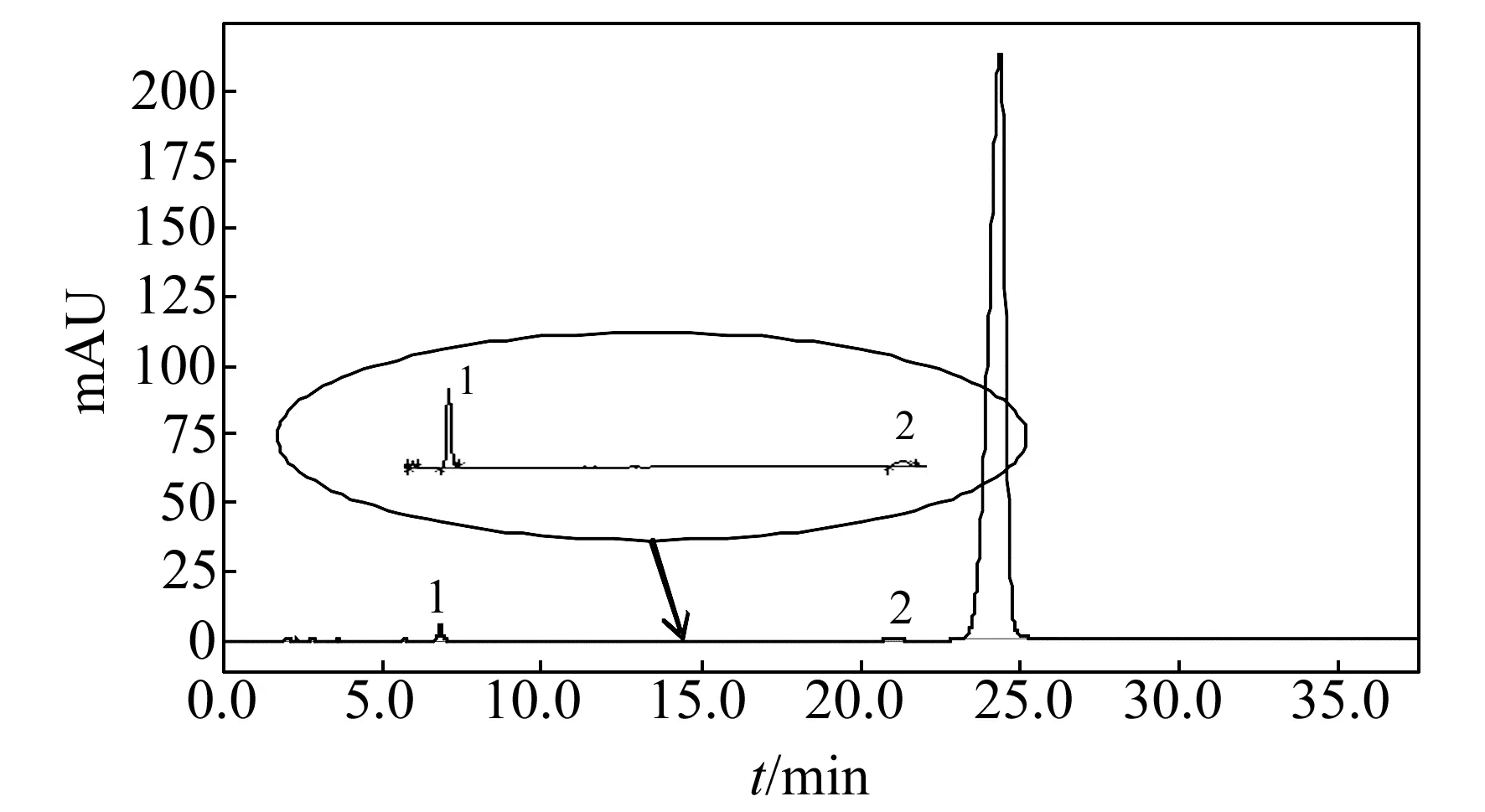
图3 表阿霉素原料药在C18色谱柱上的分离谱图Fig.3 Chromatogram of epirubicin raw materials on a C18 column
其他液相色谱条件相同情况下,考察流动相中水相的不同pH值(2.3、3.0、4.2、5.8 )时表阿霉素及其相关物质的容量因子、对称因子与理论塔板数的变化,结果见图2(A~C)。结果显示,表阿霉素和阿霉素、双氢柔红霉素、柔红霉素、表柔红霉素保留值的变化受pH值基本一致,当pH=2.3~4.2时,容量因子的变化趋于平坦,当 pH继续增大,容量因子迅速上升,表明这5种成分存在离子交换作用,在酸性较强的情况下,组分主要以阳离子形式存在,随着流动相pH升高,组分由离子状态渐渐转化为分子状态,在固定相的吸附能力逐渐增强,保留值增大。此外,对称因子随着缓冲液pH升高而增大,可能是酸性条件下流动相对固定相上游离的硅羟基掩蔽作用导致[15],从而减弱了分析物中极性基团与硅羟基的作用[16]。与此同时,柱效随着pH的升高而降低,这与离子交换作用能力强弱有关[17],随着缓冲液pH值增加,各组分的离子浓度降低,理论塔板数降低。阿霉素酮及柔红霉酮由于分子结构中缺少其他5种化合物上糖片段上-NH2,pH的变化对其影响很小,几乎不存在离子交换作用。
2.5 实际样品中的应用
本文选择表阿霉素原料药作为研究对象,用于考察反相离子对色谱模型中实际样品中表阿霉素及其相关物质的分离效果。图3所示为表阿霉素原料药在C18柱的色谱分离图,杂质阿霉素酮、阿霉素与表阿霉素的分离度均大于2。在本实验条件下,表阿霉素与其异构体阿霉素、杂质得到了较好的分离,可用于表阿霉素的质量控制。
3 结论
本文尝试了在反相离子对色谱模型中,以SDS-磷酸盐缓冲溶液和乙腈体系为流动相,考察了表阿霉素及其6种相关物质在C18柱中的色谱行为,主要探讨缓冲液pH和离子对试剂SDS对分析物分离效果、保留因子和柱效的影响,证实了SDS可作为表阿霉素及其相关物质高效液相色谱法的流动相改性剂,根据分离物质结构不同,选择不同的色谱条件,为该类化合物的分离测定方法提供新的思路。同时也发现,高浓度离子对试剂会降低色谱柱的柱效,溶解性较差的长烷基链离子对试剂对不同分析柱和整个色谱系统有所损伤等问题,有待进一步深入研究。

