罗红霉素分子印迹吸附树脂的制备及吸附性能研究
(潍坊科技学院综合教育学院,山东寿光 262700)
罗红霉素分子印迹吸附树脂的制备及吸附性能研究
李培绪
(潍坊科技学院综合教育学院,山东寿光 262700)
本文以罗红霉素(ROX)为模板分子,丙烯酰胺为功能单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂,D101树脂为载体,采用溶液聚合法,制备得到罗红霉素分子印迹D101树脂(ROX-MIP-D101),采用红外光谱、扫描电镜初步表征了结构。通过静态和动力学吸附实验研究了ROX-MIP-D101对ROX的吸附性能。以红霉素(EM)为竞争底物,研究了ROX-MIP-D101对ROX的吸附选择性。结果显示,ROX-MIP-D101对ROX的静态平衡吸附量为253 mg/g,明显大于NIP-D101的静态平衡吸附量(211 mg/g),说明其对ROX的吸附能力大于NIP-D101。ROX-MIP-D101对ROX和EM的分离因子为1.26,说明其对ROX具有较好的吸附选择性,而NIP-D101对ROX和EM的分离因子为1.01,基本没有选择性。重复使用性实验表明,ROX-MIP-D101的重复使用性能良好。环境水样的平均加标回收率达90.8%。
D101吸附树脂,罗红霉素,分子印迹,吸附性能
罗红霉素(Roxithromycin,ROX)是对红霉素进行结构改造后的一种红霉素衍生物,属于第二代大环内酯类抗生素。在我国,罗红霉素作为兽用药或者饲料的添加剂广泛应用于畜牧业。人体长期摄入含少量抗生素残留的动物源性食品后,可造成药物积累,当达到一定浓度后,就会产生毒副作用,发生过敏反应,产生致癌、致畸、致突变等作用[1]。因此,西方发达国家严格规定了罗红霉素在动物体内的残留量,我国也正在积极考虑制定相关的规定[2-3]。
动物源性食品中兽药残留量分析一般包括样品前处理和测定方法两部分,样品前处理是抗生素检测技术的核心,直接影响到分析检测的各项指标、成本和效率。目前,前处理方法以萃取为主,包括液-液萃取(LLE)[4-5]、固相萃取(SPE)[6-7]、基质固相分散(MSPD)[8,9]和超临界流体萃取(SFE)[10-11]等,以上萃取方法各有优缺点。而分离提取ROX仍以液液萃取为主,萃取剂主要有甲醇、乙腈、异丙醇、乙酸乙酯、氯仿等有机溶剂以及混合溶剂。液液萃取对实验条件要求不高,但是操作繁琐,选择性差,且溶剂毒性大,易产生大量的废液[5]。
分子印迹聚合物(MIP)是利用分子印迹技术制备的一种高分子材料,其主要特点是对特定分子具有较高的特异识别性和选择性[12-15]。将MIP用于ROX检测前的浓缩提取,有助于克服目前对ROX浓缩提取效率不高的缺陷。贾宝秀[16]以α-甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,合成了ROX分子印迹聚合物,其对ROX的最大表观结合量为 90.3 mg/g,以阿奇霉素为竞争底物,显示出较高的选择性。唐志民[17]以硅胶为载体,甲氧基硅烷为表面改性剂,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,制备得到硅胶表面罗红霉素分子印迹材料,其对ROX的饱和吸附量分别为106 mg/g,以红霉素为竞争底物,其分离因子为1.21,选择性较好。D101大孔吸附树脂是以苯乙烯为聚合单体,二乙烯苯为交联剂,甲苯、二甲苯等作为致孔剂,通过交联聚合形成的大孔吸附树脂,属于非极性树脂,具有多孔网状结构、巨大的比表面积以及优良的吸附性能。将MIP技术与D101相结合,可以在D101树脂具有的强吸附性能基础上,赋予其选择性。目前有关D101-MIP的研究报道不多[14]。
本文以ROX为模板分子,D101树脂为载体,丙烯酰胺为功能单体,采用溶液聚合法,制备ROX分子印迹D101吸附树脂(ROX-MIP-D101),并考察其对ROX的吸附性能。
1 材料与方法
1.1材料与仪器
罗红霉素(ROX,≥98%) 浙江国邦药业有限公司;红霉素(EM,≥98%) 上海沃凯化学试剂有限公司;D101大孔吸附树脂(比表面积为480~520 m2/g) 西安蓝晓科技新材料股份有限公司;丙烯酰胺(AM,CP,98%) 国药集团北京化学试剂公司;乙二醇二甲基丙烯酸酯(EGDMA,CP,98%) 阿拉丁试剂(上海)有限公司;偶氮二异丁腈(AIBN,AR) 天津市致远化学试剂有限公司;乙腈(AR) 天津市康科德科技有限公司;其他试剂 均为国产分析纯。
Quanta200E环境扫描电子显微镜 荷兰FEI公司;IR Prestige-21傅里叶红外分光光度计 日本岛津公司;Mastersizer2000激光粒度分析仪 英国马尔文公司;UV759S紫外可见分光光度计 上海仪电分析仪器有限公司。
1.2实验方法
1.2.1 树脂的预处理 D101树脂置于无水乙醇中充分搅拌浸泡24 h,用蒸馏水洗至中性。然后用5%盐酸溶液洗涤树脂,蒸馏水冲洗至中性。再用5%氢氧化钠溶液洗涤树脂,蒸馏水冲洗至中性,真空干燥备用。
1.2.2 ROX分子印迹D101树脂(ROX-MIP-D101)的制备 将一定量的EGDMA及AM加入到ROX甲醇-乙腈(体积比1∶3)溶液中并充分溶解,通入氮气以置换空气,然后密封,常温静置24 h,以生成预聚体。将一定量的D101树脂和AIBN的乙腈溶液加入到预聚体中,于50 ℃充分搅拌反应20 h。过滤,固体产品用甲醇/冰醋酸溶液(体积比9∶1)反复洗涤多次,再用蒸馏水反复洗涤至中性,然后真空干燥,得ROX分子印迹吸附树脂(ROX-MIP-D101)。空白分子印迹D101树脂(NIP-D101)按上述相同方法制备,只是不加模板分子[14-15]。
1.2.3 表征 采用傅里叶红外分光光度计测定D101树脂和DOP-MIP-D101的红外光谱,溴化钾压片法。采用环境扫描电子显微镜观察D101树脂和ROX-MIP-D101的形貌。
1.2.4 ROX标准 罗红霉素在210 nm处有紫外吸收,但吸收较弱,且受溶剂的干扰较大,导致分析重复性差、灵敏度较低[18]。罗红霉素在冰醋酸中可被浓盐酸降解,降解后可与对二甲胺基苯甲醛生成有色物,在486 nm波长处有最大紫外吸收,利用这一原理可以使用紫外分光光度法测定ROX的浓度[19]。
取6个50 mL容量瓶,将20 mL冰醋酸、5.0 mL 0.5%(w/v)对二甲胺基苯甲醛的冰醋酸溶液移入每一个容量瓶中。配制罗红霉素标准溶液(0. 8 mg/mL),然后准确量取浓度为0. 8 mg/mL的标准溶液 0.5、1.0、1.5、2.0、2.5、3.0 mL,分别移入上述6个容量瓶中。最后在每一个容量瓶中加入盐酸-冰醋酸溶液(2∶1)并稀释至刻度。将容量瓶内液体充分混合均匀后于常温条件下放置15 min,以使反应充分进行完全。
用紫外分光光度计在486 nm处测定上述溶液的紫外吸光度值,制作标准曲线。
1.2.5 ROX-MIP-D101的静态吸附性能研究 在14个5 mL的试管中,分别加入0.1 g的ROX-MIP-D101,其中的1号试管为空白对照组,内盛3 mL甲醇。在其余的试管中,分别加入不同浓度的罗红霉素溶液3 mL,其浓度分别为 0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0、2.5、3.0、4.0、6.0、8.0 g/L。将所有试管置于振荡器中连续振荡24 h,以充分达到吸附平衡,然后离心,吸取上部清液测定ROX的浓度。
1.2.6 ROX-MIP-D101的动态吸附性能研究 在9个5 mL小试管中,各加入10 mg ROX-MIP-D101和2.0 g/L的ROX溶液3 mL,混合均匀后于10、30、60、90、120、150、180、240、300 min取出一个小试管,离心分离后测定上清液的紫外吸光度值,然后根据标准曲线计算ROX浓度。
1.2.7 选择性吸附实验 因EM与ROX的结构比较相似,本文选择EM为竞争底物对ROX-MIP-D101进行选择性吸附实验。具体方法为:准确量取ROX-MIP-D101和NIP-D101各10 mg,分别置于两个容器内,在两个容器内均加入1 mmol/L的ROX和EM溶液各3 mL,于振荡器上振荡24 h,固液分离后测定上清液的紫外吸光度值,然后根据标准曲线计算ROX浓度。采用下式计算KD以及α[20]。KD为静态分配系数,α为分离因子,一般α越大则对模板分子的选择性越高。
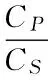

1.2.8 重复利用性能(吸附-解吸)实验 在5 mL 1.0 g/L ROX甲醇溶液中加入20 mg DOP-MIP-D101,然后室温下充分振荡4 h,离心分离,测定上层清液的ROX浓度。将离心分离出的下层DOP-MIP-D101固体,用甲醇-醋酸溶液(9∶1,体积比)充分洗涤多次直至洗脱液中检测不出ROX为止,然后再用甲醇洗涤,真空干燥。洗涤干燥后的DOP-MIP-D101,再按照上述相同步骤重复吸附解吸实验,重复10次。
1.2.9 环境水样中ROX的测定 环境水样为取自某市周边湖泊中的水样。
固相萃取柱的制备:将100 mg DOP-MIP-D101填充于聚丙烯固相萃取空管中。在空管底部预先放置一层聚乙烯筛板,压紧聚合物,使其表面平齐,上面再放置一层筛板,压实聚合物,使筛板和聚合物粉末间紧密结合。使用前分别用3 mL 甲醇和3 mL 乙腈活化,氮气吹干备用。
分离富集过程:将2 mL环境水样到萃取柱中,保持流速为2 mL/min,然后用3 mL甲醇-乙腈(体积比1∶3)溶液对萃取柱进行淋洗,最后用3 mL甲醇/冰醋酸溶液(体积比9∶1)混合溶液洗脱。收集洗脱液,用紫外光谱仪测定ROX,计算回收率。
2 结果与讨论
2.1红外光谱分析
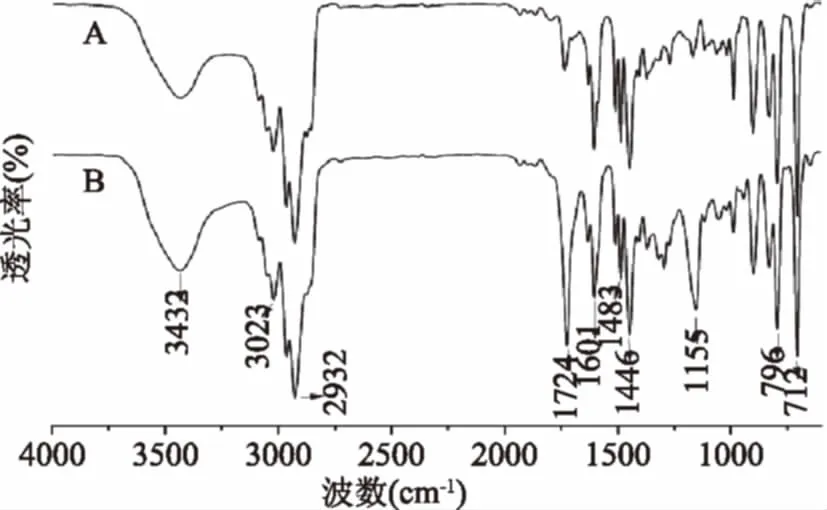
图1 D101树脂(A)和ROX-MIP-D101(B)的红外光谱图Fig.1 FTIR spectra of D101 resin(A)and ROX-MIP-D101(B)
图1是D101树脂和ROX-MIP-D101的红外光谱图。由图1可知,D101吸附树脂具有典型的由苯乙烯-二乙烯苯共聚物为主的吸附树脂的结构特征,其主要基团为苯基和-CH2基团,具体特征峰为:3432 cm-1的羟基O-H伸缩振动吸收峰(由树脂中吸附的微量水份造成);3023 cm-1的苯环上C-H伸缩振动峰;2931、2865 cm-1的饱和-CH2中C-H键的伸缩振动吸收峰,1601 cm-1处的苯环骨架上-C=C-伸缩振动吸收峰;1483、1446 cm-1的饱和-CH2的弯曲振动吸收峰;712、796 cm-1的一元取代苯环上C-H弯曲振动吸收峰。ROX-MIP-D101的红外谱图与D101树脂相似,但是新出现了1724 cm-1的-C=O特征吸收峰和1155 cm-1的-C-O-C-醚键的吸收峰,这是以丙烯酰胺为单体、乙二醇二甲基丙烯酸酯为交联剂的分子印迹聚合物的特征峰,说明在D101树脂表面形成了分子印迹聚合物[17]。
2.2扫描电镜分析
由图2A可知,D101吸附树脂基本呈现球形,表面比较干净,无明显附着物。由图2B可明显看出,ROX-MIP-D101依然保持为球形,但表面明显有附着物覆盖。

图2 D101树脂(A)和DOP-MIP-D101(B)的SEM照片Fig.2 SEM images of D101 resin(A)and ROP-MIP-D101(B)
2.3标准曲线
图3为罗红霉素标准曲线,其回归方程为y=0.0209x-0.03598,R2=0.9996(n=5)。

图3 罗红霉素标准曲线Fig.3 The standard curve of roxithromycin
2.4ROX-MIP-D101的静态等温吸附性能
图4是ROX-MIP-D101和NIP-D101(B)的静态吸附等温线。由图4可知,ROX-MIP-D101和NIP-D101对罗红霉素的吸附量,随着罗红霉素溶液浓度的增加而逐渐增大,当罗红霉素溶液浓度增大到一定数值后,吸附量不再增加,即达到吸附平衡状态。在几乎所有浓度范围内,ROX-MIP-D101对罗红霉素的吸附量均大于NIP-D101。由静态吸附等温线可知,ROX-MIP-D101和NIP-D101对罗红霉素的平衡吸附量分别为253 mg·g-1和211 mg·g-1,ROX-MIP-D101的饱和吸附量明显大于NIP-D101。

图4 ROX-MIP-D101和NIP-D101的静态等温吸附曲线Fig.4 The adsorption isotherm curve ofROX-MIP-D101 and NIP-D101
NIP-D101对罗红霉素有较强的吸附能力,这主要是因为D101树脂本身具有较大的表面积和较强的吸附能力,当然这种吸附能力是没有选择性的,同时在D101树脂表面附着的分子印迹聚合物中,含有由功能单体带来的一些特定功能基团,这些功能基团与模板分子之间可以产生一定的物理作用,形成非印迹的物理吸附作用,因此NIP-D101对罗红霉素具有较强的非印迹的物理吸附作用[21-23]。而对于ROX-MIP-D101,除了具备D101树脂本身具有的非印迹的物理吸附作用外,还具备由印迹空穴产生的高选择性的特异性吸附,所以其对罗红霉素的吸附量明显大于NIP-D101。
2.5ROX-D101的动力学吸附性能
图5是ROX-MIP-D101的动力学吸附曲线,表示吸附量随时间的变化情况。由图5可知,ROX-MIP-D101对ROX的吸附量随时间的增加而增大,当吸附进行到一定时间后,吸附量基本不变,即达到吸附平衡状态,其平衡吸附量约为252 mg·g-1,与静态等温吸附性能的研究结果一致。由图5还可以看出,在吸附前期,ROX-MIP-D101对ROX的吸附量增加较快,即吸附进行较快,达到吸附平衡时间较短;在吸附后期,吸附量随时间增加的幅度减小即吸附速度减慢,达吸附平衡所需的时间更长。
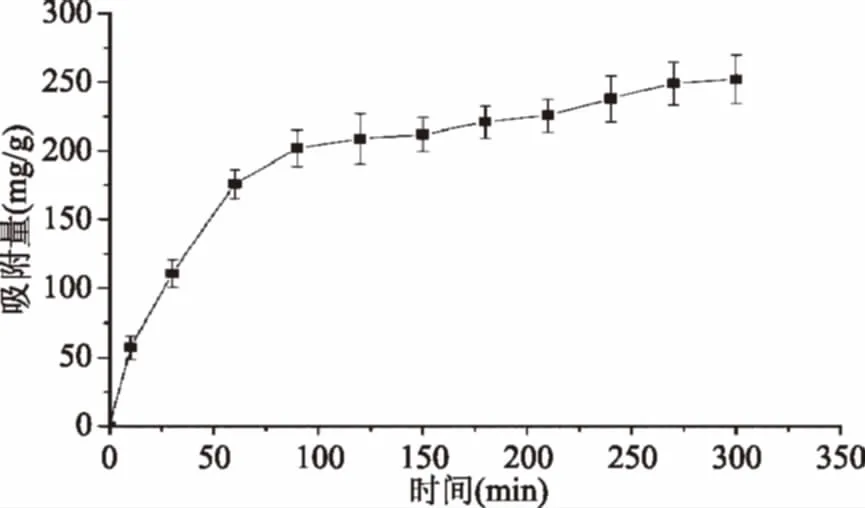
图5 ROX-MIP-D101的动力学吸附曲线Fig.5 The Absorption kinetic curve ofROX-MIP-D101
如2.4所述,在分子印迹聚合物对模板分子的吸附过程中,吸附速率快但无选择性的物理吸附以及吸附速率较慢但选择性高的特异性吸附同时存在。在吸附初期,以物理吸附为主,吸附速度较快但基本无选择性;在吸附后期,以高选择性的特异性吸附为主,但是由于存在空间位阻效应,影响到模板分子的传质速率,因此吸附量增加速度减慢,达吸附平衡所需的时间更延长。由图5可知,ROX-MIP-D101对罗红霉素达到饱和吸附的时间为250 min左右。
2.6ROX-MIP-D101的吸附选择性
本文以红霉素为竞争底物,研究ROX-MIP-D101的吸附选择性。由表1可以看出,ROX-MIP-D101对ROX和EM的吸附分配系数分别为23.26和18.45,经过计算其分离因子为1.26,以上数据均说明,在以EM为竞争底物时,ROX-MIP-D101对ROX具有较好的吸附选择性。由表1还可看出,NIP-D101对ROX和EM的吸附分配系数基本相同,分离因子为1.01,即基本没有吸附选择性。前文已述,NIP-D101仅具有物理性吸附作用,是没有选择性的;而ROX-MIP-D101对模板分子不仅具有物理吸附作用,还存在特异性吸附,这种特异性吸附是具有选择性的,也具有一定的分子识别能力。ROX-MIP-D101对ROX表现出的吸附选择性,使其在实际的分离领域具有一定的应用价值。

表1 MIP和NIP对ROX和EM的吸附选择性Table 1 The selective adsorption properties ofMIP and NIP on ROX and EM
2.7ROX-MIP-D101的重复使用性能
图6是ROX-MIP-D101的重复利用性能图,表示吸附材料在重复使用8次过程中,每一次的吸附量变化情况。由图6可知,随着重复使用次数增多,ROX-MIP-D101对ROX的吸附量呈现下降趋势。重复使用1和2次后,ROX-MIP-D101对ROX的吸附量较原始吸附量均有明显下降。重复使用3次后,吸附量下降了26.4%;重复使用8次后,吸附量下降了28.6%;可见,从重复使用3次至重复使用8次,吸附量虽然也有下降,但下降不明显。从重复使用9次开始,吸附量又有明显下降。这一结果说明,ROX-MIP-D101的重复使用性较好,至少可以重复使用8次。吸附材料在吸附过程后,可能有部分被吸附在印迹材料中的模板分子,用洗脱剂已经无法将其洗脱下来,造成了永久性的包埋或滞留,也有可能是印迹材料中的部分结合位点的空间结构遭到了某种损坏,从而造成吸附性能下降。

图6 ROX-MIP-D101的重复利用性能图Fig.6 Reusability of DOP-MIP-D101
2.8环境水样分析
本文按实验方法对取得的环境水样进行了ROX测定,同时进行了添加样品(加标)回收实验,以衡量分析方法准确度和可行性。本文参照文献[24],设置了如表2的添加量。实验结果表明,水样中未检出ROX残留。同时由表2可知,平均加标回收率达90.8%,表明制备的分离柱对ROX有良好的选择性,满足残留分析的要求[25]。

表2 环境水样的加标回收率(n=5)Table 2 Recoveries of water spiked with ROX standard(n=5)
3 结论
以罗红霉素为模板分子,丙烯酰胺为功能单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂,D101树脂为载体,采用溶液聚合法,制备得到罗红霉素分子印迹D101树脂(ROX-MIP-D101),红外光谱、扫描电镜初步表征了结构。静态等温吸附实验表明,ROX-MIP-D101对ROX的吸附能力明显大于非印迹树脂(NIP-D101),常温下其对ROX的平衡吸附量为253 mg/g。吸附动力学研究表明,ROX-MIP-D101对罗红霉素达到饱和吸附的时间为250 min左右。吸附选择性实验表明,ROX-MIP-D101对ROX具有较高的吸附选择性,而NIP-D101基本没有选择性。重复使用性实验表明,吸附材料在ROX-MIP-D101对ROX的吸附过程中,可以重复使用8次,说明其重复使用性能良好。环境水样的平均加标回收率达90%以上,表明ROX-MIP分离柱对ROX具有较好的选择性。
[1]李周敏,孙艳艳,姚开安,等. 动物源性食品中抗生素残留检测前处理及其分析方法研究进展[J]. 药物分析杂志,2013,33(6):901-906.
[2]Ronald AY,John P G,Eugene M S. Roxitliromycin,a review of antibacterial activity. Pharmacokinetics properties and clinical efficacy[J]. Drugs,1989,37(1):2-4.
[3]Zhang H,Wang S. Review on enzyme-linked immunosorbent assays for sulfonamide residues in edible animal products[J].J. Immunol Methods,2009,350:1-8.
[4]刘佳佳,金芬,佘永新,等.液相色谱-串联质谱法测定牛奶中5种多肽类抗生素[J].分析化学,2011,39(5):652-656.
[5]刘佳佳,佘永新,刘洪斌,等.高效液相色谱-串联质谱法同时测定动物源性食品中24 种磺胺类药物残留[J].分析实验室,2011,30(2):9-15.
[6]陈辉华,戴军,王洪新,等.HPLC法对鱼肉中 3 种四环素类和 5 种氟喹诺酮类兽药残留的同时测定[J].分析测试学报,2008,27(9):951-956.
[7]薄海波,雒丽丽,曹彦忠,等.超高效液相色谱-串联质谱法测定牛奶中6种聚醚类抗生素残留量[J].分析化学,2009,37(8):1161-1165.
[8]耿志明,李鹏,陈明,等.基质固相分散-高效液相色谱法测定鱼肉中磺胺类药物残留[J].江苏农业学报,2006,22(3):310-317.
[9]王学翠,刘冰,张璐鑫,等.多壁碳纳米管基质固相分散-高效液相色谱测定牛奶中6种四环素[J]. 食品科学,2011,31(14):206-212.
[10]Pensabene J W,Fiddler W,Donoghue D J.Isolation of chlorampheni-col from whole eggs by supercritical fluid extration with in line collection[J].J. AOAC Int,1999,82(6):1334-1342.
[11]Martin D,Michael K O,Jeremy G D.Development and optimisation of a method for the extraction of benzimidazoles from milk using supercritical carbon dioxide[J].Anal Chim Acta,2003,483:313-323.
[12]Chapuis F,Mullot J U,Pichon V G,et al. Molecularly imprinted polymers for the clean-up of a basic drug from environmental and biological samples[J]. Chromatogr A,2006,1135(2):127-134.
[13]Arimn M,Miller E I,Cormaek P. Molecularly imprinted solid-phase extraction of iazepam and its metabolites from samples[J]. Anal Chem,2007,79(1):256-262.
[14]唐志民,马新宾. 邻苯二甲酸二辛酯印迹吸附树脂的制备及其吸附性能[J].化工进展,2016,35(7):2135-2139.
[15]唐志民,马新宾. 林可霉素分子印迹材料的制备及吸附性能[J]. 中国粉体技术,2016,22(5):63-67.
[16]贾宝秀,孙晓业,李玉琴,等. 罗红霉素分子印迹聚合物的合成及其特性研究[J]. 中国现代应用药学,2010,27(5):441-444.
[17]唐志民,马新宾. 硅胶表面罗红霉素分子印迹聚合物的制备及选择性吸附性能[J]. 化工进展,2016,35(4):1162-1166.
[18]张敏波,张琪霞,金耀楚. 罗红霉素片溶出度的分光光度测定[J]. 中国医药工业杂志,1996,27(6):260-262.
[19]于慧娟,蔡友琼,顾润润. 高效液相色谱法测定红霉素、甲红霉素和罗红霉素的研究[J]. 分析实验室,2006,25(6):63-66.
[20]Chen R R,Qin L,Jia M,et al. Membrane fouling in membrane bioreactors characterisation,con-tradictions,cause and cures[J]. J Membr Sci,2010,363:212-220.
[21]BeresS P,Huang Y B,Oral E,et al. Surface modifieations and molecular of polymers in medical and pharmaeeutieal applicat imprinting ions[J]. J Controlled Release,2001,72(1/2/3):25-33.
[22]王茹娟,马应霞,路翠萍,等. 谷胱甘肽磁性分子印迹聚合物的制备及吸附性能研究[J]. 化学学报,2014,72(5):577-582.
[23]Kang Y F,DuanUAN W P,Li Y,et al. Molecularly imprinted polymers of allyl-p-cyclodextrin and methacrylic acid for the solid-phase extraction of phthalate[J]. Carbohydrate Polymers,2012,88(2):459-464.
[24]戈延茹,曹恒杰,傅海珍,等. 溶剂浮选分离-紫外光谱测定环境水样中的罗红霉素残留量[J]. 理化检验化学分册,2011,47:653-658.
[25]吴晶. 林可霉素分子印迹聚合物合成、表征及应用的研究[D]. 合肥:安徽农业大学,2013.
Studyonsynthesisofroxithromycinmolecularlyimprintedadsorptionresinanditsadsorptionproperties
LIPei-xu
(School of Comprehensive Education,Weifang University of Science and Technology,Shouguang 262700,China)
In this paper,roxithromycin(ROX)molecularly imprinted macroporous D101 resin(ROX-MIP-D101)was synthesized by free-radical solution polymerization process with ROX as template molecule,acrylamide as the functional monomer,ethylene glycol dimethacrylate as crosslinker,2,2-azobisisobutyronitrile as initiator,and D101 resin as carrier. And the structure was characterized by infrared spectroscopy(IR)and scanning electron microscope(SEM). The adsorption properties of ROX-MIP-D101 on roxithromycin were studied by static binding experiment and dynamic binding test,and its selective adsorption properties was investigated by selective adsorption test with erythromycin as the competing substrate. Results showed that the equilibrium adsorption capacity of ROX-MIP-D101 on ROX was 253 mg/g which was obviously higher than that of NIP-D101(211 mg/g),showing that the adsorption capacity of ROX-MIP-D101 was better than that of NIP-D101. The separation factor of ROX-MIP-D101 on ROX and EM was 1.26,showing that ROX-MIP-D101 displayed high recognition ability to ROX. The separation factor of NIP-D101 on ROX and EM was 1.01,showing no recognition ability to ROX. ROX-MIP-D101 also exhibited a good regenerability and reusability. The average recovery of water spiked with ROX standard was 90.8%.
macroporous D101 resin;roxithromycin;molecularly imprinted;adsorption property
TS201.1
A
1002-0306(2017)19-0074-05
10.13386/j.issn1002-0306.2017.19.014
2017-03-08
李培绪(1976-),男,硕士,讲师,研究方向:从事功能化合物的合成及性能研究,E-mail:hgzy88@yeah.net。

