六种不同产地的肉桂中桂皮醛及总挥发油的含量测定
黄青,许军,苏丽飞,杨振兴,董小萍,赵中振*
·品种品质·
六种不同产地的肉桂中桂皮醛及总挥发油的含量测定
黄青1,2,许军2,苏丽飞3,杨振兴3,董小萍1*,赵中振2*
目的:测定6种不同产地共18批肉桂中桂皮醛及总挥发油的含量,为肉桂的质量评价提供科学依据和方法。方法:桂皮醛的含量测定采用高效液相二极管阵列检测法(HPLC-DAD),色谱柱为CAPCELL PAK C18MGⅡ S5(4.6×250 mm,5 μm),流动相为乙腈-水(38:62),流速为1 mL.min-1,柱温为35 ℃,检测波长290 nm,进样量10 μL;总挥发油的含量测定采用水蒸气蒸馏法。结果:不同产地的肉桂中桂皮醛含量有明显差异,越南文安产含量最高,老挝产含量最低,总挥发油含量测定结果亦如此。结论:此研究结果可为肉桂的临床用药提供科学参考和依据。
肉桂;桂皮醛;总挥发油;含量测定
肉桂为樟科植物肉桂Cinnamomum cassiaPresl的干燥树皮,多于秋季剥取阴干,气香浓烈,味甜辣[1]。肉桂在我国主要分布于广西、广东,其次是云南、海南、福建,四川、江西、贵州、湖南、浙江、台湾南部也有少量栽培;国外主要分布于越南、印度、斯里兰卡、印尼和柬埔寨等国[2]。肉桂性味辛、甘、热,归肾、脾、心、肝经,具有补火助阳、散寒止痛、活血通经的功效[1]。现代药理学研究表明,肉桂挥发油具有镇痛解痉、解热、降血压、抗菌、升高白细胞、抗肿瘤、抗溃疡、健胃、壮阳等作用[3,4]。而桂皮醛作为挥发油中最主要的成分,国内外大量研究表明其具有抗炎、神经保护、抗肿瘤、降糖、抗菌等多种药理活性[5]。且桂皮醛和挥发油的含量作为2015年版《中国药典》肉桂含量测定项下规定的指标,其含量的多少是评价肉桂质量好坏的重要因素[1]。肉桂产地众多,但对其进行品质相关研究的还较少,本文采用HPLC-DAD,通过对广西平南、广西东兴、广东德庆、越南文安、云南和老挝6个产地共18批肉桂药材中桂皮醛的含量进行测定的同时采用水蒸气蒸馏法测定这18批药材的总挥发油含量,旨在为肉桂的临床用药及进一步的开发利用提供科学参考和依据。
1 材料
1.1 仪器
高效液相色谱仪(Agilent,1100型);色谱工作站(Agilent,1100型);1/10万分析天平(SARTORIUS,CP224S型);1/100万分析天平(METTLER TOLEDO,MT5型);超声波清洗器(CREST ULTRASONICS,CP-2600D型);离心机(EPPENDORF,CENTRIFUGE 5810型);超纯水仪(天恒科技有限公司,A10)。
1.2 试剂与标准品
甲醇(RCI labscan,色谱纯,LC1115-G);乙腈(RCI labscan,色谱纯,LC1005-G);桂皮醛对照品(CHEM SERV-ICE公司,纯度高于98.0%,批号1901400)。
1.3 药材
本研究所用所有肉桂药材样品均由深圳津村药业有限公司提供,经香港浸会大学中医药学院赵中振教授鉴定。(样品批号及信息见表1)

表1 18批肉桂药材信息表
2 方法与结果
2.1 桂皮醛含量测定
2.1.1 供试品溶液的制备 取肉桂粉末(过45目筛)约0.1g,精密称定,精密加入甲醇25 mL,静置0.5 h,超声提取0.5 h(300 w, 30℃),再静置0.5 h,离心(4000 r.min-1,10 min),将上清液倒入50 mL容量瓶中;药渣再加15 mL甲醇,混匀后同法提取,离心后将上清液倒入同一50 mL容量瓶中,残渣用5 mL甲醇润洗,离心(4000 r.min-1,10 min),合并上清液,加甲醇定容至50 mL,0.45 μm微孔滤膜过滤,即得。
2.1.2 色谱条件 CAPCELL PAK C18MGⅡ S5(4.6×250 mm,5 μm);流动相为乙腈-水(38:62),流速为1 mL.min-1,柱温为35 ℃, 检测波长290 nm,进样量10 μL;该条件下得到的对照品和供试品溶液所得HPLC图见图1。
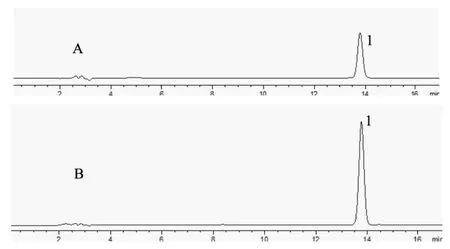
图1 对照品和样品HPLC图
2.1.3 工作曲线与线性关系 分别配置浓度为10,40,200,250,304 μg.mL-1的桂皮醛对照品溶液,0.45 μm微孔滤膜过滤,注入高效液相色谱仪,照“2.1.2”项下的色谱条件进行测定分析,以对照品浓度x(μg.mL-1)为横坐标,峰面积y为纵坐标绘制工作曲线,并进行线性回归,所得回归方程为:y=100.39x+21.924,R2=0.9999。线性范围为:10~304 μg.mL-1。结果表明在桂皮醛进样浓度为10~304 μg.mL-1时与峰面积呈现良好的线性关系。
2.1.4 灵敏度 检测限即测定信噪比为3:1时的桂皮醛对照品浓度,为0.03 μg.mL-1;定量限即测定信噪比为10:1时的桂皮醛对照品浓度,为0.14 μg.mL-1。
2.1.5 精密度 称取广东德庆产的一批肉桂(RGgddq-2)样品6份,每份各约0.1 g,精密称定,分别按“2.1.1”项下的方法制备供试品溶液,进样,照“2.1.2”项下的色谱条件测定分析,记录这6份样品溶液的峰面积,带入回归方程计算得出各自的桂皮醛浓度,结果见表2,并计算得出6份样品的桂皮醛含量之间的RSD为1.47%,小于2%,符合药典要求,表明其重复性较好。
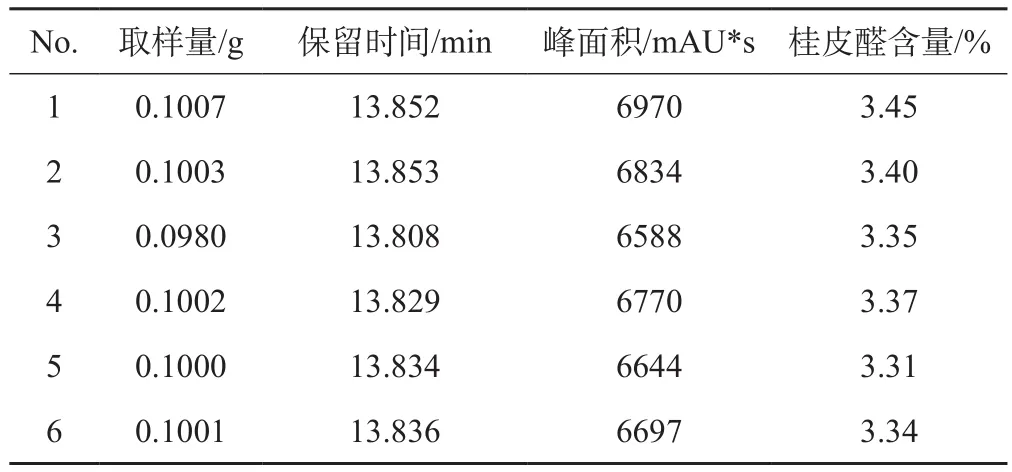
表2 精密度考察结果
2.1.6 稳定性 广东德庆产的一批肉桂(RGgddq-2)样品,按“2.1.1”项下的方法制备供试品溶液,分别于0,2,4,6,8,12,24h照“2.1.2”项下的色谱条件测定其桂皮醛含量,具体结果见表3,其RSD为0.15%,表明供试品溶液在室温下24h内稳定性良好。
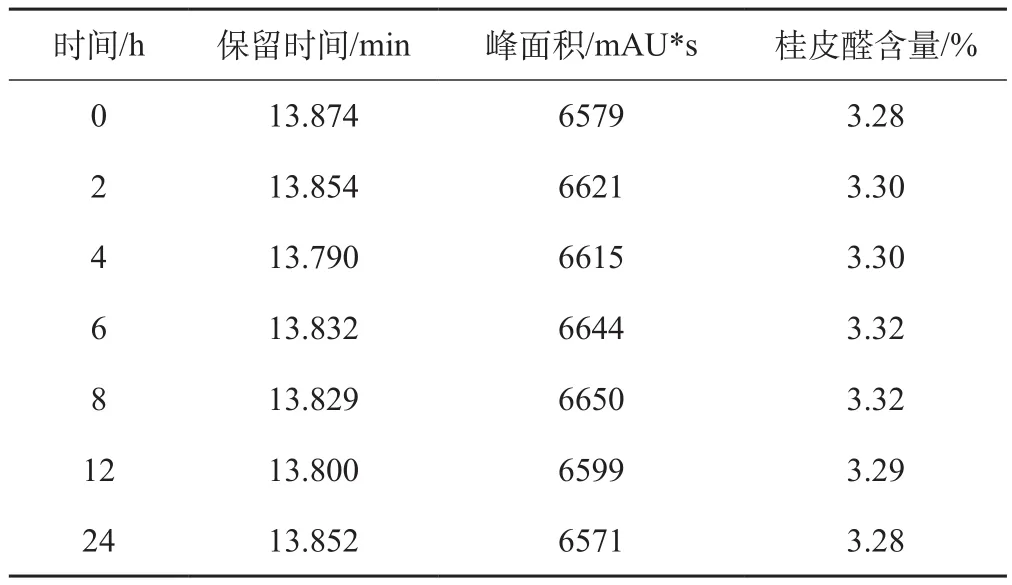
表3 稳定性考察结果
2.1.7 准确度 精密称取已知含量的肉桂药材(RGgddq-2,桂皮醛含量3.37%)9份,每份约0.05g,精密称定,加入一定量的桂皮醛对照品,按“2.1.1”项下的方法制备供试品溶液,照“2.1.2”项下的色谱条件测定其桂皮醛含量,加入的桂皮醛对照品的量及测定结果见表4。回收率均在92%~105%,表明此方法的准确度良好。

表4 加样回收率考察结果
2.1.8 样品测定 取18个批次的肉桂药材各3份,按“2.1.1”项下的方法制备供试品溶液,照“2.1.2”项下的色谱条件测定其桂皮醛含量,结果见表5和图2。
表5 18批不同产地的肉桂中桂皮醛含量测定(S, n=3)

表5 18批不同产地的肉桂中桂皮醛含量测定(S, n=3)
桂皮醛含量/%产地 样品一(x±S,n=3)样品二(x±S,n=3)平均值(x±S,n=3)广西平南 2.90 0.08 3.04 0.05 3.11 0.03 3.02 0.11广西东兴 4.02 0.17 4.01 0.21 3.13 0.16 3.72 0.51广东德庆 2.30 0.04 3.24 0.08 2.95 0.01 2.83 0.48越南文安 9.32 0.04 10.09 0.13 8.96 0.62 9.46 0.58云南 4.49 0.08 4.89 0.17 4.75 0.22 4.71 0.20老挝 2.77 0.10 2.53 0.06 2.60 0.05 2.63 0.12样品三(x±S,n=3)

图2 18批不同产地的肉桂中桂皮醛含量(S, n=3)
2.2 总挥发油含量测定
称取肉桂药材粉末25 g,置于1000 mL圆底烧瓶中,加蒸馏水200 mL浸泡1 h后(边加边搅匀)再加100 mL蒸馏水水蒸气蒸馏提取5 h,静置1 h,读数,结果见表6和图3。
表6 18批不同产地的肉桂中总挥发油含量测定S, n=3)
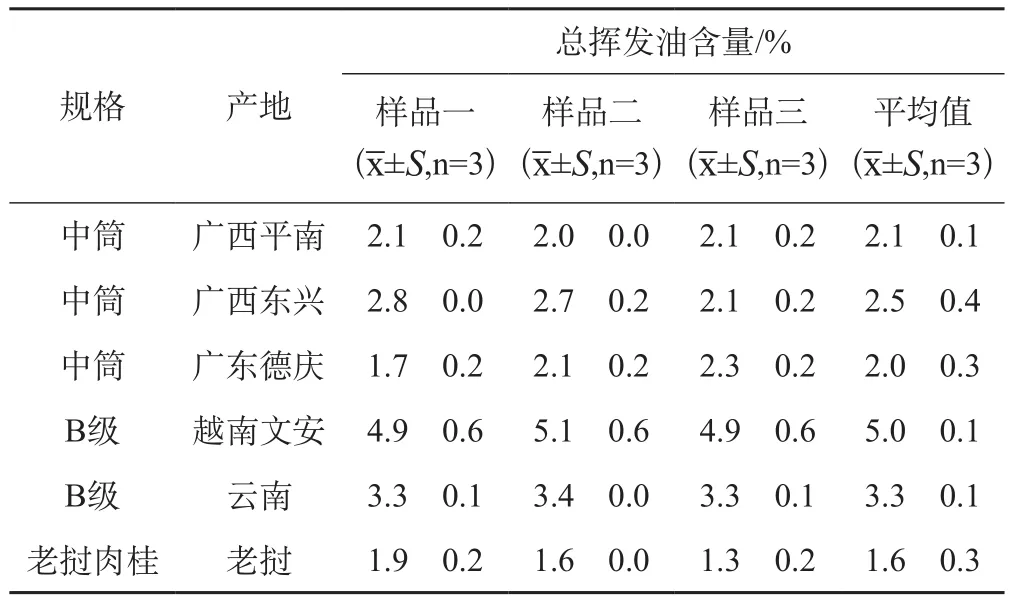
表6 18批不同产地的肉桂中总挥发油含量测定S, n=3)
总挥发油含量/%样品一(x±S,n=3)规格 产地 样品二(x±S,n=3)样品三(x±S,n=3)平均值(x±S,n=3)中筒 广西平南 2.1 0.2 2.0 0.0 2.1 0.2 2.1 0.1中筒 广西东兴 2.8 0.0 2.7 0.2 2.1 0.2 2.5 0.4中筒 广东德庆 1.7 0.2 2.1 0.2 2.3 0.2 2.0 0.3 B级 越南文安 4.9 0.6 5.1 0.6 4.9 0.6 5.0 0.1 B级 云南 3.3 0.1 3.4 0.0 3.3 0.1 3.3 0.1老挝肉桂 老挝 1.9 0.2 1.6 0.0 1.3 0.2 1.6 0.3

图3 18批不同产地的肉桂中总挥发油含量S, n=3)
3 结果与讨论
3.1 供试品及对照品溶液的制备
由于2015年版《中国药典》中肉桂项下的桂皮醛含量测定采用的提取方法需放置过夜[1],且如此操作一次并不能提取完全,故对其进行了适当优化,考察了物料比及提取时间,最终确定本文中所使用的供试品溶液制备方法,该方法经方法学考察证明符合药典要求。桂皮醛较不稳定,制作工作曲线的对照品溶液应现配现用,且实验过程应尽量避光、快速操作。
3.2 色谱条件
2015年版《中国药典》中肉桂项下的桂皮醛含量测定所采用的流动相为乙腈-水(35:75)[1],本研究对其进行适当调整以使分离度等符合药典要求,最终确定本实验中所使用的流动相为乙腈-水(38:62)。
3.3 桂皮醛含量和总挥发油含量测定结果
有效成分桂皮醛和总挥发油的含量测定结果表明,产地对肉桂中桂皮醛和总挥发油的含量影响均较大。其中,越南文安产的肉桂中桂皮醛和总挥发油的含量均明显高于其他五个产地;其次,含量较高的为云南产;而广西平南、广西东兴和广东德庆三个产地产的肉桂之间的差异则并不显著;老挝产的肉桂桂皮醛和总挥发油含量则较其他五个产地的低。众所周知,中药发挥疗效的成分及机制极为复杂,并非单一成分越高则其药效越好,临床用药时应具体用途具体考虑。但从测定结果中可看出,不同产地的肉桂中桂皮醛和总挥发油的含量有差异,其药效作用一定是有差异的,临床用药时有必要考虑产地这一因素的影响。现今药材市场流通的肉桂多种多样,如何规范肉桂市场,保证肉桂药材能发挥稳定药效这一问题 需解决。而不同产地肉桂中的成分种类及其药理作用是否亦有较大差异?差异主要体现在哪一方面?这些都还有待进一步的考察。
[1] 国家药典委员会.中国药典.一部[S].北京:中国医药科技出版社,2015:136.
[2] 韦如萍,黄水芳,胡德活,等.肉桂的研究现状及发展趋势[J].经济林研究,2006,24(3):65.
[3] Oussalah M,Caillet S,Saucier L,et al.Inhibitory effects of selected plant essential oils on the growth of four pathogenic bacteria:E.coli O157:H7,Salmonellatyphimurium,Stap hylococcus aureus and Listeria monocytogenes[J].Food control,2007,18(5):414.
[4] Somchit MN,Reezal I,Elysha Nur I,et al.In vitro antimicrobial activity of ethanol and water extracts of Cassia alata[J].J of Ethnopharmacol,2003,84:1.
[5] 张利青,张占刚,付岩等.桂皮醛药理作用的研究进展[J].中国中药杂志,2015,40(23):4568.
(责任编辑:何瑶)
The determination of cinnamaldehyde and essential oil in Rougui collected from six habitats/
HUANG Qing1,2, XU Jun2,SU Li-fei3, YANG Zhen-xing3, DONG Xiao-ping1, ZHAO Zhong-zhen2//(1.Pharmacy College, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China; 2.Shool of Chinese Medicine, Hong Kong Baptist University, Hongkong 00852,China;3.Shen Tsumura Medicine CO. LTD., Shenzhen 518103)
Objective: Cinnamaldehyde and essential oil of 18 batches Rougui collected from six different habitats were detected to provide scienti fi c basis and method for quality evaluation of Rougui. Method: A HPLC-DAD method was applied to the determination of cinnamaldehyde. The samples were analyzed on a CAPCELL PAK C18MGⅡ S5 column(4.6×250 mm,5 μm)at 40 ℃.The mobile phase was acetonitrile-water (38:62) at fl ow rate of 1 mL.min-1. The detection wavelength was aet at 290 nm, and the sample size was 10 μL. Meanwhile, the essential oil of cinnamon was detecfed by hydrodistillation. Result:Difference were found in the content of cinnamaldehyde and essential oil among samples from different cultivation areas. Rougui from Vietnam had the highest content and Rougui from Laos had the lowest content. Conclusion: The results provid a scienti fi c basis for clinic medicine and further study of Rougui.
Rougui; cinnamaldehyde; essential oils; content determination
R 282
] A
1674-926X(2017)02-004-04
1.成都中医药大学药学院,四川 成都 610081;2.香港浸会大学中医药学院,香港 999077;3.深圳津村药业有限公司,广东 深圳 518103
黄青(1992-),女,硕士研究生,主要从事中药有效成分及质量标准研究Email:616581872@qq.com
董小萍(1957-),女,教授,博士生导师,主要从事中药有效成分及质量标准研究Email:dongxiaoping11@126.com;赵中振(1957-),男,教授,博士生导师,主要从事本草学、中药鉴定学研究Tel: (00852)34112424 Email:zzzhao@hkbu.edu.hk
2017-02-23

