光谱法结合原子力显微镜研究呋喃唑酮与 牛血清白蛋白的作用机理
张秋兰, 逯 露, 李 璋, 倪永年*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2.南昌大学化学学院,江西南昌 330031)

图1 呋喃唑酮的化学结构式Fig.1 The structure of furazolidone
硝基呋喃类药物是人工合成的具有5-硝基呋喃基本结构的广谱抗菌药物,它对大多数革兰氏阳性菌和阴性菌、某些真菌和原虫均有作用,在养殖业中广泛使用。目前此类药物的副作用已引起人们的关注[1 - 2],我国出口的鱼、虾、禽肉等时有被检出含有硝基呋喃类药物,特别是出口鳗鱼多次被检出硝基呋喃类药物残留,严重影响我国动物源性食品出口的信誉。在养殖业中常使用的硝基呋喃类药物包括呋喃西林、呋喃妥因和呋喃唑酮[3 - 5]。其中,呋喃唑酮(图1)主要用于水产养殖中疾病预防和治疗,而通过食物链残留在动物脏器中的硝基呋喃类药物能进入人体而危害健康,故呋喃唑酮与蛋白质的作用机制值得进一步研究。
牛血清白蛋白(Bovine Serum Albumin,BSA)是血浆中最为丰富的蛋白质,它能与进入血液中的大多数内源和外源性物质,如与药物进行可逆的结合从而起到在体内转运的作用[6]。药物与BSA亲和力的大小也影响到药物在动物体内的分布、清除及通过改变血液组织或其中游离药物浓度来影响药效。因此,研究药物与血清白蛋白的结合作用对理解药物的作用机制具有重要意义[7 - 8]。本文在人体生理(pH=7.4)条件下,应用光谱法并结合原子力量微镜研究了呋喃唑酮与牛血清白蛋白相互作用的机理,确定了该药物对BSA的荧光猝灭机制以及对BSA构象的影响。
1 实验部分
1.1 仪器与试剂
LS-55型荧光分光光度计(美国,PE公司);8453型紫外-可见分光光度计(美国,Agilent公司);ZC-10型智能型超级恒温水槽(宁波天恒仪器厂);TENSOR 27型傅里叶红外光谱仪(德国,布鲁克公司);圆二色谱仪(法国,Bio-Logic公司);AJ-Ⅲ型原子力显微镜(上海爱建纳米公司)。
呋喃唑酮(FZD)(纯度98%,Sigma-Aldrich Chemical Co)储备液:用二次水配成3.35×10-3mol·L-1的溶液;牛血清白蛋白(BSA)(纯度99%,合肥博美生物科技有限公司)溶液:配成1.76×10-3mol·L-1和2.0×10-5mol·L-1两种储备液,置于冰箱中保存(1~4 ℃);Tris-HCl缓冲溶液:0.05 mol·L-1,pH=7.4。实验用水为二次蒸馏水。
1.2 实验过程
在比色皿中加入3.0 mL pH=7.4的Tris-HCl 缓冲溶液,根据实验需要分别加入适量的呋喃唑酮和BSA溶液。由于加入试剂的体积远小于初始体积,因此可以忽略浓度稀释效应。实验1:固定BSA的浓度(6.67×10-8mol·L-1),然后加入不同量的呋喃唑酮,使最终浓度为0至21.33×10-8mol·L-1,间隔为2.67×10-8mol·L-1,放置5 min使平衡,分别在温度298、302和306 K下测其荧光光谱。实验2:固定BSA的浓度(6.67×10-6mol·L-1),逐步加入呋喃唑酮溶液,使[FZD]∶[BSA]为0至9,分别测定不同浓度比例时的紫外吸收光谱(298 K)。实验3:分辨率为4 cm-1,取样次数为60,在800~2 000 cm-1范围内,以缓冲溶液做参比,分别扫描BSA和复合物FZD-BSA的红外光谱。实验4:在190~250 nm波长范围内,分别测定BSA和复合物FZD-BSA的圆二色谱。实验5:分别取6 μL前一天配制的实验所需浓度的BSA和FZD-BSA样品滴在云母片上,室温放置24 h后,进行原子力显微镜测试。
2 结果与讨论

图2 由实验1所得的呋喃唑酮与BSA作用的荧光光谱图Fig.2 Emission spectra of BSA in the presence of FZD with various concentration (Experiments 1) cBSA=6.67×10-8 mol·L-1;cFZD=0,2.67,5.33,…,21.33×10-8 mol·L-1 (curves 1-9);Tris-HCl buffer,pH=7.4;excitation and emission slits were 10 nm;scanning rate was 1 000 nm·min-1.
2.1 FZD对BSA内源性荧光猝灭机理的研究
BSA有两个具有内源荧光的色氨酸残基[9]:Trp212在疏水性空腔的内部,而Trp134在分子的表面。BSA在紫外区的荧光主要来源于色氨酸残基。当其他配体与BSA作用时,由于复合物的生成,使色氨酸的荧光发生变化[10];荧光的改变实际上是与发光过程相互竞争从而缩短发光分子激发态寿命的过程。固定BSA的浓度,并逐渐增大FZD的浓度(实验1),BSA在350 nm处的荧光发射强度随药物的增加而有规律地下降(图2),说明FZD与BSA发生了相互作用。
导致荧光猝灭有多种机制,主要有动态和静态猝灭,一般可遵循Stern-Volmer方程予以区分[11]:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中,F0和F分别是不存在和存在猝灭剂时蛋白质的荧光强度,[Q]是猝灭剂的浓度,KSV是Stern-Volmer猝灭常数,Kq为双分子猝灭速率常数,τ0为生物大分子荧光寿命(约为10-8s-1)。
分别作温度298、302和306 K下,FZD对BSA荧光猝灭的Stern-Volmer拟合曲线(图略),均具有良好线性关系,且随着温度的升高,药物与BSA作用的KSV减小(表1),FZD对BSA猝灭速率常数分别为1.64、1.50和1.37×106L·mol-1。一般认为,各类猝灭剂与生物大分子的最大扩散碰撞猝灭速率常数为2×1010L·mol-1·s-1[11],显然FZD对BSA猝灭过程的速率常数(1014L·mol-1·s-1)大于扩散控制的猝灭速率常数Kq,表明猝灭过程为生成复合物的静态猝灭[12]。

表1 FZD与BSA反应的结合常数和热力学参数Table 1 The binding constants and relative thermodynamic parameters of the FZD-BSA system
2.2 结合常数和结合位点数的测定
对于静态猝灭过程,荧光强度与猝灭剂之间的关系可由荧光分子与猝灭剂的结合常数表达式-双对数方程得到。由计算得到的Ka和n见表1,结合常数Ka的变化趋势与KSV相同,都随着温度的升高而减小(由6.50×106L·mol-1减小到5.07×106L·mol-1),表明温度的升高使生成的配合物的稳定性下降。结合常数大于106L·mol-1,说明FZD与BSA有比较强的作用力;结合位点数接近1,说明FZD在BSA上有一独立的结合位点[13]。
2.3 作用力类型的确定
有机小分子与生物大分子借助于疏水作用力、氢键、范德华力和静电引力等作用形成复合物[14],不同分子与蛋白质的结合力类型是不同的。Ross等[15]总结了判断生物大分子和小分子结合性质的热力学规律。根据反应前后热力学焓变和熵变的相对大小,可判断小分子与大分子之间的主要作用力类型。熵变和焓变可根据van’t Hoff方程计算[15]。而在不同温度下的吉布斯自由能(ΔG)可由下式得到:
ΔG=ΔH-TΔS
(2)
不同温度下的结合常数计算得到的热力学参数列于表1中。焓变(ΔH)小于零说明FZD与BSA形成复合物的反应为放热反应,吉布斯自由能(ΔG)小于零表明结合过程是自发进行的。焓变ΔH(-16.22 kJ·mol-1)<0,熵变ΔS(-26.01 J·mol-1·K-1)<0,说明呋喃唑酮与BSA之间的作用力主要为氢键和范德华力。
2.4 紫外光谱研究呋喃唑酮与BSA的相互作用
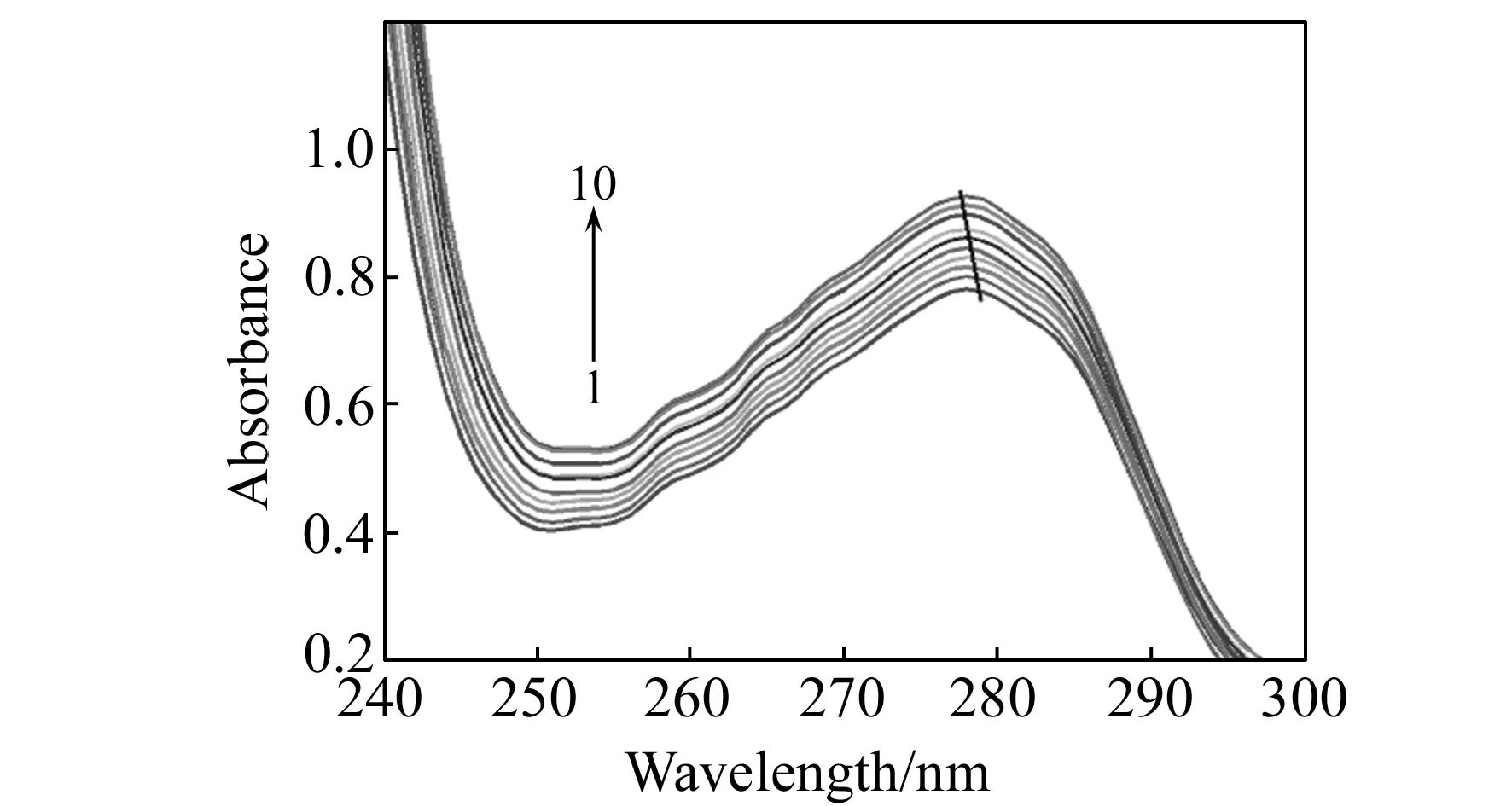
图3 Tris-HCl缓冲溶液(pH=7.4)中BSA与不同浓度FZD的紫外吸收光谱图Fig.3 The UV-Vis spectra of BSA and FZD with different concentration in Tris-HCl buffer(pH=7.4) cBSA=6.67×10-7 mol·L-1;curves(1-10):[FZD]∶[BSA]=0,1,2,3,…,10.
BSA在278 nm处的吸收峰是其肽链上的色氨酸和酪氨酸的苯杂环π-π*跃迁引起的。从图3可知,随着FZD浓度的增加,在278 nm处峰位置蓝移且吸收强度逐渐增加,说明FZD与BSA发生了作用,诱导BSA分子链发生了类似降低pH值所出现的蛋白质肽链伸展现象[16],被包含在BSA内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来,使吸收强度增加,同时疏水基团之间的疏水作用减弱;由于BSA与加入的FZD分子生成了新的共轭体系,形成新的π-π*跃迁,使吸收峰发生了位移。动态猝灭只影响荧光生色团的激发态,不会改变紫外光谱峰。因此,通过BSA紫外吸收光谱的变化可确定基态复合物的形成,并证明荧光猝灭机理为静态猝灭[17]。

图4 FZD与BSA相互作用的红外(IR)光谱图Fig.4 IR spectra of BSA before and after binding with FZD(A);Curve-fitted amide Ⅰ region (1 700-1 600 nm) of free BSA (B) and its complex (C) cBSA=6.67×10-6 mol·L-1,[FZD]∶[BSA]=4,IR spectra were recorded with a resolution of 4 cm-1 and 60 scans (range:800~2 000 cm-1).The IR spectra of sample solutions collected were corrected by subtracting the spectrum of buffer.
2.5 呋喃唑酮对BSA构象的影响
2.5.1红外光谱法研究FZD对BSA构象的影响为进一步确定药物结合蛋白后对蛋白二级结构的影响,利用红外光谱研究了FZD与BSA的相互作用[18]。由图4A可以看出,FZD与BSA的作用使得酰胺Ⅰ带由1 655 nm移至1 652 nm,酰胺Ⅱ带由1 541 nm移至1 536 nm,表明FZD分子与蛋白质结合,改变了BSA的二级结构。应用去卷积和曲线拟合法对谱图进行处理(图4B和4C),计算出BSA酰胺Ⅰ带的二级结构含量。当FZD与BSA的摩尔比为4时,BSA的α-螺旋和β-折叠含量由46.97%、11.74%分别减少至42.15%和9.87%;而β-折叠由15.91%增加至18.41%;β-转角和无规则卷曲也有不同程度的增加。由此说明FZD可改变BSA的结构。
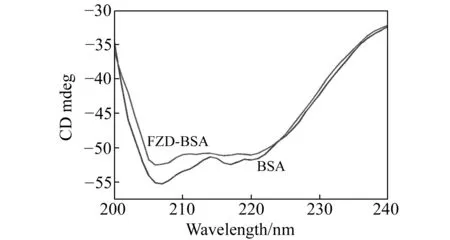
图5 呋喃唑酮与BSA相互作用的圆二色谱图Fig.5 The CD spectra of BSA before and after binding with FZD [BSA]=6.67×10-8 mol·L-1,[FZD]∶[BSA]=4,wavelength range:190-280 nm,scanning speed:1 nm·s-1.
2.5.2圆二色谱法研究FZD对BSA构象的影响不同二级结构的蛋白质产生的圆二色谱谱带位置、吸收强弱不同,α-螺旋在208 nm和222 nm处有两个负的特征肩峰谱带,β-折叠在216 nm处有一负谱带,β-转角在206 nm附近处有一正谱带,而无规则卷曲200 nm附近的负峰是其特征曲线[19]。由图5可知,随着呋喃唑酮的加入,负峰的强度明显降低,说明BSA的α-螺旋结构含量降低。根据公式[20]可计算得到α-螺旋结构的含量从55.6%降低到51.2%。实验结果与红外研究基本一致,表明FZD与BSA结合后使蛋白部分伸展,降低了BSA的稳定性。但是,BSA的圆二图谱中的峰形和峰位并未明显改变,表明BSA中的α-螺旋结构仍占主导地位。
2.5.3原子力显微镜(AFM)研究FZD对BSA构象的影响AFM具有比较好的信噪比、空间分辨率和灵活的探测环境,使其在单分子成像,和蛋白单分子结构与功能研究中得到广泛应用。AFM可观测到蛋白质分子的表面形貌,也能够连续监测生化反应的动力学过程[21]。与FZD结合后对比发现,BSA分子直径和厚度都增大,BSA的表面粗糙度(RMS)由1.65±0.21 nm增至14.23±0.32 nm(图6),可能是BSA所处微环境和构象发生变化所致[22]。
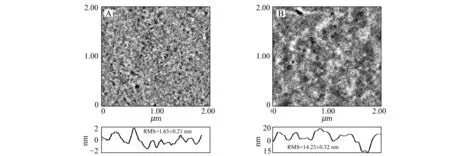
图6 BSA与呋喃唑酮相互作用前(A)和作用后(B)的原子力显微镜(AFM)图Fig.6 AFM spectra of BSA before (A) and after (B) binding with FZD [BSA]=6.67×10-8 mol·L-1,[FZD]∶[BSA]=4,samples were prepared by depositing 6.0 μL on freshly cleaved mica plates (1.2×1.2 cm),dried 24 h and used for AFM with tapping mode.
3 结论
本文利用荧光、紫外、红外光谱和圆二色谱法研究呋喃唑酮与牛血清白蛋白的相互作用。可知呋喃唑酮与BSA的相互作用过程属于形成基态复合物的静态猝灭;由热力学公式计算得到焓变ΔH<0,熵变ΔS<0,说明呋喃唑酮与BSA之间的作用力主要为范德华力和氢键;而由双对数方程得到结合常数大于106L·mol-1,说明呋喃唑酮在血液中的存在时间久,难以代谢,毒副作用强;各种光谱和AFM实验说明呋喃唑酮的存在,不仅改变了BSA所处的微环境并使BSA的构象发生变化。

