固相萃取-高效液相色谱/串联质谱法测定水产品中硫酸新霉素残留量
刘永涛, 李 乐, 徐春娟, 胥 宁, 董 靖,杨秋红, 杨移斌, 艾晓辉*
(1.中国水产科学研究院长江水产研究所,湖北武汉 430223;2.淡水水产健康养殖湖北省协同创新中心,湖北武汉 430223;3.中国水产科学研究院,北京 100141;4.上海海洋大学水产与生命学院,上海 201306)
新霉素(Neomycin Sulfate,NS)属于氨基糖苷类抗生素,新霉素B是新霉素的主要成分(含量>90%),在兽药中用其硫酸盐[1]。在水产养殖业中硫酸新霉素是我国允许使用的国标渔药,用于治疗鱼、虾、河蟹等水产动物由气单胞菌、爱德华氏菌及弧菌等引起的肠道疾病[2]。由于新霉素对人具有明显的肾毒性和耳毒性[3],其在水产品中的残留引起了人们的广泛关注。欧盟规定有鳍鱼类自然比例的肌肉和皮肤中新霉素(残留标示物为新霉素B)的最高残留限量(MRL)值为500 μg/kg[3],日本规定鲑形目、鳗鲡目、鲈形目及其它鱼类、去壳软体动物、甲壳纲动物和其他水产动物中新霉素最高残留限量值为500 μg/kg[4],我国仅规定了牛、羊、猪肌肉中新霉素(残留标示物为新霉素B)的最高残留限量为500 μg/kg[5]。因此,对水产品中硫酸新霉素残留量检测技术研究是非常必要的。
目前,畜禽肌肉中新霉素的分析方法有液相色谱法[6 - 7]、微生物法[8]、酶联免疫分析法(ELISA)[9 - 11]、液相色谱/质谱法[12 - 13],而水产品中硫酸新霉素的检测方法仅见有罗非鱼肌肉中硫酸新霉素测定的柱前衍生高效液相色谱法[14]。我们在实际工作中发现上述方法应用于水产品中硫酸新霉素残留量检测时存在一定的不足,如微生物法和酶联免疫法不适于对肌肉组织中新霉素残留量进行定量分析,而用液相色谱法分析肌肉组织中新霉素残留量时需要对其进行衍生,过程复杂,不易操作。已报道的液相色谱/串联质谱法测定动物性食品中残留的新霉素,采用挥发性离子对试剂作为流动相[12 - 13],该方法分析新霉素时对仪器和色谱柱的损伤大,需要对离子源和色谱柱定期清洗以防污染和灵敏度下降,因而,不适用于大批量样品的检测。本文通过选择合适的提取剂、净化方法,优化色谱和质谱条件,建立高效液相色谱-串联质谱(HPLC-MS/MS)法测定水产品中硫酸新霉素残留量,该方法具有简单、快速、准确、可操作性强等优点。
1 实验部分
1.1 仪器、试剂与材料
TSQ Quantum Access Max液-质联用仪(美国,Thermo Fisher Scientific公司);HITACHI 20PR-520自动高速冷冻离心机(日本,HITACHI公司);Mettler-TOLEDO XP-205型精密电子天平(瑞士,METTLER TOLEDO公司);HQ-60-Ⅱ旋涡混合器(北京北方同正生物技术发展有限公司);DC12-DA氮吹仪(上海安谱科学仪器有限公司)。
硫酸新霉素标准品(≥90.0%,德国Dr Ehrenstotfer GmbH公司)。硫酸新霉素标准储备溶液:准确称取0.01 g(精确至0.0001 g)硫酸新霉素标准品,用适量水(LC-MS级)溶解,并稀释定容至100 mL,配制成质量浓度为100 μg/mL的标准储备溶液,再用水(LC-MS级)稀释成浓度为10 μg/mL中间标准溶液。乙腈、甲醇和甲酸(色谱纯,美国J.T.Baker公司);水(LC-MS级,上海安谱科学仪器有限公司);三氯乙酸(分析纯,购自上海国药集团化学试剂有限公司);超纯水:自制双蒸水后经美国Millipore-Q Advantage A10超纯水机制备。
草鱼、斑点叉尾鮰、南美白对虾、鳗鲡和甲鱼分别购自武汉市白沙洲农副产品大市场和华南海鲜市场。草鱼,去鳞去皮,取背部肌肉;虾,去头去壳去内脏,取肌肉部分;甲鱼,去壳取肌肉部分,充分匀质后于-18 ℃保存,备用。
1.2 实验方法
1.2.1提取准确称取2.0 g(精确至0.01 g)肌肉样品于15 mL离心管中,加入6 mL 5%三氯乙酸水溶液,涡旋震荡1 min,超声提取2 min,8 000 r/min离心5 min,将提取液转移到另一支15 mL离心管中,再向残渣中加入6 mL 5%三氯乙酸溶液重复提取一次,合并提取液于15 mL离心管中,待净化。
1.2.2净化Waters Oasis HLB固相萃取小柱用3 mL乙腈、3 mL超纯水、3 mL 5%三氯乙酸水溶液活化后,将提取液过HLB固相萃取小柱,过柱时保持每秒1滴,过柱后用3 mL 5%三氯乙酸水溶液淋洗固相萃取小柱并将固相萃取小柱抽干。用6 mL乙腈将富集在固相萃取小柱上的目标物洗脱于10 mL塑料离心管中,置50 ℃氮吹仪上吹干。向残渣中加入1 mL 0.5%三氯乙酸水溶液,涡旋振荡1 min,10 000 r/min离心5 min,取澄清液过0.22 μm聚醚砜滤头后,进行HPLC-MS/MS分析。
1.3 水产品基质标准溶液的制备
按1.2节方法制备草鱼、斑点叉尾鮰、南美白对虾、鳗鲡和甲鱼肌肉空白基质溶液,并用上述5种肌肉空白基质溶液稀释硫酸新霉素中间标准溶液,配制成含硫酸新霉素浓度分别为10、25、50、100、500、1 000、2 000 ng/mL的基质标准溶液,用0.22 μm聚醚砜滤头过滤后,进行HPLC-MS/MS分析。
1.4 色谱/质谱分析条件
1.4.1色谱条件色谱柱:BDS HYPERSIL C18柱(150×2.1 mm,5 μm);流动相:A相:乙腈,B相:0.2%甲酸水溶液,梯度洗脱程序如下:0~1.0 min,5%A;1.0~4.0 min,5%~60%A;4.0~5.5 min,60%A;5.5~7.0 min,60%~5%A;7.0~8.0 min,5%A;流速:0.2 mL/min;柱温:30 ℃;进样量10 μL。
1.4.2质谱条件离子源:加热大气压电喷雾离子源(HESΙ);扫描模式:正离子模式;检测方式:选择反应监测模式(SRM);喷雾电压:3 500 V;蒸发气温度:400 ℃;鞘气压力:40 kPa;辅助气压力:4 kPa;碰撞气(Ar)压力:1.5 Pa;离子传输毛细管温度:350 ℃;选择离子监测优化参数:监测母离子:m/z615.2,定量子离子:m/z161.0,碰撞能量: 31 eV,定性子离子:m/z293.0,碰撞能量:22 eV。
2 结果和讨论
2.1 流动相的选择
乙腈的洗脱能力较甲醇的洗脱能力强,并且在同样条件下乙腈做流动相较甲醇为流动相时,硫酸新霉素有更好的峰形,所以本实验选择乙腈为流动相的有机相(A相)。分别以0.2%和0.3%甲酸水溶液为流动相的水相时硫酸新霉素在质谱上的响应度相当,且均优于纯水和0.1%甲酸水溶液,因此,本实验最终选择了乙腈-0.2%甲酸水溶液作为流动相。刘莉治等[12]和孙雷等[13]报道了采用离子对试剂七氟丁酸作为流动相,用于检测动物性食品中的新霉素残留,而七氟丁酸会对质谱仪的离子源和色谱柱造成污染,使质谱仪灵敏度下降,从而增加了仪器维护的频率和成本。本方法采用乙腈-0.2%甲酸为流动相,减少了色谱柱和质谱仪离子源的清洗频率和维护成本,有利于延长色谱柱和仪器的使用寿命。
2.2 质谱条件的优化
将10 μg/mL的硫酸新霉素标准溶液经注射泵注入质谱仪对其进行调谐和优化,使其达到最大的离子响应值。在氩气压力为1.5 Pa的条件下,采用氩气将进入三重四极质谱碰撞室Q2的新霉素离子碰撞为离子碎片,找到了适合用作定量的离子(m/z161.0)和定性的离子(m/z293.0),并优化出各自的碰撞能量。HESI源(带加热的电喷雾离子源)是采用电喷雾离子化(ESI)与加热辅助气相结合的方法,将溶液中的离子转换成气相中的离子,可以更有效去除溶剂。本文优化了HESI源的辅助气温度(50 ℃、100 ℃、200 ℃、300 ℃、400 ℃),结果表明随着辅助气温度的增加,硫酸新霉素的响应度也逐渐增大,相同条件下硫酸新霉素在辅助气温度400 ℃时的响应度约是在辅助气50 ℃时响应度的10倍。
2.3 样品前处理方法的优化
2.3.1提取溶剂的选择硫酸新霉素易溶于水,微溶于乙醇,不溶于乙醚、丙酮、氯仿,因此样品中硫酸新霉素宜采用水或含盐的水溶液进行提取。宋洁等[14]采用pH=6.5的磷酸盐缓冲液和5%三氯乙酸(体积比1∶1)作为提取剂,提取后再用三氟乙酸水溶液调节提取液的pH。本实验分别采用纯水、1%、2.5%、5%的三氯乙酸水溶液作为提取剂,结果表明纯水会溶解样品中水溶性蛋白,进而干扰目标物的分析;1%、2.5%的三氯乙酸水溶液沉淀蛋白的效果不佳,而5%的三氯乙酸水溶液沉淀蛋白的效果好,且硫酸新霉素提取率高,所以本实验选用5%的三氯乙酸水溶液作为提取剂。
2.3.2样品净化条件的优化样品经5%三氯乙酸水溶液提取后,采用Waters Oasis HLB固相萃取小柱对样品进行净化。本实验对提取液过柱后的淋洗液和洗脱液进行了筛选,当水作为淋洗液时会洗脱部分吸附在固相萃取小柱上的硫酸新霉素,回收率低,而5%三氯乙酸水溶液作为淋洗液则不易将吸附在固相萃取小柱上的硫酸新霉素淋洗下来,故选择5%三氯乙酸水溶液作为淋洗液;分别采用6 mL的乙腈、1%甲酸乙腈、2%甲酸乙腈、5%甲酸乙腈洗脱液对吸附在固相萃取小柱上的硫酸新霉素进行洗脱,结果表明4种溶液均能将硫酸新霉素从固相萃取小柱上洗脱下来。本实验最终选择了纯乙腈作为洗脱液。
2.4 方法的评价
2.4.1方法的线性范围将配制成不同浓度的水产品基质标准溶液进行HPLC-MS/MS分析,以待测物的峰面积(y)为纵坐标,质量浓度(x)为横坐标作线性回归分析。硫酸新霉素在10~2 000 ng/mL浓度范围内呈良好的线性关系,相关系数R2均≥0.9987。
2.4.2方法准确度和精密度按1.2节方法对不含目标分析物的草鱼、斑点叉尾鮰、南美白对虾、鳗鲡和甲鱼空白肌肉样品中添加硫酸新霉素的浓度水平为25、200、500、1 000 μg/kg,每个加标水平做6个平行,硫酸新霉素的加标回收率及精密度(RSD)结果见表1。硫酸新霉素在草鱼等水产品中添加水平为25~1 000 μg/kg时,平均回收率为89.03%~114.57%,RSD为2.84%~9.62%。由此可见该方法的准确度和精密度高,能满足水产品中硫酸新霉素残留量的测定。
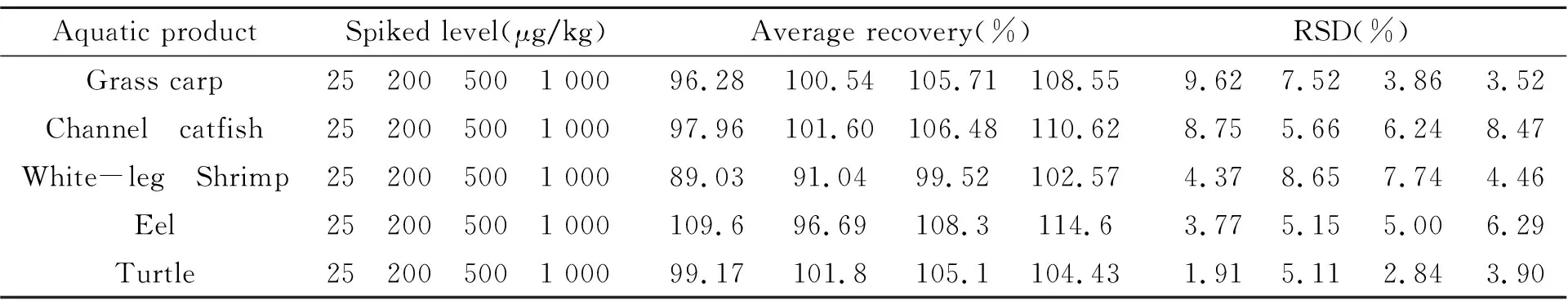
表1 不同水产品中硫酸新霉素的回收率和精密度(n=6)

图1 50 ng/mL硫酸新霉素标准溶液SRM色谱图Fig.1 The SRM chromatogram of 50 ng/mL neomycin sulfate standard solution with (a) m/z615.2,(b)m/z615.2>161.0,(c)m/z615.2>293.0
硫酸新霉素标准溶液的SRM色谱图见图1。
2.4.3方法检测限和定量限当加标水平为10 μg/kg时,硫酸新霉素的信噪比大于3,加标水平为25 μg/kg时,平均回收率大于89.03%,RSD小于9.62%,因此该方法的检测限和定量限分别为10 μg/kg和25 μg/kg。本方法的定量限远低于欧盟[5]和日本[6]规定的硫酸新霉素在水产品中的最高残留限量值,能够满足我国进出口水产品中硫酸新霉素的检测。
2.5 方法的应用
将该方法用于市售的5份团头鲂、6份斑点叉尾鮰、3份黄鳝、5份草鱼样品的测定,结果均未检出硫酸新霉素的残留,说明上述水产品未使用硫酸新霉素或硫酸新霉素在上述水产品中已被代谢消除。有研究报道罗非鱼使用硫酸新霉素后休药期少于7 d[15 - 16],作者也用该方法研究了硫酸新霉素在斑点叉尾鮰体内的组织分布规律和残留消除规律,研究结果也表明,硫酸新霉素在斑点叉尾鮰肌肉中消除到最高残留限量(500 μg/kg)以下,所需时间较短(将另文报道)。
3 结论
本文建立了固相萃取-高效液相色谱/串联质谱法测定水产品中硫酸新霉素的残留量。该方法完成1个样品的前处理仅需1 h、9 mL有机溶剂,减少了操作人员和有机溶剂的接触;选用非离子对试剂做流动相,保护了质谱检测器,提高了分析效率,具有简单、快速、安全、高效的特点,适于应用和推广。

