离子色谱法测定蓝藻培养液中有机酸和无机阴离子
黄海兰, 王 鑫, 法 芸, 张经华, 王宗花
(1.青岛大学化学科学与工程学院,山东青岛 266071;2.中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 266101;3.北京市理化分析测试中心,北京 100049)
微生物培养液成分中含有大量阴、阳离子用于其自身生长需要,有机酸、核苷酸等则主要是通过微生物新陈代谢产生。如蓝藻和热纤梭菌在厌氧条件下,主要产生乙酸和乳酸等小分子有机酸[1],在不同的生长时间下有机酸的分泌量是不同的,因此通过检测不同时间段发酵液中有机酸含量则能为研究热纤梭菌的新陈代谢途径提供必要的数据支持。 有机酸也参与生物催化过程[2],是三羧酸循环的重要中间产物。
目前检测有机酸含量的方法有很多种。其中,利用非酶光谱检测[3]和酶法检测法[4]检测有机酸含量,此类方法的缺点是实验操作复杂、耗时较长、外界环境影响大。目前应用最广泛的是色谱和电泳的方法来同时检测和分析有机酸[5 - 7],这些方法包括薄层色谱法[6]、反相高效液相色谱法[8 - 9]、气相色谱法[10 - 11]和毛细管电泳法[12 - 14]。尽管薄层色谱法具有快速和低成本的特点,但是低分离度成了它的致命缺陷;高效液相色谱法具有好的选择性和高的灵敏度,不过需要复杂的样品前处理过程[8];气相色谱能够检测有机酸含量,不过由于仪器的成本和复杂性以及样品前处理的繁琐,限制了其大批量的检测分析[15];毛细管电泳具有分辨率高、操作简单、自动化程度高、分析时间短、消耗试剂和样品少等特点,但是重复性差,影响了其准确定量[6,15]。除此之外,上述方法大部分需要有机溶剂和试剂,会对环境和实验人员造成一定的危害[16]。因此需要一种前处理简单、环境友好型的检测有机酸的分析方法。
由于有机酸能够部分电离,可以运用高灵敏度和选择性的离子色谱法进行分析检测。本文探索性地将17种有机酸和7种阴离子高效分离,并成功分析5种蓝藻培养液中的部分有机酸和阴离子,该方法实现了微生物培养液中有机酸和阴离子的同时测定,避免了有机酸和阴离子的分别检测,节省了分析时间和实验成本。
1 实验部分
1.1 仪器与试剂
ICS-5000型多功能离子色谱系统(美国,Thermo Scientific公司),包括双泵(DP)模块、电导检测器(CD)/色谱(DC)模块、自动进样器(AS)模块、Chromeleon 6.8色谱软件操作;Milli-Q®Advantage A10 超纯水制备仪。

1.2 阴离子、有机酸分析条件
色谱柱型号:保护住AG11-HC(50×4 mm) + 分析柱AS11-HC(250×4 mm) (美国Thermo Fisher Scientific公司);检测器:电导检测器(CD);流动相:KOH溶液;流速:1.0 mL/min。梯度洗脱程序为:0~15.0 min:0.8 mmol/L KOH溶液;15.1~25.0 min:15.0 mmol/L KOH溶液;25.1~31.0 min:20.0 mmol/L KOH溶液;31.1~45.0 min:22.4 mmol/L KOH溶液;45.1~55.0 min:40.0 mmol/L KOH溶液;55.1~60.0 min:45.0 mmol/L KOH溶液;60.1~65.0 min:0.8 mmol/L KOH溶液。柱温:30 ℃;进样量:25 μL。
1.3 混标溶液的配制

1.4 样品前处理
蓝藻培养液样品来自生物能源与过程研究所的微生物资源团队,取培养液10 mL于离心管中,用6 000 r/min 的转速离心3 min。取上清液过0.22 μm 水相滤膜,过滤掉溶液中悬浮物后,再经过IC-RP小柱除去基体中的色素和有机物等杂质,将处理后的样品溶液稀释相应倍数后,进样分析。
IC-RP小柱在使用前应先活化:先用注射器取10 mL甲醇慢速冲洗,再取20 mL 超纯水将小柱冲净,竖直静置20 min后方可使用。应注意的是使用此活化后小柱时,前3 mL样品应弃去不用。
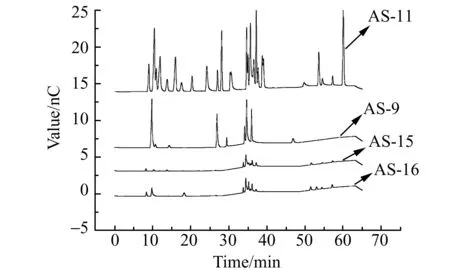
图1 不同阴离子色谱柱谱图对比情况Fig.1 Chromatogram of different anion chromatographic column
2 结果与讨论
2.1 色谱柱的选择
用不同型号阴离子色谱柱AS-9、AS-11、AS-15、AS-16对4号标准样品在初始分析条件淋洗液程序1 (0~20 min:1.0 mmol/L、20.1~30.0 min:20 mmol/L、30.1~50.0 min:45 mmol/L、50.0~65.0 min:1.0 mmol/L,流速都为1.0 mL/min)下进行分析比较,标样谱图如图1。通过比较可以看出:AS-11出峰数、峰高、峰面积都要优于其他三根阴离子柱。具体来说与AS-11阴离子柱相比,AS-9阴离子柱对24种标准品中组分的9种有分离作用,而AS-15 和AS-16两阴离子柱分离效果相似,对标准品的响应和AS-11接近,但是其响应值要远低于AS-11。
从柱填料基质材料来看,四种分离柱都是大孔的乙基乙烯基苯-二乙烯基苯(EVB-DVB)聚合物,但是选择性和分离效果主要看键合到乳胶微粒上的功能基类型和柱容量决定的。而AS-9、AS-11分析柱乳胶微球的功能基是中等疏水性的三元胺(叔胺),AS-15、AS-16分析柱乳胶微球的功能基则是弱疏水性的四元胺(季胺)。因此从图1也可看出前者要比后者的两分析柱分析的物质更多、响应值也高。再比较AS-9、AS-11两分析柱的柱容量分别为190 μmol和290 μmol,所以AS-11分析柱分离效果要更好一些,符合图1的分离情况。
因此综合分离效果、选择AS-11阴离子柱作为分离分析阴离子和有机酸混标及样品的色谱柱。
2.2 洗脱程序的优化
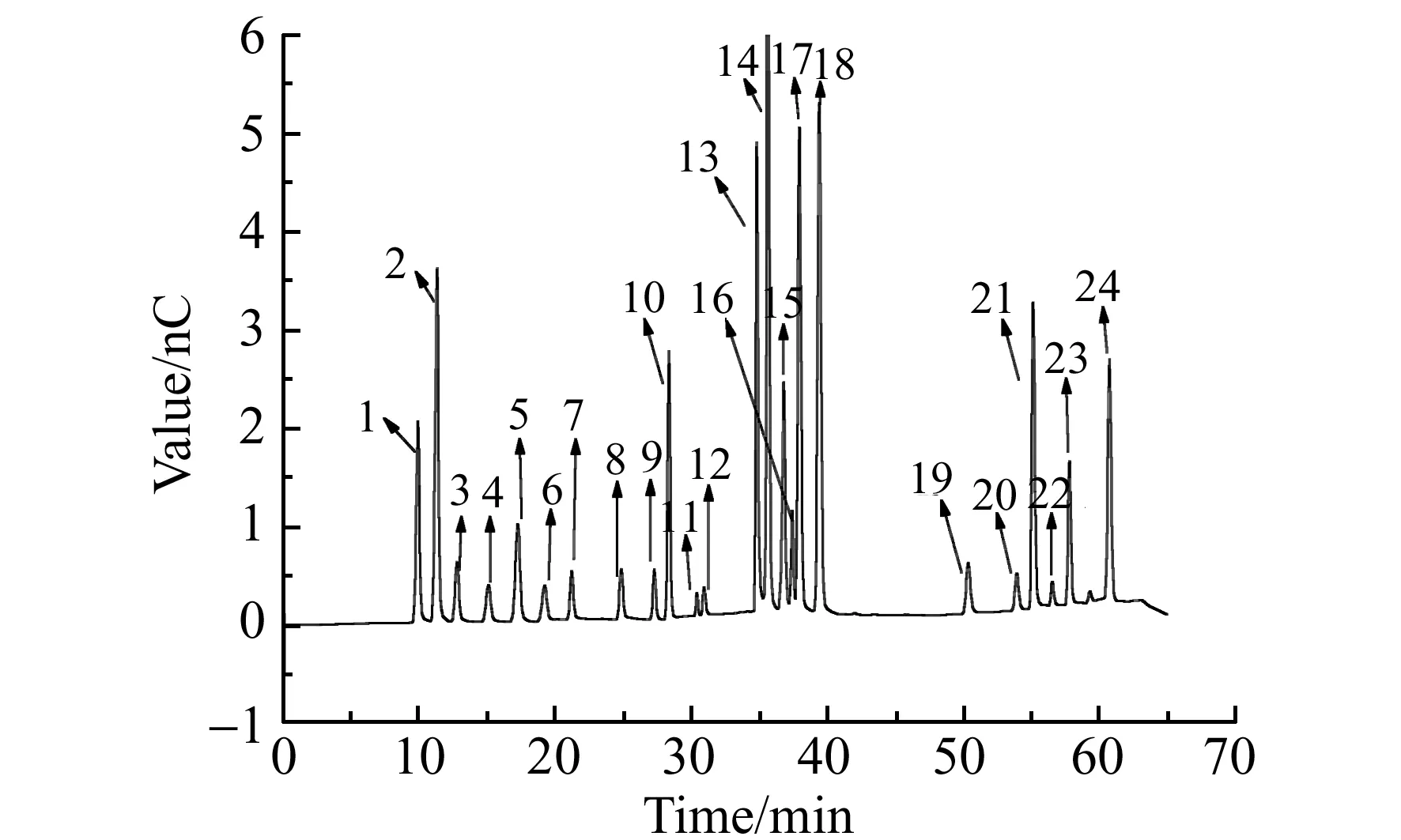
图2 混合标准溶液的色谱图Fig.2 Chromatogram of a standard solutionChromatographic peak:1.Quinic acid;2.F-;3.Acetic acid;4.Propionic acid;5.Formic acid;6.Butanoic acid;7.Pyruvic acid;8.N-pentanoic acid;13.Succinic acid;14. acid;18.Fumaric acid;21.Citric acid;22.Isocitric acid;23.Cis.Aconitic acid;24.Trans-Aconitic acid.
尽管选择了色谱柱AS-11作为分析柱,由图1可以看出在10 min、35 min左右时色谱峰仍有峰重叠情况。可以得出之前初设的程序跨度有些大,在20 min之前和20~40 min之间个别峰分离不理想,因此将20 min之前的程序分段设置,同时将20~40 min之间的淋洗液浓度上升幅度减小,目的是把出峰时间相似的物质尽可能分开,另外延长65 min以后的淋洗液看是否还有其他峰出现。
考虑到实验效率和更好地分离效果,最后得到优化程序见1.2。同样利用AS-11阴离子色谱柱对4号标准品进行分析,按照程序1.2节程序分离效果和实验效率达到了比较好的预期。
2.3 有机酸、阴离子方法学评价
将混标按照1.3配制方法,再分别取1 mL 混标按照1.2分析条件进行色谱分析;另外取4号混标1.5 mL 重复进样8次,检测其重复性。 4号混标的离子色谱图如图2所示,从标准谱图上可以看出,在此分析条件下,17种有机酸和7种阴离子分离情况良好,在相应的浓度范围内峰面积与浓度线性相关,且线性相关系数在99.6%以上。重复进样8次的24种物质峰面积的相对标准偏差(RSD)在0.31%~2.07%之间,说明其稳定性良好。

表1 混标的线性回归方程、线性范围、重复性、检测限(n=8)
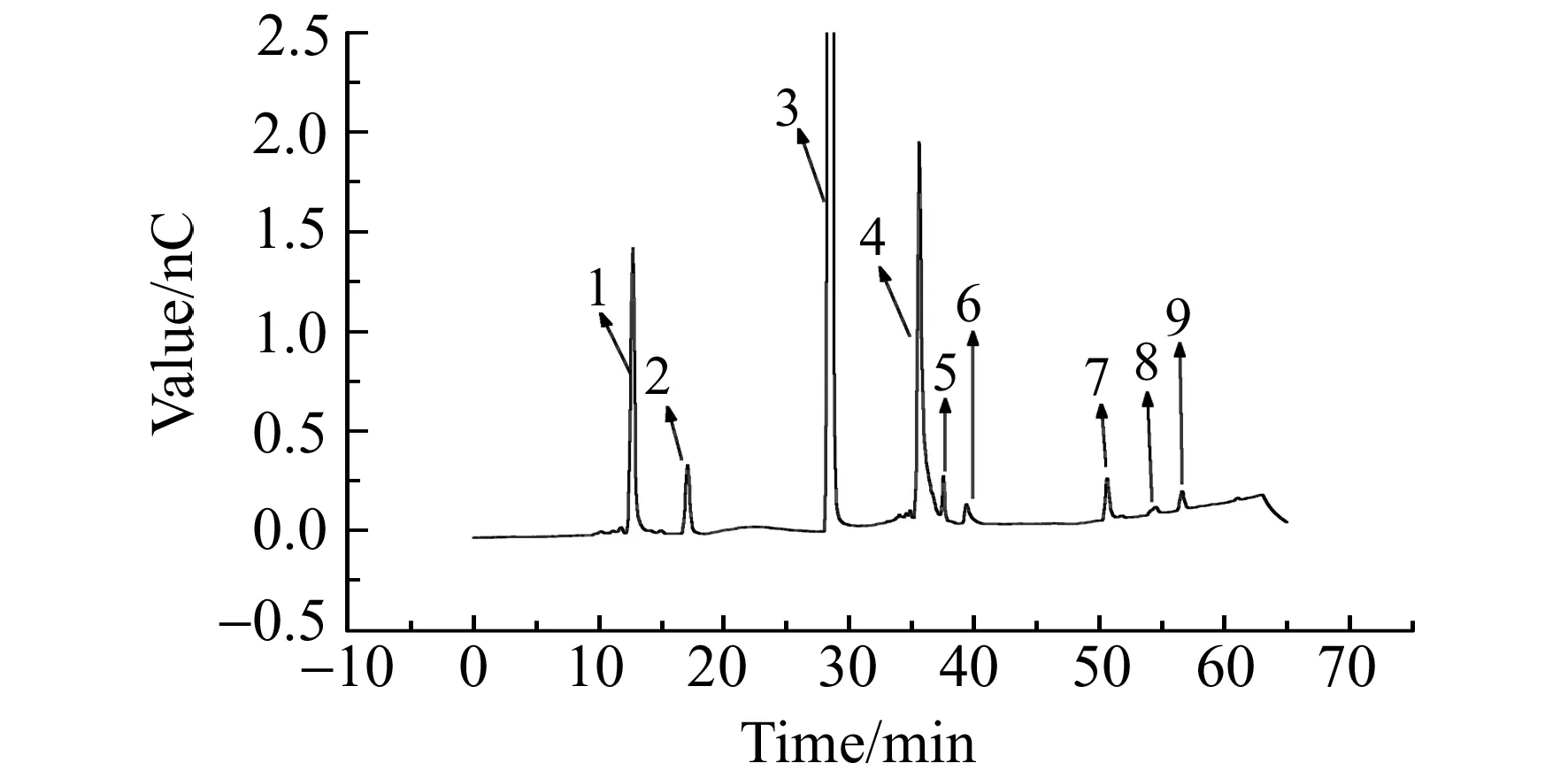
图3 蓝藻培养液色谱图Fig.3 Chromatogram of cyanobacteria cultureChromatographic peak:1.F-;2.Formic acid;9.Cis-Aconitic acid.
2.4 实际样品的分析
将蓝藻培养液经过1.4步骤处理后,分别再将其稀释400倍后进样分析。此外按照相同的处理方法对每份样品加标1.0 mg/L、10 mg/L后,每组平行进样3次。
图3是将蓝藻培养液样品色谱图,检测结果和加标回收率如表2所示,24种分析物的平均加标回收率在80.3%~108.5%之间。该方法可用于微生物培养液中有机酸和阴离子的同时测定。
3 结论
该方法实现了微生物培养液中有机酸和阴离子的同时测定,避免了有机酸和阴离子的分别检测,节省了分析时间和实验成本。利用此方法可以测定不同类型的微生物培养液,对于研究相应微生物中能量转移、物料吸收和代谢物排泄与生存环境中阴离子的关系提供帮助,也对研究有机酸的代谢产物提供数据支持。

