盐胁迫对盐芥硝酸盐的吸收及根系生长发育的影响
姜娜娜, 崔凤,刘译阳,韩燕,张荃,李军,李国卫
(1.山东省农业科学院生物技术研究中心/山东省作物遗传改良与生态生理重点实验室,山东 济南 250100; 2.山东种业集团股份有限公司,山东 济南 250100;3. 山东师范大学生命科学学院,山东 济南 250014)
盐胁迫对盐芥硝酸盐的吸收及根系生长发育的影响
姜娜娜1,2, 崔凤1,刘译阳1,韩燕1,张荃3,李军1,李国卫1
(1.山东省农业科学院生物技术研究中心/山东省作物遗传改良与生态生理重点实验室,山东 济南 250100; 2.山东种业集团股份有限公司,山东 济南 250100;3. 山东师范大学生命科学学院,山东 济南 250014)
氮素是植物生长发育所必需的主要营养元素,硝酸盐是植物吸收氮的主要形式。盐胁迫是一类非生物胁迫,抑制植物的生长发育。为了探讨盐胁迫影响硝酸盐吸收与植物生长发育的关系,本研究以耐盐模式植物盐芥为试验材料,测定了盐胁迫下盐芥体内硝酸盐含量的变化,分析其与根系发育的关系,并利用RNA-seq技术分析了盐胁迫条件下盐芥中硝酸根转运蛋白(nitrate transporter,NRT)基因的表达调控。结果显示,盐胁迫后盐芥叶片和根中的硝酸盐含量均显著下降,且根系干重与硝酸盐含量呈正相关关系,表明盐胁迫抑制了盐芥对硝酸盐的吸收,并且影响根系的发育。RNA-seq共检测到10个盐芥硝酸根转运蛋白基因的表达,大部分基因的表达受盐胁迫的调控,可能参与了盐胁迫条件下盐芥体内硝酸盐的吸收和转运。综合上述结果,推测盐胁迫抑制盐芥对硝酸盐的吸收,可能是导致盐胁迫下植物生长发育受抑制的因素之一。
盐芥;盐胁迫;硝酸盐吸收;硝酸根转运蛋白
AbstractNitrogen is a major nutrient element necessary to plant growth and development, and nitrate is the main form of nitrogen absorbed by plants. Salt stress is one type of abiotic stress, which defects plant growth and development. In order to study the effects of salt stress on nitrate absorption and plant growth and development, we employed salt-tolerant model plant Eutrema salsuginea as materials. The changes of nitrate concentrations inEutremasalsugineaunder salt stress were measured, and its relationship with root development was analyzed. In addition, the expression levels of nitrate transporter (NRT) genes were analyzed using RNA-seq technology under salt stress conditions. The results showed that the nitrate contents in leaves and roots were both significantly decreased after salt stress treatment, and the root dry weight had a positive correlation with nitrate content. It implied that salt stress inhibited plant nitrate absorption, and further affected the growth of root system. Totally, ten NRTs were detected by RNA-seq analysis, and the expression of most of NRTs was regulated by salt stress. It suggested that these genes might be related with nitrate absorption and transport inEutremasalsugineaunder high salt environment. In conclusion, we presume that salt stress inhibits the nitrate absorption inEutremasalsuginea, which might be one of the factors limiting the growth and development of plants under salt stress.
KeywordsEutremasalsuginea; Salt stress; Nitrate absorption; Nitrate transporter
氮素是植物需求量最大的营养元素,其吸收和利用是影响植物生长和发育的主要因素[1],而硝酸盐是植物吸收利用的主要氮素形式。硝酸盐不仅是植物生长必需的营养物质,也可以作为一种信号调节根冠比和根的形态建成[2-4]。 液泡内的硝态氮是重要的渗透调节物质,用于调节植物的生长发育[5]。
盐芥是分布在盐碱地中的一种盐生植物,耐盐性极强[6]。它与模式植物拟南芥的亲缘关系非常近,对从盐芥中克隆的数百个EST (expressed sequence tag)序列的分析说明,盐芥的cDNA和氨基酸序列与拟南芥的相似度为90%~95%[7]。从全基因组测序的结果来看,盐芥93.7%的基因家族与拟南芥相似,有研究者提出把盐芥作为研究植物耐盐性的模式物种[8-11]。
硝酸根转运蛋白(nitrate transporter, NRT)是一类膜蛋白,参与植物根系对硝酸根的吸收和体内分布。根据其对硝酸根亲和力的差异,可以分为低亲和力硝酸根转运蛋白(low-affinity transport system, LATS)和高亲和力硝酸根转运蛋白(high-affinity transport system, HATS),大部分NRT1为低亲和力硝酸根转运蛋白,NRT2为高亲和力硝酸根转运蛋白[12]。其中,拟南芥中的AtNRT1.1(CHL1)根据环境中硝酸根浓度差异可以表现出对硝酸根的双重亲和性,当环境中硝酸根浓度较高时,AtNRT1.1表现为对硝酸根的低亲和性;而当环境中的硝酸根浓度较低时,AtNRT1.1蛋白序列中的101位苏氨酸发生磷酸化后,表现为对硝酸根的高亲和性[13]。近年来,人们对盐芥的耐盐机理已经有了较为深入的认识[8]。然而,盐胁迫对盐芥硝酸根吸收的影响以及盐芥对硝酸根吸收与植物耐盐性的关系尚未见相关报道。
本研究通过测定不同浓度盐处理对盐芥生长以及叶片和根系内硝酸盐含量的影响,明确了盐胁迫条件下硝酸盐吸收的减少可能是影响植物发育的重要因素之一,为植物耐盐方面的研究提供新的思路,为植物耐盐基因工程改造提供理论基础。
1 材料与方法
1.1植物培养及盐处理
盐芥(山东生态型)由本实验室保存。将盐芥种子播种于1/2MS培养基上萌发,17 d后转移到盛有Hoagland 营养液的水培盒中进行水培。每个水培盒放6棵苗,水培18 d后,选生长一致的幼苗进行盐处理。盐处理浓度梯度为:0、50、100、150、200、300、400 mmol/L的NaCl,盐处理时间为15 d。每个浓度处理6棵苗,每个处理重复3次。
1.2植株地上部和根干重测定
盐芥盐处理15 d时,将植株完整地从水培盒中取出,用蒸馏水将表面冲洗干净,吸水纸吸干表面水分,将地上部分和根分开,用锡箔纸分别包好,置于80℃烘箱内烘干至恒重,分别称取每株地上部和根的干重。
1.3叶片和根系硝酸盐含量的测定
采用还原法测定硝酸盐含量。取0、0.1、0.2、0.3、0.5、1.0 mmol/L硝酸钾溶液各10 μL作为标准样品,加入90 μL硝酸还原酶,室温反应30 min。然后加入60 μL N-1奈乙二胺盐酸和对氨基苯磺酰胺(N-1奈乙二胺盐酸∶对氨基苯磺酰胺=1∶1),2 h后,540 nm测定吸光值,制作标准曲线。
在每份烘干的叶片和根样品中加入适量0.1 mol/L的HCl,过夜,溶解硝酸盐。溶解液用水稀释100倍,然后取10 μL稀释液作为待测样品,按照标准品的测定方法测定吸光值。根据标准曲线方程计算样品的硝酸盐浓度,最后再根据稀释倍数和样品重量计算硝酸盐含量。
1.4盐芥表达谱分析
盐芥RNA提取、文库构建、高通量测序参照Wang等[14]已发表论文。简述如下,将培养18 d的盐芥幼苗用200 mmol/L NaCl处理 48 h,处理后根和叶片分别取样,利用RNAiso Reagent试剂盒提取RNA,并利用DNase Ⅰ去除基因组DNA污染。RNA质量检测、建库等步骤详见文献[14]。RNA-seq由北京基因组研究所(BGI)的Illumina HiSeq 2000 平台完成,每组样品设置两次生物学重复。
2 结果与分析
2.1盐胁迫对盐芥生长的影响
试验结果表明,水培培养液中含50~400 mmol/L NaCl条件下,盐芥均可以完成其生活史。但盐胁迫下,盐芥的生长发育受到抑制,且盐浓度越高受到的抑制越明显。与对照相比,处理浓度为300、400 mmol/L的植株叶片出现黄化干枯现象(图1)。
盐胁迫下,盐芥地上部和根干重的测定结果见图2,结果显示,NaCl浓度大于100 mmol/L时,盐芥地上部分和根系干重均有不同程度下降。

图1不同浓度盐处理15 d盐芥生长情况
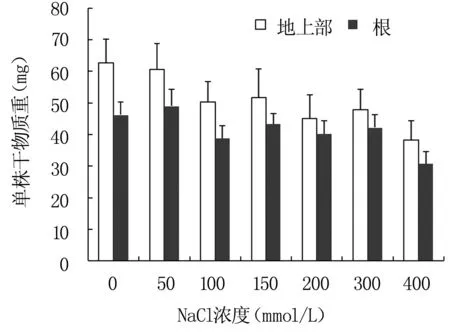
图2不同浓度NaCl处理盐芥地上部和根干重变化
2.2盐胁迫对盐芥叶片硝酸盐含量的影响
盐处理后,盐芥叶片内硝酸盐含量均比对照明显降低。在50~400 mmol/L NaCl各供试浓度下,盐芥叶片硝酸盐含量分别比对照降低53.4%、72.9%、83.9%、93.4%、100%和99.6%(图3)。

图3盐芥在不同浓度盐胁迫下叶片中硝酸盐含量比较
2.3盐胁迫对盐芥根硝酸盐含量的影响
盐处理后,盐芥根系的硝酸盐含量也发生了明显改变,各处理下的硝酸盐含量均低于对照,其中300、400 mmol/L处理的下降最明显。在50~400 mmol/L NaCl各处理浓度下,根系中硝酸盐含量分别比对照降低49.3%、55.1%、53.5%、78.1%、99.4%和97.1%(图4)。

图4盐芥在不同浓度盐胁迫下根中硝酸盐含量比较
2.4根干重与硝酸盐含量的关系
比较盐处理后植株根系硝酸盐的总量与根干重发现,根系中硝酸盐的含量与根干重呈正相关关系(R2=0.62),即根系中的硝酸盐含量越高,根干重越大(图5)。这一结果说明盐胁迫条件下根系的生长发育与硝酸盐的吸收密切相关,硝酸盐的含量降低可能是盐胁迫抑制盐芥根系发育的因素之一。
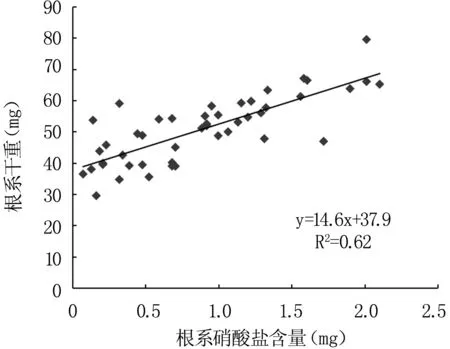
注:使用Pearson线性回归分析。
图5根系干重与硝酸盐含量的关系
2.5盐胁迫对硝酸根转运蛋白的表达调控
盐胁迫条件下,盐芥根系和叶片硝酸盐积累均显著下降。因为盐胁迫条件下植株生长受到抑制,硝酸盐的利用减少,因此推测根系吸收硝酸盐的能力下降。为此,我们利用表达谱分析了盐芥硝酸根转运蛋白(Nitrate Transporter,NRT)基因对200 mmol/L NaCl胁迫的响应。通过对表达谱数据的分析,发现10个表达丰度较高的NRT基因,聚类分析结果表明这些基因可以分为两组:4个NRT1s和6个NRT2s,分别属于低亲和力和高亲和力硝酸根转运蛋白基因(图6)。

注:盐芥NRT基因序列信息来源于盐芥基因组Eutrema salsugineum v1.0 (https://phytozome.jgi.doe.gov/pz/portal.html)。利用Clustal Omega 在线软件(https://www.ebi.ac.uk/Tools/msa/clust-
alo/)对NRT蛋白序列进行多序列比对。
图6盐芥盐胁迫响应NRT进化树分析
在叶片中,盐处理后只有Thhalv10023363m(NRT1)表达上升比较明显,上升3.46倍。Thhalv10007157m(NRT1)和Thhalv10007338m(NRT2)的表达被抑制,分别只有正常生长条件下的35%和21%。Thhalv10007254m(NRT1)和Thhalv10013237m(NRT2)为盐芥根特异表达基因,其表达均受盐胁迫抑制,分别为正常条件下的20%和32%。Thhalv10007157m(NRT1)在根中的表达量仅为正常条件下的29%(图7)。

注:NRT相对表达量(NRT relative expression)为盐胁迫条件下
3 讨论与结论
硝酸根转运蛋白(NRT)家族庞大,参与植物根系对硝酸盐的吸收、转运、分布和存储过程,与植物生长发育等重要生理活动相关联。除了参与硝酸根的转运,拟南芥中的NRT1.1还参与了生长素等的转运,与侧根的发育等生命活动密切相关[15]。NRT1.8属于NRT1亚族,参与硝酸根从木质部的转运,还参与了拟南芥对重金属镉胁迫的响应,可以提高植物对镉胁迫的抗性[16]。
本研究结果显示,盐胁迫使盐芥的生长发育受到了抑制,并且盐浓度越高抑制效果越明显。在300 mmol/L和400 mmol/L NaCl处理15 d时,盐芥出现了明显的叶片干枯现象。盐芥叶片和根系中硝酸盐含量的测定结果显示,叶片和根系中的硝酸盐含量均下降,并且叶片下降的更为明显,在300 mmol/L和400 mmol/L时,硝酸盐含量接近于零。这与盐胁迫下盐芥生长发育受到抑制的情况相吻合,根系干重与其硝酸盐含量呈线性正相关,推测盐胁迫抑制根系对硝酸盐的吸收和积累可能是盐芥生长发育受到抑制的因素之一。
尽管盐芥为盐生植物,与正常Hoagland溶液相比,高于50 mmol/L NaCl仍然会抑制其生长发育。硝酸盐在植物中的积累降低,利用也减少(因为生长受到抑制),说明盐胁迫条件下根系对硝酸盐的吸收能力下降。氮元素是构成蛋白质、核酸等生命大分子的重要成分,硝酸盐的吸收利用与植物的生长发育密切相关。拟南芥地上部的生物量随着叶片中硝酸盐含量的增加而增大,硝酸盐转运蛋白突变体nrt2.1根系吸收硝酸盐能力下降,同时植株的发育也延迟。此外,硝酸盐吸收受到限制会降低植物对水分吸收的能力[17,18]。植物自身可以通过调控硝酸根转运蛋白的表达调节根系对硝酸盐的吸收能力[13]。硝酸根转运蛋白基因是植物硝酸盐吸收和转运的关键基因,本研究表达谱数据显示盐芥中4个NRT1s和6个NRT2s表达丰度比较高。其中多个基因的表达明显受到盐胁迫的抑制,与盐胁迫条件下盐芥叶片和根系硝酸盐含量下降的趋势一致。推测这些基因表达丰度的下降可能是硝酸根积累下降的原因,Thhalv10023363m(NRT1)等基因表达上升或者维持不变,可能是盐胁迫条件下盐芥硝酸盐吸收和转运的关键基因。今后我们将进一步深入研究盐芥NRT基因参与的硝酸盐吸收调控的分子机理及其在提高植物耐盐性中的作用。
[1] 李静,张冰玉,苏晓华,等.植物中的铵根及硝酸根转运蛋白研究进展[J].南京林业大学学报,2012,36(4):133-139.
[2] Scheible W R, Gonzalez-Fontes A, Lauerer M, et al.Nitrate acts as a signal to induce organic acid metabolism and repress starch metabolism in tobacco [J].Plant Cell,1997,9(5):783-798.
[3] Zhang H, Forde B G.Regulation ofArabidopsisroot development by nitrate availability [J].J. Exp. Bot.,2000,51(342):51-59.
[4] Orsel M, Chopin F, Leleu O, et al.Characterization of a two component high-affinity nitrate uptake system inArabidopsisphysiology and protein-protein interaction [J]. Plant Physiol., 2006, 142:1304-1317.
[5] 王宇通,邵新庆,黄欣颖,等.植物根系氮吸收过程的研究进展[J].草业科学,2010,27(7):105-111.
[6] 赵昕,赵敏桂,谭会娟,等.NaCl胁迫对盐芥和拟南芥K+、Na+吸收的影响[J].草业学报,2007,16(4):21-24.
[7] 刘爱荣,赵可夫.盐胁迫下盐芥渗透调节物质的积累及其渗透调节作用[J].植物生理与分子生物学学报,2005,31(4):389-395.
[8] Bressan R A, Zhang C Q, Zhang H, et al.Learning from theArabidopsisexperience, the next gene search paradigm[J].Plant Physiol.,2001,127:1354-1360.
[9] Zhu J K.Genetic analysis of plant salt tolerance usingArabidopsis[J].Plant Physiol., 2000, 124:941-948.
[10] Zhu J K. Plant salt tolerance [J]. Trends Plant Sci., 2001, 62:66-71.
[11] Volkov V, Wang B, Doming P J, et al.Thellungiellahalophile, a salt relative ofArabidopsisthaliana, possesses effective mechanisms to discriminate between potassium and sodium [J]. Plant Cell Environ., 2003, 27:1-14.
[12] Jose A O, Vega A, Bouguyon E, et al. Nitrate transport, sensing, and responses in plants [J]. Mol. Plant, 2016, 9(6): 837-856.
[13] Ho C H, Lin S H, Hu H C, et al. CHL1 functions as a nitrate sensor in plants [J]. Cell, 2009, 138(6): 1184-1194.
[14] Wang J, Zhang Q, Cui F, et al. Genome-wide analysis of gene expression provides new insights into cold responses inThellungiellasalsuginea[J]. Front Plant Sci., 2017, 8:713.
[15] Noguero M, Lacombe B. Transporters involved in root nitrate uptake and sensing byArabidopsis[J]. Front Plant Sci.,2016,7:1391.
[16] Li J Y, Fu Y L, Pike S M, et al. TheArabidopsisnitrate transporter NRT1.8 functions in nitrate removal from the xylem sap and mediates cadmium tolerance [J]. Plant Cell, 2010, 22(5):1633-1646.
[17] Remans T, Nacry P, Pervent M, et al. A central role for the nitrate transporter NRT2.1 in the integrated morphological and physiological responses of the root system to nitrogen limitation inArabidopsis[J]. Plant Physiol., 2016, 140:909-921.
[18] Li G, Tillard P, Gojon A, et al. Dual regulation of root hydraulic conductivity and plasma membrane aquaporins by plant nitrate accumulation and high-affinity nitrate transporter NRT2.1[J]. Plant Cell Physiol., 2016, 57:733-742.
EffectsofSaltStressonAbsorptionofNitrateandRootGrowthandDevelopmentinEutremasalsuginea
Jiang Nana1,2, Cui Feng1, Liu Yiyang1, Han Yan1, Zhang Quan3, Li Jun1, Li Guowei1
(1.Bio-TechResearchCenter,ShandongAcademyofAgriculturalSciences/ShandongProvincialKeyLaboratoryofCropGeneticImprovement,EcologyandPhysiology,Jinan250100,China; 2.ShandongSeedGroupCo.,Ltd.,Jinan250100,China; 3.CollegeofLifeSciences,ShandongNormalUniversity,Jinan250014,China)
10.14083/j.issn.1001-4942.2017.09.006
2017-06-05
山东省现代农业产业技术体系棉花创新团队项目(SDAIT-03-03,SDAIT-03-05);山东农业大学盐碱地改良项目;国家自然科学基金项目(31601253);山东省农业良种工程项目(2014LZ)
徐佳陵(1990—),男,硕士研究生,研究方向:棉花耐盐分子机理。E-mail:1348573856@qq.com
宋宪亮(1972—),男,教授,博士,博士生导师,主要从事棉花遗传育种研究。E-mail:songxl999@163.com 孙学振(1963—),男,教授,博士,博士生导师,主要从事棉花栽培生理研究。E-mail:sunxz@sdau.edu.cn
S580.1
A
1001-4942(2017)09-0037-05

