动物源大肠杆菌抗药性检测及多抗高抗菌株ERIC图谱分析
刘玲红,胡明,商延,3,骆延波,李璐璐, 张印,齐静 ,张庆,常维山, 刘玉庆
(1. 山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室, 山东 济南 250100;2. 山东农业大学动物科技学院,山东 泰安 271018;3. 山东大学生命科学学院,山东 济南 250100)
动物源大肠杆菌抗药性检测及多抗高抗菌株ERIC图谱分析
刘玲红1,2,胡明1,商延1,3,骆延波1,李璐璐1, 张印1,齐静1,张庆1,常维山1,2, 刘玉庆1
(1. 山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室, 山东 济南 250100;2. 山东农业大学动物科技学院,山东 泰安 271018;3. 山东大学生命科学学院,山东 济南 250100)
为检测山东2016年动物源大肠杆菌的抗药情况,并分析多抗高抗菌株间基因重复一致序列PCR(ERIC-PCR)基因图谱,探讨多抗高抗大肠杆菌ERIC-PCR基因分型与抗药性之间的关系,从患病动物中分离并鉴定猪源和禽源大肠杆菌110株,用琼脂稀释法测定其对10种抗生素的抗药情况,并从中挑选20株多抗高抗大肠杆菌进行ERIC-PCR,根据DNA指纹图谱进行聚类遗传分析。结果表明,猪源大肠杆菌对多类抗生素具有抗药性,对氟苯尼考、多西环素和氨苄西林的抗药率达100%,对头孢噻肟抗药率较低,为57.14%;禽源大肠杆菌也具有高度抗药性,对氟苯尼考抗药率达95.51%,对环丙沙星抗药率最低,为61.80%。ERIC分析显示,多抗高抗菌株谱型分散,为多克隆来源,其基因分型B型与抗药特性之间呈一定相关性。表明,动物源大肠杆菌抗药程度高,且呈现高度多重抗药性,对不同种类抗生素及同类抗生素不同药物之间均存在严重的抗药性。多抗高抗大肠杆菌无明显种属特性,其传播和蔓延对畜牧业发展和公共卫生安全都形成潜在的巨大风险。
大肠杆菌;抗药性;ERIC-PCR;基因型
AbstractThe drug resistance ofE.colifrom animals were detected in Shandong Province in 2016, the gene mapping of Enterobacterial Repetitive Intergenic Consensus-PCR (ERIC-PCR) of multidrug resistant strains were analyzed, and then the relationship between ERIC-PCR genotyping and drug resistance of high-resistantE.coliwith multidrug resistance was discussed. Total 110E.colistrains were isolated and identified from diseased swine and avian, and their resistance to 10 kinds of antimicrobials were determined by the agar dilution method. Twenty high-resistant strains with multidrug resistance were selected to carry on the ERIC-PCR, followed by cluster genetic analysis according to the DNA fingerprint. The swine-originE.colistrains possessed serious resistance against several kinds of antimicrobial agents, for example, all strains were tolerant to florfenicol, doxycycline and ampicillin (100%), while a relative lower resistant rate to cefotaxime sodium (57.14%). The same situation was in the avian-originE.colistrains, which had a resistant rate of 95.51% against florfenicol while the lowest rate of 61.80% appeared on ciprofloxacin. Analysis of ERIC showed dispersive fingerprint patterns of high-resistant and multidrug-resistant strains which represented a multiple clone resources, and there were certain correlation between the B genotype and the drug-resistant characteristics. It indicated that animal sourceE.colistrains had high level of drug-resistance and were multidrug-resistant, that was, there were severe antibiotic resistance against not only different kinds of antibiotics but also different drugs of the same kind. The multidrug-resistant and high level-resistantE.colistrains had no apparent species preference, while its spreading and pervading posed a potential threat to the development of animal husbandry and the public health security.
KeywordsEscherichiacoli; Drug resistance; ERIC-PCR; Genotype
大肠埃希氏菌(Escherichiacoli)通常被称为大肠杆菌,多为人与动物的正常菌群,但在不良条件下为条件致病菌,某些种致病性强,能够引起严重的腹泻和败血症等[1]。近年来,随着养殖业集约化发展,养殖动物处于高营养、高密度的饲养环境中,自身免疫力低下,各种应激反应和疫苗保护不完全,极易发生感染。大肠杆菌作为常在菌群容易成为条件致病菌,引发大肠杆菌感染,对养殖业造成危害。从发病情况来看,大肠杆菌发病率居动物细菌性疾病全球首位,成为现代养殖业中最常见和最难防治的重要疾病之一,给整个畜牧业造成了巨大的经济损失[2]。
目前兽医临床上,使用抗生素仍是防治大肠杆菌病的首要方法。国内外大量研究表明,大肠杆菌极易产生抗药性,抗药率逐渐上升,抗药谱迅速增宽,抗药性的形成和传播速度也越来越快[3]。同时,抗菌药物的不规范使用,不仅加剧了在畜禽体内的残留,甚至加速了抗药菌株或抗药性基因元件在不同物种间的传播,给我国畜牧业的健康快速发展和公共卫生安全带来了隐患和潜在威胁[4]。另外,国家关于抗生素的管理正处在摸索与探究中,比如:对于同类不同抗菌药物,目前区分了不同的使用对象和范围,此措施能否有效阻断抗药性的产生和蔓延还有待于进一步研究。
肠杆菌基因间重复共有序列(enterobacterial repetitive intergenic consensus, ERIC)PCR 以其操作简便、易实现、重复性高、分辨力强等优点,逐渐引起了人们的关注[5]。本研究于2016年从病死动物样品中收集猪源和禽源大肠杆菌,检测其对常用抗生素种类的抗药性,同时关注其对兽用和医用使用范围有所区分的同类别不同药物之间交叉抗药性,并采用ERIC-PCR方法,探讨多抗高抗大肠杆菌ERIC-PCR图谱与其种属特异性和传播之间、大肠杆菌抗药情况及ERIC-PCR基因分型间的关系,对了解大肠杆菌抗药水平、药物间交叉抗药性及开展抗药菌株抗药机制的分子生物学研究有一定意义。
1 材料与方法
1.1试验材料
大肠杆菌ATCC 25922药敏标准株,由山东省农业科学院畜牧兽医研究所公共卫生实验室保存。
培养基:大肠杆菌显色培养基ECC,购自上海欣中生物有限公司;MHA琼脂和MHB肉汤培养基,购自北京陆桥技术有限责任公司。
试剂:PCR buffer、dNTP 和TaqDNA聚合酶,均购于天根生化科技(北京)有限公司;DL5000 DNA Marker, 购于宝生物工程(大连)有限公司。
抗生素:氨基糖苷类:庆大霉素(CN);四环素类:多西环素(DOX);氯霉素类:氟苯尼考(FFC);β-内酰胺类:氨苄西林(AMP)、头孢曲松(CRO)、头孢噻呋(CEF)和头孢噻肟(CEQ);氟喹诺酮类:恩诺沙星(EN)、环丙沙星(CIP)和左氧氟沙星(LVX)。以上试剂购自北京普博欣生物科技有限责任公司。
1.2方法
1.2.1 大肠杆菌分离鉴定 将2016年于山东不同地区养殖场采集的患病鸡、猪内脏和粪便拭子样品划线于大肠杆菌显色培养基上,37℃培养后挑取单个蓝色可疑菌落,接种于非选择性MHA琼脂培养基培养后,用MALDI-TOF-MS飞行时间质谱仪(法国生物梅里埃 VETIK MS)进行鉴定,将鉴定为阳性的大肠杆菌保存于30%甘油肉汤中,置于-20℃保存备用。
1.2.2 大肠杆菌药物敏感试验 参照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准,用琼脂稀释法对分离菌株进行10种药物的药敏试验[6],测定各菌株的抗药率,统计分析猪源、禽源大肠杆菌抗药性及各菌株的多重抗药性、交叉抗药性。
1.2.3 ERIC检测 根据参考文献[7]设计引物(F: 5′-ATGTAAGCTCCTGGGGATTCAC-3′,R:5′-AAGTAAGTGACTGGGGTGAGCG-3′),由上海生物工程有限责任公司合成。
根据药敏试验结果,挑取多抗高抗菌株,禽源和猪源各10株,提取DNA,进行ERIC-PCR 扩增。PCR反应条件: 95℃预变性 7 min;90℃变性 30 s,52℃退火 1 min,65℃延伸 8 min,30个循环;65℃延伸 16 min,4℃ 保存。根据电泳图记录ERIC指纹图谱并分析DNA多态性。有条带的记为“1”, 没有条带的记为“0”,将ERIC-PCR扩增的DNA多态性形成数据矩阵进行聚类遗传分析。以相似度>0.75为同一基因型,<0.75为不同基因型[8]。
2 结果与分析
2.1大肠杆菌分离鉴定
采集样品经过分离鉴定,最终确定共获得大肠杆菌110株,其中猪源大肠杆菌21株,禽源大肠杆菌89株。
2.2大肠杆菌抗药性检测
对分离的大肠杆菌进行药物敏感试验,结果如图1,可见,所有菌株抗药率均较高,其中猪源大肠杆菌对多西环素、氨苄西林和氟苯尼考抗药率达100%,对环丙沙星、恩诺沙星抗药率为90%以上,对头孢噻肟抗药性相对较低,也在57.14%。禽源大肠杆菌对氟苯尼考和氨苄西林抗药率高达90%以上,对环丙沙星抗药率较低,为61.80%。表明,山东不同动物源大肠杆菌抗药性非常严重。

图1 猪源和禽源大肠杆菌分离株的抗药率
2.3大肠杆菌的多重抗药性
统计分析110株大肠杆菌药敏试验结果,多重抗药性如图2所示,可见,未发现完全不抗药的菌株,仅有1株菌抗1种抗菌药,其余菌株均表现出对2种及多种抗菌药物的抗药性,其中同时抗10种抗菌药的多达41株(37.27%),抗6~9种抗菌药的有62株(56.36%),抗1~5种抗菌药的仅占6.36%。

图2大肠杆菌分离株的多重抗药性
2.4大肠杆菌对同类抗生素交叉抗药性
本研究中,选择了同属于第三代头孢的3种抗生素,即头孢噻呋、头孢噻肟和头孢曲松。其中,前者为动物专用抗生素,后两种为医用抗生素。
根据交叉抗药率计算公式[9]:A药对B药的交叉抗药率(%)=同时抗A、B药菌株数/抗B 药总菌株数×100 ,计算出两种头孢菌素之间交叉抗药性,结果如表1,显示头孢类抗生素间存在非常显著的交叉抗药性,每两种抗生素的交叉抗药程度多在95%以上,医用抗生素和动物用抗生素在本试验分离的大肠杆菌抗药率方面并无区别。110株大肠杆菌中,对1种及以上头孢药物具有抗药性的菌株共有81株,其中同时对3种头孢药物均抗药的菌株有70株,对3种药物的重合抗药率为86.40%。
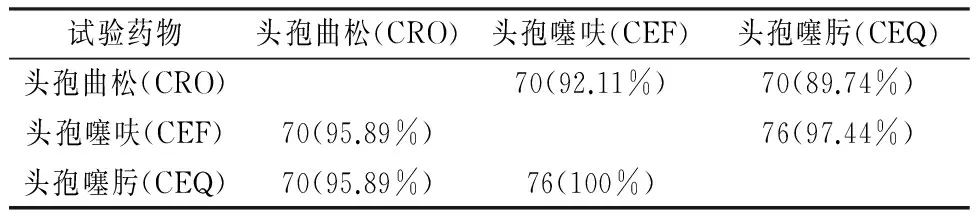
表1 对两种头孢类药物同时产生抗药性的菌株调查结果
注:表中数据括号外为菌株数,括号内为交叉抗药率。下同。
同样,研究中选择三种喹诺酮类药物,即恩诺沙星、环丙沙星和左氧氟沙星。前者是动物专用,后两者为医用。根据交叉抗药率公式, 计算出喹诺酮类两两之间交叉抗药率,结果如表2,显示喹诺酮类抗生素不同药物同样存在交叉抗药性。每两种抗菌药的交叉抗药性多高于80%以上。110株大肠杆菌中,对1种及以上喹诺酮药物具有抗药性的菌株共有95株,其中同时对3种头孢药物抗药的菌株有65株,3种药物重合抗药率为68.40%。

表2 对两种喹诺酮类药物同时产生抗药性的菌株调查结果
2.5 ERIC指纹图谱分析
根据药敏试验结果综合评价,挑取禽源和猪源多重高抗菌株各10株,进行多次ERIC-PCR,获得稳定指纹图谱。ERIC-PCR指纹图谱条带数约有1~8条,条带大小主要在200 ~3 000 bp之间,以400 bp和1 800 bp左右为主带;猪源和禽源指纹图谱主带无明显同源性。禽源4和5泳道指纹图谱几乎完全一致,表明4和5菌株可能属同一菌株;猪源指纹图谱未发现明显规律;禽源和猪源DNA指纹图谱共表现出19种ERIC谱型,如图3所示。

注:M代表DL5000 DNA Marker。
图3禽源和猪源多抗高抗大肠杆菌的ERIC-PCR电泳图谱
2.6 DNA多态性聚类分析
由聚类分析树状图(图4)可知,20株抗药菌株有8种ERIC-PCR基因型,并且与禽源或猪源没有相关性。其中有55%抗药菌株表现同一ERIC-PCR基因型,即B型,该部分菌株中63.64%菌株表现同样的抗药谱,即对10种抗生素全部抗药。所选择菌株中共有10株细菌对10种抗菌药均为抗药,其中7株都为B型ERIC-PCR基因型。

图4 多抗高抗菌株聚类分析树状图
3 讨论与结论
近年来,大肠杆菌的抗药株不断增多,出现了大量多重抗药菌。国内外研究结果表明,抗药性大肠杆菌在全球范围内广泛存在[10,11]。雷连成[12]、隋慧[13]及贺丹丹[14]等均报道动物源大肠杆菌的抗药性以多重抗药为主。本研究结果发现,110株大肠杆菌中仅1株单一抗药菌株,其余均为多重抗药菌株。本研究中多重抗药株高度集中,可能由于兽医临床大量使用抗菌药治疗细菌性感染,或者在饲料中添加抗生素来促进生长和预防疾病,导致大肠杆菌长期在药物选择压力下产生越来越显著的抗药性[15]。同时,大量抗药菌的出现可能是菌体携带介导抗药性的质粒导致抗药基因在菌体间传播。另据研究报道,多重抗药菌的出现,可能是菌体细胞膜通透性的改变和菌体主动外排系统表达量增加作用的结果[16,17]。
本研究表明,分离的大肠杆菌不仅对多种抗生素产生抗药性,还对同类抗生素不同药物存在严重的交叉抗药性,如头孢类和喹诺酮类药物,菌株对医用抗菌药的抗药性也很高。虽然此现象可能与养殖场存在用药不规范的情况有关,但作用机理和治疗效果相似的同类抗菌药不可能同时大量和重复使用,因此,高度交叉抗药性的现象应该引起人们的高度重视。一种药物产生抗药性,同类产品的其它药物可能因此而产生交叉抗药性,所以单纯将动物专用抗菌药和医用抗菌药分开,而不考虑交叉抗药性的问题,不可能阻止抗药菌株的传播和蔓延。本研究结果同类抗生素间存在交叉抗药性与李筱涵等[18]报道喹诺酮类药物间存在交叉抗药性的结果一致。喹诺酮类抗菌药体外诱导抗药性试验证明,这类药物之间存在交叉抗药性是由于有相同的母体结构,同理,头孢类抗菌药间存在抗药性是因为含有相同的环状结构[19]。交叉抗药性的检测可以反映兽医临床抗药的实际情况,给兽医临床指导用药奠定基础,同时交叉抗药性给公共卫生领域带来了挑战和潜在的威胁。
病原菌给养殖业带来高风险,尤其是多抗高抗菌株给实际生产带来巨大危害,本文探讨了多抗高抗菌株表型与其DNA指纹图谱间的关系,分析抗药菌株同源性、抗药表型与ERIC-PCR基因型的关系,探索抗药菌株产生抗药性机制的相似点。研究发现所测菌株谱型非常分散,并且禽源和猪源大肠杆菌之间并无明显的种属特异性,这预示菌株易在不同物种间传播,增加了包括人在内的不同物种共患的可能性。结果还显示菌株抗药性与特定ERIC-PCR基因型之间存在一定程度的关联,具体为对10种药物全部抗药的多抗高抗菌与B型ERIC-PCR基因型存在最大的重合和覆盖度,表明此基因型的大肠杆菌易形成多重抗药性,或者是此基因型大肠杆菌具有较强的传播和蔓延能力,对养殖业和世界公共卫生安全造成了潜在的极大的威胁因素。
统计分析动物源大肠杆菌抗药性和抗药菌株间ERIC基因型间的关系,有助于从大肠杆菌表型和分子水平多方面检测大肠杆菌抗药性,本文将DNA指纹图谱与抗药性和同源性联系起来,为深入抗药菌株产生抗药性的分子机制研究奠定基础,利用ERIC-PCR技术研究其DNA 指纹图谱与抗药表型的关系还需更多数据的支持,有待进一步深入研究。
[1] Orth D, Grif K, Zimmerhackl L B, et al. Prevention and treatment of enterohemorrhagicEscherichiacoliinfections in humans [J]. Expert Rev. Anti. Infect. Ther. ,2008,6:101-108.
[2] 安微,张秀英,李蕊,等. 致病性大肠杆菌毒力因子和耐药性研究进展[J]. 畜牧与兽医,2013,45(8):106-110.
[3] Titilawo Y, Sibanda T, Obi L, et al. Multiple antibiotic resistance indexing ofEscherichiacolito identify high-risk sources of faecal contamination of water[J]. Environ. Sci.Pollut. Res. Int., 2015,22: 10969-10980.
[4] 林居纯,卓家珍,蒋红霞,等.不同地区猪源和禽源大肠杆菌耐药性监测[J].华南农业大学学报,2009,30(1):86-88.
[5] Hulton C S, Higgnsc F. ERIC sequences: a novel family of repetitive elements in the genomes ofEscherichiacoli,Salmonellatyphimuriumand other enterobacteria [J]. Journal of Molecular Microbiology and Biotechnology, 1991,5:825-830 .
[6] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: 18th informational supplement [S]. CLSI Document M100-S18,2008.
[7] Versalovic J, Koeuth T, Lupski J R. Distribution of repetitive DNA sequences in eubacteria and application to finerpriting of bacterial genomes [J]. Nucleic Acids Research,1991, 19(24): 6823-6831.
[8] Sandvang D, Aarestrup F M , Jensen L B. Characterisation of integrons and antibiotic resistance genes in Danish multiresistantSalmonellaentericaTyphimutium DT104 [J]. FEMS Microbiology Letters, 1998, 160(1):37-41.
[9] 张健騑,李跃龙,陈鲜花,等. 禽致病性大肠杆菌对氟喹诺酮类药物交叉耐药性研究[J]. 广东农业科学, 2005(2):74-76.
[10] Chaieb K, Abbassi M S, Touati A, et al. Molecular characterization ofStaphylococcusepidermidisisolated from biomaterials in a dialysis service[J]. Annals of Microbiology, 2005, 55: 307-312
[11] Mathai E, Chandy S, Thomas K, et al. Antimicrobial resistance surveillance among commensalEscherichiacoliin rural and urban areas in Southern India[J].Trop. Med. Int. Health.,2008,13(1):41-45.
[12] 雷连成,郑丹,韩文瑜,等 动物源性大肠杆菌药物敏感性检测及耐药性分析(英文)[J]. 中国兽医学报,2005,25(5):470-473.
[13] 隋慧,杨金生.动物源性多重耐药大肠杆菌的分离与鉴定 [J]. 中国兽医杂志,2013,49(6):48-50.
[14] 贺丹丹,黄良宗,陈孝杰,等. 不同动物源大肠杆菌的耐药性调查[J]. 中国畜牧兽医,2013,40(10):211-215.
[15] 张纯萍,宁宜宝,宋立. 健康鸡猪体内大肠杆菌对四环素的耐药性及耐药基因分布[J]. 中国农业科学,2010,43(12):2578-2583.
[16] 赵静,杨汉春,查振林.规模化猪场大肠杆菌耐药性监测[J]. 中国兽医杂志,1998,24(11):12-13.
[17] 张小林,李家泰.主动外排系统在大肠杆菌中的分布与表达[J]. 中国临床药理学杂志,1999,15(3):171-174.
[18] 李筱涵,曲芬,鲍春梅,等. 氟喹诺酮类药物对肠道致病菌的体外耐药性及交叉耐药[J]. 中国抗生素杂志,2009(4):251-253.
[19] Barry A L, Jones R N. Cross -resistance among cinoxacin, ciprofloxacin, DJ -6783, enoxacin, nalidixic acid, no-rfloxacin, and oxolinic acid afterinvitroselection of resistant populations [J]. Antimicrob. Agents Chemo. Ther., 1984, 25:775-777.
DetectionofDrugResistanceofEscherichiacoliIsolatedfromAnimalsandERICAnalysisofMultipleResistantStrains
Liu Linghong1,2, Hu Ming1, Shang Yan1,3, Luo Yanbo1, Li Lulu1, Zhang Yin1, Qi Jing1, Zhang Qing1, Chang Weishan1,2, Liu Yuqing1
(1.InstituteofAnimalHusbandryandVeterinaryMedicine,ShandongAcademyofAgriculturalSciences/ShandongProvincialKeyLaboratoryofAnimalDiseaseControlandBreeding,Jinan250100,China; 2.CollegeofAnimalScienceandVeterinaryMedicine,ShandongAgriculturalUniversity,Taian271018,China; 3.SchoolofLifeSciences,ShandongUniversity,Jinan250100,China)
10.14083/j.issn.1001-4942.2017.09.001
2017-06-26
山东省农业科学院农业科技创新工程项目(CXGC2017A01);山东省农业重大应用技术创新项目“山东省肉鸡业公共卫生模式建立的示范”
刘玲红(1991—),女,山东烟台人,硕士研究生,主要从事预防兽医学研究。 E-mail:1074150258@qq.com
常维山(1960—),男,山东泰安人,教授,主要从事预防兽医学研究。 E-mail:wschang@sdau.edu.cn 刘玉庆(1969—),男,山东烟台人,研究员,主要从事兽医公共卫生研究。E-mail: liuiuqing@163.com
S852.61+2+Q78
A
1001-4942(2017)09-0001-06

