Cu2+对鲫鱼过氧化物同工酶表达的影响
刘金霞


摘 要:研究不同浓度的Cu2+对鲫鱼过氧化物同工酶表达的影响。用四个不同浓度梯度的硫酸铜溶液饲养鲫鱼,处理4 d后,使用聚丙烯凝胶垂直平板电泳法,研究不同浓度的Cu2+对鲫鱼肝脏、鳃过氧化物同工酶的影响。结果显示,不同浓度的Cu2+都有可能使肝脏、鳃组织过氧化物同工酶带强弱发生较明显的变化,并且对其组织过氧化物同工酶的影响显现出一定的组织差异性,在一定量的浓度范围内表现出应激性,可以说,低剂量的铜离子可以诱导酶活性的提高。
关键词:铜离子;鲫鱼;过氧化物同工酶
对于生物而言,毒物与毒性是两个不同而又相关的概念,表现出毒性的物质,不能统统称为毒物,毒物也只在一定浓度、一定接触时间后才显出毒性,有的甚至还是生物不可缺少的微量元素,铜就是这种情况[1]。铜离子(Cu2+)在浓度较低时可提高抗氧化酶的活性;而在浓度较高时,会降低抗氧化酶的活性,从而使Cu2+变成一种抑制剂或有毒制剂[1],因此,研究、探讨Cu2+对水生动物的影响十分必要。
Cu2+被鱼体吸收后,一部分通过血液循环到达各组织器官,可能影响鲫鱼各组织内的过氧化物同工酶的活性,过氧化物同工酶(POD)是细胞中的一组重要的抗氧化酶,它们存在于细胞的过氧化物酶体内,以铁卟啉为辅基,可催化活性氧中的过氧化氢氧化[1]。同工酶是基因表达后分子水平的表型,测定同工酶谱是了解基因存在和表达的重要工具。
本研究以鲫鱼作为研究对象,通过聚丙烯凝胶垂直平板电泳法来观察过氧化物同工酶的表型,采用生态学单因子梯度实验方法,对鲫鱼的过氧化物酶的表型进行观察研究。以期探讨Cu2+对鱼类的毒害机制以及与水体中的Cu2+浓度的相关性。
1 材料与试剂
1.1 实验鱼
鲫鱼:健康,体表无损伤,体型匀称,体长8~10 cm。将购买回来的鲫鱼放在之前准备的、曝晒之后的自来水中预饲养,并投喂一定的鱼食,一天后染毒。
1.2 实验试剂及其配制
硫酸铜(分析纯):使用前先配成10 g/L的母液,使用时稀释成所需要的浓度。
分离胶缓冲溶液(pH 8.9):取48 mL 1 mol/L HCl,Tris36.8 g,用蒸馏水溶解后定容至100 mL。
浓缩胶缓冲溶液(pH 6.7):取48 mL 1 mol/L HCl,Tris5.96 g,用蒸馏水溶解后定容至100 mL。
凝胶贮备液:丙烯酰胺 58 g,双丙烯酰胺 2 g,加蒸馏水溶解,定容至200 mL。存放于4 ℃棕色瓶避光保存。
10%过硫酸铵溶液:1 g过硫酸铵溶于10 mL蒸馏水中(现用现配)。
电极缓冲液pH 8.3:Tris 6 g,甘氨酸28.8 g用蒸馏水定容至1 000 mL。用时稀释10倍。
上样缓冲液:浓缩胶缓冲液10 mL,甘油(丙三醇)5 g,1%溴酚兰1 mL。
7%冰乙酸:取7 mL冰乙酸加水至100 mL容量瓶中定容。
染色剂:联苯胺0.1 g+无水乙醇15 mL(提前配好)、15 mol/L乙酸钠10 mL、1.5 mol/L冰乙酸10 mL、蒸馏水75 mL混匀。
PBS缓冲液pH 7.0: 取母液①32 mL和母液②68 mL混合即可。
母液的配制:① 0.2M Na2HPO4:称取 71.6 g Na2HPO4-12H2O,溶于 1 000 mL 水
② 0.2M NaH2PO4:称取 31.2 g NaH2PO4-2H2O,溶于1000 mL 水
1.3 主要实验器材
台式冷冻离心机、电子天平、HHS-2S型电热恒温水浴锅、DYCZ-24D 双垂直电泳仪、FD201 稳压稳流电泳、电子称、分析天平、托盘天平、移液枪(5 mL、1 mL、200 μL)、增氧泵、微量加样器
2 实验方法
2.1 鲫鱼的染毒实验
将实验鱼在实验室暂养4 d后,挑选体格键壮,规格一致的鲫鱼进行染毒实验。实验在塑料水族箱中进行,实验用水为曝气24 h以上的自来水,每个水族箱中加入 40 L 含有 不同浓度Cu2+的溶液。实验分 4 个浓度处理组,Cu2+浓度分别为0.000 mg/L、0.008 mg/L、0.016 mg/L、0.032 mg/L,并配有平行组。每一水族箱中放实验鱼20尾,实验时水温保持在15~20 ℃,实验期间停止喂食,并用充氣泵连续不断的充气。
2.2 粗酶液的制备
Cu2+处理3 d后,从每个处理组中随机抽取健康鲫鱼 3尾,在冰盘内迅速解剖,分别取鳃和肝胰脏,用吸水纸吸去组织液后称重,并按 1∶1(W/V)比例加入预冷的提取液(0.1 mol/L pH 7.0 PBS),分别于冰浴中研磨成匀浆。匀浆后经 12 000 r/min,4 ℃条件下离心 20 min 制成粗酶液,于-20 ℃条件下保存。
2.3 电泳待测酶液的制备
电泳前,将已制备好的各组粗酶液与电泳上样缓冲液按 1∶1(V/V)混匀,后直接进行电泳。
2.4 过氧化物同工酶电泳实验
2.4.1 电泳方法 POD同工酶电泳采用不连续的聚丙烯酰胺凝胶(PAGE)垂直平板电泳,7%分离胶(pH 8.9) 和 3%浓缩胶(pH 6.7),电极缓冲液为Tris- Gly(pH 8.3)。用50μL的微量进样器点样量,点样量 20 μL/孔。电泳开始时电流恒定在每块板10 mA,当溴酚兰指示剂完全进入分离胶时,电流改为每块板20 mA,当溴酚兰指示剂电泳至凝胶底端大约0.5 cm时,停止电泳,小心地将凝胶片分离,以备染色。电泳过程约5 h。电泳水环境温度为 4 ℃。endprint
2.4.2 染色并固定 将制好的凝胶片做好标记后放在大培养皿内,用蒸馏水冲洗数次,然后加过氧化氢溶液5~6滴,再加染色液染色,轻轻振摇 ,观察颜色变化。然后把染色液倒掉,放在7%的乙酸中固定。
2.4.3 结果记录及酶谱分析 染色结束后对凝胶片进行拍照留存。随后,按照酶带的迁移距离及染色深浅,参考拍摄的照片,绘制出酶谱示意图。把向距离阴极最近的酶带进行编号为1,且按照从阴极至阳极的顺序依次编号,并计算其相对迁移率(Rf值)。
相对迁移率的计算方法如下:
相对迁移率(Rf)=电泳条带移动距离(cm)/ 染料移动距离(cm)
3 实验结果
3.1 电泳图片及Rf计算
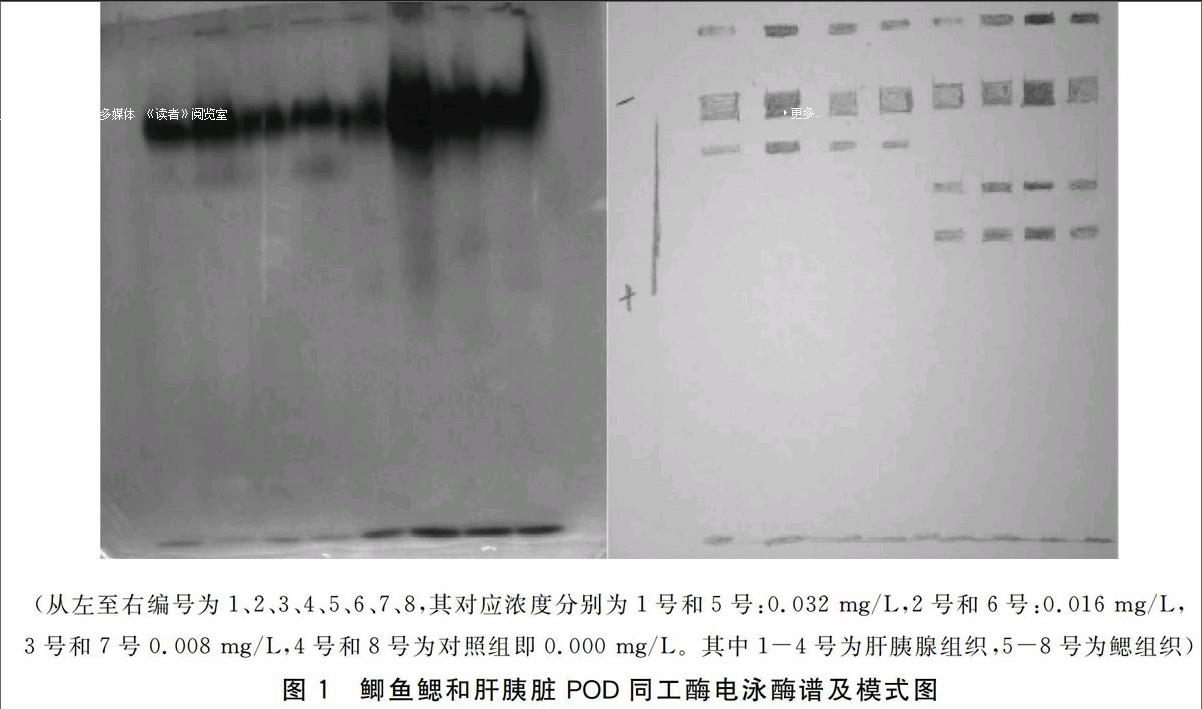
不同浓度的Cu2+处理3 d后鲫鱼肝胰脏及鳃组织POD同工酶电泳图谱如图1。图1左侧为鲫鱼肝胰脏及鳃的POD同工酶电泳酶谱,右侧为模式图。 酶谱中各酶带从负极到正极按POD1、POD2、POD3、POD4和POD5命名。酶谱中各酶带Rf见表1。
不同浓度的Cu2+处理后POD同工酶在鲫鱼肝胰脏和鳃两种组织中的表达情况见表2。从表2可以看出,POD同工酶的表达具有明显的组织特异性,鲫鱼 POD 同工酶电泳酶谱共检测出五条酶带,两种不同组织中的 POD 酶带数量及颜色的深浅都表现出差别。鳃组织中检测出POD-1、POD-2 、POD-4和POD-5四条酶带,而在肝组织中只检测出POD-1、POD-2 和POD-3三条酶带。其中POD-2颜色最深,其与POD-1在两种组织中都有表达。
(从左至右编号为1、2、3、4、5、6、7、8,其对应浓度分别为1号和5号:0.032 mg/L,2号和6号:0.016 mg/L,3号和7号0.008 mg/L,4号和8号为对照组即0.000 mg/L。其中1-4号为肝胰腺组织,5-8号为鳃组织)
3.2 数据分析与讨论
过氧化物同工酶是一种活性较高的适应性酶,在大部分动植物体内的各个组织内都有所发现,由于该酶在逆境中适应能力特别强,反应十分敏感,因此该酶可以及早地反映出生物生长发育的特性、体内新陈代谢的状态和对外界水环境不断改变的适应性。
通过酶带数目和颜色的深浅进行对比发现:POD-1和POD-2在肝胰腺和鳃组织同时都有表达,而POD-4和POD-5只有在鳃组织内有表达。说明不同组织间的过氧化物同工酶具有差异性。
相同组织间观察,1-4号,随着Cu2+的浓度升高到一定浓度,其过氧化物同工酶具有超强表达,浓度过高时反而具有抑制作用。
4 结论
正常情况下鲫鱼不同组织间过氧化物同工酶具有明显的差异性;肝组织过氧化物同工酶活性要大于鳃组织过氧化物同工酶活性;
同一组织中的过氧化物同工酶在不同浓度的Cu2+溶液中表现的活性是不一样的,肝组织中的过氧化物同工酶随着Cu2+浓度的升高,当达到低浓度时活性会增强,达到中浓度甚至高浓度时,其酶的活性会受到抑制,甚至表达很微弱。
而鳃组织中的过氧化物同工酶随着Cu2+浓度的升高时,在达到中浓度之前,其活性一直是增强的,浓度在升高时,酶的活性会变弱。
这种现象所反映的可能是鲫鱼机体对重金属离子毒害的一种抵抗力,或者称之为适应性。当重金属离子进入动物体内后,动物通过同工酶的改变去抵抗该毒性或者去适应该逆境,使得动物体得以生存。由此可见,Cu2+染毒引起鲫鱼鳃部和肝脏的损害,而这种损害又与鲫鱼体组织内的过氧化物同工酶的改变有一定的联系。其中过氧化物同工酶的变化在鲫鱼Cu2+中毒過程中起着重要作用。
参考文献:
[1] 湛江水产专科学校.淡水养殖水化学[M].北京 :农业出版社,1979.endprint

