大蒜素在鲫鱼体内的药动学及残留消除规律
潘 浩, 王 荻, 卢彤岩
(1. 中国水产科学研究院 黑龙江水产研究所, 哈尔滨 150070; 2. 上海海洋大学 水产与生命学院, 上海 201306)
大蒜素在鲫鱼体内的药动学及残留消除规律
潘 浩1,2, 王 荻1, 卢彤岩1
(1. 中国水产科学研究院 黑龙江水产研究所, 哈尔滨 150070; 2. 上海海洋大学 水产与生命学院, 上海 201306)
采用气相色谱法,研究了以7.5 mg/kg(体质量)单次剂量口灌给药后,大蒜素在鲫鱼体内的药物代谢动力学及药物残留消除规律。结果表明:单次口灌给药后,大蒜素在血浆中的药时关系符合一级吸收二室开放模型。每天一次,连续3 d给药后,大蒜素的主要成分: 二烯丙基二硫醚(DADS)于13 d开始低于10 μg/kg,二烯丙基三硫醚(DATS)于15 d开始低于10 μg/kg。研究表明,建议休药期不低于15 d。
鲫鱼;大蒜素;药动学;药物残留
AbstractThe pharmacokinetics and residues of allicin were studied in crucian carp exposed to oral administration at 7.5 mg/kg bodyweight by means of gas chromatography (GC).The results showed that the concentrations versus time of allicin in muscle was well described by two-department open model with first-order absorption after a single oral administration.The residues in crucian carp by oral administration for 3 d once a day were found to be less than the maximum residue limit (MRL) (10 μg/kg) at the day 13 for DADS and the day 15 for DATS. The findings indicated that the withdrawal time should be 15 days after administration on these conditions.
Keywordscrucian carp; allicin; pharmacokinetics; residue
大蒜素(allicin),化学名为二烯丙基三硫化物,是大蒜的主要有效成分,有刺鼻气味,微溶于水,溶于乙醇、苯、乙醚等有机溶剂[1]。大蒜素性质不稳定,常温下极易挥发,可进一步分解生成性质稳定的二烯丙基二硫化物(DADS) 、二烯丙基硫化物(DAS) 、阿霍烯(ajoene) 及少量的二烯丙基硫化合物(DATS,即大蒜素) 等[2]。大蒜素对多数细菌有抑制作用,药效良好,对革兰氏细菌、真菌都有显著的抑制作用[3],对有益菌如大肠杆菌则无抑制作用,而且大蒜素无毒副作用,不会产生药物残留,且不会导致细菌产生耐药性,是抗生素的首选替代药物[4]。
目前,虽然对大蒜素在水产养殖中作为添加剂的研究已经做了大量的工作[5-12],但尚未见关于大蒜素在鱼体内的药动学及残留研究报道。本文就此进行研究,通过计算有关的药动学参数,为制定大蒜素在鲫鱼养殖中鱼病的防治以及科学、合理使用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验鱼
鲫鱼(Carassiusauratus)(0.7±0.2)kg,由呼兰试验基地提供;试验在室内进行,试验期间正常供氧。试验鱼在自动循环水族缸中暂养,水温试验期间保持恒定,暂养驯化3 d,驯化期间正常喂养。给药前停饲24 h,试验期间不投喂,水温保持在(20±0.5)℃,正常供氧,水体溶氧保持在6.00 mg/L以上。
1.1.2 试验用品
标准品:DADS标准品,含量94.2%,中国食品药品检定研究院,批号:100384-201403;DATS标准品,含量75%,上海安普CNW,货号:CFEQ-4-440081-0005。二氯甲烷(A.R);正己烷(GC)。
1.1.3 试验仪器
安捷伦7890B气相色谱仪,Agilent仪器公司;3-18K高速离心机,Sigma公司;HYQ-3110调速混匀器,深圳市宝域科技有限公司;SB5002电子天平,上表电子仪器厂;DCY-24A氮吹仪,上海精密仪器仪表有限公司。
1.2 试验方法
1.2.1 给药剂量及样品采集
1) 药动学试验。以7.5 mg/kg体质量的给药剂量对鲫鱼单次口灌大蒜素,18尾鲫鱼,随机分为Ⅰ、Ⅱ和Ⅲ组,每组6尾鱼。单次口灌大蒜素后,采用活体多次体侧取血法[13],各剂量组取样方案为,Ⅰ组分别于给药后 0.25、1、4、12和48 h,Ⅱ组于 0.5、1.5、6、24和72 h,Ⅲ组于 0.75、2、8和36 h 在试验鱼尾部采集血液1 mL(注射器事先用3‰肝素钠润洗),每次采样前后均用 75%酒精棉球于进针部位进行消毒,并在采样后按压针孔部位以止血。血液样品4000 r/min 离心10 min 后,取上层血浆于-20℃冰箱中保存。
2)残留量试验。以有效成分7.5 mg/kg (体质量)的剂量,每天1次,连续3 d对鲫口灌大蒜素溶液(食用油配制) ,停药当天为第1天,于1、2、3、4、5、6、7、9、11、13、15、17、21、25和30 d每天随机选取6尾试验鱼,采集肌肉组织,保存于冰箱(-20℃)中备用。
1.2.2 样品的前处理
1)血浆处理。将采集的血浆从-20℃冰箱中取出,4℃自然解冻后摇匀,取0.5 mL血浆,加0.5 mL正己烷涡旋0.5 min,3000 r/min离心5 min,过0.22 μm有机滤膜上机待测。
2)肌肉。肌肉从冰箱取出室温化冻,称重后放入50 mL平底离心管中,加4 mL二氯甲烷浸没肌肉匀浆,刀头用3 mL二氯甲烷清洗,合并2次提取液,漩涡混匀,离心机高速离心5 min后吸取上清液。残渣按上述步骤重新提取2次。将最后提取液通风橱内于30℃下氮吹吹干,管底残渣加1 mL流动相震荡至完全溶解,再加入1 mL正己烷去除油脂,震荡后离心,吸取底层溶液过0.22 μm有机相滤膜,吸取1 mL转入样品瓶上机待测。
1.2.3 气相色谱条件
色谱柱: Agilent 7890B HP-5柱(30 m×320 μm×0.25 μm);检测器:火焰光度检测器FPD(S);检测器温度:200℃;进样量:1 μL,不分流进样;进样口温度:160℃;载气:高纯氮气,恒流模式,2 mL/min。
1.2.4 标准曲线的绘制
用正己烷将DATS、DADS标准品稀释成浓度为25、50、75、100、200、300、400、500、600、700、800、900和1000 ng/mL的混合标准工作液,精确吸取1 μL注入气相色谱仪,以检测峰面积为Y坐标轴,大蒜素质量浓度为X坐标轴绘制标准曲线,分别求出DADS、DATS的回归方程和相关系数。
1.2.5 回收率测定
取空白血浆0.5 mL,添加100、500和1000 μg/L的混合标准液,添加标准液的总体积为1 mL,设3个平行组, 4℃静置过夜,使药物充分渗入组织中,按上述处理方法处理后,与样品一起上机检测。按照公式进行计算:
回收率(%)= 测得药物浓度/实际药物浓度×100%
1.2.6 精密度测定
一天内不同时间重复测定3次,一周内不同时间重复测定3次,计算出样品在不同浓度梯度下的相对标准偏差,计算出日内精密度和日间精密度。
1.3 数据处理
标准曲线由气象色谱检测报告所得,药-时曲线与药动学模型拟合及参数计算均由DAS3.0软件处理。
2 结果
2.1 标准曲线及其检测限
以上述建立的气象色谱检测方法所测得结果,DADS和DATS的最低检测限均为10 ng/mL。以两者的质量浓度为横坐标X,以测得的峰面积为纵坐标Y,绘制标准曲线如图1和图2所示。回归方程分别为:y=9.11274e-2x2+3.76400x-802.57674,相关系数r为0.99925;y=6.64668e-2x2-3.37901x+64.55161,相关系数r为0.99919。

图1 DADS标准曲线
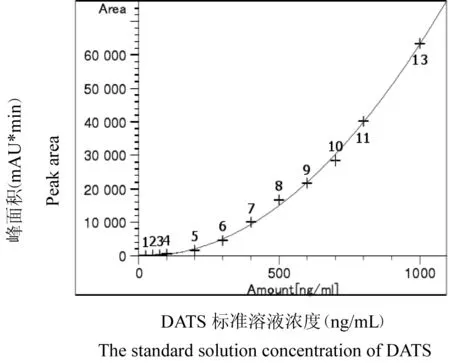
图2 DATS标准曲线
2.2 标准品与样品色谱图
由DADS、DATS标准品色谱图(图3)可见, 本试验所应用的检测方法, DADS在3.7 min 左右出峰, DATS在5.2 min 左右出峰。与标准品色谱图对比可以发现, 两者的色谱峰和出峰时间一致(图4)。

图3 DADS和DATS标准品色谱图
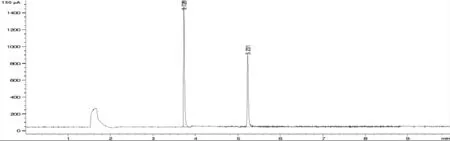
图4 样品中DADS和DATS色谱图
2.3 回收率与精密度
本试验条件下,混合标准液在鲫鱼血浆、肌肉的回收率为73%~100%和90%~96%。鲫鱼血浆、肌肉的日内精密度分别为0.36%±0.043%和0.39%±0.050%,日间精密度分别为0.33%±0.059%和0.42%±0.027%。
2.4 大蒜素在鲫血浆的药时曲线与主要药动学参数
DADS和DATS在鲫鱼血浆中药动学特征符合一级吸收二室开放模型,其代谢方程分别为:C=26.04e-0.57t+18.3e-0.23t-44.34e-44.34t、C=7.07e-0.61t+12.18e-0.11t-19.25e-19.25t。
主要药代学参数如表1。图 5为(20±0.5)℃时以7.5 mg/kg 体质量药量给鲫鱼单次口灌大蒜素后,鲫鱼血浆的药物浓度随时间变化的规律。
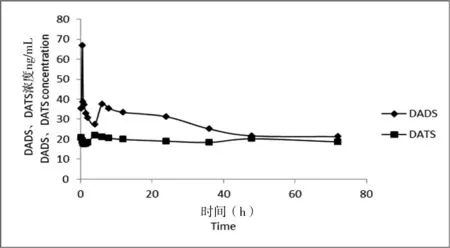
图5 DADS和DATS在鲫鱼血浆中的浓度
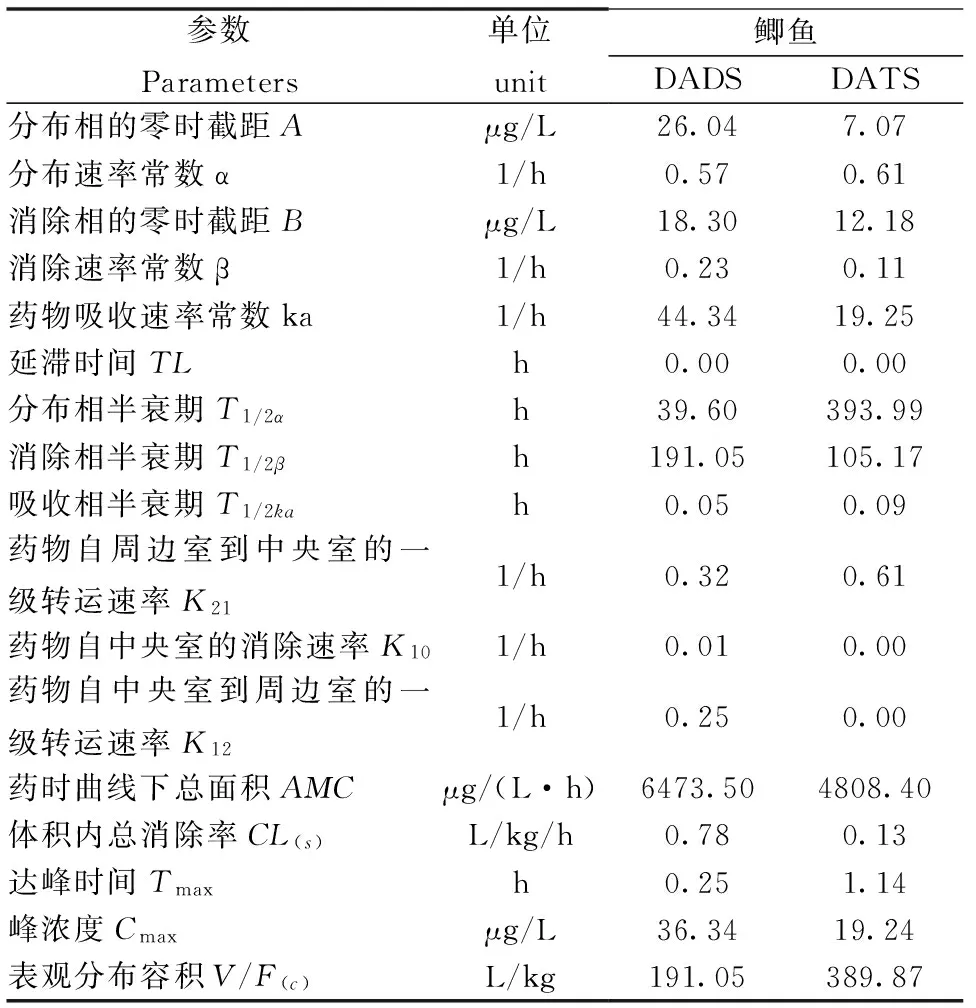
参数Parameters单位unit鲫鱼DADSDATS分布相的零时截距Aμg/L26.047.07分布速率常数α1/h0.570.61消除相的零时截距Bμg/L18.3012.18消除速率常数β1/h0.230.11药物吸收速率常数ka1/h44.3419.25延滞时间TLh0.000.00分布相半衰期T1/2αh39.60393.99消除相半衰期T1/2βh191.05105.17吸收相半衰期T1/2kah0.050.09药物自周边室到中央室的一级转运速率K211/h0.320.61药物自中央室的消除速率K101/h0.010.00药物自中央室到周边室的一级转运速率K121/h0.250.00药时曲线下总面积AΜCμg/(L·h)6473.504808.40体积内总消除率CL(s)L/kg/h0.780.13达峰时间Tmaxh0.251.14峰浓度Cmaxμg/L36.3419.24表观分布容积V/F(c)L/kg191.05389.87
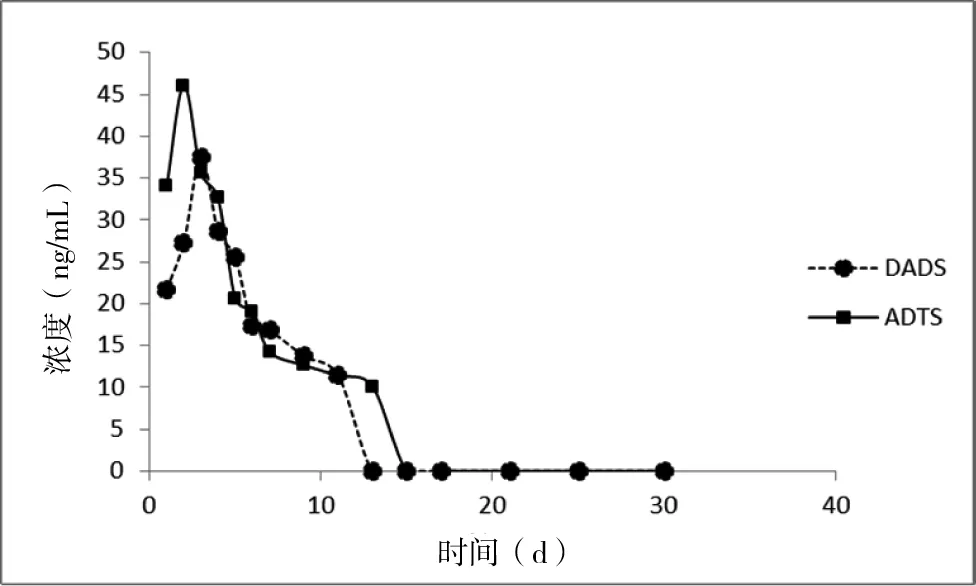
图6 DADS和DATS在鲫鱼组织内浓度与时间关系
Fig 6 The concentration of DADS and DATS in the tissue of crucian carp
2.5 残留消除规律
给药后各采样时间点,DADS和 DATS 在肌肉组织中的含量见表2。据表2可见,在停止给药的第5天,DADS 在鲫鱼肌肉的含量仍然较高(25.565 ng/g),而DATS在鲫鱼体内的达峰时间较DADS 早一天。随着停药时间的延长,DADS 在鲫鱼体内的消除要快于 DATS,在停药后检测DADS含量始终低于DATS,且DADS在鲫鱼肌肉内消除快。而 DATS在肌肉中的含量在降到19.021 ng/g 后,消除开始极其缓慢。经吸收代谢后,DATS 在肌肉中的残余量在停药后第15天开始低于10 ng/g,而DADS在肌肉中的残余量则于停药后13天开始低于10 ng/g。

表 2 DADS和DATS在鲫组织中的残留浓度
3 讨论
3.1 大蒜素在鲫体内的药动学特征
有关研究表明,当表观分布容积V/F(c)值大于1.0 L/kg时,则能够说明药物广泛分布于机体内。由该试验结果可见,DADS和DATS的V/F(c)值分别为191.05和389.87 L/kg,表明DADS和DATS在鲫体内均广泛分布。比较DADS和DATS的分布相半衰期T1/2α和消除相半衰期T1/2β可以发现,DADS比DATS吸收快,但是消除极其缓慢。以7.5 mg/kg体质量的剂量单次口灌大蒜素0.25 h后,DADS和DATS在鲫血浆中的浓度分别为75.46和20.76 μg/L,血浆中DADS含量高于DATS,与大蒜素药品中两者含量对比相符。在鲫鱼体内DADS于给药后0.25 h达到峰浓度66.72 μg/L,而后含量逐渐降低,并于6 h时再次达到峰值,此处可能与重吸收有关;DATS在鲫鱼体内代谢较为平稳,于4 h达到峰值,峰浓度为22.03 μg/L。相同给药剂量下,DADS和DATS在鲤体内达峰时间的不同也说明了不同成分对药物的代谢动力学特征有很大的影响,这种现象在史氏鲟[14]、镜鲤[15]、鲫鱼[16-17]、金鳟[18]、虹鳟[19]、斑点叉尾鮰[20]、大菱鲆[21]得到了大量的药代动力学试验的验证。
由药-时曲线可以看出,DADS在鲫的血浆组织中有两个峰浓度。魏凤环等[22]研究表明:体内药物吸收出现的双峰现象是由于肝-肠二次吸收和胃肠道的多部位吸收而引起的,而肝-肠二次吸收则被认为是产生双峰现象最有可能的一种机制,而且若存在肠-肝的二次吸收,则第二次药物峰的药物面积是要低于第一峰的药物面积[23-24]。本试验中, DADS在鲫鱼血浆中第二峰浓度低于第一峰,因此推测DADS在鲫血浆中出现的双峰现象可以认定为肝-肠循环。本试验中大蒜素在鲫血浆中的药物代谢动力学与其它常规药物不同,其吸收分布机制有待进一步研究。
3.2 大蒜素在鲫鱼体内的药残
入口食用食品中药残的检测,通常只选用食用组织,中国农业行业标准NY5070—2002《无公害食品水产品中渔药残留限量》关于鱼类药残选取的是肌肉和皮[13]。考虑到大蒜素的可食性及本身易吸收代谢的特性,因此,本研究中只选取肌肉进行大蒜素在鲫鱼体内的残留消除规律进行研究。
在 (20±0.5)℃水温条件下,以实际含量为7.5 mg/kg(体质量)的药物剂量,每天1次,连续3 d 对鲫鱼口灌大蒜素后,DADS和DATS在鲫鱼的组织中的药时曲线见图6。在停药后,DADS在肌肉中的残留量明显小于DATS,且在停药后,DADS消除速度较 DATS快。说明DADS在鲫鱼体内较DATS吸收、消除快。
大蒜素有诱食、增食抗病毒等[25]多种生物学功能,因此目前大蒜素主要用于饲料添加剂或用于抗菌[26-28],大蒜素在鱼体内的药物代谢动力学研究较少,其具体吸收代谢机制尚不明确,有待于进一步研究。考虑到大蒜素的药用价值与可食性,建议休药期15 d,或在与其他药物一同使用杀菌治疗鱼病时,可以以其他药物的代谢期为标准制定休药期。
[1]杨俊峰. 大蒜素研究进展[J]. 广州化工,2011,39(1):32-34.
[2]马丽娜,李峰杰,陈 坚,等. 大蒜主要活性成分及药理作用研究进展[J]. 中国药理学通报, 2014,30(6):760-763.
[3]徐小江,肖文军,陈 庆,等. 大蒜素抗菌作用及其机制研究进展[J]. 医药导报,2010,29(8):1048-1051.
[4]时 威,张 岩,白 阳,等. 大蒜素的抑菌作用及其稳定性研究[J]. 食品与发酵科技,2011,47(3):76-78.
[5]陈欣然, 牛翠娟. 大蒜素对鲤鱼生长的研究[J]. 饲料研究, 2010(10): 20-21,27.
[6]唐 玲,徐奇友. 大蒜茎粉和牛至草粉对镜鲤生长性能、消化酶活性以及血清生化指标的影响[J]. 上海海洋大学学报,2010,19(5):642-647.
[7]吕 富,黄金田,丁 研,等. 大蒜渣对异育银鲫生长、消化酶活性及免疫功能的影响[J]. 安徽农业科学, 2012, 40(26):12928-12930.
[8]聂乾忠. 大蒜素对草鱼鱼种阶段生产性能及抗病力影响研究[D]. 长沙:湖南农业大学,2003.
[9]王常安,徐奇友,畅亚萍,等. 几种添加剂对哲罗鲑生长和血液生化指标的影响[J].大连水产学院学报,2009,24(6):578-582.
[10]李 婵,徐奇友,许 红,等. 几种饲料添加剂对虹鳟(OncrhynchusmykissWalbaum)免疫活性和抗氧化能力的影响[J]. 安徽农业大学学报,2008,35(3):456-461.
[11]陈 超,吕树臣,王春清. 大蒜素对中华大蟾蜍蝌蚪生长性能的影响[J]. 黑龙江畜牧兽医,2015(8):112-114.
[12]宋文华,张 涛,富丽静,等. 大蒜素、枸杞多糖对草鱼血清非特异性免疫指标的影响[J]. 河北渔业,2011(6):12-18.
[13]韩 冰,杨洪波,王 荻,等. 复方磺胺甲噁唑在鲫组织中高压液相色谱检测法的建立与残留消除规律[J]. 大连海洋大学学报,2014,5(2):401-407.
[14]卢彤岩, 杨雨辉, 徐连伟,等. 达氟沙星在史氏鲟体内药物代谢动力学比较研究[J]. 水生生物学报, 2006, 30(3): 349-355.
[15]杨洪波,王 荻,卢彤岩. 甲砜霉素在松浦镜鲤体内的药物代谢动力学研究[J]. 大连海洋大学学报, 2013, 28(3): 298-302.
[16]杨洪波,王 荻,卢彤岩. 甲砜霉素在鲫体内的药物代谢动力学研究[J]. 淡水渔业,2013, 43(3):72-76.
[17]韩 冰,杨洪波,王 荻,等. 复方磺胺甲噁唑在鲫鱼体内的药代动力学研究[J]. 西北农林科技大学学报(自然科学版),2015,43(3):13-19.
[18]艾晓辉,刘长征,周运涛. 不同水温和给药方式下磺胺甲噁唑在草鱼体内的药动学研究[J]. 水生生物学报, 2005, 29(2): 210-214.
[19]ABEDINI S, NAMDARI R, LAW F C P. Comparative pharmacokinetics and bioavailability of oxytetracycline in rainbow trout and chinook salmon[J]. Aquaculture, 1998, 162(1-2): 23-32.
[20]GAUNT P S, LANGSTON C, WRZESINSKI C, et al. Single intravenous and oral dose pharmacokinetics of florfenicol in the channel catfish (Ictaluruspunctatus)[J]. Journal of Veterinary Pharmacology and Therapeutics, 2012, 35(5): 503-507.
[21]LIANG J, LI J, ZHAO F, et al. Pharmacokinetics and tissue behavior of enrofloxacin and its metabolite ciprofloxacin in turbotScophthalmusmaximusat two water temperatures[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(4): 644-653.
[22]魏凤环,王永刚,罗佳波. 药动学多峰现象研究概况[J]. 中国药学杂志, 2005, 40(23): 1772-1774.
[23]刘秀红. 氯霉素和诺氟沙星在牙鲆体内的药代动力学及残留消除规律研究[D]. 青岛:中国海洋大学, 2003.
[24]王 慧. 噁喹酸在养殖牙鲆(Paralichthysolivaceus)体内的残留消除规律研究[D]. 青岛:中国海洋大学, 2006.
[25]田海军. 复方中草药添加剂对草鱼免疫功能的影响[J]. 贵州农业科学,2010,38(8):158-159.
[26]马丽娜,李峰杰,陈 坚,等. 大蒜主要活性成分及药理作用研究进展[J]. 中国药理学通报,2014,30(6):760-763.
[27]梅四卫,朱涵珍.大蒜素的研究进展[J].中国农学通报,2009, 25 (9):97-101.
[28]徐小江,肖文军,陈 庆,等. 大蒜素抗菌作用及其机制研究进展[J]. 医药导报,2010,29(8):1048-1051.
Pharmacokinetics and residues of allicin in crucian carp
PAN Hao1,2, WANG Di1, LU Tong-yan1
(1. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070; 2. College of Fisheries and Life Science, Shanghai Ocean university, Shanghai 201306, China)
S948
A
2095-1736(2017)05-0043-04
2016-09-06;
2016-09-18
公益性行业(农业)科研专项(201203085);渔药使用风险评估及其控制技术研究与示范;现代农业产业技术体系建设专项资金项目(No.CARS-46)
潘 浩,硕士研究生,研究方向为鱼类病害研究,E-mail:zcph6666@126.com
卢彤岩,研究员,主要从事水产动物病害研究,E-mail:lutongyan@hotmail.com
doi∶10.3969/j.issn.2095-1736.2017.05.043

