Xanthomonascampestris CCTCC M2015714以甘油为底物发酵产黄原胶的性质分析
王子朝, 吴剑荣, 朱 莉, 郑志永, 高敏杰, 詹晓北
(1. 江南大学 生物工程学院, 无锡 214122; 2. 江苏瑞光生物科技有限公司, 无锡 214125)
XanthomonascampestrisCCTCC M2015714以甘油为底物发酵产黄原胶的性质分析
王子朝1, 吴剑荣1, 朱 莉2, 郑志永1, 高敏杰1, 詹晓北1
(1. 江南大学 生物工程学院, 无锡 214122; 2. 江苏瑞光生物科技有限公司, 无锡 214125)
主要研究以甘油为底物由XanthomonascampestrisCCTCC M2015714发酵合成的黄原胶,并分析黄原胶的特性。合成的黄原胶中含有葡萄糖、甘露糖和葡萄糖醛酸3种单糖,摩尔比为葡萄糖∶甘露糖∶葡萄糖醛酸=2.0∶1.65∶1.0。红外光谱和核磁共振结果显示:甘油产黄原胶的官能团和化学结构与商品级黄原胶基本一致。甘油产黄原胶的分子质量 (3.0×106u) 约为商品级黄原胶的一半 (6.4×106u),且其水溶液的黏度远低于商品级黄原胶。结果展示了甘油产黄原胶的优良特性,同时为甘油的利用提供了一个有效途径。
甘油;野油菜黄单胞菌;黄原胶;性质分析
AbstractThis study focused on the xanthan gum produced byXanthomonascampestrisCCTCC M2015714 with carbon source of glycerol. The monosaccharide composition of xanthan gum was glucose, mannose and glucuronic acid, the molar ratio of three monosaccharides was glucose∶mannose∶glucuronic acid=2.0∶1.65∶1.0. The results of FT-IR and NMR showed that xanthan gum produced from glycerol had similar functional groups and chemical structure comparing with commercial xanthan. The molecular weight of xanthan gum produced using our method was 3.0×106u, which was about half of the commercial xanthan (6.4×106u). Moreover, the viscosity of xanthan gum produced from glycerol was significantly lower than that of the commercial xanthan. Depending on this work, xanthan gum produced from glycerol exhibited great characteristics and also supplied a valuable method for glycerol application.
Keywordsglycerol;Xanthomonascampestris; xanthan gum; characterization
黄原胶是被FDA和WHO公认的安全、无添加量限制的食品添加剂。同时,良好的乳化性、悬浮性、增稠性和假塑性使其在食品、医药和石油开采等领域应用广泛[1]。黄原胶在工业生产中一般采用玉米淀粉作碳源,实验室规模的生产和研究也用蔗糖和葡萄糖做碳源。随着全球人口的不断增加,国内外许多学者都在研究采用一些工农业产品的副产物来代替玉米淀粉实现黄原胶的工业生产,如木糖、甘蔗糖浆、甜菜糖浆、乳清、脂肪酸和谷物水解物等[2]。
随着全球能源危机加剧和环境恶化,人们努力寻找可以替代化石燃料的清洁能源。生物柴油的清洁、可再生和高燃点受到人们的广泛好评,加上各国对生物柴油产业的政策扶持,生物柴油的产量越来越大。但是在生物柴油的转脂化生产过程中,不可避免的会产生甘油这一副产物,且甘油的比例占生物柴油总量的10% (W/W)[4]。生物柴油的大量生产导致甘油的量远远超过了其处理和回收利用的能力。
微生物可以利用甘油合成不同的发酵产品,且微生物转化法具有条件温和、简单易操作的特点。已报道的以甘油为原料合成的发酵产物有1,3-丙二醇、酯类、有机酸、生物乙醇、异性蛋白和生物表面活性剂等[3]。如果可以使微生物利用甘油实现黄原胶的工业化生产,不仅可以缓解甘油过剩和全球粮食短缺双重危机,还可以降低黄原胶的生产成本。
1 材料与方法
1.1 实验菌种
XanthomonascampestrisCCTCC M2015714,由本研究室驯化得到并保藏于中国典型培养物保藏中心。
1.2 材料与试剂
甘油、鱼粉蛋白胨、牛肉浸膏、酵母浸膏、NaOH、HCl、NaNO3、MgSO4·7H2O、FeSO4·7H2O、K2HPO4·3H2O、KH2PO4、无水乙醇和三氟乙酸等试剂购于国药集团化学试剂有限公司;商品级黄原胶 (食品级) 购于山东淄博中轩生化有限公司;葡萄糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖、木糖、果糖、葡萄糖醛酸、半乳糖醛酸和用于测定分子质量的葡聚糖标准品等均购于美国Sigma公司。
1.3 实验仪器
BioFlo 115 7 L机械搅拌发酵罐,美国New Brunswich Scientific公司;Waters1525高效液相色谱仪,美国Waters公司;ICS-5000离子色谱仪,美国Dionex公司;Nexus 470傅立叶变换红外光谱仪,美国Nicolet公司;Agilent 800 MHz核磁共振系统,美国Agilent公司;MCR301旋转流变仪,奥地利Anton Paar公司;数显恒温金属浴,美国Boekel公司;FreeZone冷冻干燥机,美国Labconco公司。
1.4 培养基组成及培养条件
1.4.1 培养基组成
种子培养基 (g/L): 甘油 20.0,鱼粉蛋白胨 5.0,牛肉浸膏 3.0,酵母浸膏 1.0,pH 7.0~7.2。
发酵培养基 (g/L): 甘油 40.0,鱼粉蛋白胨 1.5,酵母浸膏 1.0,NaNO30.8,MgSO4·7H2O 2.5,FeSO4·7H2O 0.01,K2HPO4·3H2O 3.5,KH2PO42.0,pH 7.0~7.2。
1.4.2 培养条件
种子培养:500 mL三角瓶中加入50 mL种子培养基,接种1~2环斜面菌体,30 ℃、200 r/min旋转摇床中培养24 h。
7 L机械搅拌罐发酵:7 L发酵罐中装4 L发酵培养基,10% (V/V) 接种量,培养温度30 ℃;搅拌转速600 r/min;通气量0.4 vvm;培养过程中用3 mol/L HCl和3 mol/L KOH调节pH维持在7.0左右。
1.5 实验方法
1.5.1 样品的提取与纯化
发酵结束后,向发酵液中加入3倍体积去离子水对发酵液进行稀释,20 000 r/min离心30 min除菌体。将离心得到的上清倒出并向其中加入3倍体积无水乙醇沉淀多糖。将醇沉析出的多糖分为两部分进行下述实验:一部分多糖在40℃、0.1 MPa下真空干燥48 h后研究这一多糖和商品级黄原胶的流变学特性。
另一部分醇沉析出的多糖重新溶于去离子水中,然后用sevage法去除可能残存在多糖中的蛋白,商品级黄原胶采用上述同样方法去除可能残留的蛋白。之后,向sevage法处理后的多糖溶液中加入3倍体积无水乙醇析出多糖,将析出的多糖重新溶于水中并冷冻干燥用于测量它们的分子特性,包括单糖组成、红外光谱、核磁共振及分子质量。
1.5.2 单糖组成分析
准确称取多糖和商品级黄原胶各12 mg,放入两支具塞试管中,分别加入18 mL、2 mol/L的三氟乙酸,塞好塞子之后放入金属浴中110℃水解3 h,水解之后转入楔形瓶中,用纯水冲洗3次也转入楔形瓶中,旋转蒸发仪上40℃减压蒸干,之后再加入3 mL甲醇继续蒸干,重复4~5次以带走残留的三氟乙酸,蒸干之后,用1 mL纯水溶解并冲洗楔形瓶,并将溶液收集到2 mL离心管中,定容后采用离子色谱仪检测单糖组成。Dionex ICS5000系统包括:GS50四元梯度泵;ED50A电化学检测器(金电极);LC30柱温箱;Chromeleon 7.0色谱工作站和CarboPac PA20阴离子交换分析柱(150 mm×3 mm i.d.)。采用2 mmol/L的NaOH进行淋洗,流速0.45 mL/min,淋洗时间120 min。采用三元梯度洗脱,流动相A是去离子水,B是0.25 mol/L的NaOH,C是1 mol/L的醋酸钠。洗脱程序 (A% B% C%): 0 min:99.2, 0.8, 0;30 min: 99.2, 0.8, 0;40 min: 79.2, 0.8, 20;40.1 min: 20, 80, 0;60 min: 99.2, 0.8, 0,流速0.45 mL/min。进样体积20 μL,Au电极,Ag/AgCl参比电极,脉冲安培检测器。
1.5.3 红外光谱分析
取大约1 mg多糖样品与溴化钾充分研磨并压片,采用Nexus 470红外光谱仪对多糖进行红外扫描,扫描波长范围400~4000 cm-1,并用OMNIC-8.2软件处理红外数据。
1.5.41H核磁共振分析
将50 mg多糖样品溶于0.5 mL D2O中,用Agilent 800 MHz的核磁共振仪进行分析。以D2O作为内标物,样品测试温度35 ℃。
1.5.5 分子量测定
采用高效体积排阻色谱 (High-performance size exclusion chromatograph,HPSEC) 测定多糖的重均分子质量(Weight-average molecular mass,MW)。仪器为Waters1525高效液相色谱仪,配有2414示差折光检测器和Empower3工作站。色谱条件如下:UltrahydrogelTMLinear 300 mm×7.8 mmid 二级串联柱;流动相0.1 mol/L NaNO3;流速0.9 mL/min;柱温45℃;样品制备:样品溶于0.1 mol/L NaNO3中,用0.22 μm微孔滤膜过滤后供进样,进样体积20 μL。用MW分别为270、975、3680和13 535 ku的葡聚糖标品绘制分子质量校正曲线,根据样品的保留时间和校正曲线计算多糖MW。
1.5.6 流变学特性分析
将多糖样品溶于去离子水中配制成质量浓度分别为0.1%、0.5%和1.0%的多糖溶液,室温下磁力搅拌24 h后10 000 r/min离心30 min除去多糖溶液中的气泡。采用安东帕Physica MCR301高级旋转流变仪测量各溶液的流变学特性,测量温度25℃。在测量每个样品的黏度之前,先将样品放到流变仪的样品架上预停10 min,保证样品在样品架上分布均匀,同时使样品的温度达到测量温度。剪切速率的扫描范围是0.01~1000 1/S,采样周期是8 s,每个样品的采样时间为10 min。样品的稠度系数 (K) 和流态特性指数(n)用仪器自带的RheoPlus流变高级软件进行计算。
2 结果与讨论
2.1 单糖组成分析
黄原胶在合成过程中,每一步都需要特殊的酶和前体物质来完成,无论是前体物质还是酶发生缺失,都会导致黄原胶的合成受阻而改变黄原胶的单糖组成和结构[7]。Hassler和dohetry[8]发现,当用X.campestris1361和X.campestris1419进行发酵时,得到的黄原胶其单糖组成和摩尔比为葡萄糖∶甘露糖∶葡萄糖醛酸=2.0∶1.0∶1.0;但当发酵菌种为X.campestris1263和X.campestris1454时,这一值变为2.0∶1.0∶0。同时,Sutherland[5]发现,不同的野油菜黄单胞菌可以合成单糖组成和摩尔比相同的黄原胶。X.campestrisCCTCC M2015714以甘油为底物合成的黄原胶其单糖组成与摩尔比为2.0∶1.65∶1.0,这一值与商品级黄原胶十分相近 (2.0∶1.85∶1.0)。
2.2 红外光谱分析
图1中,3200~3500 cm-1的吸收峰是由-OH的轴向形变引起,对应黄原胶中的羟基;2900 cm-1处的吸收峰是由-CH2的轴向形变引起;1600 cm-1处的吸收峰由丙酮酸盐上的-C=O伸缩振动引起;酯基、羧基、醛基和酮基的吸收峰在1700~1730 cm-1,而1700 cm-1处的吸收峰则对应黄原胶侧链上葡萄糖醛酸中的羧基。800~1500 cm-1范围内的吸收峰最多,这些吸收峰是由官能团的轴向形变和整个分子的伸缩振动引起,对于辨别和区分两种化合物十分重要。图1中甘油产黄原胶的红外扫描结果和商品级黄原胶一致,说明以甘油为底物发酵得到的多糖可能是黄原胶。Faria 等[9]研究甘蔗渣水解液发酵产黄原胶和Gunasekar 等[10]研究木薯淀粉酸解液发酵产黄原胶时得到了与我们相同的红外扫描结果。
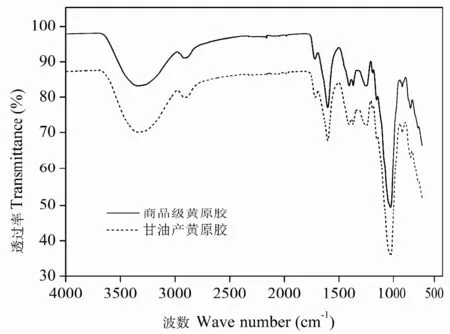
图1 商品级黄原胶和甘油产黄原胶的红外扫描结果
2.3 核磁共振分析
从图2-a商品级黄原胶的1H核磁扫描结果可以看出,0 ppm的峰归因于实验所用内标物D2O中的H;1.2 ppm左右的峰是由黄原胶侧链上丙酮酸修饰基团中的H所引起;黄原胶侧链上乙酰基中H的吸收峰在1.8~1.9 ppm;在2.1~2.7 ppm之间的峰,是由糖醛或糖醛酸上-CH2中的H所引起,在黄原胶中对应侧链上的葡萄糖醛酸;羟基上H的吸收峰在3.4~3.9 ppm。从图2-b可以看出,甘油产黄原胶的NMR吸收峰与商品级黄原胶基本吻合,加上单糖组成和红外扫描结果,基本可以说明X.campestrisCCTCC M2015714以甘油为碳源发酵生产的多糖是黄原胶。这一结果与Sutherland[5]的报道一致,即野油菜黄单胞菌只能合成黄原胶这一种胞外多糖。
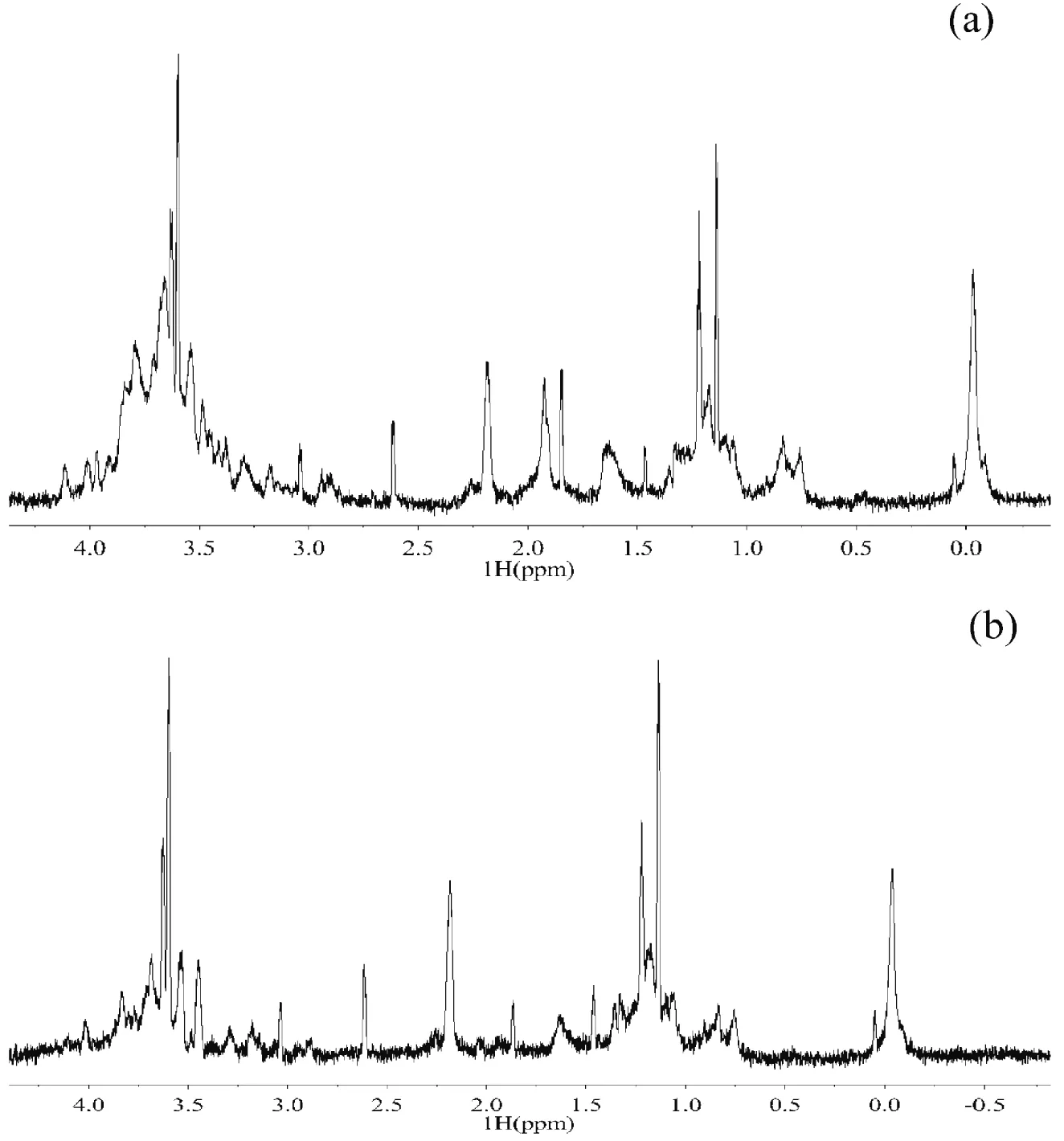
图 2 商品级黄原胶(a)和甘油产黄原胶(b)的1H核磁结果
2.4 分子质量测定
由图3-a可知,商品级黄原胶的相对分子质量约为6.4×106u,而以甘油为碳源发酵得到的黄原胶其分子量约为3.0×106u(图3-b),是商品级黄原胶的一半。一般来说,在微生物多糖的合成过程中,链的长短是由微生物体内特殊的酶和基因进行调控[11]。如Sanchez等[12]报道用不同的野油菜黄单胞菌可以得到分子质量不同的黄原胶产品。此外,黄原胶分子质量的大小还受培养基组成、发酵条件和提取条件的影响。当培养基中添加木糖[13]或者培养基中氮源NH4Cl浓度发生变化[14]时,黄原胶的分子质量发生变化;同时,培养过程中pH、搅拌转速以及提取时发酵液温度的变化都会影响到黄原胶的分子质量[15]。X.campestrisCCTCC M2015714以甘油为碳源驯化得到,黄原胶分子质量的减小可能与其体内甘油代谢途径相关酶的活性有关[16]。这一低分子质量黄原胶对研究黄原胶的分子质量与流变学、分子质量与应用十分有帮助。同时,对采用发酵法生产其他低分子质量多糖具有一定指导意义。
2.5 流变学特性
一般来说,黄原胶的黏度与其分子质量成正比,分子质量大对应的黏度大,反之则黏度较小[10]。由图4可知,在低剪切速率时,1.0%和0.5% (W/V) 商品级黄原胶和甘油产黄原胶溶液的黏度随剪切速率的增大而增大,对这一现象的解释是Liu等[17]提出的“液体流动引起的大分子聚集现象”理论。在高剪切速率下,黄原胶聚合体结构解聚为无规则线团结构使黏度迅速降低。
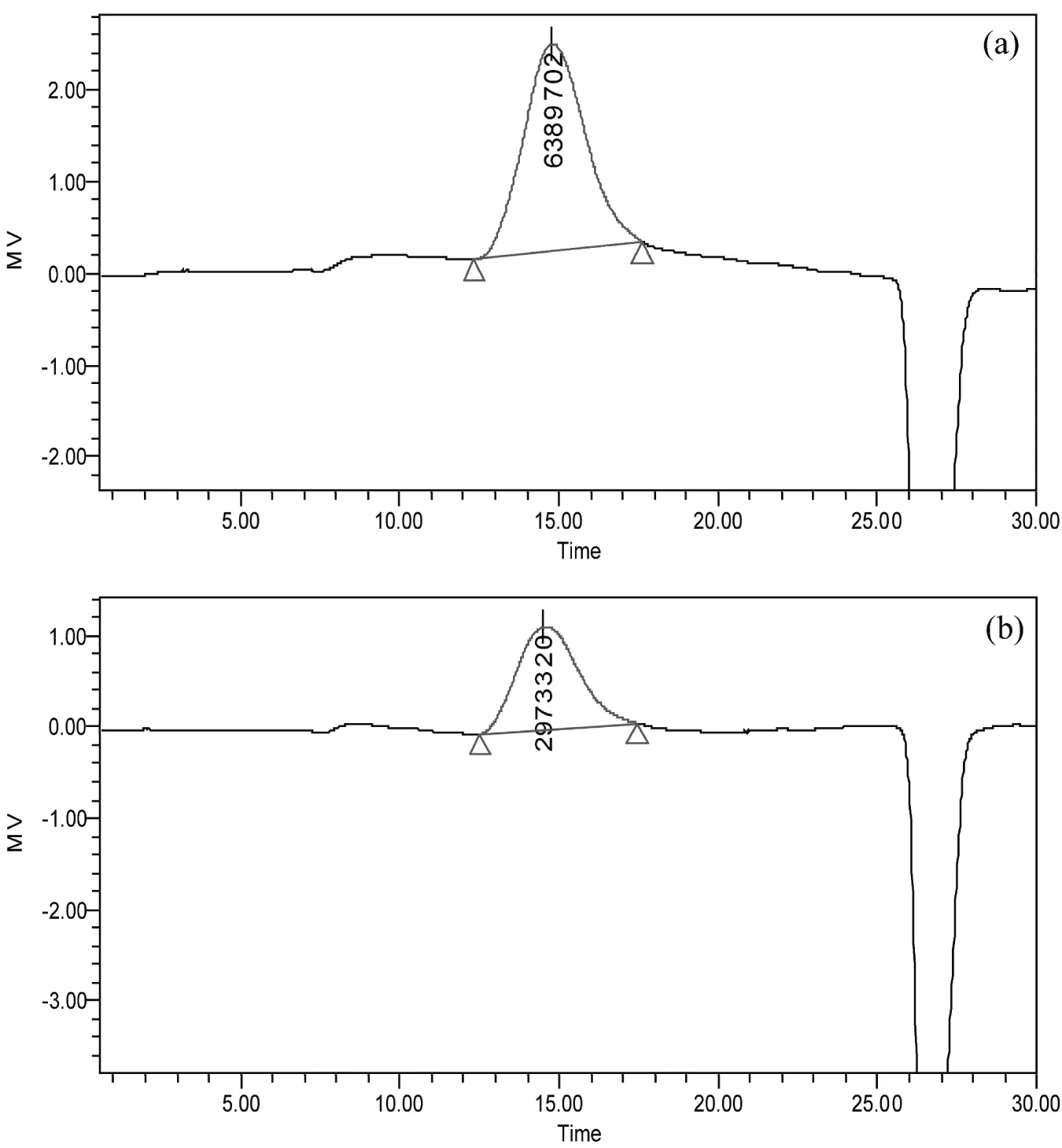
图3 商品级黄原胶(a)和甘油产黄原胶(b)的高效体积排阻色谱图

图4 商品级黄原胶(a)和甘油产黄原胶(b)的流变学特性
对于1.0%(W/V) 的两种黄原胶溶液来说,甘油产黄原胶的稠度系数为1.7958,而商品级黄原胶的稠度系数则为21.0842,是甘油产黄原胶的10倍多,说明甘油产黄原胶的黏度明显低于商品级黄原胶;甘油产黄原胶的流态特性指数为0.235,这一值比商品级黄原胶 (0.109) 的2倍还要大,说明甘油产黄原胶的剪切变稀能力不如商品级黄原胶。但甘油产黄原胶的流态特性指数n小于1.0,说明其仍是假塑性流体,在应用时仍然具有假塑性流体的特性。黄原胶的黏度受酸、碱、盐、温度和分子质量等众多因素的影响,但从本实验结果来看,黄原胶是一个例外。低黏度黄原胶在一些工业和食品领域应用极广,如作为膳食纤维或者膳食纤维辅料,预防和治疗糖尿病、高血压、高血脂、肥胖等[18]。许多学者[19-20]采用超声或者热处理的方法降低黄原胶黏度,而本文通过发酵直接获得一种低黏度黄原胶,既可以降低产品处理过程中的能耗,又能保证产品的安全性。
3 结论
通过单糖组成、红外光谱和核磁共振分析,基本可以确定X.campestrisCCTCC M2015714以甘油为碳源发酵生产的胞外多糖是黄原胶。HPSEC结果显示甘油产黄原胶的分子质量仅为商品级黄原胶的一半。虽然甘油产黄原胶溶液的黏度明显低于商品级黄原胶,但其仍表现出假塑性流体的特性。同时,较低的溶液黏度可以增加其在食品中的添加量,使其作为膳食纤维或者膳食纤维辅料。
[1]ROSALAM S, ENGLAND R. Review of xanthan gum production from unmodified starches byXanthomonascomprestrissp [J]. Enzyme and Microbial Technology, 2006, 39 (2): 197-207.
[2]PALANIRAJ A, JAYARAMAN V. Production, recovery and applications of xanthan gum byXanthomonascampestris[J]. Journal of Food Engineering, 2011, 106 (1): 1-12.
[3]YANG F, HANNA M, SUN R. Value-added uses for crude glycerol-a byproduct of biodiesel production [J]. Biotechnol Biofuels, 2012, 5: 13.
[4]JOHNSON D T, TACONI K A. The glycerin glut: options for the value-added conversion of crude glycerol resulting from biodiesel production [J]. Environmental Progress, 2007, 26 (4): 338-348.
[5]SUTHERLAND I W. Microbial polysaccharides from gram-negative bacteria [J]. International Dairy Journal, 2001, 11 (9): 663-674.
[6]GARCIA-OCHOA F, SANTOS V E, CASAS J A, et al. Xanthan gum: production, recovery, and properties [J]. Biotechnology Advances, 2000, 18 (7): 549-579.
[7]DONOT F, FONTANA A, BACCOU J C, et al. Microbial exopolysaccharides: main examples of synthesis, excretion, genetics and extraction [J]. Carbohydrate Polymers, 2012, 87 (2): 951-962.
[8]HASSLER R A, DOHERTY D H. Genetic engineering of polysaccharide structure: production of variants of xanthan gum inXanthomonascampestris[J]. Biotechnology Progress, 1990, 6 (3): 182-187.
[9]FARIA S, DE OLIVEIRA PETKOWICZ C L, DE MORAIS S A L, et al. Characterization of xanthan gum produced from sugar cane broth [J]. Carbohydrate Polymers, 2011, 86 (2): 469-476.
[10]GUNASEKAR V, RESHMA K R, TREESA G, et al. Xanthan from sulphuric acid treated tapioca pulp: influence of acid concentration on xanthan fermentation [J]. Carbohydrate Polymers, 2014, 102: 669-673.
[11]WOODWARD R, YI W, LI L, et al.Invitrobacterial polysaccharide biosynthesis: defining the functions of Wzy and Wzz [J]. Nature Chemical Biology, 2010, 6 (6): 418-423.
[12]SANCHEZ A, RAMIREZ M E, TORRES L G, et al. Characterization of xanthans from selectedXanthomonasstrains cultivated under constant dissolved oxygen [J]. World Journal of Microbiology & Biotechnology, 1997, 13 (4): 443-451.
[13]ZHANG Z, CHEN H. Fermentation performance and structure characteristics of xanthan produced byXanthomonascampestriswith a glucose/xylose mixture [J]. Applied Biochemistry and Biotechnology, 2010, 160 (6): 1653-1663.
[14]FLORES CANDIA J, DECKWER W D. Effect of the nitrogen source on pyruvate content and rheological properties of xanthan [J]. Biotechnology Progress, 1999, 15 (3): 446-452.
[15]BORGES C D, DE PAULA R C M, FEITOSA J P A, et al. The influence of thermal treatment and operational conditions on xanthan produced byX.arboricolapv prunistrain106 [J]. Carbohydrate Polymers, 2009, 75 (2): 262-268.
[16]WANG Z, WU J, ZHU L, et al. Activation of glycerol metabolism inXanthomonascampestrisby adaptive evolution to produce a high-transparency and low-viscosity xanthan gum from glycerol [J]. Bioresource Technology, 2016, 211: 390-397.
[17]LIU W H, YU T L, LIN H L. Shear thickening behavior of dilute poly (diallyl dimethyl ammonium chloride) aqueous solutions [J]. Polymer, 2007, 48 (14): 4152-4165.
[18]DIKEMAN C L, FAHEY G C. Viscosity as related to dietary fiber: a review [J]. Critical Reviews in Food Science & Nutrition, 2006, 46 (8): 649-663.
[19]LI R, FEKE D L. Rheological and kinetic study of the ultrasonic degradation of xanthan gum in aqueous solutions [J]. Food Chemistry, 2015, 172: 808-813.
[20]SRIVASTAVA A, MISHRA V, SINGH P, et al. Comparative study of thermal degradation behavior of graft copolymers of polysaccharides and vinyl monomers [J]. Journal of Thermal Analysis & Calorimetry, 2012, 107 (1): 211-223.
Characterization of xanthan gum produced from glycerol byXanthomonascampestrisCCTCCM2015714
WANGZi-chao1,WUJian-rong1,ZHULi2,ZHENGZhi-yong1,GAOMin-jie1,ZHANXiao-bei1
(1.School of Biotechnology, Jiangnan University, Wuxi 214122; 2.Jiangsu Ruiguang Biotech Co. Ltd., Wuxi 214125, China)
TQ920.6
A
2095-1736(2017)05-0015-05
2016-08-26;
2016-09-05
国家自然科学基金 (31171640);中央高校基本科研业务费专项资金项目 (JUSRP51632A,JUSRP51504)
王子朝,博士,主要从事微生物多糖的发酵生产及应用研究,E-mail: 6832917@163.com
詹晓北,教授,博士研究生导师,主要从事高黏度反应器和微生物多糖的研究,E-mail:xbzhan@yahoo.com
doi∶10.3969/j.issn.2095-1736.2017.05.015

