葡萄糖对冷冻干燥血红蛋白色素稳定性的影响
宋 璇,侯成立,李 铮,王文婷,吴立国,朱 杰*,张德权,*
(1.西北农林科技大学理学院,生物物理研究所,生物力学与工程研究室,陕西 杨凌 712100;
2.中国农业科学院农产品加工研究所,北京 100193)
葡萄糖对冷冻干燥血红蛋白色素稳定性的影响
宋 璇1,2,侯成立2,李 铮2,王文婷1,2,吴立国2,朱 杰1,*,张德权2,*
(1.西北农林科技大学理学院,生物物理研究所,生物力学与工程研究室,陕西 杨凌 712100;
2.中国农业科学院农产品加工研究所,北京 100193)
以猪血红蛋白为研究对象,研究添加5 g/100 mL的葡萄糖对冷冻干燥血红蛋白色差值和水分含量的影响,分析不同pH值、温度和NaCl浓度对血红蛋白色素稳定性的影响。结果表明:添加葡萄糖能够显著提高血红蛋白的亮度L*值和红绿度a*值,并且降低高铁血红蛋白含量(P<0.05);添加葡萄糖可显著提高血红蛋白对pH值、温度、NaCl浓度的稳定性(P<0.05)。当pH 7、温度低于60 ℃、NaCl浓度为0.6 mol/L时葡萄糖处理组中血红蛋白的稳定性最高。
血红蛋白;葡萄糖;冷冻干燥;稳定性
血液是动物屠宰后的主要加工副产物,含有大量的蛋白质,但目前血液的综合利用率不足30%。血液由血浆(65%)和血细胞(35%)组成,其中血红蛋白约占血细胞的90%。血红蛋白具有天然的红色,可以作为天然色素应用于食品的加工中[1-3]。工业生产中为方便血红蛋白色素的运输和保藏,将血红蛋白干燥,制备为粉末产品,目前常见的干燥方式有喷雾干燥和真空冷冻干燥两种,在喷雾干燥过程中蛋白质会在短时的高温条件下发生氧化和变性,影响蛋白质的品质。其在干燥过程中会发生各种物理、化学或生物学的变化,这些变化会导致血红蛋白的稳定性降低从而致使其利用率降低。主要原因为血红蛋白含有亚铁离子,在喷雾干燥过程中与空气接触后,与氧分子以配位键络合,成为氧合血红蛋白,呈鲜红色;氧合血红蛋白不稳定,在氧或氧化剂的作用下,亚铁被氧化成高铁,配位的氧原子变成共价键连接的羟基,形成高铁血红蛋白,从而呈褐色[4],因此限制了血红蛋白的使用。
相对于喷雾干燥,真空冷冻干燥在低温、低氧条件下进行,能够最大程度地保护蛋白质等大分子活性物质的性质不受影响[5-6]。但蛋白质在冷冻干燥过程中表面残留的水分会形成冰晶,破坏蛋白质的高级结构。此前,有研究者通过加入多糖研究血红蛋白的低温稳定性,结果表明多糖能够维持血红蛋白形态的稳定,同时防止其氧化为高铁血红蛋白[7]。葡萄糖作为一种亲水性物质在冷冻干燥过程中能够与血红蛋白表面的水分结合,从而能够保护血红蛋白在冷冻干燥过程中的高级结构不被破坏。但目前对于添加葡萄糖对血红蛋白稳定性研究较少。
本研究采用葡萄糖作为血红蛋白冷冻干燥过程中的低温保护剂,研究了添加葡萄糖对血红蛋白色差值和水分含量的影响,分析了pH值、温度变化和NaCl浓度对血红蛋白稳定性的影响,以期为推进血红蛋白在食品工业中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
猪血 北京市第五肉联厂;柠檬酸钠、NaCl、NaOH、葡萄糖均为国产分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
MS204S电子天平、FE20 pH计、MJ33快速水分测定仪 瑞士梅特勒-托利多公司;himac CR 22 GⅡ低温冷冻高速离心机 日本日立制作所;DK-S28电热恒温水浴锅 上海精宏实验设备有限公司;UV1800紫外分光光度计 岛津仪器(苏州)有限公司;Digieye电子眼英国Verivide公司;KH7200DE型数据超声波清洗仪昆山禾创超声仪器有限公司;EMS-19磁力搅拌器 天津欧诺仪器股份有限公司;LGJ-25型冷冻干燥机 北京四环科学仪器厂有限公司;Tensor27傅里叶变换红外光谱仪美国布鲁克光谱仪器公司。
1.3 方法
1.3.1 血红蛋白的提取
电刺激后屠宰放血,向新鲜血液中按照1∶9(V/V)加入3.8 g/100 mL的柠檬酸钠溶液。收集血液,轻微摇晃,使之与血液混匀。低温(4~7 ℃)条件下运回肉品科学实验室,将抗凝血置于离心管中以3 000 r/min离心20 min。弃去上清液,取下部分血细胞,加入等体积的生理盐水清洗附着在红细胞膜表面的血浆,收集血细胞[8-9]。采用超声法对红细胞进行破碎[10-11],按照血浆与超纯水比例为1∶2的体积比例混合,超声功率250 W、频率25 kHz、超声处理15 min,之后从超声仪中取出置于离心管中,将溶液以8 000 r/min离心20 min,弃去沉淀,所得上清液为血红蛋白粗提取液。在避光情况下,于60 ℃水浴加热30 min。以6 000 r/min离心30 min,取上清液,得到血红蛋白。
将提取的血红蛋白平均分为6 份,其中3 份作为对照组不添加任何试剂;其他3 份作为葡萄糖处理组,在每份中加入5 g/100 mL的葡萄糖[12-13],室温条件下在磁力搅拌器中搅拌混匀。将以上不同处理的血红蛋白置于真空冷冻干燥机中干燥。冻干条件为:冷阱温度-60 ℃、真空度1.0 Pa、干燥时间48 h。
1.3.2 血红蛋白的红外光谱分析
取添加5 g/100 mL葡萄糖及未添加葡萄糖的血红蛋白干燥样品,置于中红外下扫描光谱,以空气为空白对照。
1.3.3 血红蛋白的紫外全波长扫描
分别对添加葡萄糖和未添加葡萄糖的血红蛋白样品进行紫外-可见光谱分析,观察500~600 nm波长处的血红蛋白紫外吸收图谱,与报道的血红蛋白标准品的紫外图谱进行对比[14-15]。
1.3.4 添加葡萄糖对血红蛋白色差值和3 种形态血红蛋白含量的影响
利用Digieye电子眼和水分测定仪分别测定不同处理的血红蛋白冻干样品的亮度L*值、红绿度a*值、黄蓝度b*值[16]和水分含量,其中测定色差值时每个样品测定20 个点,水分含量测定中每个样品做3 次重复。参考Benesch等[17]的方法测定配体血红蛋白(ligand hemoglobin,LHb)、血红蛋白(hemoglobin,Hb)、高铁血红蛋白(methemoglobin,MetHb)含量。分别测定血红蛋白色素在560、576、630 nm波长处的吸光度,每个样品重复3 次。其3 种不同状态下的血红蛋白含量计算如公式(1)~(3)所示。

1.3.5 血红蛋白色素稳定性影响因素
血红蛋白在540 nm波长处有一个特征吸收峰,因此测定不同处理的样品在540 nm波长处的吸光度,作为血红蛋白稳定性的评价标准[18-20],A540nm的大小反映了血红蛋白稳定性的强弱。
1.3.5.1 pH值对血红蛋白色素稳定性的影响
分别用1 mol/L HCl和0.1 mol/L的NaOH调节溶液pH值为3、4、5、6、7、8、9、10,将血红蛋白按照1 mg/mL的质量浓度溶解于以上不同pH值的溶液中,充分搅拌10 min,离心取上清液,测定A540nm。
1.3.5.2 温度对血红蛋白色素稳定性的影响
用超纯水将不同处理血红蛋白配制为1 mg/mL的血红蛋白溶液。分别置于2、20、40、60、80 ℃条件下30 min,离心取上清液,测定A540nm。
1.3.5.3 NaCl浓度对血红蛋白色素稳定性的影响
取不同处理血红蛋白冻干样品分别溶解于0.2、0.4、0.6、0.8、1.0 mol/L的NaCl溶液中,使血红蛋白的终质量浓度均为1 mg/mL,离心取上清液,测定A540nm。
1.4 数据分析
每个实验重复3 次,采用Excel 2010软件进行数据处理和绘图,利用SPSS 17.0程序中独立样本t检验进行方差显著性检验,以P<0.05为差异显著性判断标准。
2 结果与分析
2.1 葡萄糖对血红蛋白结构的影响
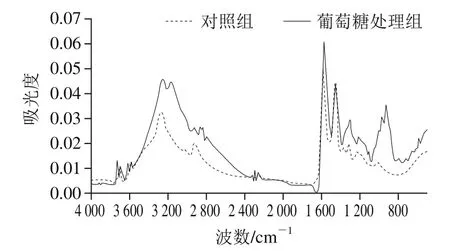
图1 不同处理的血红蛋白红外光谱Fig. 1 IR spectra of hemoglobin with and without glucose addition
由图1可知,样品在3 400~3 000 cm-1处均可以观察到尖锐的吸收峰,该位置为N—H伸缩振动吸收峰,为蛋白质的特征吸收峰。在低温条件下,糖类可通过氢键和血红蛋白共价结合。葡萄糖处理组在该处的吸收强度相对于对照组较为强烈且峰形较宽,这是由于糖类化合物中存在多个羟基,在和血红蛋白共价结合后在3 570~3 050 cm-1处常出现多个O—H伸缩振动吸收峰,这些吸收峰堆叠在一起形成较宽的吸收带[21-22]。

图2 血红蛋白紫外-可见光吸收曲线Fig. 2 UV-Vis absorption spectra of hemoglobin with and without glucose addition
紫外-可见吸收光谱特性能够反映血红蛋白的结构性质。血红蛋白分子是由1分子珠蛋白和4分子亚铁血红素组成,其中血红素是具有卟啉结构的小分子,卟啉中的4 个吡咯环上的氮原子分别与血红素中的亚铁离子配位结合,当与空气接触后,亚铁离子与氧分子以配位键络合,在约576 nm波长处形成一个吸收峰,血红蛋白以氧合的形式存在,其中铁仍为二价[23],但形成了六配体的复合物。如图2所示,血红蛋白的最大吸收峰分别位于576 nm和540 nm波长处,其中540 nm为亚铁血红素的特征吸收峰,这与卟啉类化合物的Q带特征一致[24],因此可以用A540nm来反映血红蛋白的稳定性。在加入葡萄糖冷冻干燥后血红蛋白的紫外吸收峰并未发生变化,这与Salvador等[13]的研究结果一致。
2.2 葡萄糖对血红蛋白色差值和血红蛋白状态的影响
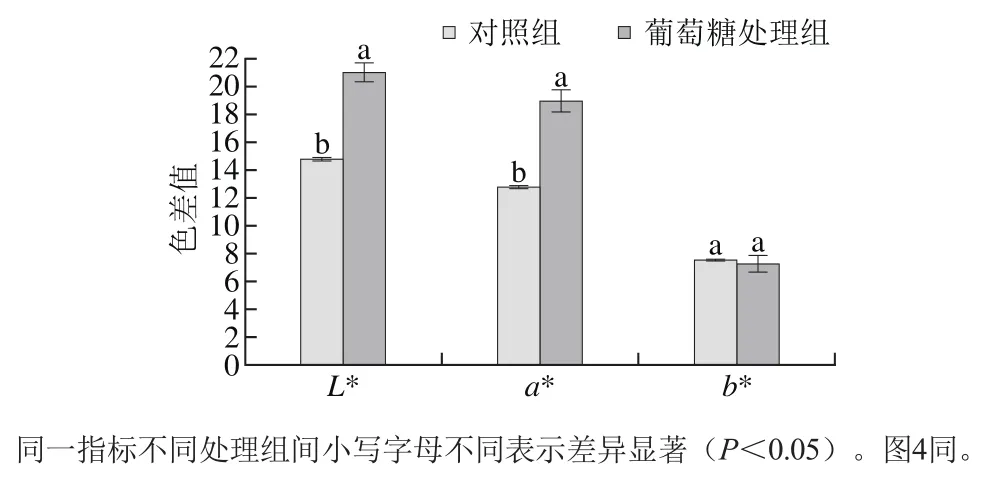
图3 血红蛋白色素的色泽变化Fig. 3 Change in color parameters of hemoglobin with glucose addition
由图3可知,与对照组相比,加入葡萄糖后,血红蛋白色素的L*和a*值均有显著提高(P<0.05),b*值无显著差异(P>0.05);冷冻干燥后葡萄糖处理组和对照组的水分含量分别为:(19.55±0.52)%、(4.27±0.15)%。添加葡萄糖后的血红蛋白水分含量明显高于对照组(P<0.05)。这是由于葡萄糖作为一种亲水性物质,能够在冷冻干燥过程中与蛋白质表面残留的水结合形成水化膜,从而保护蛋白质的高级结构,防止蛋白质在低温状况下变性沉淀,维持血红蛋白的原有特性[25]。由图4可知,在加入葡萄糖后同一状态的血红蛋白含量在不同处理组之间差异显著(P<0.05)。加入葡萄糖后配体血红蛋白的含量显著增高(P<0.05);高铁血红蛋白含量显著降低(P<0.05)。说明在冷冻干燥过程中葡萄糖减少了血红蛋白的氧化程度。结合不同处理的血红蛋白色素的色差值分析原因如下:亚铁血红蛋白为鲜红色,高铁血红蛋白呈红褐色。在加入葡萄糖后,高铁血红蛋白的含量降低,因此加入葡萄糖后的血红蛋白L*值和a*值有一定程度的升高。

图4 血红蛋白衍生物的相对含量Fig. 4 Relative contents of hemoglobin derivatives
2.3 pH值对不同处理血红蛋白稳定性的影响

图5 pH值对血红蛋白色素稳定性的影响Fig. 5 Effect of pH on stability of hemoglobin
pH值的改变会影响蛋白质的解离程度和带电性,从而影响蛋白质的稳定性[26]。由图5可知,pH值对血红蛋白的稳定性影响显著(P<0.05),其稳定性呈先升高后降低的趋势。当pH值在3~4之间时,葡萄糖处理组的稳定性相对于对照组较低,这是由于在水溶液中,葡萄糖本身呈酸性,因此在低pH值条件下,葡萄糖不能起到保护血红蛋白的作用。当pH值在5~10之间时,加入葡萄糖后血红蛋白的稳定性高于对照组。除在pH 8条件下,葡萄糖处理组吸光度均显著高于对照组(P<0.05);当溶液的pH值为7时,血红蛋白的吸光度最高,这是由于血红蛋白溶液的pH值为7左右[27],高于或低于血红蛋白溶液的pH值,血红蛋白的吸光度均有不同程度下降。溶液pH值低于血红蛋白溶液的pH值时,血红蛋白带负电,反之,血红蛋白分子带正电,pH值过高或过低都会引起蛋白质的充水膨胀而导致蛋白质变性,从而使稳定性降低。
2.4 温度对不同处理血红蛋白稳定性的影响
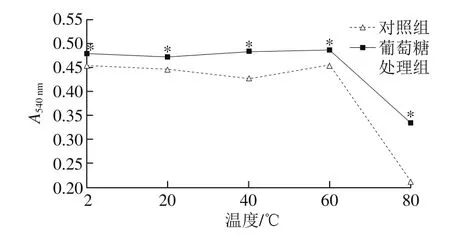
图6 温度对血红蛋白色素稳定性的影响Fig. 6 Effect of temperature on stability of hemoglobin
由图6可知,随着温度的变化,葡萄糖处理组和对照组的血红蛋白的稳定性呈现出由平稳到下降的趋势。当温度在2~80 ℃时,葡萄糖处理组的血红蛋白吸光度均显著高于对照组血红蛋白的A540nm吸光度(P<0.05);在葡萄糖处理组中,温度为60 ℃时血红蛋白的吸光度最大;当温度为2 ℃时,对照组中的血红蛋白吸光度最大,但与60 ℃时血红蛋白的吸光度差异并不明显;温度在60~80 ℃时,血红蛋白的吸光度骤然下降,这是由于蛋白质的变性产生沉淀,溶液中可溶性物质的浓度降低,导致溶液的吸光度下降。由此可见,血红蛋白的变性温度在60 ℃左右,并且加入葡萄糖后能够显著提高血红蛋白的稳定性[28]。
2.5 NaCl浓度对不同处理血红蛋白稳定性的影响
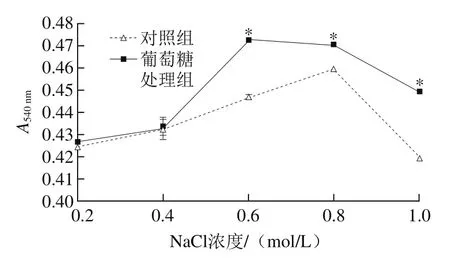
图7 盐浓度对血红蛋白吸光度的影响Fig. 7 Effect of NaCl concentration on stability of hemoglobin
由图7可知,血红蛋白的吸光度随着NaCl浓度的增加呈现出先上升后下降的趋势。NaCl浓度在0.2~0.4 mol/L时,不同处理组的血红蛋白的吸光度并无显著差异(P>0.05);当NaCl浓度在0.6~1.0 mol/L之间时,葡萄糖处理组的血红蛋白吸光度显著高于对照组(P<0.05),分析主要原因是在一定的NaCl浓度条件下,NaCl溶液中的金属离子通过离子键能够与血红蛋白络合形成稳定配体,因此血红蛋白的吸光度升高,但当NaCl浓度过高时,离子强度增加使血红蛋白的溶解度降低,导致蛋白质之间的交联作用减弱,蛋白分子之间的斥力增强[29],使其结构发生变化而稳定性降低,从而使吸光度降低。
3 结 论
添加葡萄糖能够提高冷冻干燥血红蛋白的色泽和稳定性。主要表现为,添加葡萄糖能够降低高铁血红蛋白的含量同时增加配体血红蛋白的含量,从而提高血红蛋白L*值和a*值;另添加葡萄糖会增加血红蛋白的水分含量;此外,葡萄糖能够显著增加冷冻干燥后血红蛋白对pH值、温度和NaCl的稳定性。因此,葡萄糖可用来提高血红蛋白色素的稳定性。
[1] OFORI J A, HSIEH Y H P. The use of blood and derived products as food additives[M]// EL SAMRAGY Y. Food additive. Vienna: InTech Open Access Publisher, 2012: 230-256. DOI:10.5772/32374.
[2] 黄群, 马美湖, 顾仁勇, 等. 新型肉品着色剂亚硝基血红蛋白的应用研究[J]. 食品工业科技, 2006, 27(1): 179-182. DOI:10.3969/j.issn.1002-0306.2006.01.058.
[3] NORGAARD-PEDERSEN B, SIGGAARD-ANDERSEN O, REM J.Hemoglobin pigments. Mixing technique for preparation of known fractions of hemoglobin pigments[J]. Clinica Chimica Acta, 1972,42(1): 109-113. DOI:10.1016/0009-8981(72)90382-8.
[4] 杨锡洪. 以血红蛋白制备腌制色素替代亚硝酸钠发色的研究[D]. 无锡:江南大学, 2005: 7-9.
[5] RATTI C. Hot air and freeze-drying of high-value foods: a review[J].Journal of Food Engineering, 2001, 49(4): 311-319. DOI:10.1016/S0260-8774(00)00228-4.
[6] 乔晓玲, 闫祝炜, 张原飞, 等. 食品真空冷冻干燥技术研究进展[J]. 食品科学, 2008, 29(5): 469-474. DOI:10.3321/j.issn:1002-6630.2008.05.107.
[7] 朱永宁, 泉本胜利. 血红蛋白(Hb)的低温保护剂[J]. 吉林大学自然科学学报, 1999(3): 88-92. DOI:10.3321/j.issn:1671-5489.1999.03.020.
[8] 李盛华. 猪血亚硝基血红蛋白的合成及应用研究[D]. 济南: 齐鲁工业大学(山东轻工业学院), 2009: 16-17 .
[9] 曹磊, 宋玉, 汪晓鸣, 等. 血红蛋白检测方法的探讨[J]. 农产品加工(学刊), 2013, 15(8): 72-74. DOI:10.3969/jissn.1671-9646(X).2013.08.024.
[10] 周玲, 阚建全, 汪学荣. 超声波法提取猪血液中血红蛋白的研究[J].食品科学, 2009, 30(4): 92-95.
[11] 赫玉兰, 卢士玲, 吴亚楠, 等. 响应面优化超声波法提取牛血红蛋白工艺[J]. 食品工业科技, 2015, 36(10): 259-263; 268.
[12] 张立娟, 邢绍平, 孔保华, 等. 糖基化血红蛋白着色剂在肉制品中的应用[J]. 肉类工业, 2011(10): 9-11.
[13] SALVADOR P, TOLDRÀ M, PARÉS D, et al. Color stabilization of porcine hemoglobin during spray-drying and powder storage by combining chelating and reducing agents[J]. Meat Science, 2009,83(2): 328-333. DOI:10.1016/j.meatsci.2009.06.001.
[14] 臧家涛, 刘建仓, 徐竞, 等. 一种安全高效的血红蛋白纯化方法[J]. 中国生物工程杂志, 2011, 31(11): 69-74. DOI:10.13523/j.cb.20111112.
[15] 李任强, 陈瑶, 江凤仪. 生物有机大分子中血红素铁的可见光谱特性[J]. 光谱学与光谱分析, 2004, 24(1): 95-97. DOI:10.3321/j.issn:1000-0593.2004.01.027.
[16] 杨琦, 谢志镭, 严维凌, 等. CIELAB色空间原理在血红蛋白色素呈色效果评价中的应用[J]. 中国食品学报, 2012, 12(11): 183-188.
[17] BENESCH R E, BENESCH R, YUNG S. Equations for the spectrophtometric analysis of hemoglobin mixtures[J]. Analytical Biochemistry, 1973, 55(1): 245-248.
[18] 欧秀琼, 景绍红, 黄萍, 等. 一种新型血红蛋白色素制品稳定性的研究[J]. 食品工业科技, 2013, 34(5): 288-290. DOI:10.13386/j.issn1002-0306.2013.05.073.
[19] 叶慧琼, 汪慧, 秦浩, 等. L-赖氨酸对血红蛋白浓缩物色泽稳定性的影响[J]. 农产品加工(学刊), 2014, 16(11): 5-11.
[20] 李飞, 隋新, 刘红娟, 等. 糖基化亚硝基血红蛋白的稳定性及其在猪肉脯中的应用研究[J]. 农产品加工, 2015(4): 9-14.
[21] 翁诗甫. 傅里叶变换红外光谱分析[M]. 北京: 化学工业出版社,2010: 325-327.
[22] 朱永宁. 关于血红蛋白(Hb)低温稳定性的研究[J]. 大连大学学报,2001, 22(6): 42-46. DOI:10.3969%2fj.issn.1008-2395.2001.06.009.
[23] TERWILLIGER N B. Molecular structure of the extracellular heme proteins[M]// BROUWER M, DECKER H, FUCHSMAN W H, et al.Blood and tissue oxygen carriers. Berlin Heidelberg: Springer, 1992:193-229.
[24] OLIVEIRA K M T, TRSIC M. Comparative theoretical study of the electronic structures and electronic spectra of Fe2+, Fe3+-porphyrin and free base porphyrin[J]. Journal of Molecular Structure: THEOCHEM,2001, 539(1/2/3): 107-117. DOI:10.1016/S0166-1280(00)00778-8.
[25] BALDWIN R L. How Hofmeister ion interactions affect protein stability[J]. Biophysical Journal, 1996, 71(4): 2056-2063.DOI:10.1016/S0006-3495(96)79404-3.
[26] SANTIAGO P S, CARVALHO F A O, DOMINGUES M M, et al.Isoelectric point determination for glossoscolex paulistus extracellular hemoglobin: oligomeric stability in acidic pH and relevance to proteinsurfactant interactions[J]. Langmuir, 2010, 26(12): 9794-9801.DOI:10.1021/la100060p.
[27] YANG A S, HONIG B. On the pH dependence of protein stability[J].Journal of Molecular Biology, 1993, 231(2): 459-474. DOI:10.1006/jmbi.1993.1294.
[28] 丁士勇, 张家年. 牛肉肌红蛋白和血红蛋白稳定性研究[J]. 食品科学, 2006, 27(7): 93-94.
[29] VON HIPPEL P H, PETICOLAS V, SCHACK L, et al. Model studies on the effects of neutral salts on the conformational stability of biological macromolecules. I. Ion binding to polyacrylamide and polystyrene columns[J]. Biochemistry, 1973, 12(7): 1256-1264.DOI:10.1021/bi00731a003.
Effect of Glucose on the Stability of Freeze-Dried Hemoglobin
SONG Xuan1,2, HOU Chengli2, LI Zheng2, WANG Wenting1,2, WU Liguo2, ZHU Jie1,*, ZHANG Dequan2,*
(1. Laboratory of Biomechanics and Engineering, Institute of Biophysics, College of Science, Northwest A & F University, Yangling 712100, China;
2. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
We studied the effect of adding 5 g/100 mL glucose on the color and residual water content of freeze-dried hemoglobin and explored the influences of pH, temperature and NaCl concentration on the stability of freeze-dried hemoglobin. The results showed that glucose could improve the L* and a* values of hemoglobin, and decrease the relative content of methemoglobin. Besides, glucose could signif i cantly enhance the stability of hemoglobin to pH, temperature and NaCl concentration. Meanwhile, the stability of glucose-treated hemoglobin was the highest under the conditions of pH 7,temperatures below 60 ℃ and NaCl concentration of 0.6 mol/L.
hemoglobin; glucose; freeze-drying; stability
10.7506/spkx1002-6630-201717013
TS251.93
A
1002-6630(2017)17-0072-05引文格式:
宋璇, 侯成立, 李铮, 等. 葡萄糖对冷冻干燥血红蛋白色素稳定性的影响[J]. 食品科学, 2017, 38(17): 72-76.
DOI:10.7506/spkx1002-6630-201717013. http://www.spkx.net.cn
SONG Xuan, HOU Chengli, LI Zheng, et al. Effect of glucose on the stability of freeze-dried hemoglobin[J]. Food Science,2017, 38(17): 72-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717013. http://www.spkx.net.cn
2016-06-21
国家现代农业(肉羊)产业技术体系建设专项(CARS-39);国家农业创新工程项目
宋璇(1991—),女,硕士研究生,研究方向为肉品科学。E-mail:songxuan120@163.com
*通信作者:朱杰(1980—),男,副教授,博士,研究方向为肉品科学。E-mail:jiezhu@nwafu.edu.cn
张德权(1972—),男,研究员,博士,研究方向为肉品科学与技术。E-mail:dequan_zhang0118@126.com

